Kemins grunder Den vetenskapliga metoden Observation Hypotes Experiment
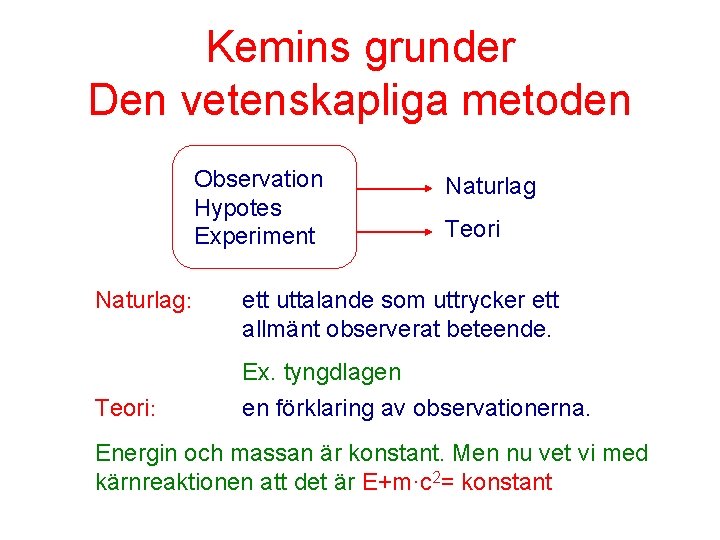
Kemins grunder Den vetenskapliga metoden Observation Hypotes Experiment Naturlag: Teori: Naturlag Teori ett uttalande som uttrycker ett allmänt observerat beteende. Ex. tyngdlagen en förklaring av observationerna. Energin och massan är konstant. Men nu vet vi med kärnreaktionen att det är E+m·c 2= konstant

SI-enheter Mätetal (Book of Data Kap I. 5) Storhet/enhet Längd l/m (1 dm = 10 -2 m, 1 Å = 10 -10 m) Massa Tid Temperatur Mängd Strömstyrka m/kg t/s T/K n/mol I/A (1 g = 10 -3 kg) (1 min = 60 s) (T(K) = T(°C) + 273, 15)

Signifikanta siffror Hur många signifikanta siffror finns det i: 2 0, 020100 2, 01· 10 -10? Svar: 1, 1, 3, 5 och 3 Addition och subtraktion: 0, 02 + 0, 0201 - 0, 02 144, 3 - 143, 9 = 0, 4 Notera att noggrannheten ofta blir låg vid subtraktion Multiplikation och division: 2· 314, 23 = 628, 46 2, 00· 314, 23 = 628 Ett par specialfall: Temperaturer som +10ºC, 0 ºC osv har 3 (!) signifikanta siffror, eftersom de egentligen är 283 K, 273 K osv. Av liknande anledning är 1 atm 2 signifikanta siffror, eftersom lufttrycket normalt ligger inom 740 – 780 mm Hg. Felet ligger alltid i den sista siffran.

Medelvärde och standardavvikelse n försök : x 1 x 2 x 3. . . . xn medelvärde standardavvikelse

Ex. Bestäm volymen av en vollpipett: ~20 cm 3. Fem försök gav 20, 1 cm 3 20, 4 cm 3 20, 5 cm 3 Volymen = 20, 4 cm 3± 0. 3 cm 3 20, 2 cm 3 20, 8 cm 3

Osäkerhet i mätningar Snabbvåg ±(0. 1 - 0. 001) g Analysvåg ± 0. 0001 g Mätglas (50 cm 3) ± 0, 2 cm 3 Mätkolv (50 cm 3) ± 0, 05 cm 3
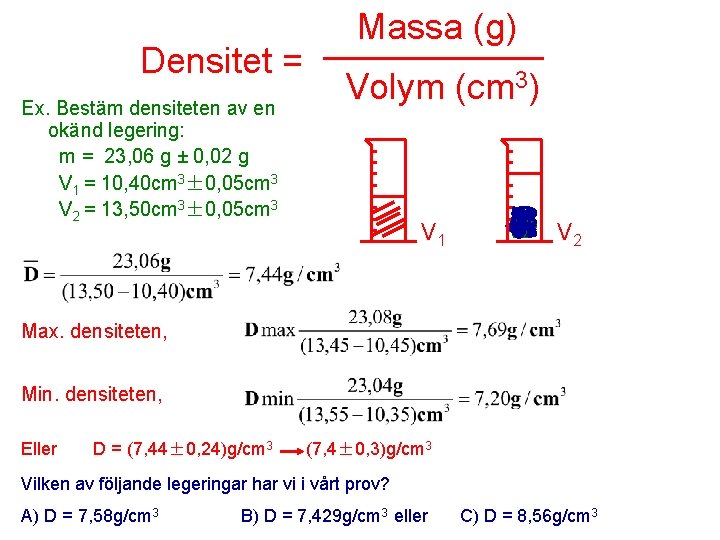
Massa (g) ______ Densitet = 3) Volym (cm Ex. Bestäm densiteten av en okänd legering: m = 23, 06 g ± 0, 02 g V 1 = 10, 40 cm 3± 0, 05 cm 3 V 2 = 13, 50 cm 3± 0, 05 cm 3 V 1 V 2 Max. densiteten, Min. densiteten, Eller D = (7, 44± 0, 24)g/cm 3 (7, 4± 0, 3)g/cm 3 Vilken av följande legeringar har vi i vårt prov? A) D = 7, 58 g/cm 3 B) D = 7, 429 g/cm 3 eller C) D = 8, 56 g/cm 3

Atomer, molekyler och joner Daltons atomteori • Kemiska ämnen består av atomer • Kemiska föreningar består av bestämda relativa antal och typer av atomer men. . . Alla atomer består av neutroner (n), protoner (p) och elektroner (e). Kärnan består av neutroner (laddning 0) och protoner (+). Elektronerna är kemin. Hur kan då atomslagen vara så olika? Isotoper: samma antal protoner samma antal esamma kemi men olika antal neutroner olika massor Masstal A Z Atomnummer X 23 11 Na 24 Na 11
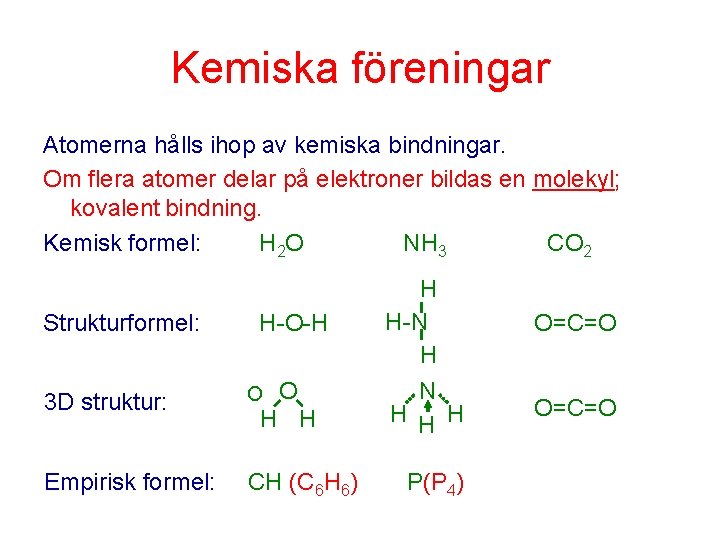
Kemiska föreningar Atomerna hålls ihop av kemiska bindningar. Om flera atomer delar på elektroner bildas en molekyl; kovalent bindning. Kemisk formel: H 2 O NH 3 CO 2 Strukturformel: H-O-H O 3 D struktur: O Empirisk formel: CH (C 6 H 6) H H-N H H H P(P 4) O=C=O
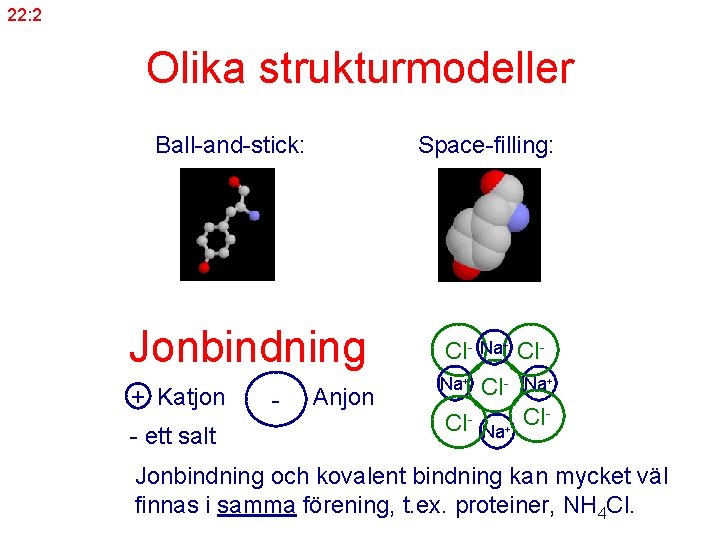
22: 2 Olika strukturmodeller Ball-and-stick: Space-filling: Jonbindning + Katjon - ett salt - Anjon Cl- Na+ Cl Jonbindning och kovalent bindning kan mycket väl finnas i samma förening, t. ex. proteiner, NH 4 Cl.

Periodiska systemet Dimitri Ivanovich Mendelev 1872 (1834 -1907) De allra flesta grundämnen är metaller, men de biologiskt viktigaste (C H N O samt S och P) är icke-metaller. Men+ Katjoner O 2 - FCl. Anjoner Alla metaller (Me) är + Icke-metallerna binder kovalent.

Nomenklatur masstal = namngivning Symbol antal laddning atomnummer peroxidjon Oxidationstal • Oxidationstal för en atom i ett rent grundämne alltid noll O 2: O(0) Na: Na(0) • Enatomiga joner = laddningen O 2 -: O(-II) Na+: Na (l) • Kemiska föreningar: O är i allmänhet –II (undantag ) H är i allmänhet I (undantag hydrider –I) • Summan av alla individuella atomers oxidationstal = laddningen

Systematiska namn Salt: Na. Cl + Natrium Klorid (jfr oxid hydrid) Övergångsmetaller kan ha olika oxidationstal: Ex. Fe. Cl 2: järn(ll)klorid Fe 2+ Fe 3+ Fe. Cl 3: järn(lll)klorid ferrous ferric på eng. Hg 22+: kvicksilver(l) NH 4+ ammonium Flertomiga anjoner: Cl. O- NO 2 - nitrit SO 32 - sulfit Cl. O 2 - klorit NO 3 - nitrat SO 42 - sulfat (S 2 - sulfid) Cr. O 42 - kromat Cr 2 O 72 - dikromat Kovalenta föreningar: hypoklorit Cl. O 3 - klorat Cl. O 4 - perklorat Mn. O 4 - permanganat C 2 H 3 O 2 - acetat skrivs hellre CH 3 COO N 2 O dikväveoxid NO Kväveoxid NO 2 Kvävedioxid N 2 O 5 dikvävepentoxid men H 2 O vatten NH 3 ammoniak

Stökiometri Atomär massenhet Atommassor är relativt 12 C massan 12 C = 12. 000000. . . amu Mol En mol = antalet kolatomer i exakt 12 gram rent 12 C = 6, 022 · 1023 = Avogadros tal Det finns lika många atomer i ett sandkorn som det finns sandkorn i Sahara. Molmassa Vilken molmassa har metan, CH 4? Svar: Massan av 1 mol C = 12, 011 g + 4 mol H = 4 x 1, 008 g ____________ = 1 mol CH 4 = 16, 043 g

Procentuell sammansättning Beräkna massprocenten av C, H och O i etanol: C 2 H 5 OH Massan av C = 2· 12, 011 g/mol = 24, 022 g/mol H = 6· 1, 008 g/mol = 6, 048 g/mol O = 1· 15, 999 g/mol = 15, 999 g/mol C 2 H 5 OH = 24, 022 + 6, 048 +15, 999 = 46, 099 g/mol Massprocenten

Kontrollera svaret! Summan måste bli 100%. Blir den det? 52, 144 13, 13 +_____ 34, 728 100, 002 avrunda 100, 00 rätt inom siffernoggrannheten

Hur får man fram ett ämnes kemiska formel? Väg hela provet, sönderdela provet och väg varje grundämne för sig. I praktiken görs ofta en förbränning, så C mäts ofta i en form av CO 2, H som H 2 O. Ex. En förening som bara innehåller C, H och N förbränndes. 0, 1156 g prov 0, 1638 g CO 2 0, 1676 g H 2 O

Vilken empirisk formel har föreningen? Massan Resten måste vara N; Procentuella andelar:

. . . Men vi vill ha antalet atomer C, H, N i ämnet Antag 100 g prov: I 100 gram har vi Antal mol: 38, 67 g C 16, 23 g H 45, 10 g N Relativa heltal: C 1 H 5 N 1 CH 5 N empirisk formel Molekylen kan vara CH 5 N (CH 5 N)n eller C 2 H 10 N 2 t. ex. från masspektra Molekylens formel: 62, 1 g/mol Molmassan ___________ n = Empiriska formelns massa = 31, 058 g/mol = 2, 00 2·(CH 5 N) = C 2 H 10 N 2

Kemiska reaktioner Skriv reaktionsformel och balansera. Balansera den mest komplicerade molekylen. Kontrollera att det finns lika många atomer av varje slag på vänstra och högra sidan. Ex. C 2 H 5 OH (l) + O 2(g) CO 2(g) + H 2 O(g)

Beräkna förhållandet mellan reagerande mängder och massor 1 C 2 H 5 OH(l) + 3 O 2(g) 2 CO 2(g) + 3 H 2 O(g) Hur mycket syre reagerar med 98, 2 g etanol? Begränsande ämnen 25 kg kväve och 5 kilo väte reagerar. Ammoniak bildas, men hur mycket?
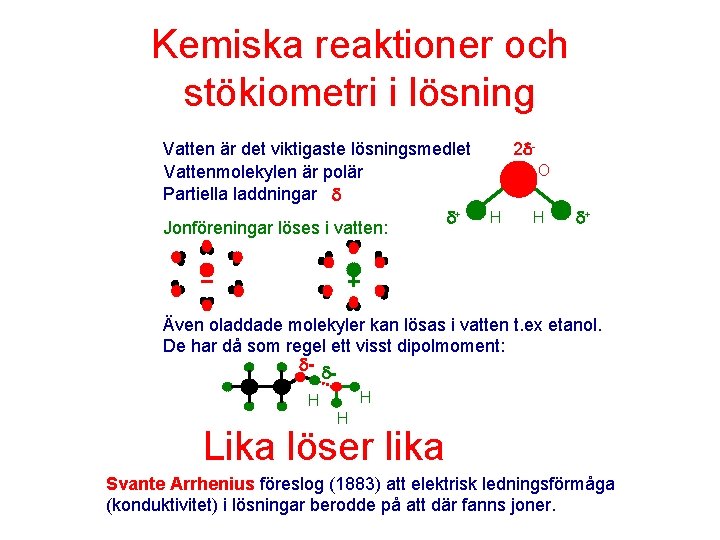
Kemiska reaktioner och stökiometri i lösning Vatten är det viktigaste lösningsmedlet Vattenmolekylen är polär Partiella laddningar + Jonföreningar löses i vatten: 2 O H H + Även oladdade molekyler kan lösas i vatten t. ex etanol. De har då som regel ett visst dipolmoment: - H H H Lika löser lika Svante Arrhenius föreslog (1883) att elektrisk ledningsförmåga (konduktivitet) i lösningar berodde på att där fanns joner.

3 starka elektrolyter: lösliga salter, starka syror, starka baser. Arrhenius var först med att föreslå att en syra är ett ämne som avger H+ när det löses i vatten. Starka syror (HCl, HNO 3, H 2 SO 4) är till >99% dissocierade i vatten. (H 2 SO 4 dock bara till HSO 4 - och H+) Starka baser (Na. OH, KOH) är till >99% dissocierade till OH- och Me+.

Svaga elektrolyter: bara några enstaka % är dissocierad. Ex. Ättiksyra är en svag syra CH 3 COOH CH 3 COO- + H+ 99% 1% En svag bas är NH 3: NH 3(aq) + H 2 O(l) 99% Skilj på: NH 4+(aq) + OH-(aq) 1% stark koncentrerad svag utspädd

Icke-elektrolyter ger inga joner alls. Ex. Etanol C 2 H 5 OH och sukros C 12 H 22 O 11. Kemiska reaktioner i lösning: Kvalitativt: Vad händer? Kvantitativt: Hur mycket?

Lösningarnas koncentration: Molaritet = n mol _______ M= V liter massprocent = Antal mol löst ämne _________ liter lösning 1 liter = 1 dm 3 = 1000 cm 3 Antal gram löst ämne __________ · 100% gram lösning g löst ämne = ____________ · 10+6 ppm = m. L lösning g lösning DH 2 O = 1 g/m. L ng löst ämne = ______ g löst ämne ______ ppb = · 10+9 g lösning m. L lösning (halt)

Spädning Antal mol är detsamma före och efter spädning: M 1·V 1= M 2·V 2 före efter Xml · 10, 0 M = 500 ml · 1, 00 M Stamlösningen (The stock solution) Stamlösning = stock solution men Standardlösning = standard solution = lösning med noga känd koncentration.

Hur tillverkar man 1. 00 l 0. 50 M H 2 SO 4 från koncentrerad H 2 SO 4 (18 M)? 18 M·Vkonc. H 2 SO 4 = 0, 50 M· 1, 00 L Vkonc. H 2 SO 4 = ________ 18 M = 0, 02778 L = 0, 028 L 1000 m. L = 0, 02778 L· ______ 1 L = 28 m. L OBS! Syra sätts till vatten.

Kemiska reaktioner i lösning Utfällningar Syra-bas Redox Utfällningar: Kom ihåg: -NO 3 - och Na+, Li+, Cs+, Rb+, NH 4+ salter är alltid lättlösliga. (Z: Tabell 4. 1) Lär några svårlösliga utantill: Ag. Cl, Ba. SO 4. . . Alla fällningar och gaser har nettoladdning noll. Alla laddade är (aq). Några få oladdade är (aq): NH 3, H 2 O 2

3 typer av reaktionsformler Molekylformel: 3 Ba. Cl 2(aq) + Fe 2(SO 4)3(aq) 3 Ba. SO 4(s) + 2 Fe. Cl 3(aq) Fullständig jonformel: 3 Ba 2+(aq) + 6 Cl-(aq) + 2 Fe 3+(aq) + 3 SO 42 -(aq) 3 Ba. SO 4(s) + 6 Cl-(aq) Nettoformel: Ba 2+(aq) + SO 42 -(aq) Ba. SO 4(s) Om 100, 0 m. L 0, 100 M Ba. Cl 2 blandas med 100, 0 m. L 0, 100 M Fe 2(SO 4)3, hur många gram Ba. SO 4 kan man få?

Syra-bas reaktioner Starka syror + starka baser: H+(aq) + OH-(aq) H 2 O(l) Svaga syror + starka baser: CH 3 COOH(aq) + OH-(aq) H 2 O(l) + CH 3 COO-(aq)
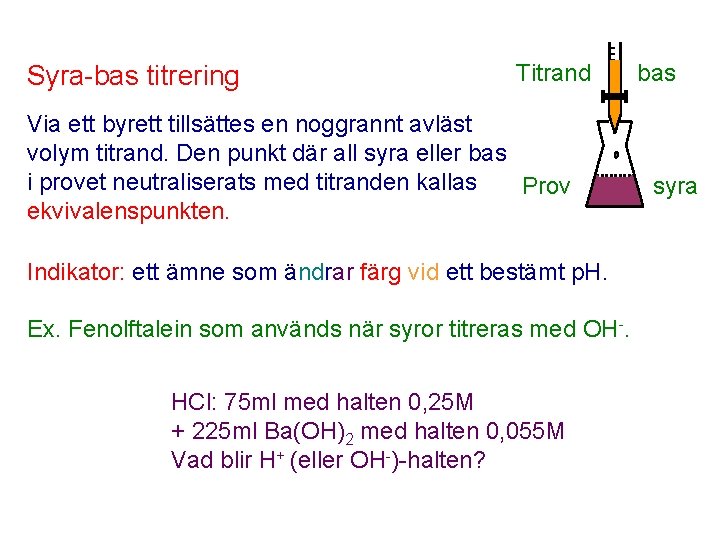
Syra-bas titrering Titrand Via ett byrett tillsättes en noggrannt avläst volym titrand. Den punkt där all syra eller bas i provet neutraliserats med titranden kallas Prov ekvivalenspunkten. Indikator: ett ämne som ändrar färg vid ett bestämt p. H. Ex. Fenolftalein som används när syror titreras med OH-. HCl: 75 ml med halten 0, 25 M + 225 ml Ba(OH)2 med halten 0, 055 M Vad blir H+ (eller OH-)-halten? bas syra

Redoxreaktioner Reduktion+Oxidation En eller flera elektroner förs från en atom till en annan. Fe(s)+Cu 2+(aq) Fe 2+(aq)+Cu(s) 2 e- OBS! Inga elektroner kan försvinna! Förbränningsreaktioner (inkl. biologiska) är oftast redox-reaktioner Ex. CH 4(g)+2 O 2(g) CO 2(g)+2 H 2 O(g)
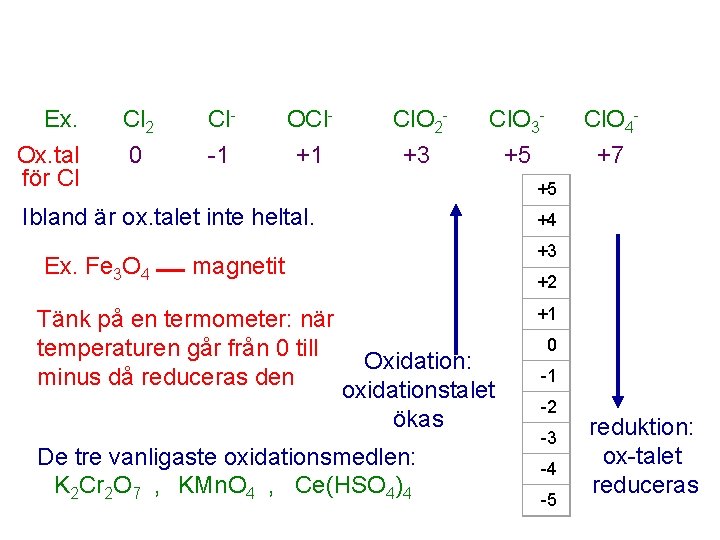
Ex. Ox. tal för Cl Cl 2 Cl- OCl- Cl. O 2 - Cl. O 3 - Cl. O 4 - 0 -1 +1 +3 +5 +7 +5 Ibland är ox. talet inte heltal. Ex. Fe 3 O 4 +4 +3 magnetit Tänk på en termometer: när temperaturen går från 0 till minus då reduceras den +2 +1 Oxidation: oxidationstalet ökas De tre vanligaste oxidationsmedlen: K 2 Cr 2 O 7 , KMn. O 4 , Ce(HSO 4)4 0 -1 -2 -3 -4 -5 reduktion: ox-talet reduceras

Balansera redoxformlel Metod 1: Metod 2: 3 Mn. O 2 (s) + 4 Al (s) +4 0 3 Mn (s) + 2 Al 2 O 3 (s) 0 +3 Halvreaktioner 1. Reduktion: 3·(Mn. O 2(s) + 4 e- Mn(s) + 2 O 2 -) 2. Oxidation: 2·(2 Al(s) + 302 - Al 2 O 3(s) + 6 e-) 3. Balansera atomer och e- för varje halvreaktion a) Balansera alla atomer utom H och O. b) Balansera O med H 2 O. c) Balansera H med H+. Inga H+ i basisk lösning! d) Balansera laddningarna med e 4. Balansera elektronerna i halvreaktionerna, summera. Stryk överflödiga atomer, joner och e-.

Om lösningen är basisk: OHlägg till OH- (antal OH- = antal H+) OH-(aq) + H+(aq) H 2 O(l) stryk sedan överflödiga H 2 O
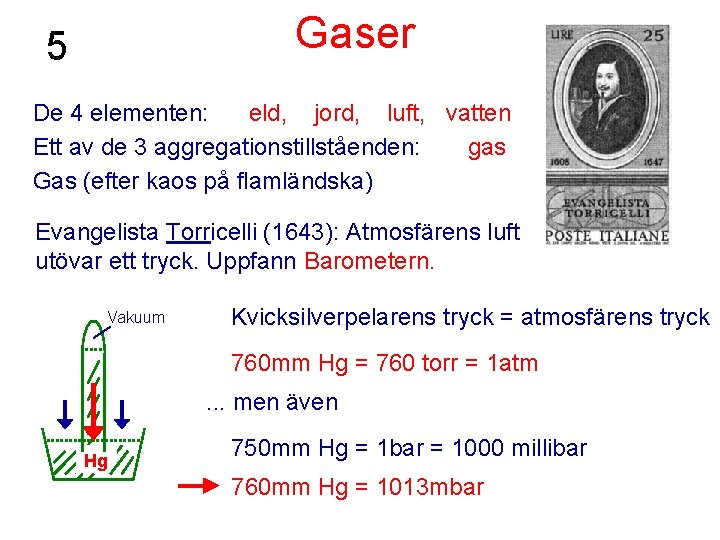
Gaser 5 De 4 elementen: eld, jord, luft, vatten Ett av de 3 aggregationstillståenden: gas Gas (efter kaos på flamländska) Evangelista Torricelli (1643): Atmosfärens luft utövar ett tryck. Uppfann Barometern. Vakuum Kvicksilverpelarens tryck = atmosfärens tryck 760 mm Hg = 760 torr = 1 atm. . . men även Hg 750 mm Hg = 1 bar = 1000 millibar 760 mm Hg = 1013 mbar

SI - enheter: Tryck = kraft/yta i Newton/m 2 1 N/m 2 = 1 Pascal (Pa) 1 atm = 101 325 Pa (1 mbar 1 h. Pa (hektopascal)
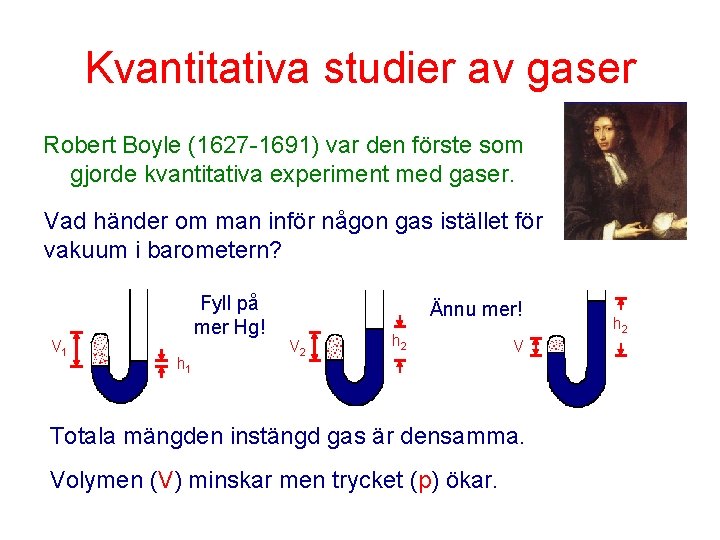
Kvantitativa studier av gaser Robert Boyle (1627 -1691) var den förste som gjorde kvantitativa experiment med gaser. Vad händer om man inför någon gas istället för vakuum i barometern? V 1 Fyll på mer Hg! h 1 Ännu mer! V 2 h 2 V Totala mängden instängd gas är densamma. Volymen (V) minskar men trycket (p) ökar. h 2
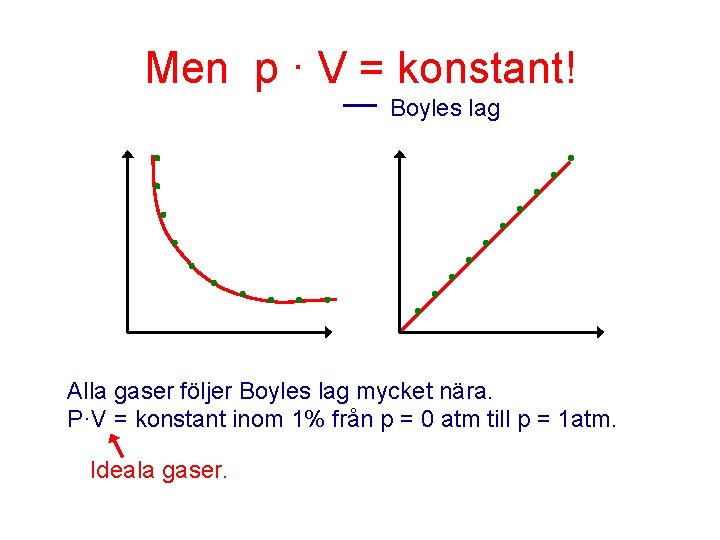
Men p · V = konstant! Boyles lag Alla gaser följer Boyles lag mycket nära. P·V = konstant inom 1% från p = 0 atm till p = 1 atm. Ideala gaser.
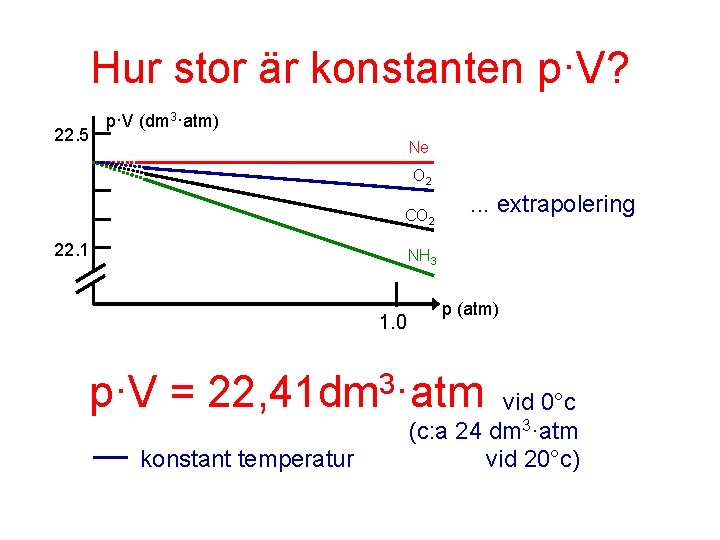
Hur stor är konstanten p·V? 22. 5 p·V (dm 3·atm) Ne O 2 CO 2 22. 1 . . . extrapolering NH 3 1. 0 p (atm) p·V = 22, 41 dm 3·atm konstant temperatur vid 0°c (c: a 24 dm 3·atm vid 20°c)

Men vad händer om temperaturen ändras? Volymen som f(T) vid konstant p Jaques Charles (1776 -1823): förste ballongflygaren. 1787 upptäckte Charles inte bara att gasers volym V ökar om T ökar, utan även att volymen ökar linjärt med temperaturen. Charles lag: V = b·T T i Kelvin. Om T går mot 0 K, då går V mot 0 dm 3, men eftersom volymen inte kan vara noll, kan T = 0 Kelvin inte uppnås. Det finns en absolut nollpunkt, vid – 273, 15°C

Avogadros lag Avogrados föreslog* 1811 att: Alla gaser vid samma p, T och V innehåller exakt lika många partiklar*. V = a·n V = volymen, n = antalet mol a = konstant *Avogadros hade rätt men det skulle dröja ända till 1860 innan världens kemister accepterade hans idé. Först då kunde man få ordning på grundämnenas relativa atomvikter, vilket var en förutsättning för periodiska systemet (1869). Avogadros dog 1856.

Allmänna gaslagen: p·V= n·R·T OBS! T i Kelvin! De viktigaste parametrarna för en gas: Tryck Volym temperatur mängd Pa atm m 3 L K mol Allmänna gaskonstanten: R = 8, 3145 J K-1 mol-1 R = 0, 082058 L atm K-1 mol-1 BD: s. 15 BD: s. 148 Vad är enheten för p·V ? Beräkna gaskonstanten R i enheten m 3·Pa·K-1·mol-1 från R = 0, 082058 L atm·K-1·mol-1 Molmassan för en gas kan direkt fås ur tätheten

STP Vid STP: Standard Temp Pressure (=tryck). T = 0°c, P = 1 atm (OBS! T 25°c) (1, 000 mol)·(0, 08206 dm 3 atm K-1 mol-1)·(273, 2 K) ____ n. RT ____________________ V= = p 1 atm = 22, 42 dm 3 = 22, 42 L (1 mol gas) Denna molvolym stämmer inom 1% för alla vanliga gaser.

Ex: Ca. CO 3(s) sönderfaller vid. . °C. Se Bo. D! Ca. CO 3(s) Ca. O(s)+CO 2(g) Hur stor volym CO 2 fås om 100 gram Ca. CO 3 Calcit aragonit upphettas till sönderfall? Svara vid STP. 1 mol ______ -1 = 0, 999 mol m. Ca. CO 3 = 100, 1 gmol n. Ca. CO 3 = 100 g · 100, 1 g vid STP 1 mol CO 2(g) fyller 22, 42 liter. n____ n. CO 2 = 0, 999 mol co 2 naco 3 = 1 1 V RT __ ___ PV = n. RT n = p = Konstant vid STP vco 2 22, 42 L ______ = VCO 2 = · 0, 999 mol = 22, 4 L nco 2 1 mol Beräkna även VCa. CO 3: m. Ca. O= 56, 19/mol VCa. O VCO 2 i Ca. CO 3 = VCa. CO 3 - VCa. O = Gaser är tusen gånger större än (l) och (s)!
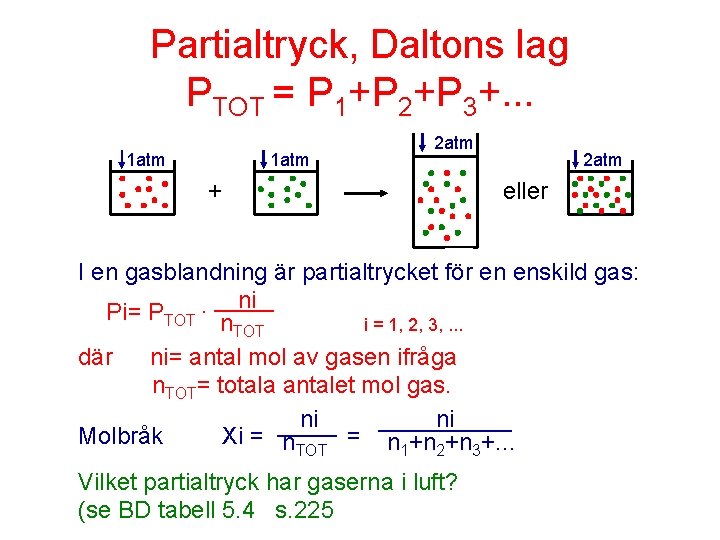
Partialtryck, Daltons lag PTOT = P 1+P 2+P 3+. . . 1 atm 2 atm + 2 atm eller I en gasblandning är partialtrycket för en enskild gas: ni Pi= PTOT · ______ n. TOT i = 1, 2, 3, . . . där ni= antal mol av gasen ifråga n. TOT= totala antalet mol gas. ni ______ Molbråk Xi = n. TOT = n 1+n 2+n 3+. . . Vilket partialtryck har gaserna i luft? (se BD tabell 5. 4 s. 225
- Slides: 47