Chapitre 3 Gaz parfait la limite classique Proprits




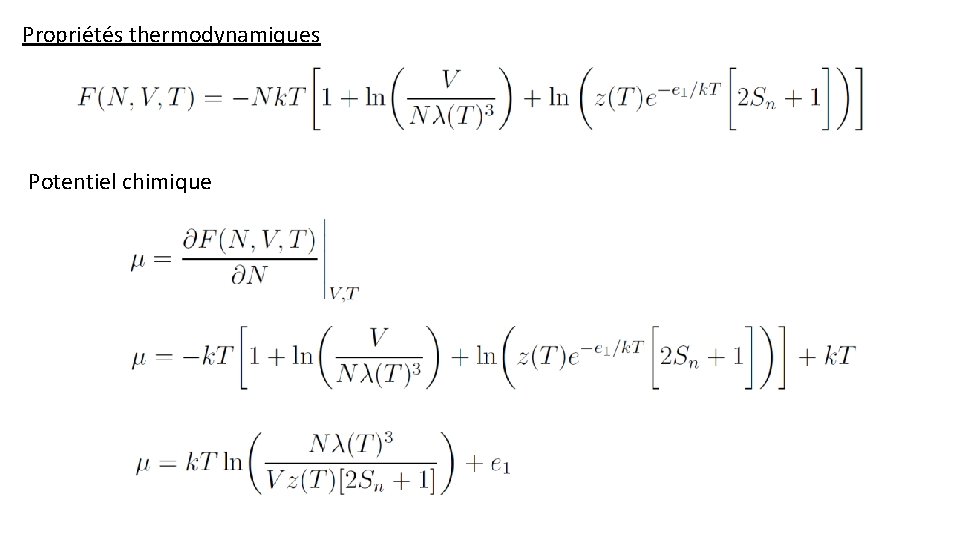





























- Slides: 49

Chapitre 3 – Gaz parfait à la limite classique Propriétés thermodynamiques

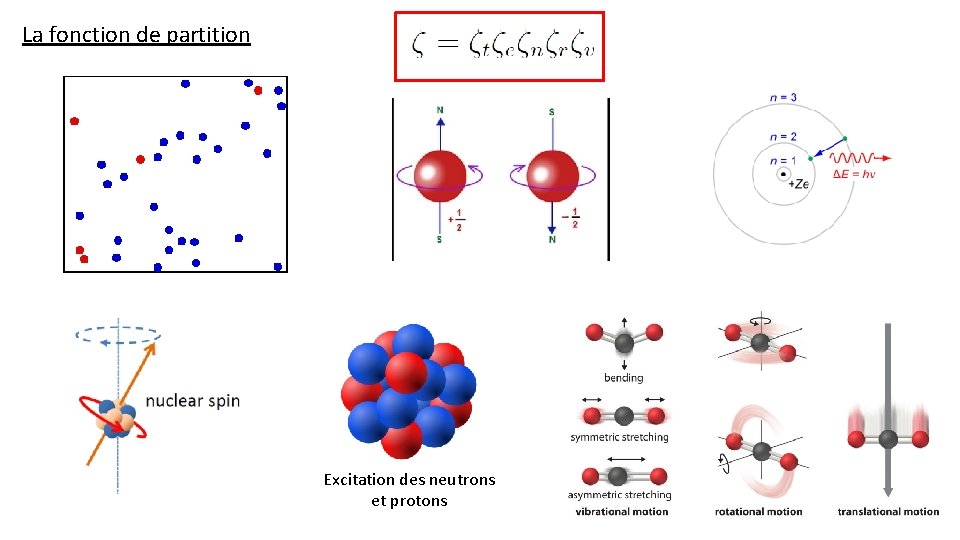
La fonction de partition Excitation des neutrons et protons

Stratégie à suivre (rappel du chapitre 1)

Propriétés thermodynamiques gaz idéal monoatomique Énergie libre de Helmholtz avec

Propriétés thermodynamiques Pression Équation d’état d’un gaz parfait monoatomique
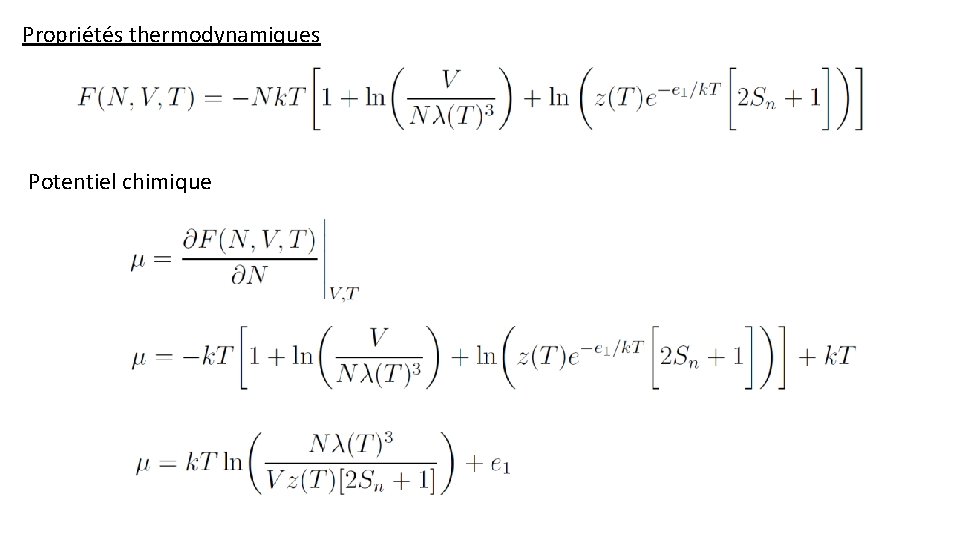
Propriétés thermodynamiques Potentiel chimique

Propriétés thermodynamiques Entropie

Propriétés thermodynamiques Note : en PHY 2215 nous avions obtenu une expression pour l’entropie Ces deux expressions sont équivalentes si

Propriétés thermodynamiques Gaz monoatomiques (à P = 1 atm et T = 298 K)

Propriétés thermodynamiques Énergie interne énergie cinétique : La pression est égale à 2/3 de la densité d’énergie cinétique

Propriétés thermodynamiques Énergie interne dépend de notre choix (arbitraire) du point zéro de l’énergie (ici < 0) Énergie d’excitation électronique ( donc négligeable)

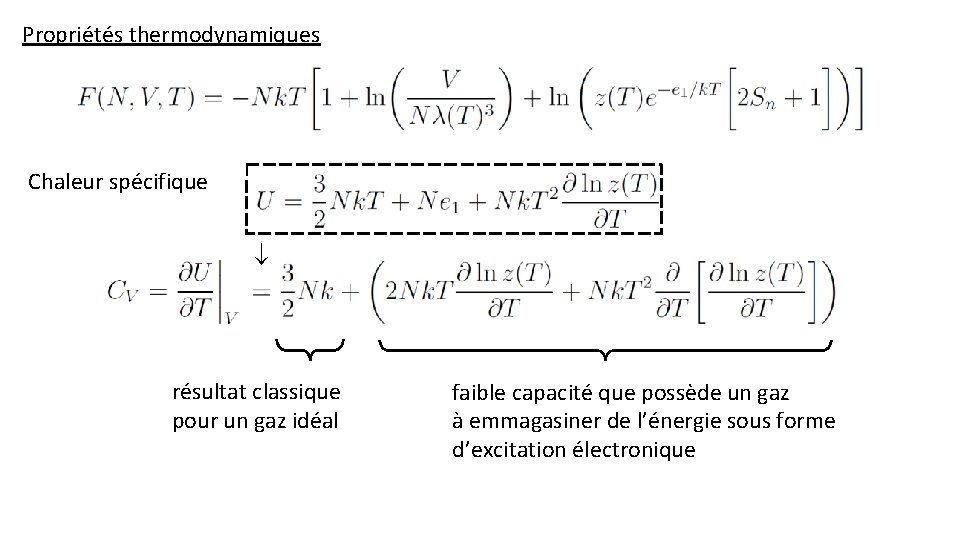
Propriétés thermodynamiques Chaleur spécifique résultat classique pour un gaz idéal faible capacité que possède un gaz à emmagasiner de l’énergie sous forme d’excitation électronique

Gaz à plusieurs composantes

Rappel : fonction de partition Somme sur tous les états d’énergie du système macroscopique

Gaz à plusieurs composantes Fonction de partition où particules discernables ici est l’énergie de la particule 2 dans l’état n et est la somme sur tous ses états accessibles

Gaz à plusieurs composantes Fonction de partition où

Gaz à plusieurs composantes Fonction de partition où Si on considère 2 types de particules et

Gaz à plusieurs composantes

Gaz à plusieurs composantes somme des pressions partielles un potentiel chimique par espèce j

Potentiel chimique

Potentiel chimique Relation fondamentale de la thermodynamique Généralisation de la relation fondamentale de la thermodynamique changement de l’énergie interne dû aux Ni qui changent

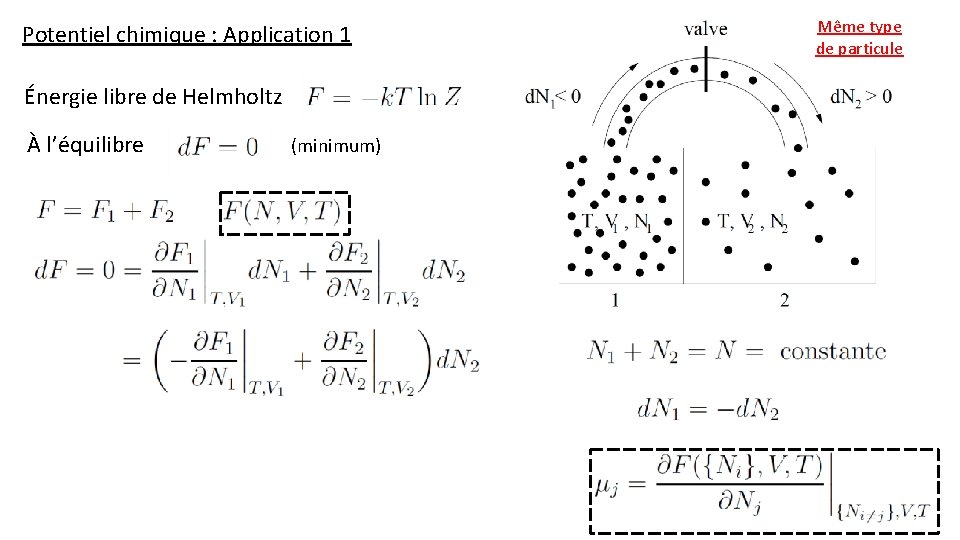
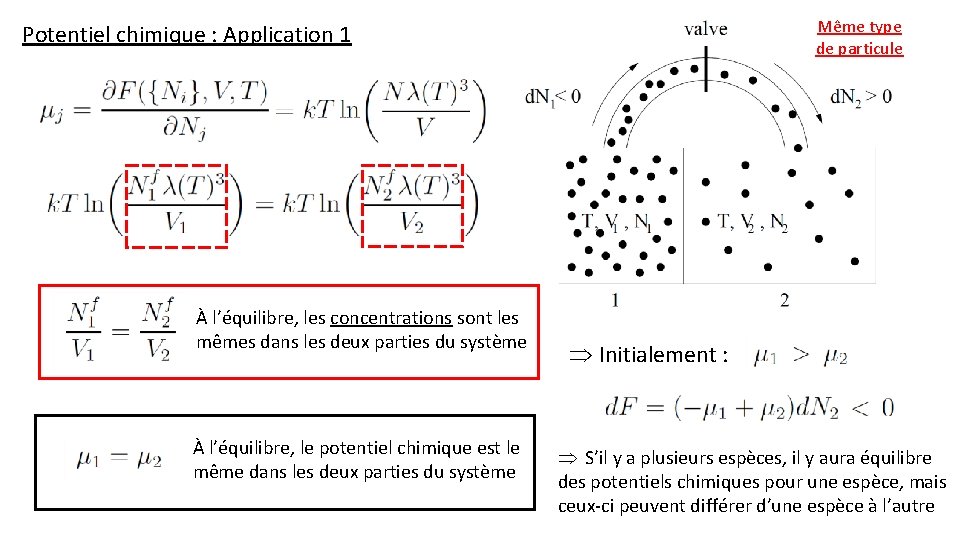
Potentiel chimique : Application 1 Énergie libre de Helmholtz À l’équilibre (minimum) Même type de particule

Potentiel chimique : Application 1 Énergie libre de Helmholtz À l’équilibre (minimum) À l’équilibre, le potentiel chimique est le même dans les deux parties du système Même type de particule

Rappel : Propriétés thermodynamiques Potentiel chimique

Même type de particule Potentiel chimique : Application 1 À l’équilibre, les concentrations sont les mêmes dans les deux parties du système À l’équilibre, le potentiel chimique est le même dans les deux parties du système Initialement : S’il y a plusieurs espèces, il y aura équilibre des potentiels chimiques pour une espèce, mais ceux-ci peuvent différer d’une espèce à l’autre

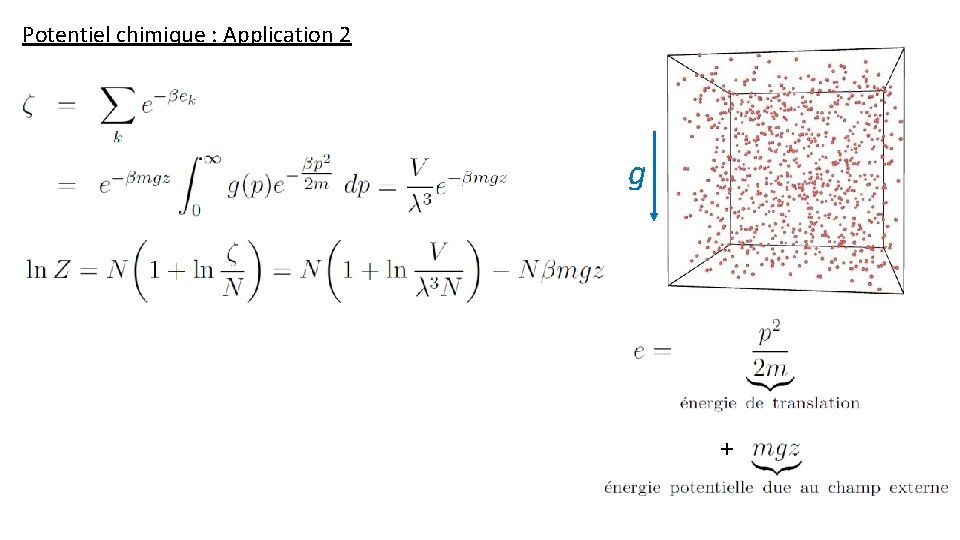
Potentiel chimique : Application 2 g +

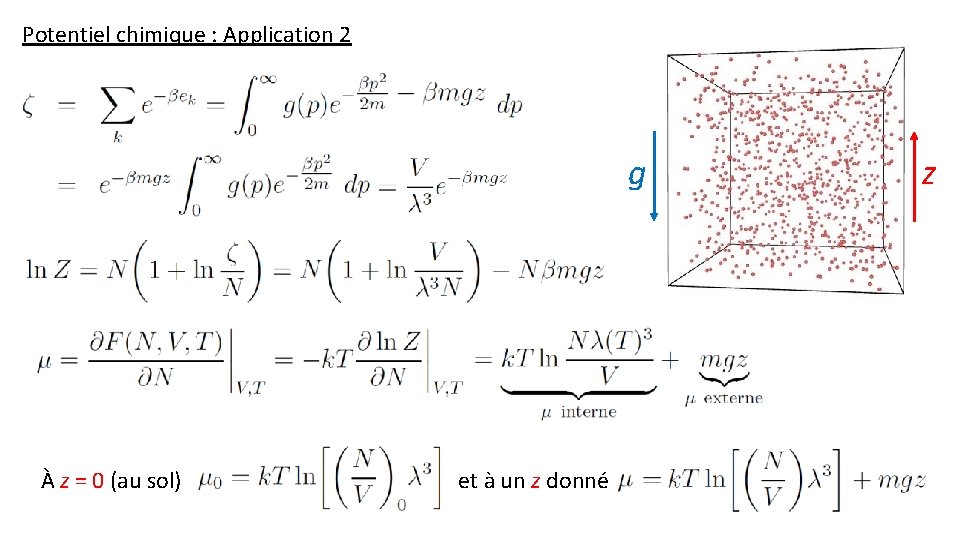
Potentiel chimique : Application 2 g À z = 0 (au sol) et à un z donné z

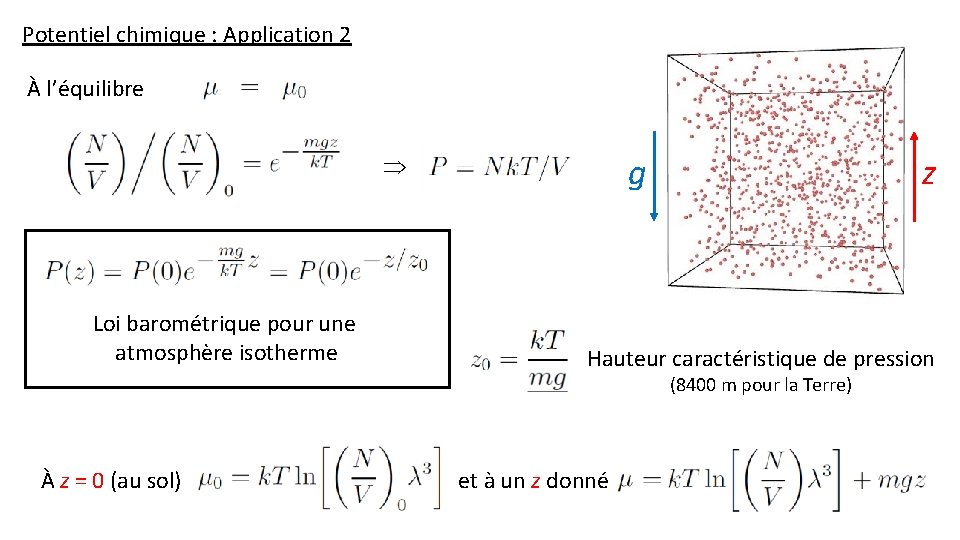
Potentiel chimique : Application 2 À l’équilibre g Loi barométrique pour une atmosphère isotherme z Hauteur caractéristique de pression (8400 m pour la Terre) À z = 0 (au sol) et à un z donné

Généralisation à un gaz réactif

Généralisation à un gaz réactif Ici on considère la possibilité de réactions « chimiques » . Lors d’une réaction chimique, le nombre d’atomes est conservé, mais le nombre de molécules ne l’est pas. Exemple : Énergie libre de Helmholtz minimum à l’équilibre 0 À l’équilibre : 0

symbole chimique Généralisation à un gaz réactif On peut symboliser chaque réaction chimique par Si dn est le nombre de réactions chimiques : Condition d’équilibre chimique (une par réaction chimique)

Équation d’ionisation de Saha On peut symboliser une réaction d’ionisation par ( Condition d’équilibre chimique : : zème état d’ionisation)

Équation d’ionisation de Saha

Équation d’ionisation de Saha Rapport des populations de deux niveaux d’ionisation successifs : Meghnad Saha où Rappel : Formule d’excitation de Boltzmann (rapport des populations des atomes dans les états d’excitation k et r)

Équation d’ionisation de Saha Exemple : ionisation de l’hydrogène Meghnad Saha

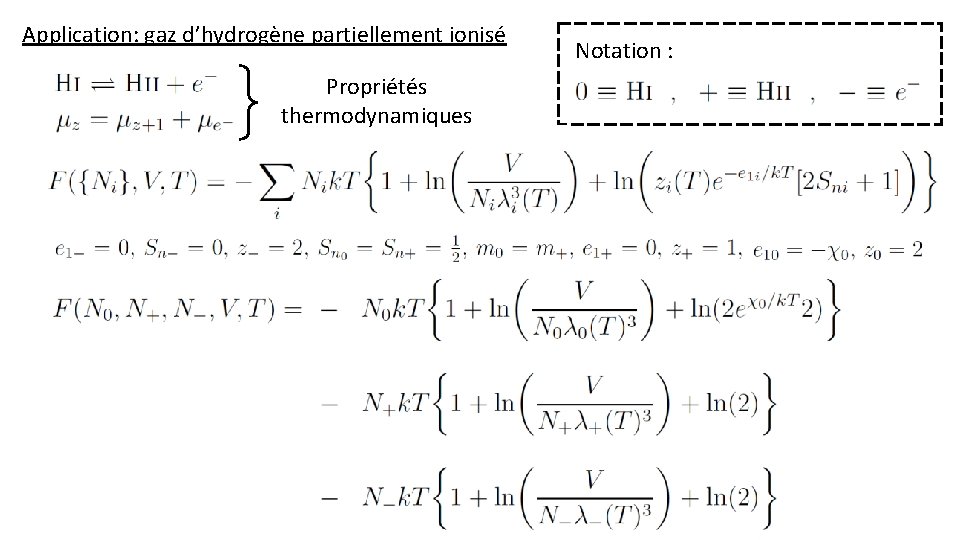
Application: gaz d’hydrogène partiellement ionisé

Application: gaz d’hydrogène partiellement ionisé Propriétés thermodynamiques Notation :

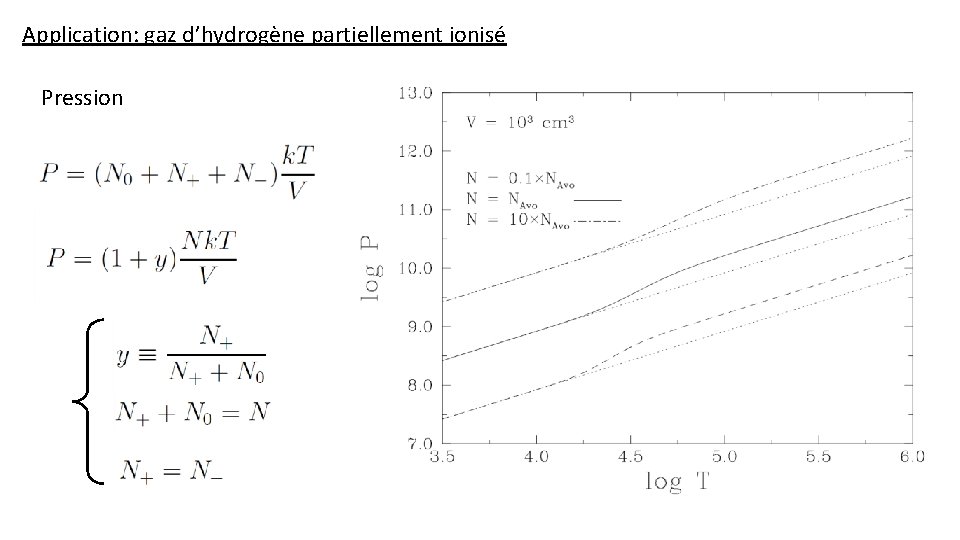
Application: gaz d’hydrogène partiellement ionisé Pression Somme des pressions partielles (contributions égales si complètement ionisé)

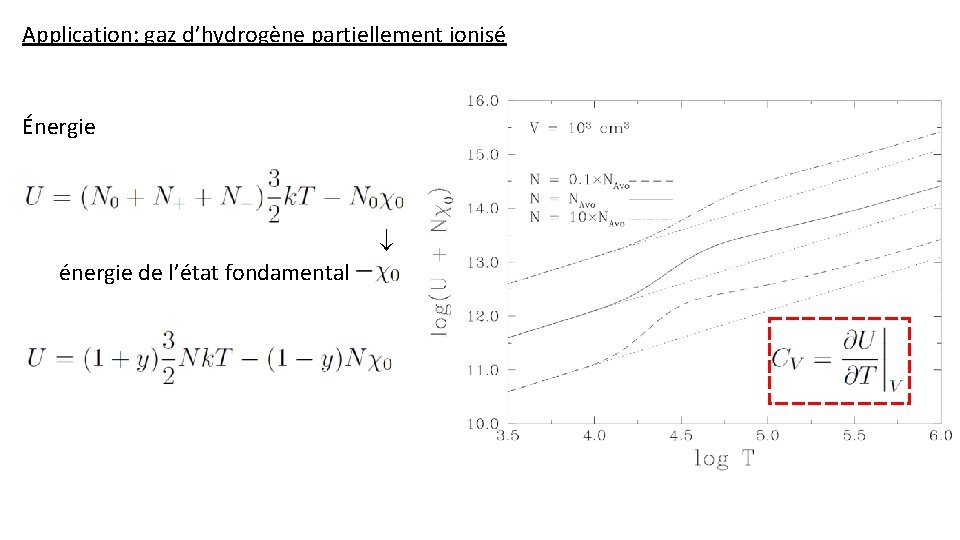
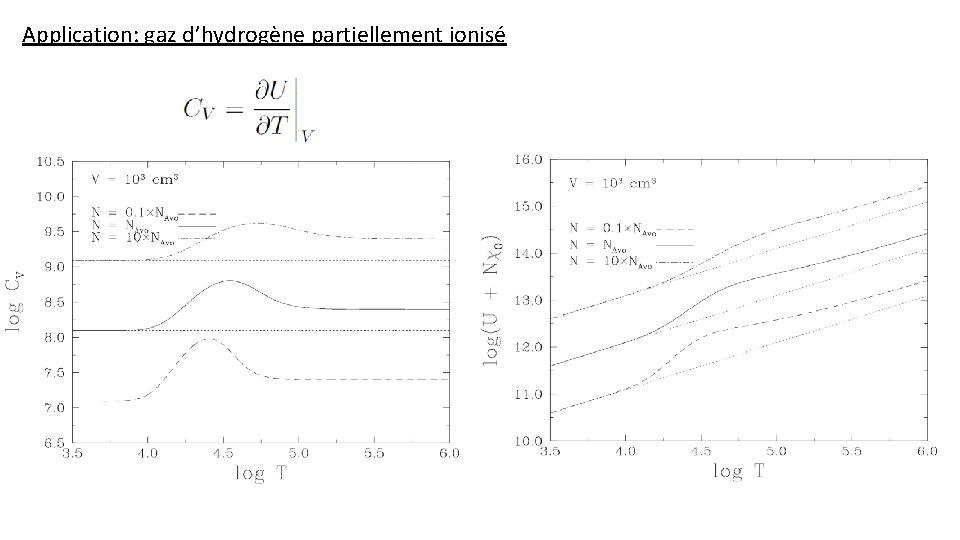
Application: gaz d’hydrogène partiellement ionisé … Énergie Chaleur spécifique à volume constant les Ni ne sont pas constants!

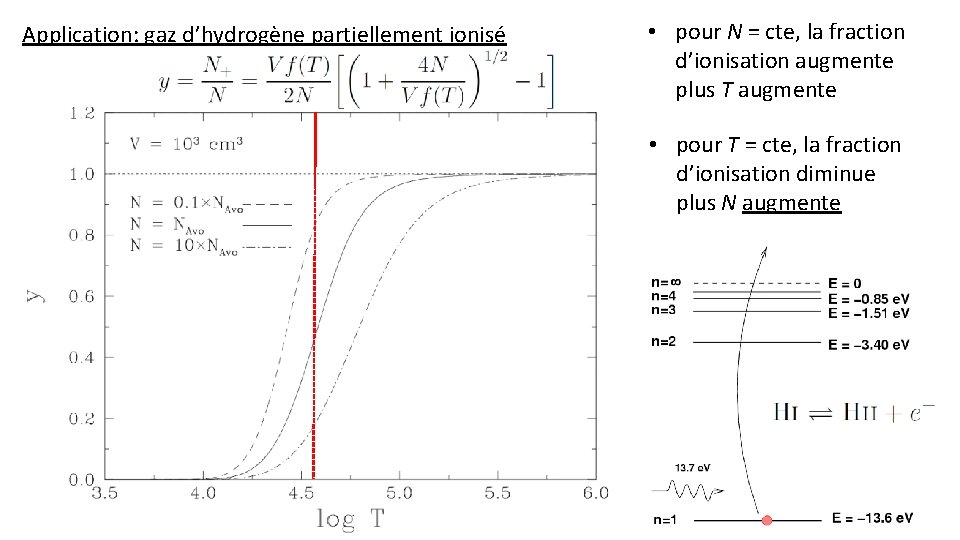
Application: gaz d’hydrogène partiellement ionisé sont reliés par l’équation de Saha : De plus nous devons avoir la neutralité électrique du gaz : Soit la fraction des atomes d’hydrogène ionisés : On obtient à partir de ces définitions que : constante du problème

Application: gaz d’hydrogène partiellement ionisé Après un peu d’algèbre on obtient : Pour T >> : Pour T << :

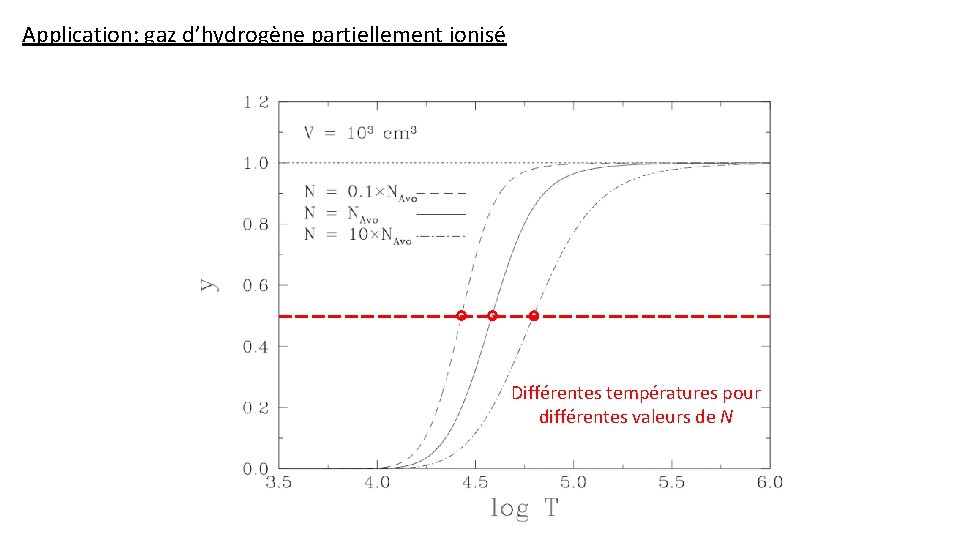
Application: gaz d’hydrogène partiellement ionisé • pour N = cte, la fraction d’ionisation augmente plus T augmente • pour T = cte, la fraction d’ionisation diminue plus N augmente

Application: gaz d’hydrogène partiellement ionisé Pression

Application: gaz d’hydrogène partiellement ionisé Énergie énergie de l’état fondamental

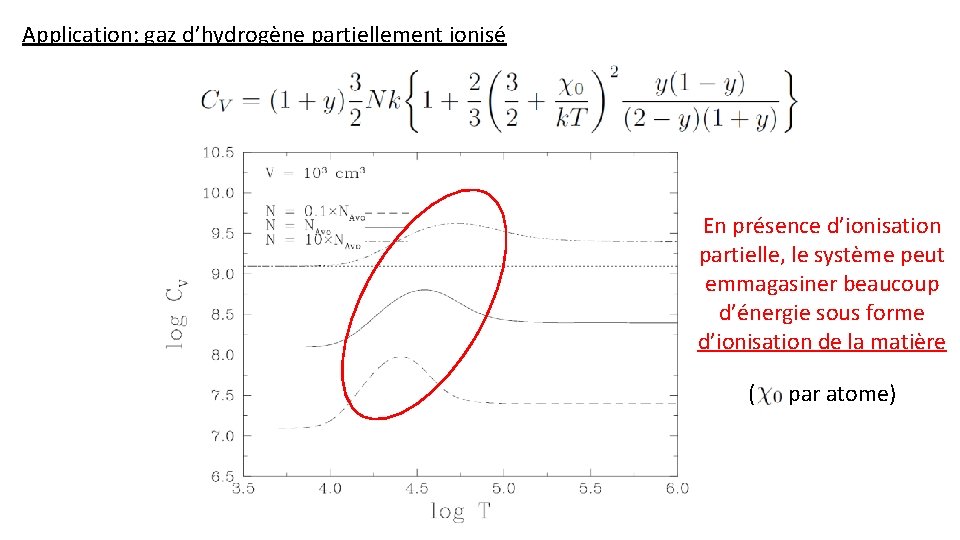
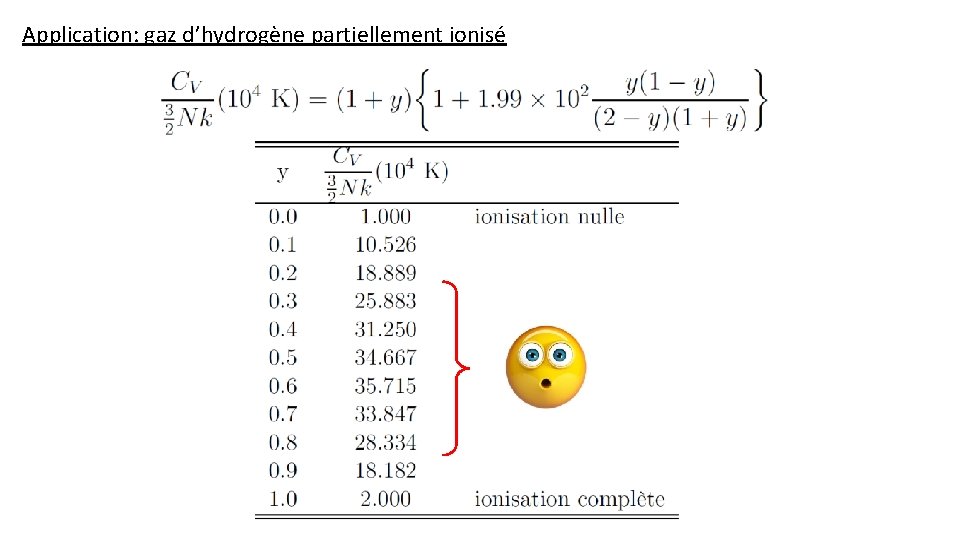
Application: gaz d’hydrogène partiellement ionisé Chaleur spécifique à volume constant = cte Passe par un maximum quand

Application: gaz d’hydrogène partiellement ionisé Différentes températures pour différentes valeurs de N

Application: gaz d’hydrogène partiellement ionisé En présence d’ionisation partielle, le système peut emmagasiner beaucoup d’énergie sous forme d’ionisation de la matière ( par atome)

Application: gaz d’hydrogène partiellement ionisé

Application: gaz d’hydrogène partiellement ionisé