Les proprits des solutions 2 Proprits des acides






















- Slides: 30

Les propriétés des solutions • 2. Propriétés des acides, des bases et des sels • 3. La concentration • 4. Le p. H et les indicateurs acido-basiques • 5. Les réactions chimiques • 6. Les substances chimiques et l ’environnement

Les propriétés des solutions Rappel sur les types de solutions • Solution : Mélange homogène, en phase gazeuse, liquide ou solide, d’au moins deux substances. • Solvant : Constituant qui est présent en plus grande quantité et qui se trouve dans le même état physique la solution. • Soluté : Toute substance qui peut être dissoute dans le solvant. • Lorsque le solvant utilisé est de l’eau, on appelle cette solution une solution aqueuse.

Les propriétés des solutions • Quelques exemples de solutions

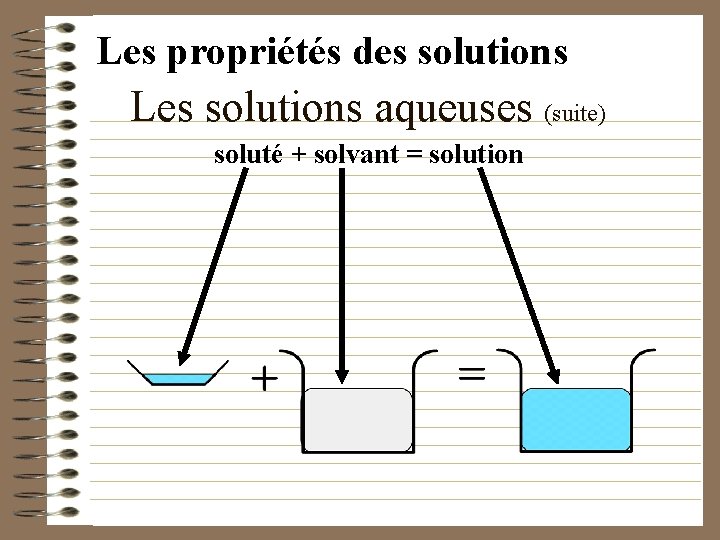
Les propriétés des solutions Les solutions aqueuses • Une solution est formée d ’un soluté et d ’un solvant. • On utilise habituellement moins de soluté que de solvant. Ex: . Une solution de jus d ’orange, est formée de soluté, la poudre de jus, et de solvant, l ’eau.

Les propriétés des solutions Les solutions aqueuses (suite) soluté + solvant = solution

Les propriétés des solutions La concentration • La concentration d ’une solution se calcule en divisant la quantité de soluté par la quantité de solution. Concentration = quantité de soluté quantité de solution 40 grammes 0, 5 g 80 ml ml

Les propriétés des solutions La concentration (suite) • La concentration peut s ’exprimer… en g/m. L, en g/L, en m. L/m. L en g/100 m. L ou % en g/1000000 m. L ou 1 mg/L ou 1 ppm en mol/L • Dans chaque cas c’est la quantité de soluté sur la quantité de solution.

Les propriétés des solutions La concentration d’une solution • La concentration molaire volumique : c = nb de moles de soluté = n (mol) volume de solution V (L) (mol/L) • Pourcentages massique, volumique et masse/volume % massique : masse de soluté (g) x 100 (s. u. ) masse de solution (g) % volumique : volume de soluté (m. L) x 100 (s. u. ) volume de solution (m. L) % masse/volume: masse soluté (g) 100 m. L de solution (g/100 m. L)

Les propriétés des solutions Quelques autres unités de concentration • Parties par million, milliard, billion – Parties par million = ppm – Parties par milliard = ppb (billion en anglais) – Parties par billion = ppt (trillion, en anglais) – 1 ppm = 1 mg/L (milligramme par litre de solution) – 1 ppb = 1 mg/L (microgramme par litre de solution) – 1 ppt = 1 ng/L (nanogramme par litre de solution) – Ces unités de concentrations sont valides pour des solutions aqueuses diluées. On fait l’approximation que 1 kg de solution est égal à 1 litre de solution.

Les propriétés des solutions Quelques autres unités de concentration • La molalité = moles de soluté = n (mol) masse de solvant (kg) masse (kg) (mol/kg) – C’est la seule unité de concentration où le dénominateur exprime la quantité de solvant plutôt que la quantité de solution. Ceci permet d’avoir une unité de concentration qui est indépendante de la température (le volume d’une solution dépend de la température).

Les propriétés des solutions Quelques autres unités de concentration • La fraction molaire c. A = nb de moles de A + nb de moles de B + nb de moles de C… – La fraction molaire est sans unité (mol/mol; les unités s’annulent) – La somme des fractions molaires de toutes les composantes de la solution est toujours égale à 1. – Le pourcentage molaire est sa fraction molaire multipliée par 100%. Voir exemples de calcul vus en classe.

Les propriétés des solutions La dilution • La dilution consiste à préparer, à partir d’une solution mère, une solution dont la concentration est moindre. • Méthode : introduire, à l’aide d’une pipette, un volume déterminé de solution mère dans une fiole jaugée, et ajouter de l’eau jusqu’au trait de jauge. • Constatation de base : le nombre de moles de soluté présent dans la solution diluée est le même que dans l’échantillon de solution mère prélevé.

Les propriétés des solutions La dilution • Les problèmes de dilution peuvent donc être résolus par une méthode algébrique avec la formule : cconc x Vconc = cdil x Vdil • SÉCURITÉ : La dilution d’un acide concentré dans l’eau produit un dégagement de chaleur. Cette chaleur peut amener l’eau à ébullition et causer des éclaboussures. On peut donc recevoir des gouttelettes de solution acide sur soi. Il est donc important de se rappeler cette règle de sécurité toute simple : «Acide dans l’eau, bravo! Eau dans l’acide, suicide! » Voir exemples faits en classe.

Les propriétés des solutions L’influence de la température sur la solubilité • La solubilité varie avec la température. • Il existe une relation entre le sens de cette variation et l’effet de la température sur la solubilité : – si DH > 0 (processus endothermique), la solubilité augmente avec la température – si DH < 0 (processus exothermique), la solubilité diminue avec une augmentation de la température • Pour la plupart des composés solides, la solubilité augmente lorsque la température de la solution augmente.

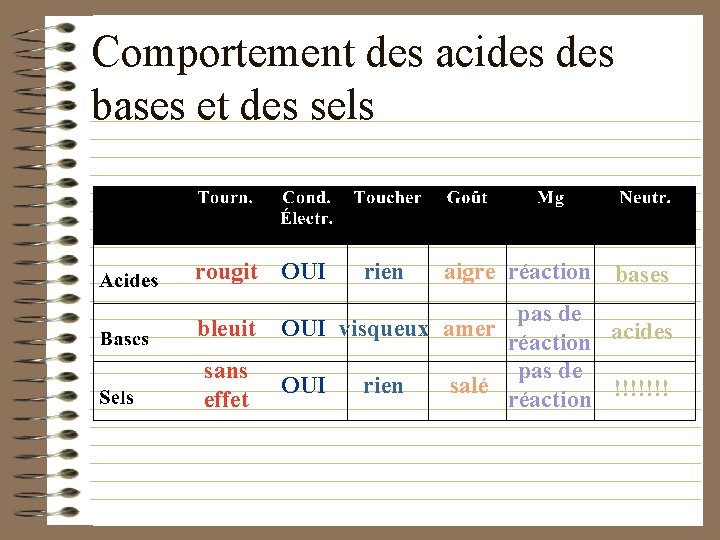
Comportement des acides bases et des sels rougit OUI rien aigre réaction bases pas de réaction acides pas de salé réaction !!!!!!! bleuit OUI visqueux amer sans effet OUI rien

Comportement des acides bases et des sels (suite) • Il faut que les substances soient en solution dans l ’eau pour manifester leur caractéristiques acido-basiques.

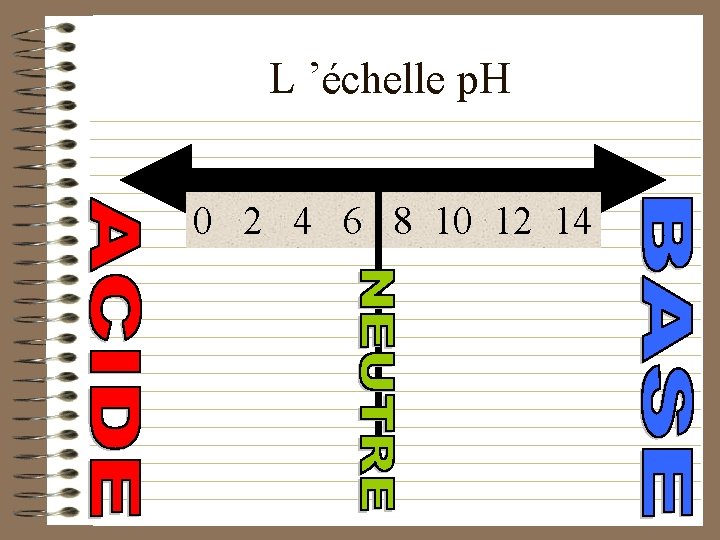
L ’échelle p. H 0 2 4 6 8 10 12 14

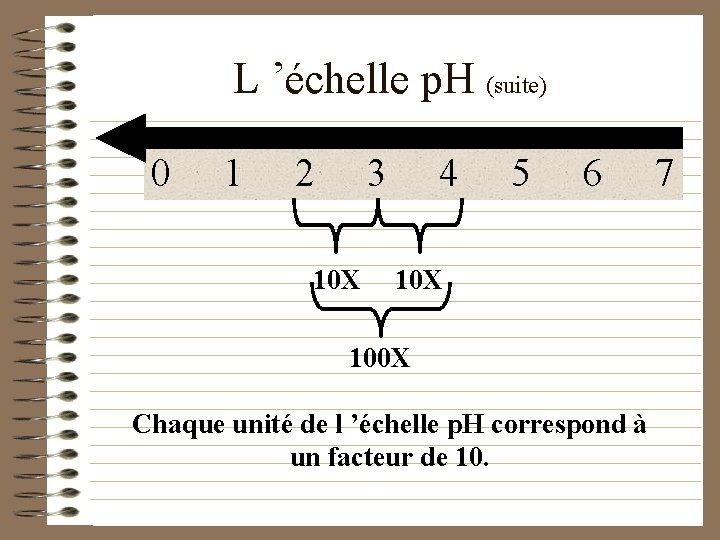
L ’échelle p. H (suite) 0 1 2 3 10 X 4 5 6 10 X 100 X Chaque unité de l ’échelle p. H correspond à un facteur de 10. 7

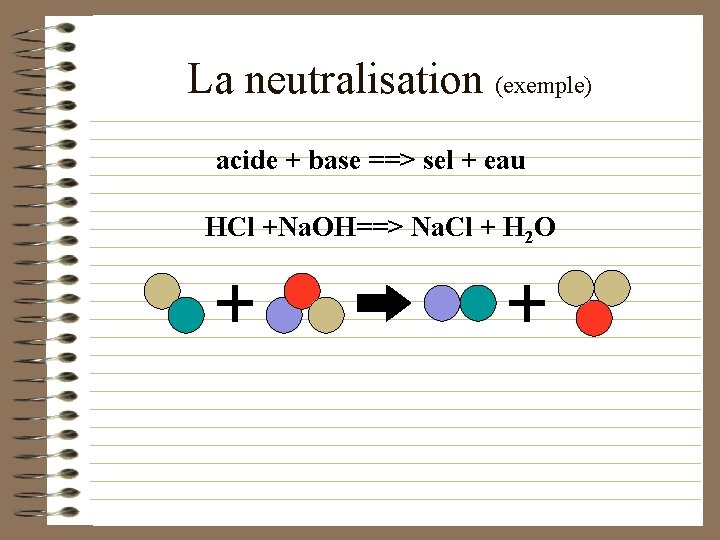
La neutralisation (définition) • Réaction par laquelle les acides et les bases réagissent ensemble. • Dans une neutralisation les réactifs (acide et base) perdent leurs propriétés respectives et forment des substances neutres.

La neutralisation (exemple) acide + base ==> sel + eau HCl +Na. OH==> Na. Cl + H 2 O

I - Le courant électrique dans les solutions. 1) Les solutions ioniques sont conductrices. • Voir TP chimie N° 2 • L’eau pure, l’eau sucrée ou l’huile contiennent des molécules : ce ne sont pas des soluti conductrices. • Les solutions qui contiennent ions des (solutions ioniques ) sont des solutions conductrices. Ex: eau salée, solution de sulfate de cuivre, …

Conclusion : Les solutions aqueuses doivent contenir des ions (particules chargées) pour être conductrices. Les solutions qui ne contiennent que des molécules ne sont pas conductrices.

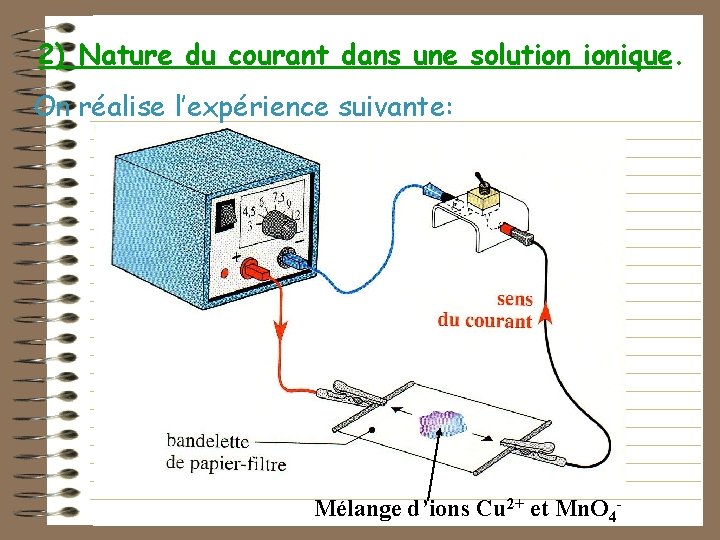
2) Nature du courant dans une solution ionique. On réalise l’expérience suivante: Mélange d’ions Cu 2+ et Mn. O 4 -

Voir la vidéo sur la migration des ions

Les ions cuivre Cu 2+, de couleur bleue, se sont déplacés dans le sens du courant, vers la borne – du générateur. • • Les ions permanganate Mn. O 4 -, de couleur violette, se sont déplacés dans le sens opposé à celui du courant, vers la borne +.

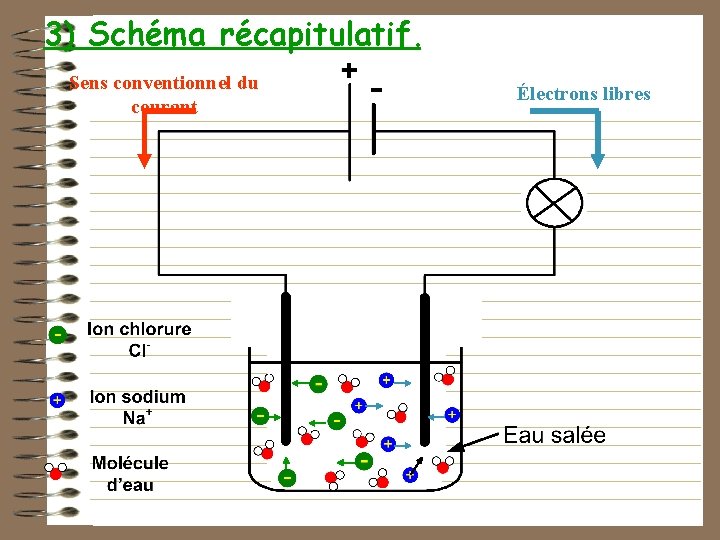
Conclusion : Dans les solutions aqueuses, le courant électrique est dû à un déplacement d’ions. Les ions positifs se déplacent dans le sens du courant (vers la borne -) et les ions négatifs dans le sens contraire (vers la borne +).

3) Schéma récapitulatif. Sens conventionnel du courant Électrons libres

Voir l’animation

Voir l’animation

Les substances chimiques et l ’environnement Les pluies acides sont produites par la combustion de non-métaux. Ces combustions produisent des oxydes acides tels que: . . . SO 2 NOx