Carlos Corra Reaces de oxidaoreduo Carlos Corra Departamento






























- Slides: 39

Carlos Corrêa – Reacções de oxidação-redução Carlos Corrêa Departamento de Química (FCUP) Centro de Investigação em Química (CIQ)

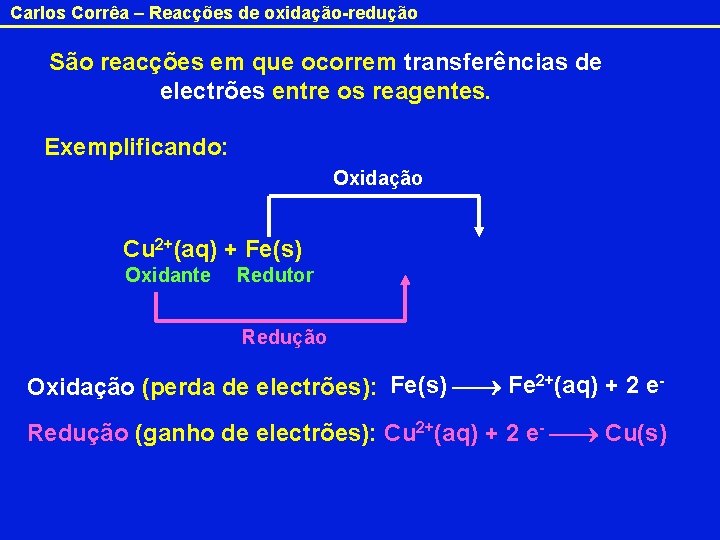
Carlos Corrêa – Reacções de oxidação-redução São reacções em que ocorrem transferências de electrões entre os reagentes. Exemplificando: Oxidação 2 e Cu 2+(aq) + Fe(s) Cu(s) + Fe 2+(aq) Oxidante Redutor Redução Oxidação (perda de electrões): Fe(s) Fe 2+(aq) + 2 e. Redução (ganho de electrões): Cu 2+(aq) + 2 e- Cu(s)

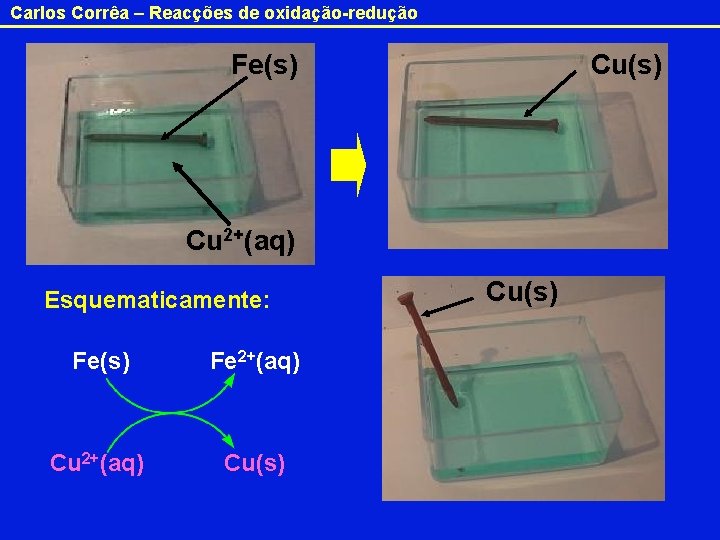
Carlos Corrêa – Reacções de oxidação-redução Fe(s) Cu 2+(aq) Esquematicamente: Fe(s) Fe 2+(aq) Cu(s)

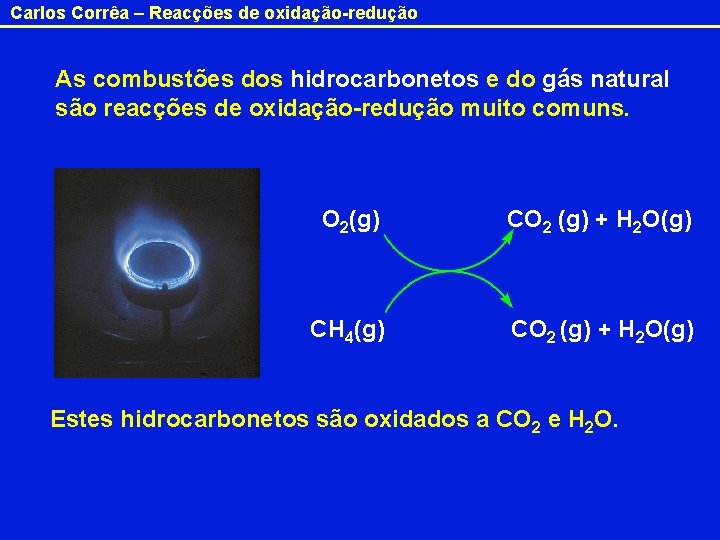
Carlos Corrêa – Reacções de oxidação-redução As combustões dos hidrocarbonetos e do gás natural são reacções de oxidação-redução muito comuns. O 2(g) CO 2 (g) + H 2 O(g) CH 4(g) CO 2 (g) + H 2 O(g) Estes hidrocarbonetos são oxidados a CO 2 e H 2 O.

Carlos Corrêa – Reacções de oxidação-redução Oxidação do cobre pelo catião prata Cu(s) Ag+(aq) Esquematicamente: Cu(s) Cu 2+(aq) Ag(s)

Carlos Corrêa – Reacções de oxidação-redução 2 Ag+(aq) + Cu(s) Cu 2+(aq) + 2 Ag(s) Vejamos a prata depositada sobre o cobre Clicar

Carlos Corrêa – Reacções de oxidação-redução É útil ter-se a noção de número de oxidação dos átomos nos diferentes compostos para verificar a ocorrências de reacções de oxidação-redução. Nos iões monoatómicos, o número de oxidação (n. o. ) do átomo é igual à sua carga: Cu 2+ n. o. = +2 Ag+ n. o. = +1 S 2 - n. o. = - 2 Em iões poliatómicos, como Hg 22+, o número de oxidação obtem-se dividindo a carga pelo número de átomos (neste caso, +2 / 2 = +1).

Carlos Corrêa – Reacções de oxidação-redução Em particulas (iónicas ou não) constituídas por átomos ligados por ligações covalentes, o número de oxidação de um átomo é a carga que esse átomo adquiria se os electrões das várias ligações covalentes fossem atribuídos aos átomos mais electronegativos. Electrões atribuídos ao cloro . . : H : Cl. . Ligação covalente Ficaria Átomo mais electronegativo H+. . ¯ : Cl: . . = Cl n. o. = +1 n. o. = -1 Cloro: Grupo 17 – 7 electrões de valência. Tem um electrão a mais: n. o. = -1.

Carlos Corrêa – Reacções de oxidação-redução Sulfureto de hidrogénio, H 2 S: Átomo mais electronegativo . . H: S. . : H Electrões atribuídos ao enxofre Ficaria H+ n. o. = +1 H+. . : S: . . n. o. = +1 Soma dos números de oxidação n. o. = -2 0 (Zero) Enxofre: Grupo 16 – 6 electrões de valência. Tem dois electrões a mais: n. o. = -2. Nas moléculas (neutras), a soma dos números de oxidação é igual zero.

Carlos Corrêa – Reacções de oxidação-redução Anião hidrogeno sulfureto, HS¯ : Átomo mais electronegativo . . H: S. . : Electrões atribuídos ao enxofre Ficaria H+. . : S: . . Soma dos números de oxidação n. o. = +1 n. o. = – 2 – 1 Nos iões poliatómicos, a soma dos números de oxidação é igual à carga do ião.

Carlos Corrêa – Reacções de oxidação-redução Estabelecimento dos números de oxidação a partir das fórmulas de estrutura: água e peróxido de hidrogénio. . . H–O. . – H Electrões atribuídos ao átomo mais electronegativo Átomo O rodeado por 8 electrões (ganhou 2) n. o. = -2 . . H–O. . – H. . . ou divididos pelos dois átomos. Cada átomo de O rodeado por 7 electrões (ganhou 1) n. o. = -1

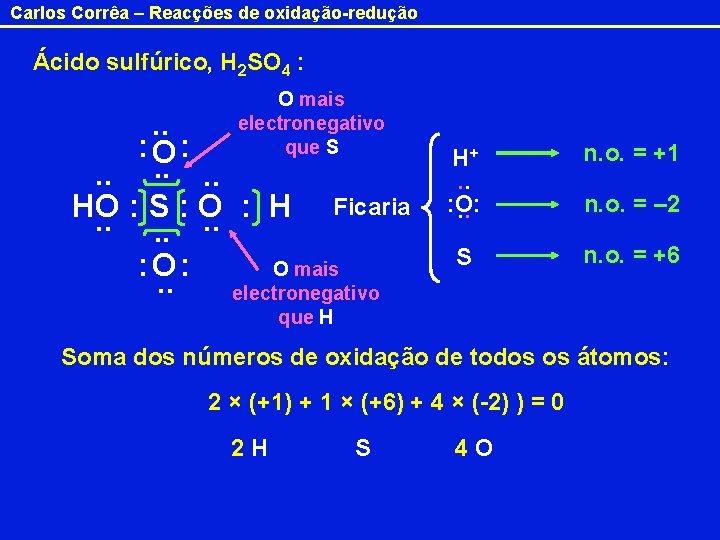
Carlos Corrêa – Reacções de oxidação-redução Ácido sulfúrico, H 2 SO 4 : O mais electronegativo que S . . : O: . . . Ficaria HO : S : O : H. . . : O: O mais. . electronegativo H+. . : O: . . n. o. = +1 S n. o. = +6 n. o. = – 2 que H Soma dos números de oxidação de todos os átomos: 2 × (+1) + 1 × (+6) + 4 × (-2) ) = 0 2 H S 4 O

Carlos Corrêa – Reacções de oxidação-redução Números de oxidação mais vulgares para alguns átomos Átomos n. o. Exemplos H 0 , +1 H 2, HCl, H 2 O O 0 , -2, -1 +1 O 2, H 2 O 2 Na. Cl, K 2 S Metais alcalinos Metais alcalino-terrosos +2 Mg. Cl 2, Ca. SO 4 Al +3 Al. Cl 3 A partitr do conhecimento dos números de oxidação destes átomos é possível, nos vários compostos, determinar os números de oxidação de outros átomos.

Carlos Corrêa – Reacções de oxidação-redução

Carlos Corrêa – Reacções de oxidação-redução Reacção H 2 O 2 + KI (meio ácido) -2 -1 H 2 O 2(aq) -1 I–(aq) H 2 O(l) (g) 0 I 2 (aq) CLICAR

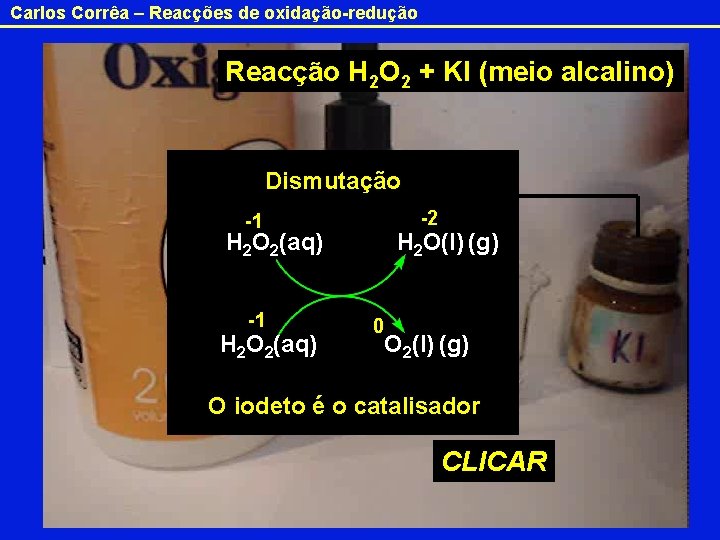
Carlos Corrêa – Reacções de oxidação-redução Reacção H 2 O 2 + KI (meio alcalino) Dismutação -2 -1 H 2 O 2(aq) H 2 O(l) (g) 0 O 2(l) (g) H 2 O 2 O iodeto é o catalisador CLICAR

Carlos Corrêa – Reacções de oxidação-redução Peróxido de hidrogénio (meio neutro) alcalino) Reacção He. Oiodeto + KI (meio 2 2 CLICAR

Carlos Corrêa – Reacções de oxidação-redução Calcular o número de oxidação do S no anião sulfato. Ácido sulfúrico: H 2 SO 4 Anião sulfato: SO 42 - SO 42 n. o. = x Carga n. o. = -2 Como a soma dos números de oxidação de todos os átomos é igual à carga do ião virá: x + 4 × ( -2) = -2 x = +6 (estes cálculos devem ser feitos mentalmente)

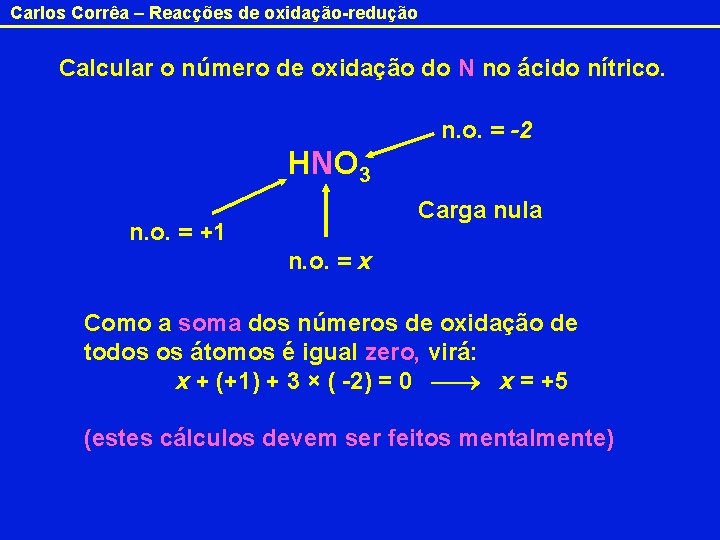
Carlos Corrêa – Reacções de oxidação-redução Calcular o número de oxidação do N no ácido nítrico. n. o. = -2 HNO 3 Carga nula n. o. = +1 n. o. = x Como a soma dos números de oxidação de todos os átomos é igual zero, virá: x + (+1) + 3 × ( -2) = 0 x = +5 (estes cálculos devem ser feitos mentalmente)

Carlos Corrêa – Reacções de oxidação-redução Outro modo de definir oxidação e redução Oxidação é um aumento do número de oxidação. n. o. = 0 Oxidação n. o. = +2 2 e Cu 2+(aq) + Zn(s) Cu(s) + Zn 2+(aq) n. o. = +2 Redução n. o. = 0 Redução é uma diminuição do número de oxidação.

Carlos Corrêa – Reacções de oxidação-redução Oxidação de Na. HSO 3 por KMn. O 4 (meio ácido) +7 Mn. O 4¯(aq) +4 HSO 3–(aq) +2 Mn 2+(aq) +6 SO 42– (aq) CLICAR KMn. O 4 (aq)

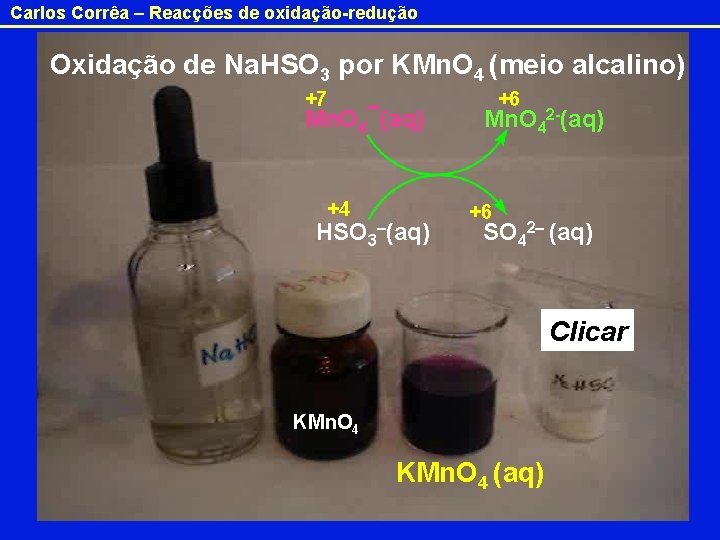
Carlos Corrêa – Reacções de oxidação-redução Oxidação de Na. HSO 3 por KMn. O 4 (meio alcalino) +7 Mn. O 4¯(aq) +4 HSO 3–(aq) +6 Mn. O 42 -(aq) +6 SO 42– (aq) Clicar KMn. O 4 (aq)

Carlos Corrêa – Reacções de oxidação-redução Notar que a força dos oxidantes e os produtos das suas reacções dependem da acidez do meio. Nas reacções observadas, o anião permanganato, Mn. O 4– (violeta) em meio ácido, originou o catião Mn 2+(solução incolor); em meio alcalino, originou o aníão manganato, Mn. O 42–(solução verde). Captados 5 electrões +7 Ácido +2 Mn. O 4¯(aq) Mn 2+(aq) +7 Alcalino +6 Mn. O 4¯(aq) Mn. O 42 -(aq) Captado 1 electrão

Carlos Corrêa – Reacções de oxidação-redução Vamos escrever as correspondentes equações: (× 2) Mn. O 4– + 8 H+ + 5 e– Mn 2+ + 4 H 2 O (meio ácido) (× 5) HSO 3– + H 2 O SO 42– + 3 H+ + 2 e– (meio ácido) 2 Mn. O 4– + 5 HSO 3– + H+ 2 Mn 2+ + 5 SO 42– + 3 H 2 O (× 2) Mn. O 4– + e– Mn. O 42– (meio alcalino) (× 1) HSO 3– + 3 HO– SO 42– + 2 H 2 O + 2 e– (meio alcalino) 2 Mn. O 4– + HSO 3– + 3 HO– 2 Mn. O 42– + SO 42– + 2 H 2 O

Carlos Corrêa – Reacções de oxidação-redução Oxidação de H 2 O 2 por KMn. O 4(meio ácido) +7 +2 Mn. O 4¯(aq) Mn 2+(aq) -1 H 2 O 2(aq) 0 O 2 (g) CLICAR H 2 O 2

Carlos Corrêa – Reacções de oxidação-redução Oxidação de H 2 O 2 por KMn. O 4(meio alcalino) +7 +4 Mn. O 4¯(aq) Mn. O 2(s) -1 H 2 O 2(aq) 0 O 2 (g) CLICAR

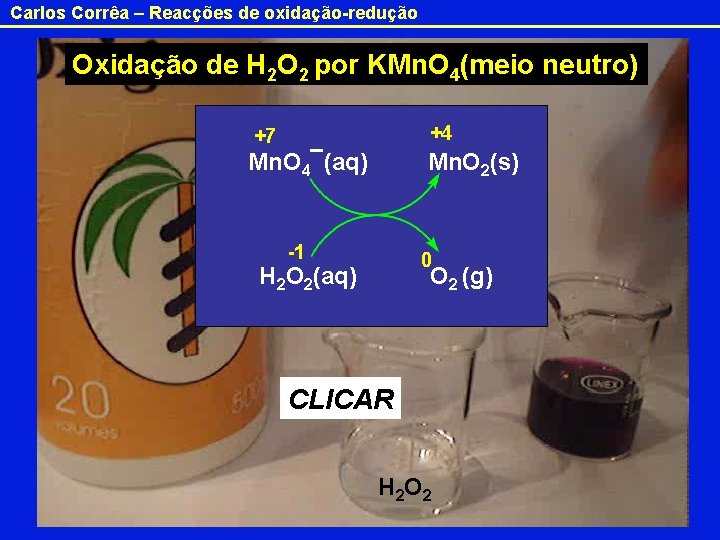
Carlos Corrêa – Reacções de oxidação-redução Oxidação de H 2 O 2 por KMn. O 4(meio neutro) +7 +4 Mn. O 4¯(aq) Mn. O 2(s) -1 0 H 2 O 2(aq) O 2 (g) CLICAR H 2 O 2

Carlos Corrêa – Reacções de oxidação-redução Vamos escrever as correspondentes equações: +7 +2 (× 2) Mn. O 4– + 8 H+ + 5 e– Mn 2+ + 4 H 2 O (meio ácido) -1 0 H 2 O 2 + 2 H+ + 2 e– (meio ácido) (× 5) 2 Mn. O 4– + 5 H 2 O 2 + 6 H+ 2 Mn 2+ + 5 O 2 + 8 H 2 O +4 +7 (× 2) Mn. O 4– + 2 H 2 O + 3 e– Mn. O 2+ 4 HO– (meio alcalino) (× 3) -1 H 2 O 2 + 2 HO– 0 O 2 + 2 H 2 O + 2 e– (meio alcalino) 2 Mn. O 4– + 3 H 2 O 2 2 Mn 2+ + 5 O 2 + 2 HO– + 2 H 2 O

Carlos Corrêa – Reacções de oxidação-redução Oxidação do Fe(II) por KMn. O 4 (em meio ácido) +2 +7 Mn. O 4¯(aq) +2 Fe 2+(aq) Mn 2+(aq) +3 Fe 3+ (aq) CLICAR

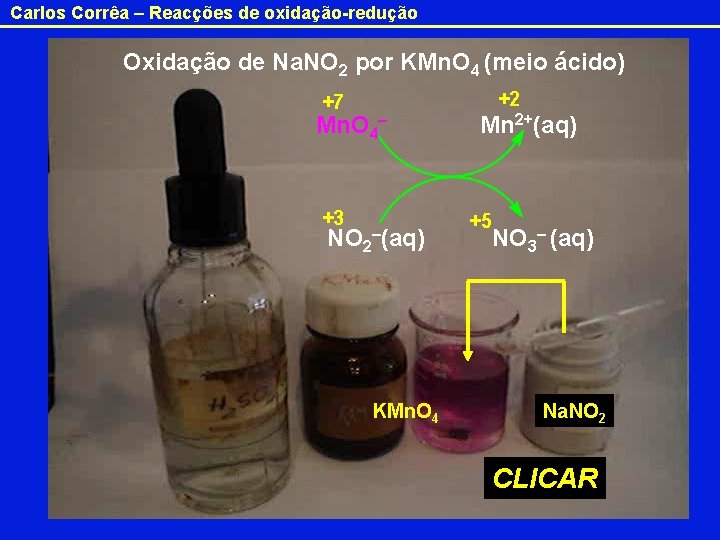
Carlos Corrêa – Reacções de oxidação-redução Oxidação de Na. NO 2 por KMn. O 4 (meio ácido) +2 +7 Mn. O 4– +3 NO 2 –(aq) KMn. O 4 Mn 2+(aq) +5 NO 3– (aq) Na. NO 2 CLICAR

Carlos Corrêa – Reacções de oxidação-redução Oxidação de Na. NO 2 por KMn. O 4(meio alcalino) KMn. O 4 Na. NO 2 CLICAR

Carlos Corrêa – Reacções de oxidação-redução Vamos escrever as correspondentes equações: +7 +2 (× 1) Mn. O 4– + 8 H+ + 5 e– Mn 2+ + 4 H 2 O (meio ácido) +2 (× 5) Fe 2+ +3 Fe 3+ + e– (meio ácido) Mn. O 4– + 5 Fe 2+ + 8 H+ Mn 2+ + 5 Fe 3+ + 4 H 2 O +7 (× 2) Mn. O 4 + 8 (× 5) +3 – H+ + 5 e– +4 Mn 2+ + 4 H 2 O (meio ácido) +5 NO 2– + H 2 O NO 3– + 2 H+ + 2 e– (meio ácido) 2 Mn. O 4– + 5 NO 2– + 6 H+ 2 Mn 2+ + 5 NO 3– + 3 H 2 O

Carlos Corrêa – Reacções de oxidação-redução Oxidação de Fe 2+ por K 2 Cr 2 O 7 (meio ácido) +6 Cr 2 O 7 2– (aq) +2 Fe 2+(aq) +3 Cr 3+(aq) +3 Fe 3+ (aq) CLICAR

Carlos Corrêa – Reacções de oxidação-redução Oxidação de Na. HSO Ácido 3 por K 2 Cr 2 O 7 (meio ácido) +6 Cr 2 O 7 2– (aq) +4 +3 Cr 3+(aq) +6 HSO 3–(aq) SO 42– (aq) Cr 2 O 72 -(aq) CLICAR

Carlos Corrêa – Reacções de oxidação-redução Oxidação de H 2 O 2 por K 2 Cr 2 O 7 (meio ácido) +6 Cr 2 O 7 2– (aq) -1 H 2 O 2(aq) +3 Cr 3+(aq) 0 O 2 (g) H 2 O 2 CLICAR

Carlos Corrêa – Reacções de oxidação-redução Vamos escrever as correspondentes equações: +6 +3 (× 1) Cr 2 O 72– + 14 H+ + 6 e– 2 Cr 3+ + 7 H 2 O (meio ácido) +2 Fe 2+ (× 6) +3 Fe 3+ + e– (meio ácido) Cr 2 O 72– + 6 Fe 2+ + 14 H+ 2 Cr 3+ + 6 Fe 3+ + 7 H 2 O +3 +6 (× 1) Cr 2 O 72– + 14 H+ + 6 e– 2 Cr 3+ + 7 H 2 O (meio ácido) +4 +6 (× 3) HSO 3– + H 2 O SO 42– + 3 H+ + 2 e– (meio ácido) Cr 2 O 72– + 3 HSO 3– + 5 H+ 2 Cr 3+ + 3 SO 42– + 4 H 2 O

Carlos Corrêa – Reacções de oxidação-redução Acerto de equações de oxidação-redução Cr 2 O 72– + 14 H+ + 6 e– 2 Cr 3+ + 7 H 2 O (meio ácido) Notar que o número de oxidação do Cr passa de +6 a +3 e, como são dois átomos de Cr, o número de electrões em jogo é de 2 x 3 = 6. Agora acertam-se as cargas com partículas H+. Terão de ser 14 H+ para dar uma carga 6+ no primeiro membro da equação (igual à carga 6+ do segundo membro - 2 Cr 3+). Finalmente acertam-se os átomos de hidrogénio: 7 moléculas de água = 14 átomos de hidrogénio.

Carlos Corrêa – Reacções de oxidação-redução Este é o melhor método para acertar equações de oxidação-redução: 1 – A partir da variação dos números de oxidação, escrever o número de elctrões em jogo. 2 – Acertar as cargas com H+ ou HO–. 3 – Acertar os átomos de H ou de O. Experimente e verifique como é fácil e cómodo.

Carlos Corrêa – Reacções de oxidação-redução
 Carlos corra
Carlos corra Carlos corra
Carlos corra Reaces
Reaces Reaces
Reaces Reaces
Reaces Multivaluado base de datos
Multivaluado base de datos Departamento forestal
Departamento forestal Zootecnia ufpr
Zootecnia ufpr Departamento del quiche
Departamento del quiche Departamentos en una empresa
Departamentos en una empresa Organigrama departamento de marketing
Organigrama departamento de marketing Departamento ceres
Departamento ceres Departamento de economia
Departamento de economia Departamento de higiene de los alimentos
Departamento de higiene de los alimentos Departamento de investigación en una agencia de publicidad
Departamento de investigación en una agencia de publicidad Preparatoria abierta gratuita
Preparatoria abierta gratuita Sesc - departamento nacional
Sesc - departamento nacional Departamento de housekeeping de un hotel
Departamento de housekeeping de un hotel El significado de departamento
El significado de departamento Potencialidad de cochabamba
Potencialidad de cochabamba La señora guajardo compra un departamento
La señora guajardo compra un departamento Organización del departamento de enfermería
Organización del departamento de enfermería Www.iessuel.org/ccnn
Www.iessuel.org/ccnn Objetivos del departamento de enfermería
Objetivos del departamento de enfermería Organigrama de departamento de contabilidad
Organigrama de departamento de contabilidad V
V Finestra terapeutica
Finestra terapeutica Departamento solicitante
Departamento solicitante Departamento ceres
Departamento ceres Rui carlos botter
Rui carlos botter Roberto carlos mi querido, mi viejo, mi amigo
Roberto carlos mi querido, mi viejo, mi amigo Carlos avila uniandes
Carlos avila uniandes Ies jci recursos
Ies jci recursos Hugo
Hugo Carlos mansilla herrera
Carlos mansilla herrera Carlos nalda
Carlos nalda Em que ano surgiu o futsal
Em que ano surgiu o futsal Carlos varela rpi
Carlos varela rpi Dr. carlos hermansen truan
Dr. carlos hermansen truan Carlos arias lopez
Carlos arias lopez


























































