Aula 7 Volumetria de OxidaoReduo Etapas de Anlise





















- Slides: 22

Aula 7 Volumetria de Oxidação-Redução

Etapas de Análise Química • • 1. Coleta de amostra: amostragem; 2. Preparo da amostra; 3. Preparo do extrato; 4. Análise do analito/composto de interesse. – Gravimetria; – Volumetria; – Instrumental ou Físico-químico.

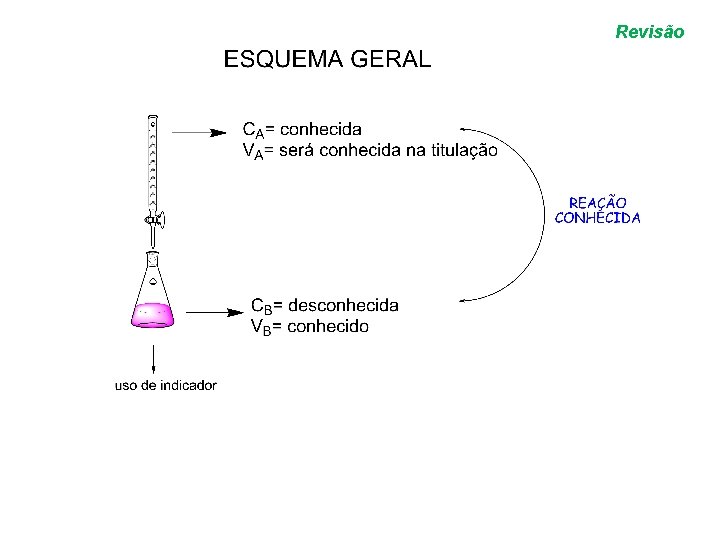
VOLUMETRIA Revisão • VOLUMETRIA: através de uma medida de volume determinamos qual a concentração desconhecida de uma solução.

Revisão

Aula de Hoje: Determinação do Carbono oxidável ou carbono orgânico em águas residuárias industriais.

• Emprego de reações químicas de oxi-redução para determinação de espécies químicas em solução • Reação de oxi-redução: são aquelas em que ocorrem transferência de elétrons entre as espécies envolvidas. • Oxidação: perda de elétrons. • Redução: ganho de elétrons.

• Agente oxidante: (que provoca oxidação)sofre a redução • Agente redutor: sofre a oxidação. • EX: Zn 0 + Cu 2+ Zn 2+ + Cu 0 • Zn 0 doa 2 e- para o Cu 2+ promove a redução do Cu. • Cu agente oxidante , retirou 2 e- do Zn.

Carbono Oxidável • No solo temos carbono , nas matérias orgânicas e carbonatos inorgânicos. • a determinação de carbono orgânico de amostras de efluente fornece uma medida rápida e confiável da soma dos poluentes orgânicos da água.

Como determinar o carbono oxidável ? • Podemos fazer uma reação entre o Dicromato de potássio e o carbono oxidável. 3 C o + 2 Cr 2 O 7 2 - +16 H+ Relação Estequiométrica: 3 Carbono: 2 Dicromato 4 Cr 3+ + 3 CO 2 + 8 H 2 O

Resumo das Etapas 1) Coleta o material que contem Carbono oxidável ou orgânico; 2) Extrato ou solução de extrato com C oxid. ; 3) Reação: entre o C oxid (da amostra) com Dicromato de potássio (em excesso) em meio ácido (Reação de oxi-redução, com relação estequiométrica 3 C: 2 Dicromato); 4) Titulação do excesso de Dicromato (K 2 Cr 2 O 7) com sulfato ferroso (Reação de oxi-redução, 6 Fe 2+ : 1 Cr 2 O 72 -)

• Como o Dicromato não é um bom padrão primário (para reagir com o Carbono), temos que fazer uma outra reação, em um BRANCO (ou seja, fazer todo o experimento, mas sem amostra)- para padronizar- determinar a concentração do dicromato. • Titulação com Dicromato e sulfato ferroso amoniacal (padrão primário).


• Reação na Volumetria entre Dicromato e o Ferro Cr 2 O 72 - + 6 Fe 2+ + 14 H+ Relação: 6 Fe 2+ : 1 Cr 2 O 7 2 - 2 Cr 3+ + 6 Fe 3+ + 7 H 2 O

Aula no 7 • Título: Determinação do carbono oxidável ou carbono orgânico em águas residuárias industriais. • Material Utilizado: resíduo A, B e C (efluentes de indústria alimentícia) e resíduo D vinhaça

• Procedimento (etapa já realizada): • 1. 1. Transferir a amostra do resíduo (que contem carbono orgânico) para Erlenmeyer de 300 m. L com tampa esmerilhada. (Para o resíduo: A e B = 10 m. L; C = 2, 5 m. L ou D = 25 m. L). • 1. 2. Acrescentar ao Erlenmeyer 50 m. L (que está em excesso) de solução de K 2 Cr 2 O 7 (aproximada. . . por isso fazer o “branco”) 0, 2 mol L-1 e 50 m. L de H 2 SO 4 concentrado. • 1. 3. Levar o Erlenmeyer para conjunto de aquecimento e deixar em ebulição por 30 minutos. (aqui já aconteceu a reação, o carbono já foi consumido e sobrou dicromato!) • 1. 4. Esperar esfriar e transferir o conteúdo do Erlenmeyer para balão volumétrico de 250 m. L (só transferiu e completou o volume. ). • 1. 5. Completar o volume do balão e homogeneizar a solução (solução -pós reação). Aguardar esfriar a solução e completar novamente o volume do balão.

• Procedimento (etapa já realizada): • 1. 6. Fazer uma prova em branco (para determinar a concentração exata do dicromato) adicionando a um Erlenmeyer com boca esmerilhada 50 m. L de K 2 Cr 2 O 7 0, 2 mol L-1, 50 m. L de H 2 SO 4 concentrado, aquecendo-se à ebulição por 30 minutos e transferir a solução obtida para um balão volumétrico de 250 m. L. Após esfriar, completar o volume do balão e retirar uma alíquota de 10, 0 m. L para a titulação com a solução padronizada de sulfato ferroso amoniacal. Anotar o volume consumido na titulação da prova “em branco”.

• Etapas a serem realizadas: • 2. 1. Transferir da solução de 10, 0 m. L da solução (pós reação que terminou no item 1. 5; aqui não tem mais carbono, já foi consumido na reação anterior. . . só (das soluções A, B, C ou D) para Erlenmeyer de 250– 300 m. L, adicionar 60 m. L de água destilada, 5 m. L de solução de H 3 PO 4 (1+1) e 5 gotas de solução de difenilamina sulfonato de bário (indicador). A solução adquire cor castanho. • 2. 2. Titular o excesso de K 2 Cr 2 O 7 contido no Erlenmeyer com solução padronizada de sulfato ferroso amoniacal (Fe (NH 4)2(SO 4)2 6 H 2 O) de concentração 0, 1000 mol L-1. Até a solução passar de arroxeado para verde puro estável. Anotar o volume gasto na titulação da amostra. tem excesso de dicromato que sobrou da reação com o carbono)

Resultados: • Calcular a concentração exata do dicromato de potássio, a partir do branco. • Calcular o teor de C orgânico ou oxidável presente no resíduo (para os 4 exemplos de amostras) em g L-1. (Tabelar) OBS: Para os cálculos usar o valor da prova em branco

Usar os dados abaixo para os cálculos: Resíduo Volume de sulfato ferroso gasto na titulação (em m. L) A 20, 0 B 17, 2 C 11, 5 D 15, 8 BRANCO 24, 5

Exemplo de cálculo- Branco Solução padrão Sulfato ferroso amoniacal (0, 1000 mol L-1) Relação Estequiométrica: 1 Dicromato: 6 Ferro gastou 27 m. L de sulfato ferroso para titular uma alíquota de 10 m. L de Dicromato. 1º ) Achar os mols de sulfato ferroso utilizado 2º ) dividir por 6 e achou o no de mols de dicromato na alíquota. 3º ) Achar o no de mols no total de 250 m. L. Esse será o total de mols INICIAL de Dicromato utilizado na reação

Exemplo de cálculo- Amostra Solução padrão Sulfato ferroso amoniacal (0, 1000 mol L-1) Relação Estequiométrica: 1 Dicromato: 6 Ferro gastou 12 m. L de sulfato ferroso para titular uma alíquota de 10 m. L de Dicromato (EXCESSO). 1º ) Achar os mols de sulfato ferroso utilizado; 2º ) ao dividir por 6, achou o no de mols de dicromato (EXCESSO na alíquota). 3º ) Achar no de mols na amostra total de 250 m. L. 4º ) Subtrair do Dicromato INICIAL (BRANCO) ; 5º ) Desta subtração vai achar o que foi consumido; 6º ) Multiplicar por 3 e dividido por 2, achará mols de C. 7º ) Pela MM do Carbono (12 g mol -1), achar em g de carbono. 8º ) E achar g L-1; pelo valor do resíduo utilizado no seu caso (ver procedimento item 1. 1).

10 m. L (ou 2, 5 m. L ou 25 m. L) ----- x g 1000 m. L --------------- Y Y= x g L-1 de C
 Anlise swot
Anlise swot Endotermicas
Endotermicas Volumetria de precipitação
Volumetria de precipitação Volumetria de precipitação
Volumetria de precipitação Titulação ácido-base
Titulação ácido-base Etapas de un cuento
Etapas de un cuento Triage
Triage Revelacion primitiva
Revelacion primitiva Quais são as etapas do catecumenato
Quais são as etapas do catecumenato Carlos serrador
Carlos serrador Eclesastica
Eclesastica Psicosociall
Psicosociall Qué inventos importantes se hicieron en el neolítico
Qué inventos importantes se hicieron en el neolítico Etapas de la historia de israel
Etapas de la historia de israel Características del proceso administrativo
Características del proceso administrativo Estructura argumentativa secuencial
Estructura argumentativa secuencial Etapas do catecumenato
Etapas do catecumenato La fe humana
La fe humana Triada de louis
Triada de louis Fase eliptica
Fase eliptica Etapas del puerperio
Etapas del puerperio La lectura interactiva
La lectura interactiva Crédito presupuestario
Crédito presupuestario









































