Aula 5 Volumetria de Neutralizao Etapas de Anlise



























- Slides: 31

Aula 5 Volumetria de Neutralização

Etapas de Análise Química • • 1. Coleta de amostra: amostragem; 2. Preparo da amostra; 3. Preparo do extrato; 4. Análise do analito/composto de interesse. – Gravimetria; – Volumetria; – Instrumental ou Físico-químico.

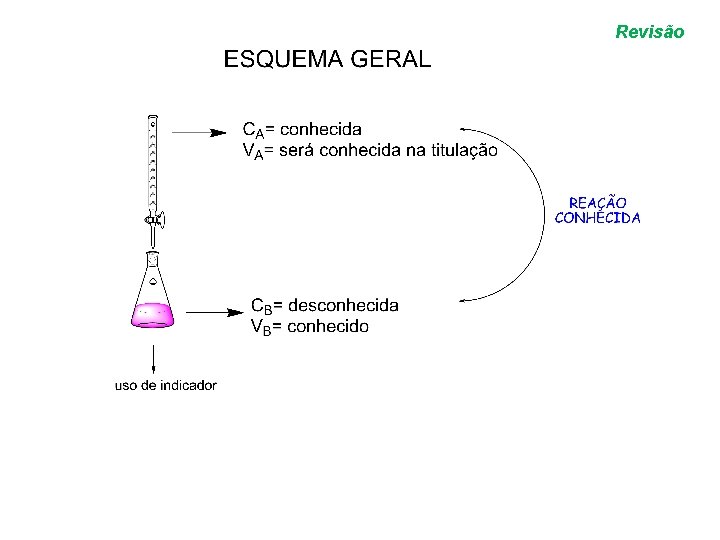
VOLUMETRIA Revisão • VOLUMETRIA: através de uma medida de volume determinamos qual a concentração desconhecida de uma solução.

Revisão

Aula de Hoje: Determinação do nitrogênio em material vegetal Aplicação: Acidimetria

• Aula de hoje: avaliação de folhas de material vegetal (folha de eucalipto, cana-de-açúcar, braquiaria e mandioca); • Deficiência em Nitrogênio: geralmente folhas amareladas.

Determinação do Nitrogênio em Material Vegetal • Para avaliação do estado nutricional das plantas é usual se fazer a determinação do teor de nitrogênio. • O nitrogênio pode aparecer na natureza sob várias formas e, entre elas, podem ser citadas:

• • N Total • • Vários Tipos de Nitrogênio: Nitrogênio Orgânico (aa, proteínas, comp. orgânicos); N 2 - ar; NO 3 – nitrato (NO 2 - nitrito se converte em nitrato, conservantes: salames, mortadelas); N- amoniacal (NH 4+); NH 2 (uréia) N -amídico

• Para se determinar o nitrogênio orgânico de um material deve-se primeiramente reduzi-lo à forma amoniacal o que é feito por digestão com ácido sulfúrico concentrado em presença de catalisadores. • (ETAPA JÁ REALIZADA NO PREPARO DO EXTRATO 2ª AULA)

• A determinação de qualquer das formas de nitrogênio envolve sempre como 1ª etapa a transformação da forma nitrogenada presente no material em nitrogênio amoniacal. • Em uma 2ª etapa se faz a transformação do NH 4+ (íon amônio) em NH 3 (amônia) gasoso e destilação.

• A transformação do NH 4+(amônio) em NH 3 (amônia)é feita por simples alcalinização da solução e posteriormente, o NH 3 é separado da solução por destilação.

Determinação do N em material Vegetal (método Kjedahl) • Resumo das Etapas • 1ª : FOLHA-N Transforma em N-amoniacal (digestão com ácido); aula 2; preparo do extrato, 6 horas EXTRATO DE FOLHA DE PLANTA • 2ª : reação NH 4+ (alcalinização) transforma NH 3; (amônia- gas) • 3ª : volatilização do NH 3 e destilação; • 4ª : recepção do NH 3 na solução que contém H 3 BO 3 (ác. Bórico) reage formando a base Borato H 2 BO 3 • 5ª : Titulação com ácido sulfúrico ( H 2 SO 4 ).

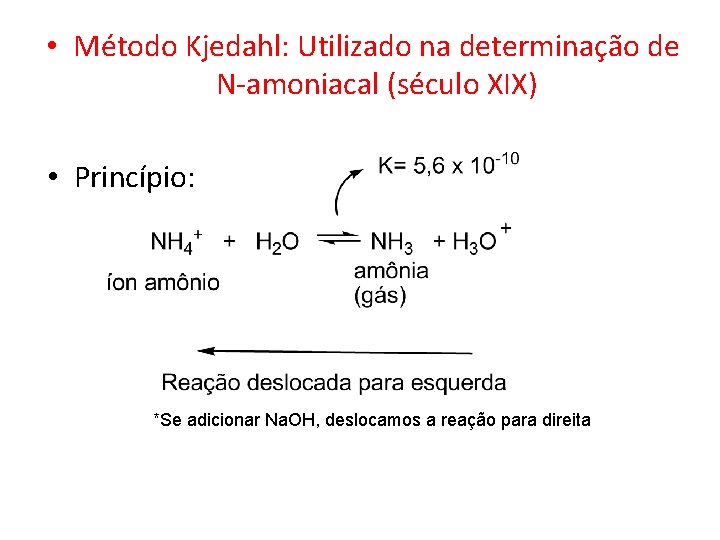
• Método Kjedahl: Utilizado na determinação de N-amoniacal (século XIX) • Princípio: *Se adicionar Na. OH, deslocamos a reação para direita



A determinação do NH 3 destilado reage com ácido bórico H 3 BO 3 (no Erlenmeyer), formando a base borato H 2 BO 3 - , e esta determinamos realizando uma titulação com uma solução padronizada de ácido forte (H 2 SO 4), conforme equações abaixo: 1 NH 3 + 1 H 3 BO 3 1 NH 4 + 1 H 2 BO 3 excesso + - 2 H 2 BO 3 - + 1 H 2 SO 4 2 H 3 BO 3 + SO 4 Relação Estequiométrica na Titulação: 2 Base: 1 ácido Quem será determinado será a Base borato H 2 BO 3 -

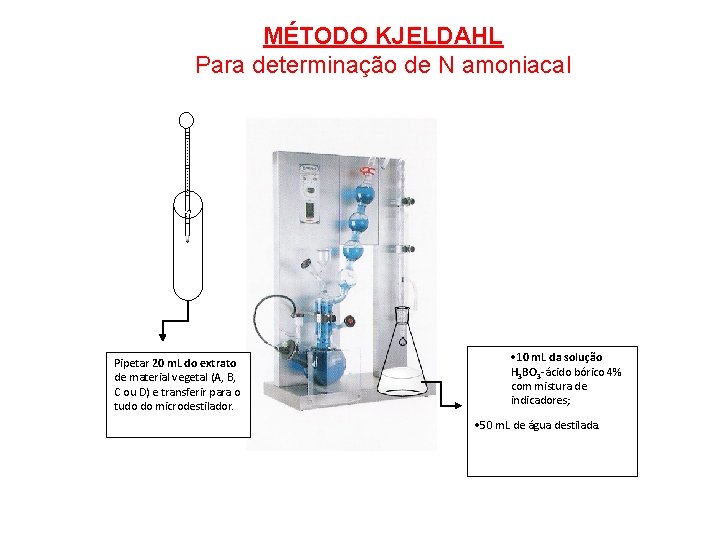
MÉTODO KJELDAHL Para determinação de N amoniacal Pipetar 20 m. L do extrato de material vegetal (A, B, C ou D) e transferir para o tudo do microdestilador. · 10 m. L da solução H 3 BO 3 -ácido bórico 4% com mistura de indicadores; · 50 m. L de água destilada.


Aula no 5 • Título: Determinação do nitrogênio em material vegetal. • Objetivo: • Introdução: • Material Utilizado:

• Procedimento: 1. Preparo do Extrato de material vegetal (Etapas já realizadas 2ª aula): 1. 1. Pesar 0, 5000 g de amostra seca e moída e transferir para frasco Kjeldahl de 100 m. L, acrescentar 10 m. L da mistura digestora. 1. 2. Levar os frascos a um micro–digestor e deixar que a digestão se processe até o material estiver totalmente digerido (bem claro, cerca 6 h). Deixar esfriar. 1. 3. Transferir para balões volumétricos de 50 m. L, completar o volume com água destilada e homogeneizar a solução.

• Procedimento 2. Determinação de N (Etapas a serem realizadas): SOLUCAO RECEPTORA 2. 1. Transferir 10 m. L da solução de H 3 BO 3 ac bórico 4% com mistura de indicadores para Erlenmeyer de 250 m. L. 2. 2. Acrescentar ao Erlenmeyer 50 m. L de água destilada. 2. 3. Levar o Erlenmeyer ao micro-destilador de forma que o tubo de saída do aparelho fique mergulhado na solução de H 3 BO 3 (solução receptora).

2. 4. Pipetar 20 m. L do extrato A ou B ou C ou D, e transferir para tubo de vidro do microdestilador; 2. 3. Acoplá-lo ao aparelho; acrescentar em seguida 20 m. L de Na. OH 10% (que está ao lado dos destiladores e será utilizada apenas pelos técnicos) e deixar destilar por 3 minutos. 2. 6. Destilar também uma prova em branco. (JÁ FEITO). O volume gasto foi 0, 2 m. L. 2. 7. Titular a solução contida no Erlenmeyer com solução padronizada de H 2 SO 4 0, 0500 mol L 1, até a cor azul mudar para rósea (ANOTAR O VOLUME GASTO).

• Resultados • Calcular o teor de N presente no material vegetal em % e em g Kg -1. • Conclusão

Resumo das Etapas 1ª : Transforma em N-amoniacal (digestão com ácido); 2ª : reação NH 4+ (alcalinização); 3ª : volatilização do NH 3 e destilação; 4ª : recepção do NH 3 na solução que contém H 3 BO 3 (ác. Bórico) reage formando a base Borato H 2 BO 3 • 5ª : Titulação com ácido sulfúrico- H 2 SO 4. • • •

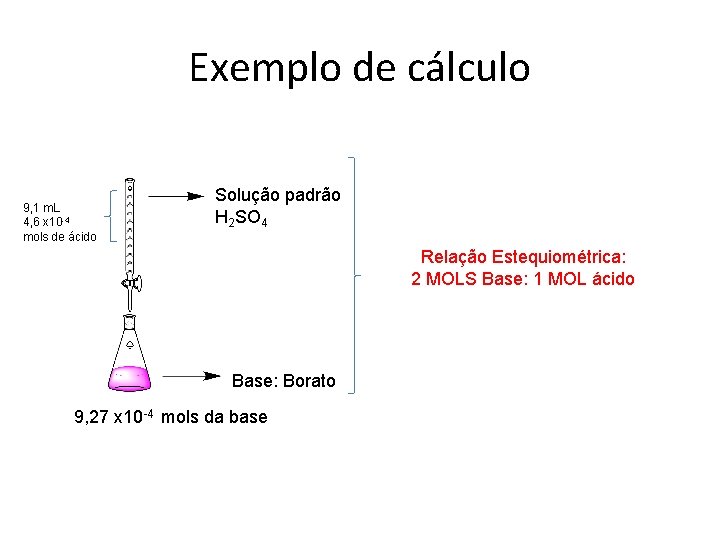
Exemplo de cálculo 9, 1 m. L 4, 6 x 10 -4 mols de ácido Solução padrão H 2 SO 4 Relação Estequiométrica: 2 MOLS Base: 1 MOL ácido Base: Borato 9, 27 x 10 -4 mols da base

O QUE EU DEVO PENSAR ? ? Em volumetria • Terminei o experimento. . . então começo a pensar de traz para frente. . . o que foi feito: • Quanto de volume eu utilizei na titulação: ver na bureta: ____; • Com esse volume calculo o numero de mols desta espécie química; • Sabendo a reação que aconteceu, calculo o numero de mols da outra espécie que reagiu; • E depois calculo concentração, diluição, %, etc

Padrão ácido- H 2 SO 4 Supondo que você tenha gasto na titulação 9, 1 m. L (- 0, 1 m. L Prova em Branco)= 9, 0 m. L Ou seja, na bureta que tinha ácido, você gastou isso de VOLUME NA SUA REAÇÃO ATE MUDAR DE COR (PONTO DE EQUILIBRIO) Exemplo M do acido = 0, 05150 mol L-1 ou seja, No mols= 0, 05150 x 9, 0 x 10 -3 = 4, 6 x 10 -4 mols de ácido Como a relação é : 1 ácido: 2 base Temos que no de mols da base será 4, 6 x 10 -4 x 2 = 9, 27 x 10 -4 mols da base Borato Como Base borato e NH 3 tem relação 1: 1 (NH 3 = 9, 27 x 10 -4 mols ) Como NH e NH+ tem relação 1: 1 (NH+ = 9, 27 x 10 -4 mols )

Considera que todo N amoniacal = N total Com o número de mols posso achar o valor em g Massa molar do Nitrogênio N 14 g –---- 1 mol X ------9, 27 x 10 -4 mols X= 1, 29 x 10 -2 = 0, 0129 g de N na amostra

No material Vegetal Etapa já realizada: 0, 500 g em 50 m. L X ----20 m. L (alíquota) X= 0, 2 g de material vegetal (levou para o tubo do microdestilador) 0, 2 g de material vegetal ----100 % de amostra vegetal 0, 0129 g de N na amostra ---X X= 6, 45 % de N na folha de bananeira

No material Vegetal, se temos: 0, 2 g de material vegetal----- 0, 0129 g de N em 1000 g de material vegetal----- X X= 64, 5 g Kg -1 de N na folha de bananeira

• ESQUECI DE EXPLICAR SOBRE A PROVA EM BRANCO. . • MAS este valor deve ser subtraído do volume antes de iniciar os cálculos. . (é como se fosse um “erro” do experimento). Ou seja, é feito um experimento igualzinho só que com água destilada ao invés de amostra de extrato de folha, e ao titular no final, usa-se 0, 2 m. L (ou seja este valor é um “erro “ considerado no experimento. . Ok?
 Anlise swot
Anlise swot Titulação ácido-base
Titulação ácido-base Ejemplo de reaccion exotermica
Ejemplo de reaccion exotermica Volumetria de precipitação
Volumetria de precipitação Fluoresceinato
Fluoresceinato Como colocar girafa na geladeira
Como colocar girafa na geladeira Fondos de pantalla depresivos
Fondos de pantalla depresivos Etapas del ciclo vital familiar
Etapas del ciclo vital familiar Epocas historicas
Epocas historicas Todas as etapas
Todas as etapas Etapas de antonio machado
Etapas de antonio machado Etapas de un cuento
Etapas de un cuento Paleolitico esquema
Paleolitico esquema Etapas de desarrollo preoperacional
Etapas de desarrollo preoperacional Biografía
Biografía Indutivo dedutivo
Indutivo dedutivo Gametognesis
Gametognesis Etapa previa del concurso mercantil
Etapa previa del concurso mercantil Etapas de la mariposa
Etapas de la mariposa Etapas del proceso grupal
Etapas del proceso grupal Función simbólica piaget
Función simbólica piaget Etapas del ciclo presupuestario en chile
Etapas del ciclo presupuestario en chile Teoría de sigmund freud
Teoría de sigmund freud Etapas de la modernización
Etapas de la modernización Etapas de machado
Etapas de machado Etapas de formação dos fósseis
Etapas de formação dos fósseis Pareja penal
Pareja penal Etapas del lavado de activos
Etapas del lavado de activos Grecia etapas
Grecia etapas Etapas del nihilismo
Etapas del nihilismo Etapas del presupuesto nacional argentino
Etapas del presupuesto nacional argentino Etapas de la reingenieria
Etapas de la reingenieria