Reaces Qumicas Unidade 3 Tipos de reaces qumicas





























- Slides: 36

Reacções Químicas Unidade 3 – Tipos de reacções químicas Unidade 4 – Velocidade das reacções químicas Unidade 5 – Explicação e representação das reacções químicas Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Tipos de reacções químicas Unidade 3 Ciências Fisico-Químicas 8. º ano — Universo da Matéria

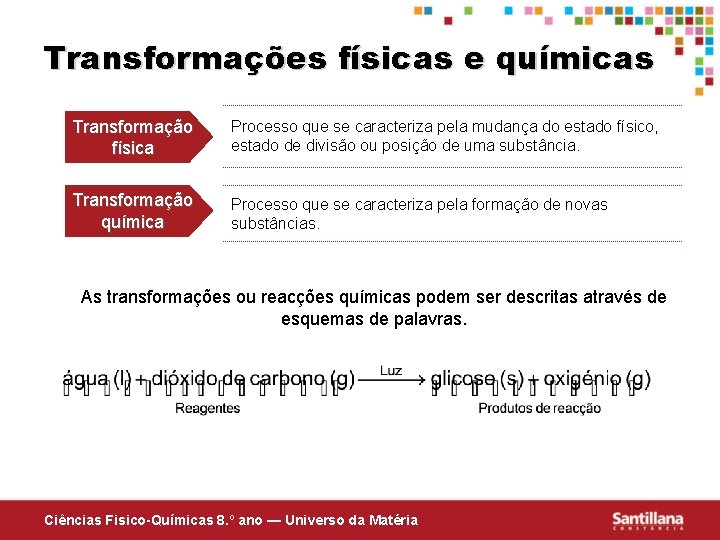
Transformações físicas e químicas Transformação física Processo que se caracteriza pela mudança do estado físico, estado de divisão ou posição de uma substância. Transformação química Processo que se caracteriza pela formação de novas substâncias. As transformações ou reacções químicas podem ser descritas através de esquemas de palavras. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Como detectar reacções químicas? A ocorrência de reacções químicas pode ser detectada de várias formas: § § § alteração de cor; variação de temperatura; variação de volume; libertação de um gás; aparecimento/desaparecimento de um sólido. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Reacções de combustão As reacções de combustão caracterizam-se pela combinação entre: § combustível – um material que arde; § comburente – oxigénio. Combustão do carbono (s) + oxigénio (g) Combustão do magnésio (s) + oxigénio (g) Combustão do enxofre Combustão do sódio dióxido de carbono (g) óxido de magnésio (s) enxofre (s) + oxigénio (g) dióxido de enxofre (g) enxofre (s) + oxigénio (g) trióxido de enxofre (g) sódio (s) + oxigénio (g) óxido de sódio (s) + oxigénio (g) peróxido de sódio (s) Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Importância das combustões Muitas combustões são utilizadas diariamente para obter energia. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Soluções ácidas Materiais de carácter ácido utilizados no dia-a-dia De um modo geral, as soluções ácidas apresentam as seguintes características: § têm sabor azedo; § reagem com os metais, produzindo hidrogénio; § conduzem a electricidade; § alteram a cor de certos corantes vegetais. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Soluções básicas ou alcalinas Materiais de carácter básico utilizados no dia-a-dia As soluções básicas ou alcalinas também possuem algumas características comuns: § têm sabor amargo; § são escorregadias ao tacto; § conduzem a electricidade; § alteram a cor de certos corantes vegetais. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Soluções neutras Materiais de carácter neutro utilizados no dia-a-dia Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Indicadores Os indicadores são substâncias naturais ou sintéticas cuja cor na presença de uma solução ácida, básica ou neutra é alterada. Os indicadores mais utilizados são a tintura azul de tornesol e a fenolftaleína. AZUL DE TORNESOL Solução ácida Solução neutra Solução básica A tintura azul de tornesol fica vermelha na presença de soluções ácidas, torna-se azul-arroxeada na presença de soluções neutras e não sofre alteraçõesde cor na presença de soluções básicas. FENOLFTALEÍNA Solução ácida Solução neutra Solução básica A fenolftaleína não sofre alterações de cor na presença de soluções ácidas ou neutras e fica carmim na presença de soluções básicas. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

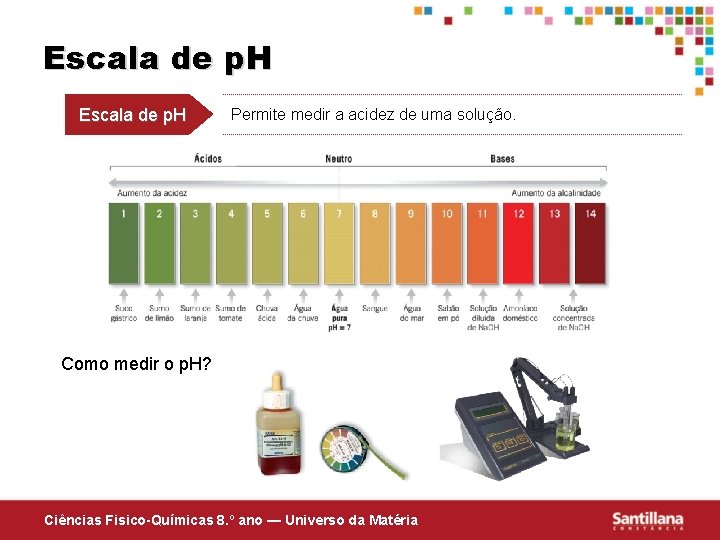
Escala de p. H Permite medir a acidez de uma solução. Como medir o p. H? Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Reacções ácido-base O esquema que traduz as reacções ácido-base é: ácido + base água + sal Exemplos ácido sulfúrico + hidróxido de potássio ácido clorídrico + hidróxido de sódio água + sulfato de potássio água + cloreto de sódio Variação do p. H numa reacção ácido-base Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Solução e solubilidade Solução Uma solução é uma mistura homogénea de duas ou mais substâncias. Solubilidade A solubilidade é a quantidade máxima de soluto que é possível dissolver numa certa quantidade de solvente, a uma dada temperatura. O sulfato de cobre é solúvel em água. Ciências Fisico-Químicas 8. º ano — Universo da Matéria O carbonato de cobre é insolúvel em água.

Reacções de precipitação Caracterizam-se pela formação de um precipitado – sólido pouco solúvel – obtido a partir de reagentes que se encontram dissolvidos. REACÇÕES DE PRECIPITAÇÃO Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Importância das reacções de precipitação Estalactites da gruta de Mira d’Aire Recife de corais Ciências Fisico-Químicas 8. º ano — Universo da Matéria

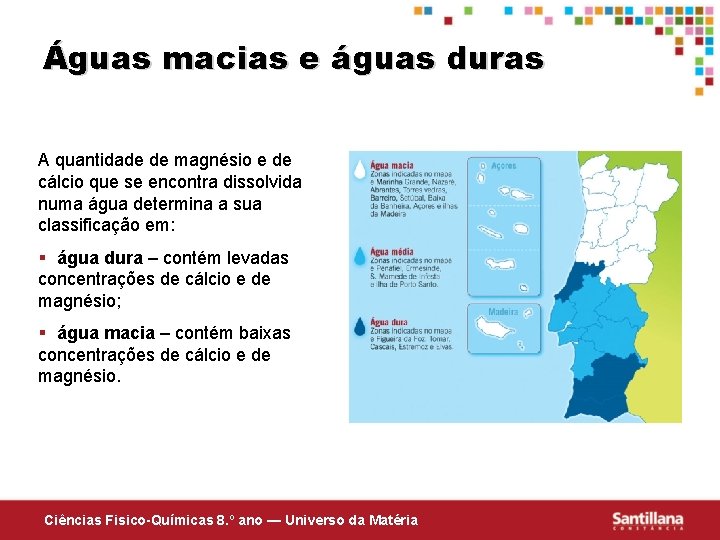
Águas macias e águas duras A quantidade de magnésio e de cálcio que se encontra dissolvida numa água determina a sua classificação em: § água dura – contém levadas concentrações de cálcio e de magnésio; § água macia – contém baixas concentrações de cálcio e de magnésio. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

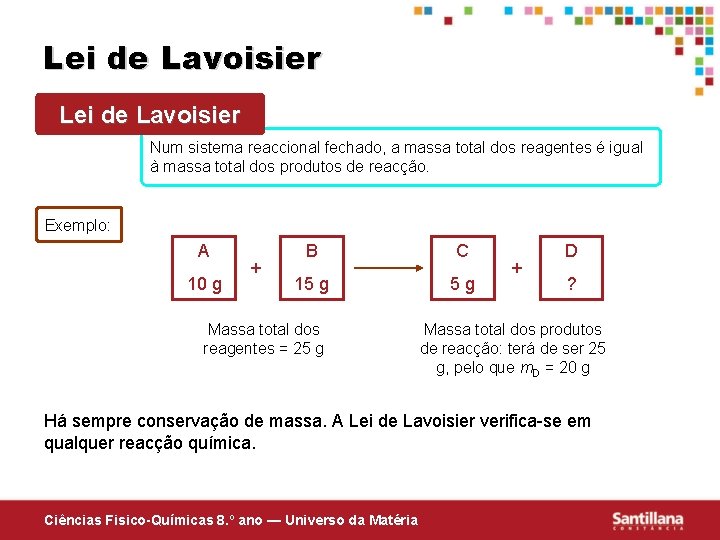
Lei de Lavoisier Num sistema reaccional fechado, a massa total dos reagentes é igual à massa total dos produtos de reacção. Exemplo: A 10 g + B C 15 g 5 g Massa total dos reagentes = 25 g + D ? Massa total dos produtos de reacção: terá de ser 25 g, pelo que m. D = 20 g Há sempre conservação de massa. A Lei de Lavoisier verifica-se em qualquer reacção química. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Velocidade das reacções químicas Unidade 4 Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Velocidade das reacções químicas Reacções lentas REACÇÕES QUÍMICAS Peças de ferro a enferrujar. Explosão. Formação de iodeto de chumbo. Reacções rápidas Formação de estalagmites. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Factores que influenciam a velocidade da reacção Os factores que influenciam a velocidade de uma reacção química são: § § § concentração dos reagentes; estado de divisão dos reagentes sólidos; temperatura do sistema reaccional; luz; presença de catalisadores. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Concentração dos reagentes De um modo geral, quanto maior for a concentração dos reagentes maior é a velocidade da reacção. Solução diluída de tiossulfato de sódio e ácido clorídrico. Solução concentrada de tiossulfato de sódio e ácido clorídrico. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Estado de divisão dos reagentes sólidos Quanto maior é o estado de divisão dos reagentes sólidos (maior su+erfície de contacto), maior é a velocidade da reacção. A combustão da serradura é mais rápida do que a de blocos de madeira. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Temperatura De um modo geral, quanto maior for a temperatura a que ocorre a reacção química, maior é a velocidade da reacção. O leite azeda e coalha mais rapidamente se estiver fora do frigorífico. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Luz A luz permite aumentar a velocidade de algumas reacções químicas. Os jornais ficam amarelados quando expostos à luz solar. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Explicação e representação das reacções químicas Unidade 5 Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Natureza corpuscular da matéria De acordo com a teoria cinéticocorpuscular: § toda a matéria é constituída por pequeníssimas partículas – corpúsculos; § a matéria é descontínua, pois entre os corpúsculos existem espaços vazios; § os corpúsculos estão em constante movimento; § os corpúsculos têm movimentos mais rápidos à medida que a temperatura aumenta. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Estados físicos da matéria ESTADO FÍSICO DA MATÉRIA Sólido Líquido Gasoso PROPRIEDADES §apresentam forma própria e volume constante; §São muito difíceis de comprimir; §São mais densos do que a maior parte dos líquidos e do que todos os gases. §apresentam a forma do recipiente onde se encontram; §têm volume constante; §São difíceis de comprimir. §apresentam a forma do recipiente onde se encontram; §têm volume variável; §São facilmente compressíveis. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

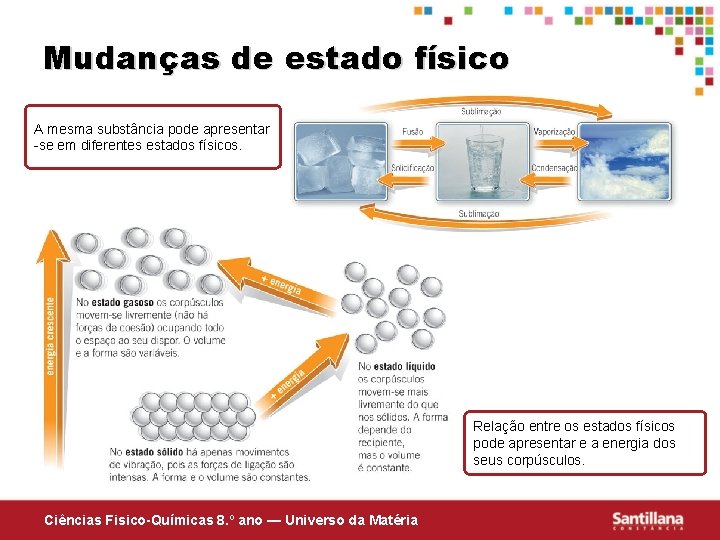
Mudanças de estado físico A mesma substância pode apresentar -se em diferentes estados físicos. Relação entre os estados físicos pode apresentar e a energia dos seus corpúsculos. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Pressão e quantidade de corpúsculos Quando se aumenta a quantidade de corpúsculos num recipiente com volume fixo, a pressão no interior daquele aumenta. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Pressão e volume de um gás Quando o volume de uma certa quantidade de gás diminui, a uma temperatura constante, a pressão exercida pelo gás aumenta. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Pressão e temperatura de um gás Quando se aumenta a temperatura de um volume fixo de gás, aumenta a pressão exercida pelo gás. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

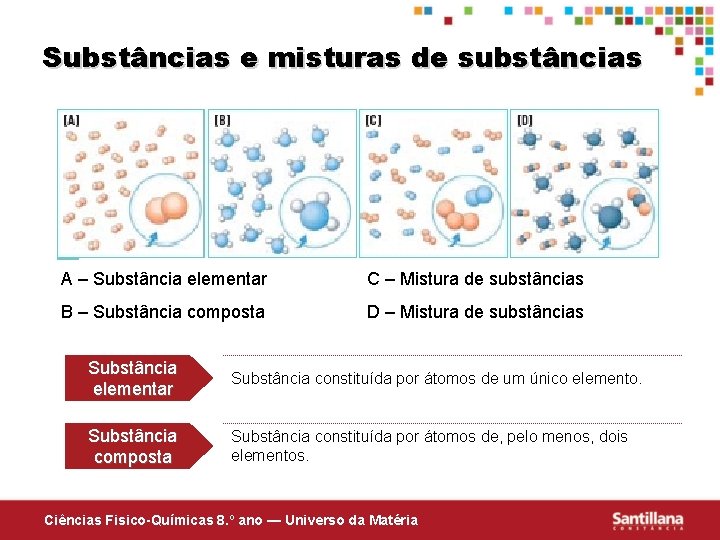
Substâncias e misturas de substâncias A – Substância elementar C – Mistura de substâncias B – Substância composta D – Mistura de substâncias Substância elementar Substância constituída por átomos de um único elemento. Substância composta Substância constituída por átomos de, pelo menos, dois elementos. Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Fórmulas químicas de substâncias moleculares NOME DA SUBST NCIA MOLECULAR UNIDADE ESTRUTURAL FÓRMULA QUÍMICA Oxigénio O 2 Hidrogénio H 2 Água H 2 O Amoníaco NH 3 Dióxido de carbono CO 2 Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Fórmulas químicas de substâncias moleculares TRÊS MOLÉCULAS DE ÁGUA QUATRO MOLÉCULAS DE OXIGÉNIO 3 H 2 O 4 O 2 DUAS MOLÉCULAS DE HIDROGÉNIO CINCO MOLÉCULAS DE AMONÍACO 2 H 2 5 NH 3 Ciências Fisico-Químicas 8. º ano — Universo da Matéria

Fórmulas químicas de substâncias iónicas SUBST NCIA IÓNICA Cloreto de sódio IÕES CONSTITUINTES Ião sódio Na+ Ião cloreto Cl- Dicromato de potássio Ião potássio K+ Ião dicromato Cr 2 O 72 Nitrato de cálcio Óxido de ferro(III) Ião cálcio Ca 2+ Ião nitrato NO 3 Ião ferro(III) Fe 3+ Ião óxido O 2 - Ciências Fisico-Químicas 8. º ano — Universo da Matéria FÓRMULA QUÍMICA Na. Cl K 2 Cr 2 O 7 Ca(NO 3)2 Fe 2 O 3

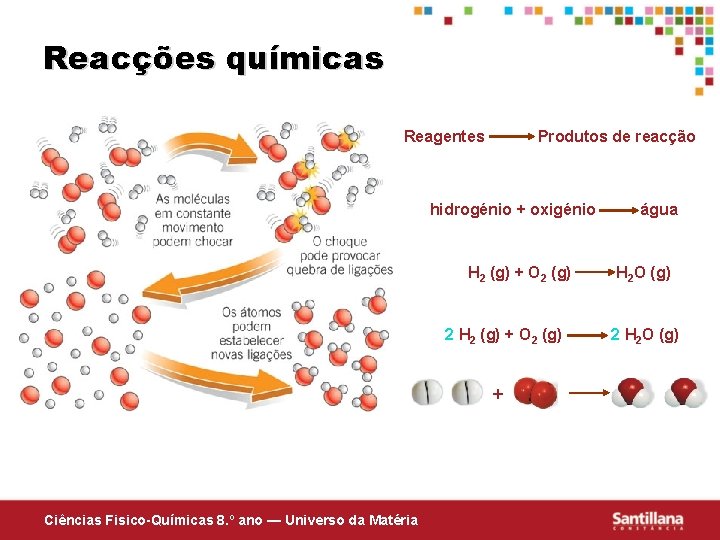
Reacções químicas Reagentes Produtos de reacção hidrogénio + oxigénio H 2 (g) + O 2 (g) 2 H 2 (g) + O 2 (g) + Ciências Fisico-Químicas 8. º ano — Universo da Matéria água H 2 O (g) 2 H 2 O (g)
 Qumicas
Qumicas Reaces
Reaces Reaces
Reaces Reaces
Reaces Maximização
Maximização Funcional dos seres vivos
Funcional dos seres vivos Din newton
Din newton Primeira unidade de conservação do brasil
Primeira unidade de conservação do brasil Simbolo unidade de medida
Simbolo unidade de medida Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Quando jesus passar
Quando jesus passar Constante de boltzmann unidade
Constante de boltzmann unidade Tkm 50
Tkm 50 Humildes pastores deixam seus rebanhos
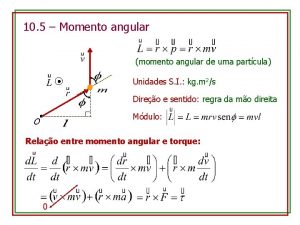
Humildes pastores deixam seus rebanhos Momento angular unidade
Momento angular unidade Unidade caloria
Unidade caloria Unidade central de processamento
Unidade central de processamento Unidade de medida
Unidade de medida Igreja nova oeiras
Igreja nova oeiras Mol
Mol Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Newton unidade
Newton unidade Ufersa tem peso
Ufersa tem peso Semntica
Semntica Unidades de pressão
Unidades de pressão Tipos de textos expositivos
Tipos de textos expositivos Tipos de nervaduras de las hojas
Tipos de nervaduras de las hojas Tipos de celulas
Tipos de celulas Verbos en español y ingles
Verbos en español y ingles Tipos de contusiones
Tipos de contusiones Tiene introducción desarrollo y cierre
Tiene introducción desarrollo y cierre Pleuromitosis
Pleuromitosis Multibanding fish
Multibanding fish Tipos de queresas
Tipos de queresas Subjetivemas tipos
Subjetivemas tipos Sujeito das orações
Sujeito das orações Tipos de lesion celular irreversible
Tipos de lesion celular irreversible