Captulo 20 Termodinmica Presentacin Power Point de Paul
























- Slides: 78

Capítulo 20 - Termodinámica Presentación Power. Point de Paul E. Tippens, Profesor de Física Southern Polytechnic State University © 2007

TERMODINÁMICA La termodinámica es el estudio de las relaciones de energía que involucran calor, trabajo mecánico y otros aspectos de energía y transferencia de calor. Calefacción central

Objetivos: Después de terminar esta unidad, deberá: • Establecer y aplicar la primera y segunda leyes de la termodinámica. • Demostrar su comprensión de los procesos adiabático, isocórico, isotérmico e isobárico. • Escribir y aplicar una relación para determinar la eficiencia ideal de una máquina térmica. • Escribir y aplicar una relación para determinar el coeficiente de rendimiento para un refrigerador.

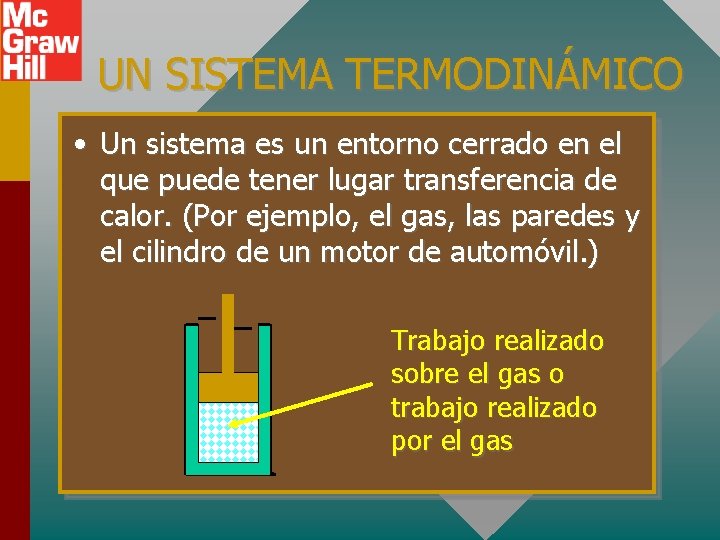
UN SISTEMA TERMODINÁMICO • Un sistema es un entorno cerrado en el que puede tener lugar transferencia de calor. (Por ejemplo, el gas, las paredes y el cilindro de un motor de automóvil. ) Trabajo realizado sobre el gas o trabajo realizado por el gas

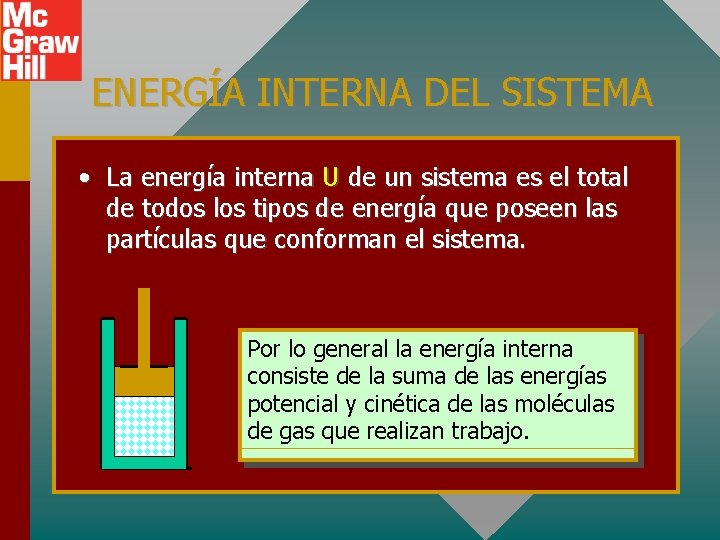
ENERGÍA INTERNA DEL SISTEMA • La energía interna U de un sistema es el total de todos los tipos de energía que poseen las partículas que conforman el sistema. Por lo general la energía interna consiste de la suma de las energías potencial y cinética de las moléculas de gas que realizan trabajo.

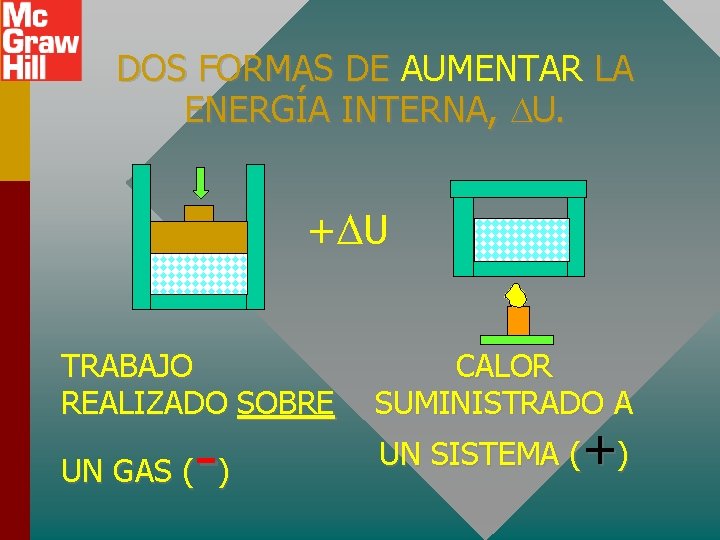
DOS FORMAS DE AUMENTAR LA ENERGÍA INTERNA, U. + U TRABAJO REALIZADO SOBRE - UN GAS ( ) CALOR SUMINISTRADO A UN SISTEMA (+)

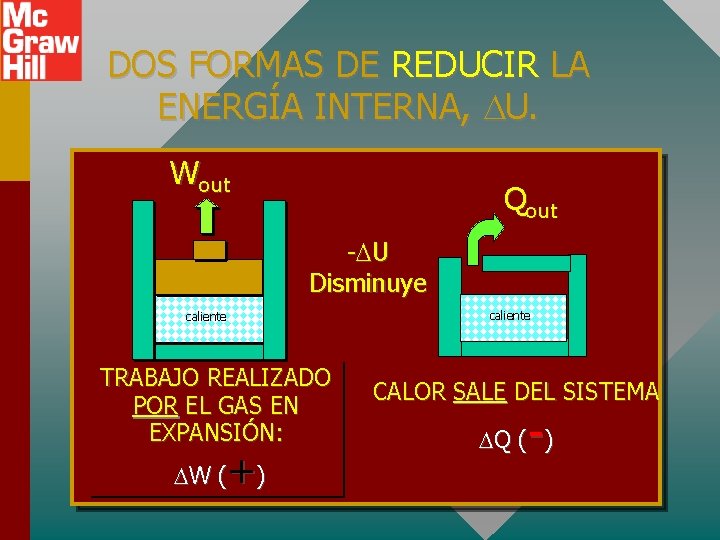
DOS FORMAS DE REDUCIR LA ENERGÍA INTERNA, U. Wout Qout - U Disminuye caliente TRABAJO REALIZADO POR EL GAS EN EXPANSIÓN: +) W ( CALOR SALE DEL SISTEMA - Q ( )

ESTADO TERMODINÁMICO El ESTADO de un sistema termodinámico se determina mediante cuatro factores: • • • Presión absoluta P en pascales Temperatura T en Kelvins Volumen V en metros cúbicos • Número de moles, n, del gas que realiza trabajo

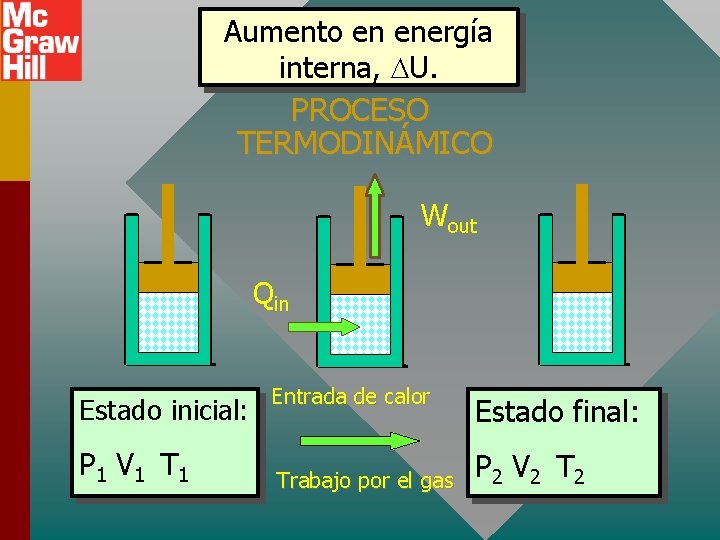
Aumento en energía interna, U. PROCESO TERMODINÁMICO Wout Qin Estado inicial: P 1 V 1 T 1 Entrada de calor Trabajo por el gas Estado final: P 2 V 2 T 2

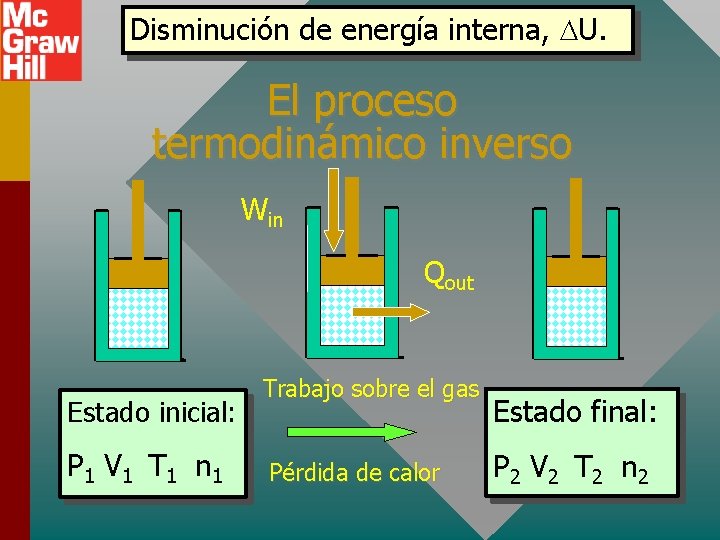
Disminución de energía interna, U. El proceso termodinámico inverso Win Qout Estado inicial: P 1 V 1 T 1 n 1 Trabajo sobre el gas Pérdida de calor Estado final: P 2 V 2 T 2 n 2

LA PRIMERA LEY DE LA TERMODINÁMICA: • La entrada neta de calor en un sistema es igual al cambio en energía interna del sistema más el trabajo realizado POR el sistema. Q = U + W final - inicial)

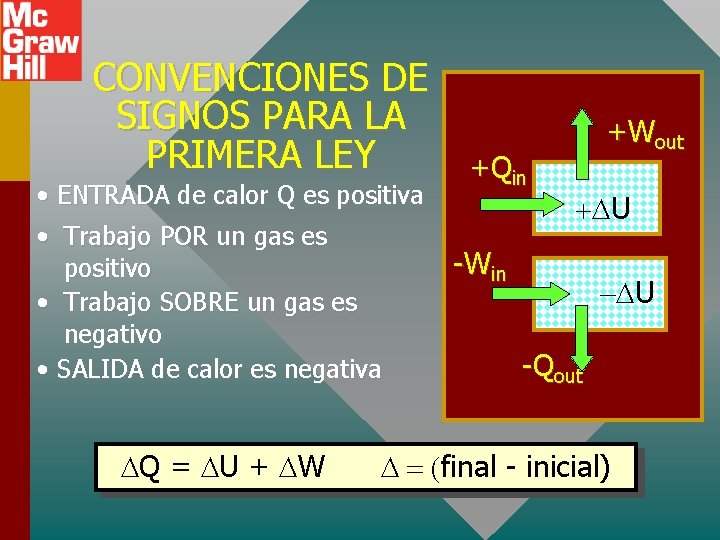
CONVENCIONES DE SIGNOS PARA LA PRIMERA LEY • ENTRADA de calor Q es positiva • Trabajo POR un gas es positivo • Trabajo SOBRE un gas es negativo • SALIDA de calor es negativa Q = U + W +Qin +Wout U -Win U -Qout final - inicial)

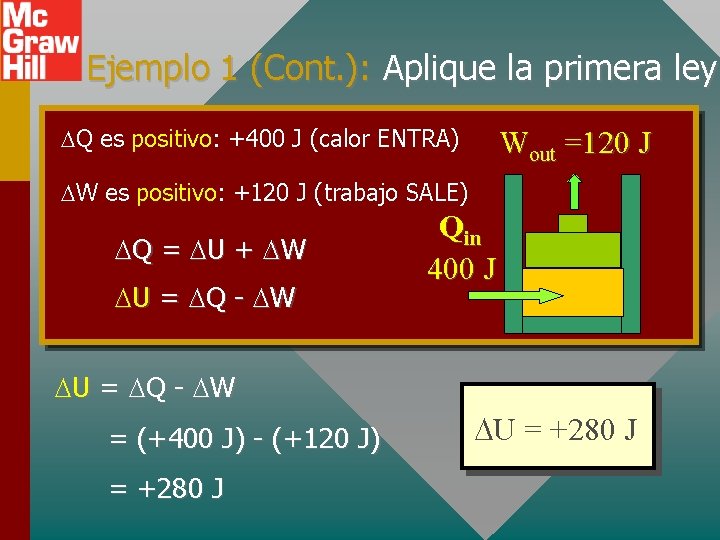
APLICACIÓN DE LA PRIMERA LEY DE LA TERMODINÁMICA Ejemplo 1: En la figura, el gas Wout =120 J absorbe 400 J de calor y al mismo tiempo realiza 120 J de trabajo sobre el pistón. ¿Cuál es el cambio en energía interna del sistema? Qin Aplique primera ley: Q = U + W 400 J

Ejemplo 1 (Cont. ): Aplique la primera ley Q es positivo: +400 J (calor ENTRA) Wout =120 J W es positivo: +120 J (trabajo SALE) Q = U + W U = Q - W = (+400 J) - (+120 J) = +280 J Qin 400 J U = +280 J

Ejemplo 1 (Cont. ): Aplique la primera ley La energía se conserva: Los 400 J de energía térmica de entrada se usan para realizar 120 J de trabajo externo, aumenta la energía interna del sistema en 280 J El aumento en energía interna es: Wout =120 J Qin 400 J U = +280 J

APLICACIÓN DE LA PRIMERA LEY DE LA TERMODINÁMICA Una máquina térmica realiza 240 J de trabajo durante el cual su energía interna disminuye en 400 J. ¿Cuál será el intercambio de calor neto de este proceso?

APLICACIÓN DE LA PRIMERA LEY DE LA TERMODINÁMICA Datos: Fórmula W = + 240 J Q = U+ W U = - 400 J Q =?

Sustitución: Q = U+ W= (-400 J) + (240 J) = -400 J + 240 J = -160 J El signo negativo del intercambio de calor indica que el calor neto es expulsado por el sistema. Si no hay cambio de fase, la temperatura del sistema disminuirá.

CUATRO PROCESOS TERMODINÁMICOS: • Proceso isocórico: • Proceso isobárico: V = 0, W = 0 P = 0 • Proceso isotérmico: T = 0, U = 0 • Proceso adiabático: Q = 0 Q = U + W

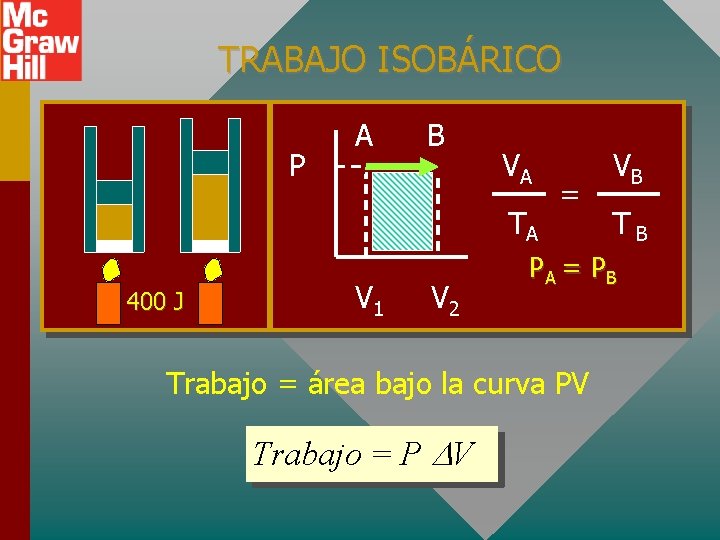
TRABAJO ISOBÁRICO Trabajo = área bajo la curva PV P = 0

TRABAJO ISOBÁRICO P A B VA TA 400 J V 1 V 2 = TB PA = P B Trabajo = área bajo la curva PV Trabajo = P V VB

PROCESO ISOBÁRICO: PRESIÓN CONSTANTE, P = 0 Q = U + W pero W = P V

PROCESO GENERAL:

PROCESO GENERAL:

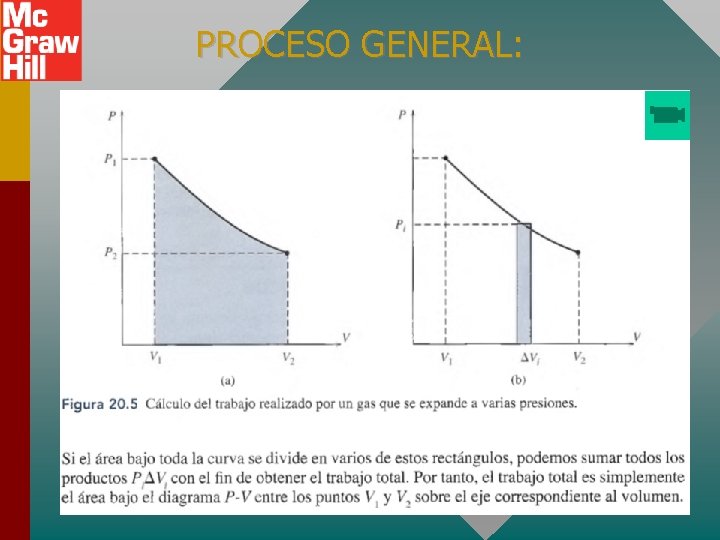
PROCESO GENERAL:

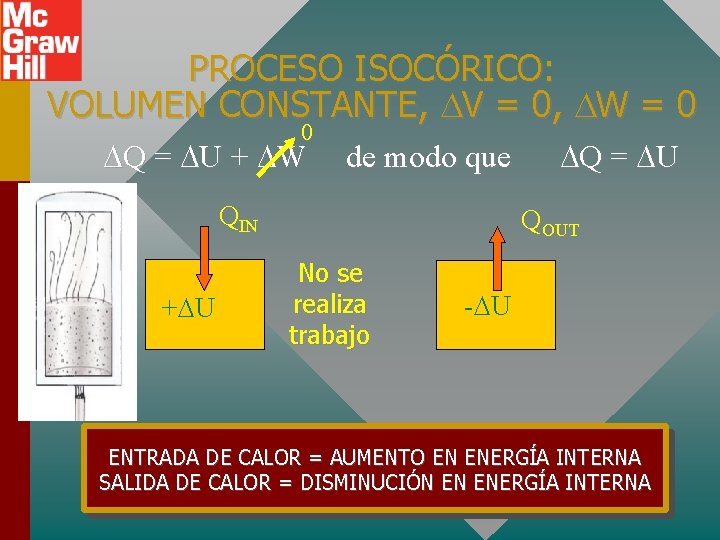
PROCESO ISOCÓRICO: VOLUMEN CONSTANTE, V = 0, W = 0 0 Q = U + W de modo que QIN + U Q = U QOUT No se realiza trabajo - U ENTRADA DE CALOR = AUMENTO EN ENERGÍA INTERNA SALIDA DE CALOR = DISMINUCIÓN EN ENERGÍA INTERNA

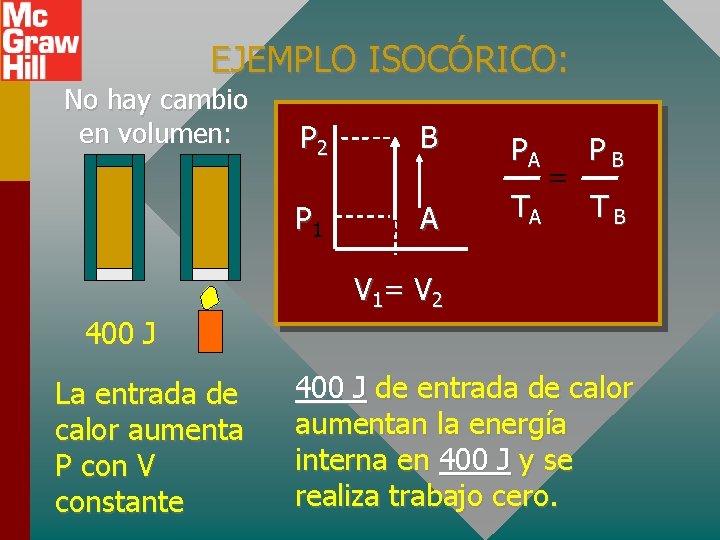
EJEMPLO ISOCÓRICO: No hay cambio en volumen: P 2 B P 1 A PA TA = PB TB V 1= V 2 400 J La entrada de calor aumenta P con V constante 400 J de entrada de calor aumentan la energía interna en 400 J y se realiza trabajo cero.

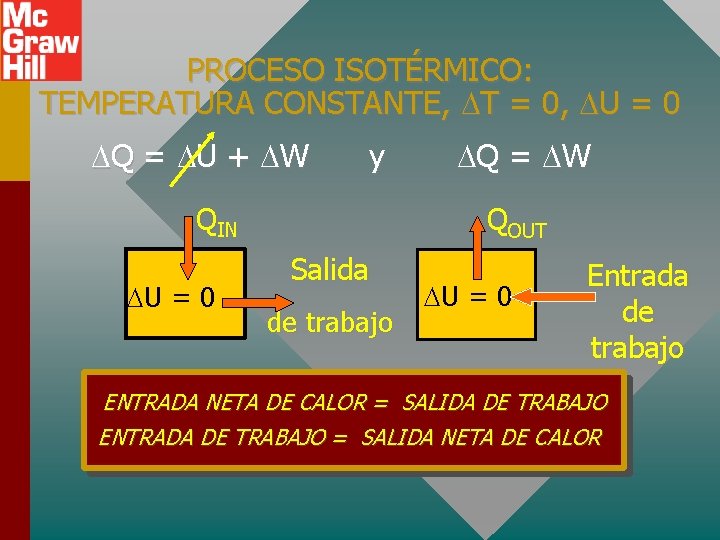
PROCESO ISOTÉRMICO: TEMPERATURA CONSTANTE, T = 0, U = 0 Q = U + W y Q = W QIN U = 0 QOUT Salida de trabajo U = 0 Entrada de trabajo ENTRADA NETA DE CALOR = SALIDA DE TRABAJO ENTRADA DE TRABAJO = SALIDA NETA DE CALOR

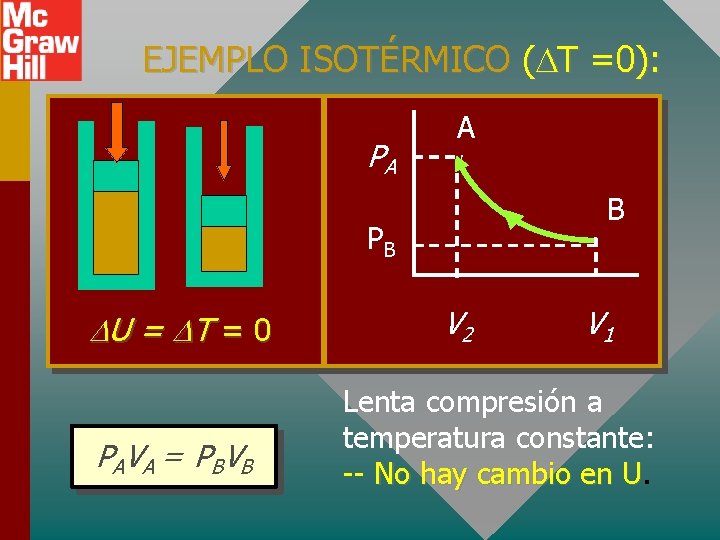
EJEMPLO ISOTÉRMICO ( T =0): PA A B PB U = T = 0 P A V A = PBV B V 2 V 1 Lenta compresión a temperatura constante: -- No hay cambio en U. U

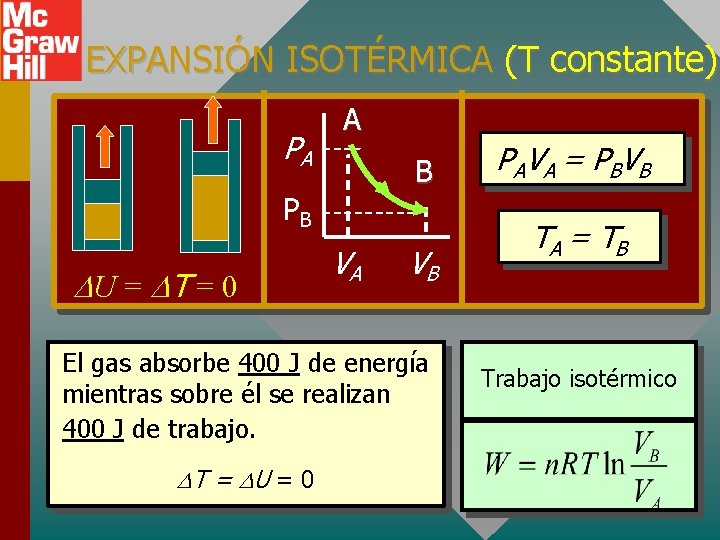
EXPANSIÓN ISOTÉRMICA (T constante): PA A B PB U = T = 0 VA VB El gas absorbe 400 J de energía mientras sobre él se realizan 400 J de trabajo. T = U = 0 PA V A = P BV B TA = T B Trabajo isotérmico

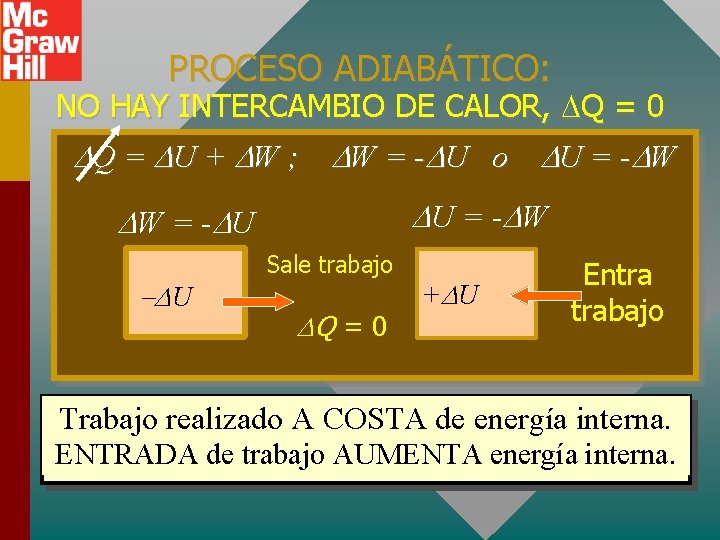
PROCESO ADIABÁTICO: NO HAY INTERCAMBIO DE CALOR, Q = 0 Q = U + W ; W = - U o U = - W W = - U U Sale trabajo Q = 0 + U Entra trabajo Trabajo realizado A COSTA de energía interna. ENTRADA de trabajo AUMENTA energía interna.

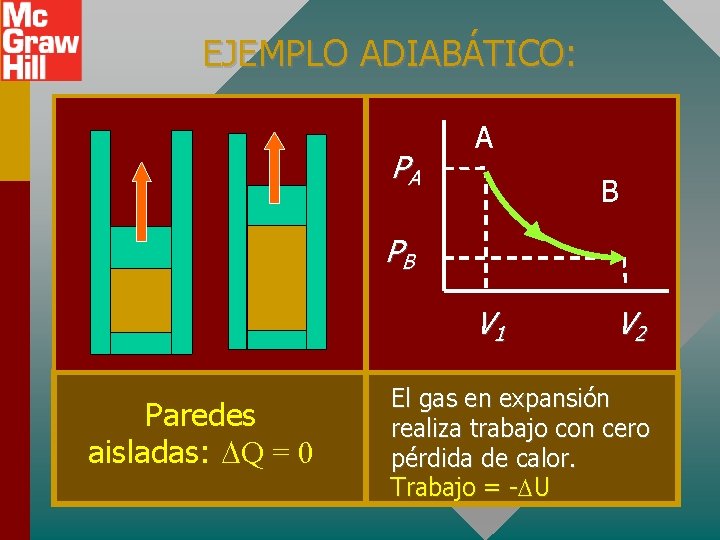
EJEMPLO ADIABÁTICO: PA A B PB V 1 Paredes aisladas: Q = 0 V 2 El gas en expansión realiza trabajo con cero pérdida de calor. Trabajo = - U

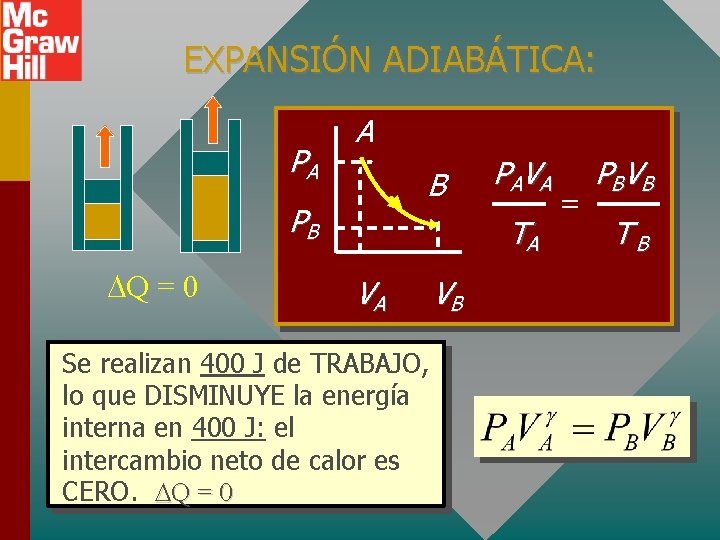
EXPANSIÓN ADIABÁTICA: PA A B PB Q = 0 PA V A TA VA Se realizan 400 J de TRABAJO, lo que DISMINUYE la energía interna en 400 J: el intercambio neto de calor es CERO. Q = 0 VB = PBV B TB

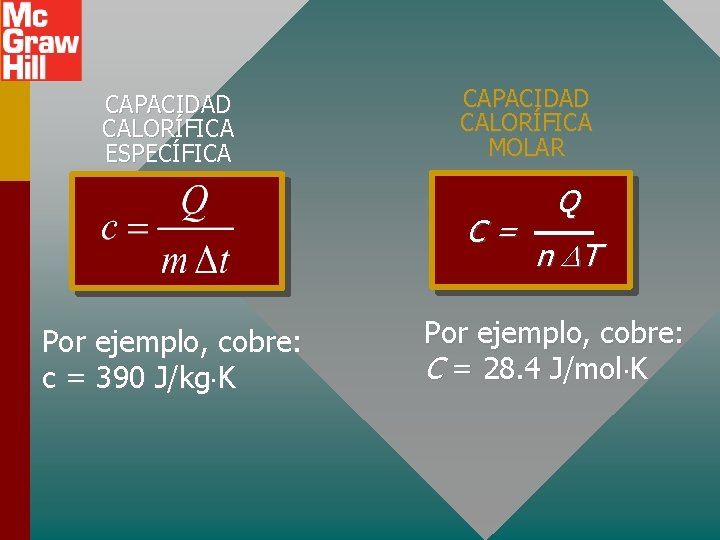
CAPACIDAD CALORÍFICA ESPECÍFICA CAPACIDAD CALORÍFICA MOLAR C= Por ejemplo, cobre: c = 390 J/kg K Q n T Por ejemplo, cobre: C = 28. 4 J/mol K


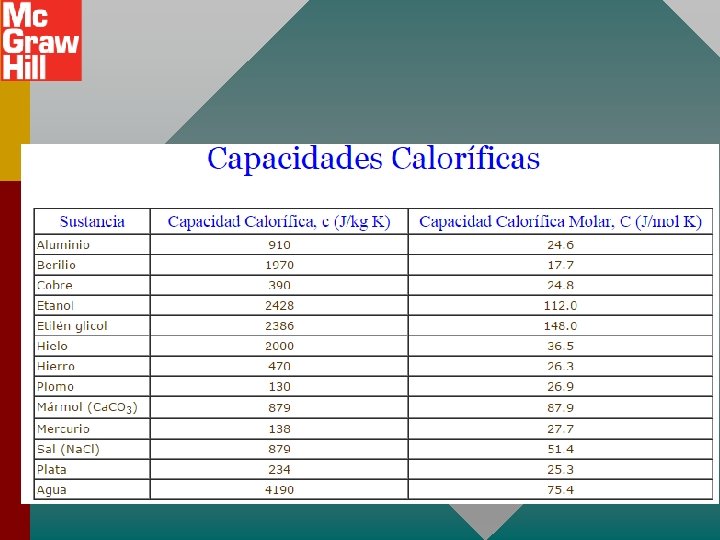
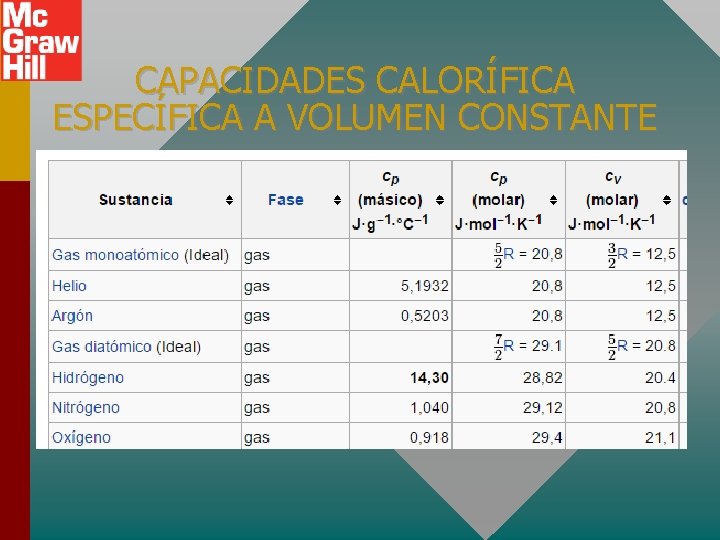
CAPACIDADES CALORÍFICA ESPECÍFICA A VOLUMEN CONSTANTE

CAPACIDADES CALORÍFICA ESPECÍFICA A VOLUMEN CONSTANTE ¿Cuánto calor se requiere para elevar la temperatura de 2 moles de O 2 de 0 o. C a 100 o. C? Q = n. Cv T Q = (2 mol)(21. 1 J/mol K)(373 K - 273 K) Q = +4220 J

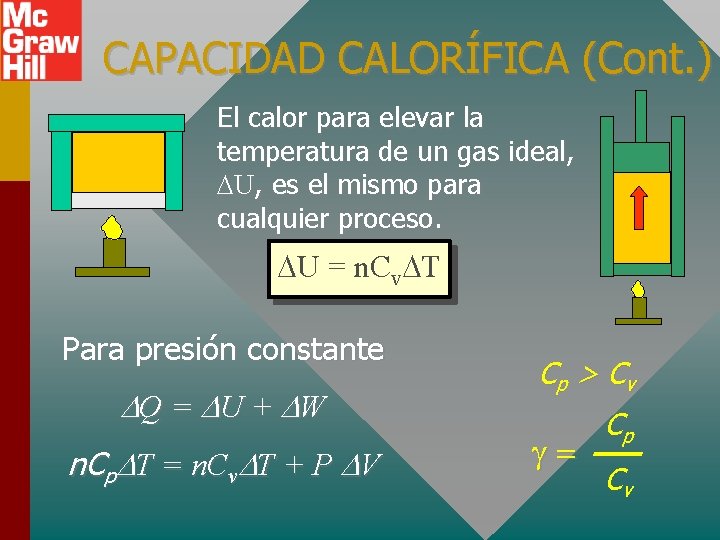
CAPACIDAD CALORÍFICA (Cont. ) El calor para elevar la temperatura de un gas ideal, U, es el mismo para cualquier proceso. U = n. Cv T Para presión constante Q = U + W n. Cp T = n. Cv T + P V Cp > C v Cp Cv

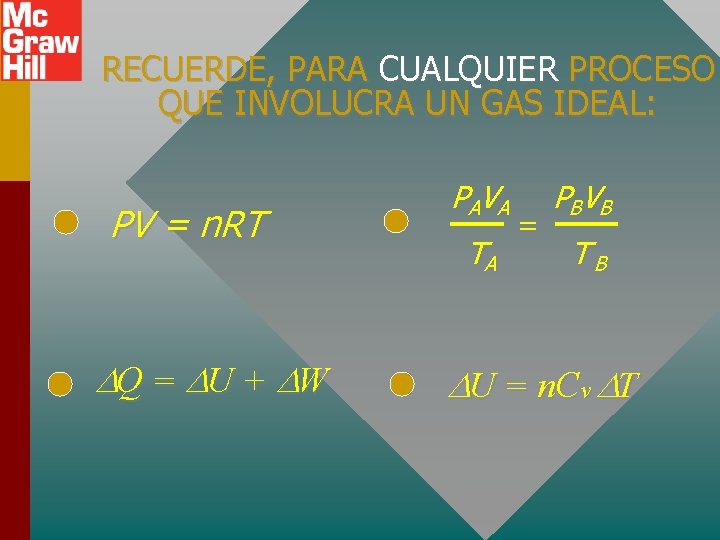
RECUERDE, PARA CUALQUIER PROCESO QUE INVOLUCRA UN GAS IDEAL: PV = n. RT Q = U + W PA V A TA = PBV B TB U = n. Cv T

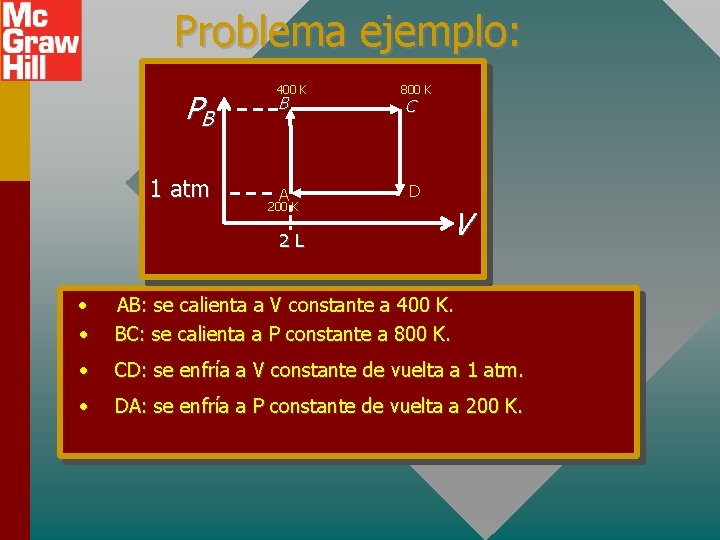
Problema ejemplo: Una muestra de 2 L de gas oxígeno tiene temperatura y presión iniciales de 200 K y 1 atm. El gas experimenta cuatro procesos:

Problema ejemplo: PB 1 atm 400 K B A 200 K 2 L 800 K C D V • • AB: se calienta a V constante a 400 K. BC: se calienta a P constante a 800 K. • CD: se enfría a V constante de vuelta a 1 atm. • DA: se enfría a P constante de vuelta a 200 K.

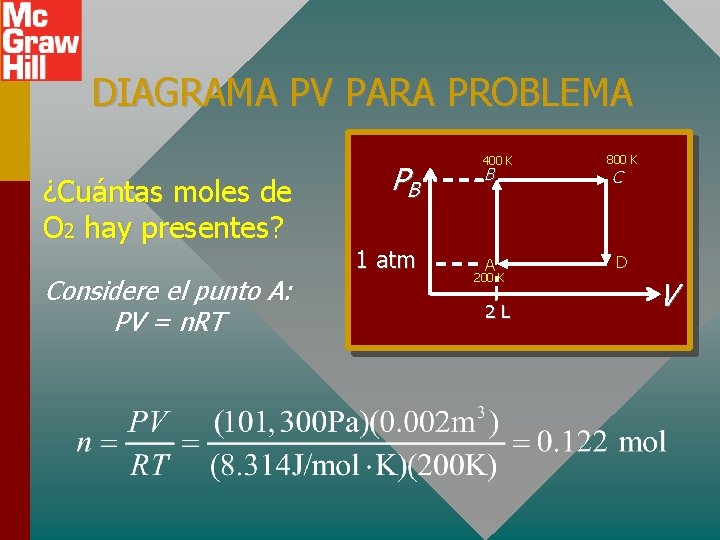
DIAGRAMA PV PARA PROBLEMA ¿Cuántas moles de O 2 hay presentes? Considere el punto A: PV = n. RT PB 1 atm 400 K B A 200 K 2 L 800 K C D V

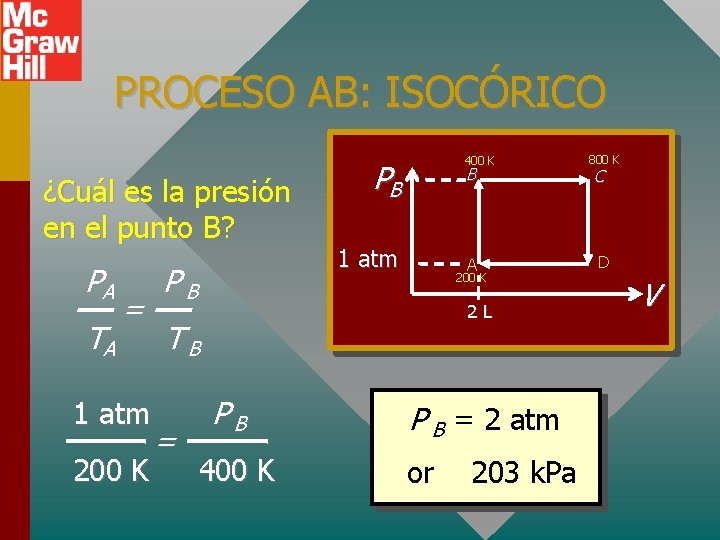
PROCESO AB: ISOCÓRICO ¿Cuál es la presión en el punto B? PA TA = 1 atm 200 K PB 400 K PB B 1 atm A 200 K 2 L TB = PB 400 K P B = 2 atm or 203 k. Pa 800 K C D V

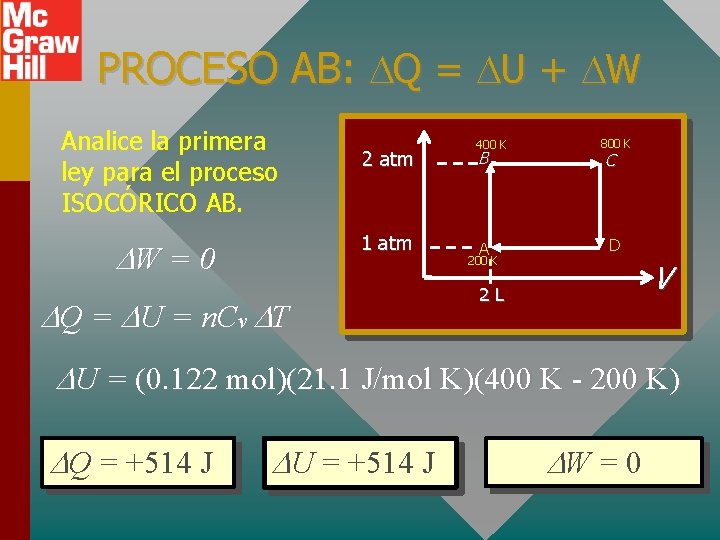
PROCESO AB: Q = U + W Analice la primera ley para el proceso ISOCÓRICO AB. 2 atm 1 atm W = 0 Q = U = n. Cv T 400 K B A 200 K 800 K C D V 2 L U = (0. 122 mol)(21. 1 J/mol K)(400 K - 200 K) Q = +514 J U = +514 J W = 0

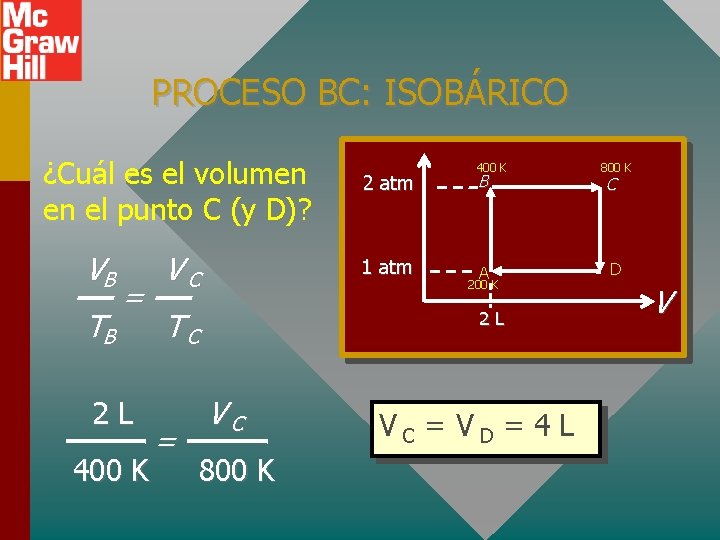
PROCESO BC: ISOBÁRICO ¿Cuál es el volumen en el punto C (y D)? VB TB = 2 L 400 K VC 1 atm TC = 2 atm 400 K B A 200 K 2 L VC 800 K VC = VD = 4 L 800 K C D V

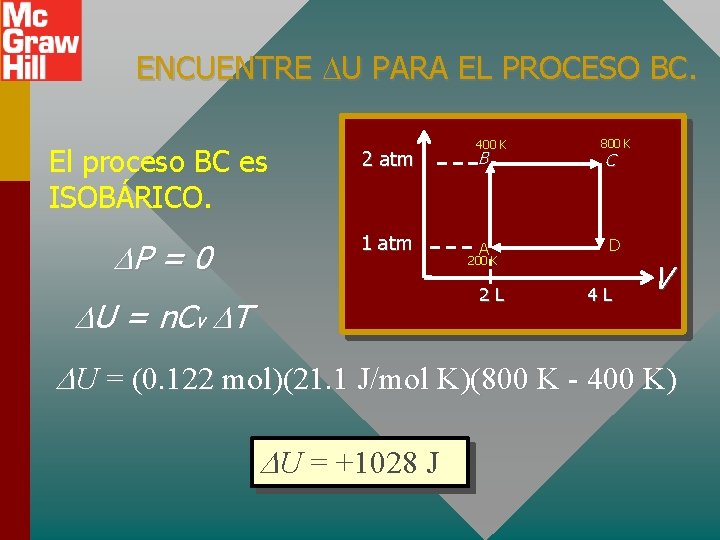
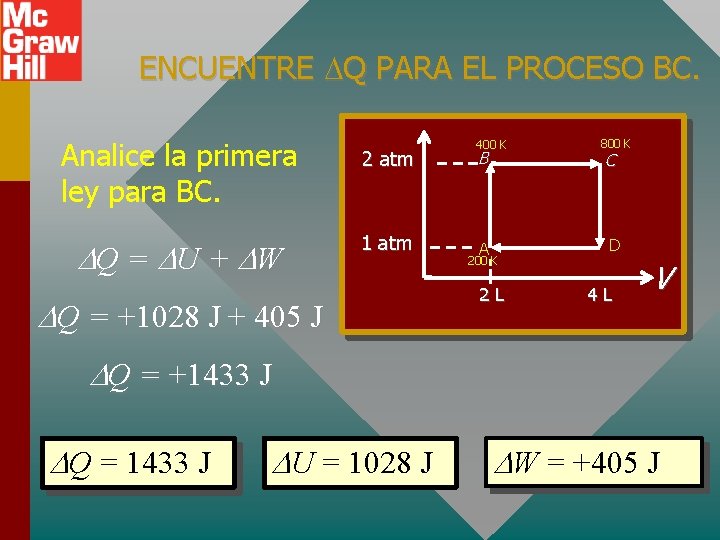
ENCUENTRE U PARA EL PROCESO BC. El proceso BC es ISOBÁRICO. 2 atm P = 0 1 atm 400 K B A 200 K 2 L U = n. Cv T 800 K C D 4 L V U = (0. 122 mol)(21. 1 J/mol K)(800 K - 400 K) U = +1028 J

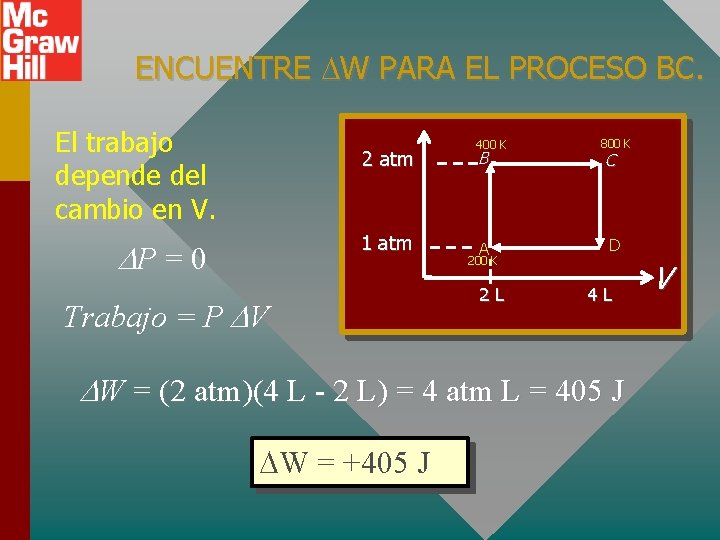
ENCUENTRE W PARA EL PROCESO BC. El trabajo depende del cambio en V. 2 atm 1 atm P = 0 Trabajo = P V 400 K B A 200 K 2 L 800 K C D 4 L W = (2 atm)(4 L - 2 L) = 4 atm L = 405 J W = +405 J V

ENCUENTRE Q PARA EL PROCESO BC. Analice la primera ley para BC. Q = U + W 2 atm 1 atm Q = +1028 J + 405 J 400 K B A 200 K 2 L 800 K C D 4 L V Q = +1433 J Q = 1433 J U = 1028 J W = +405 J

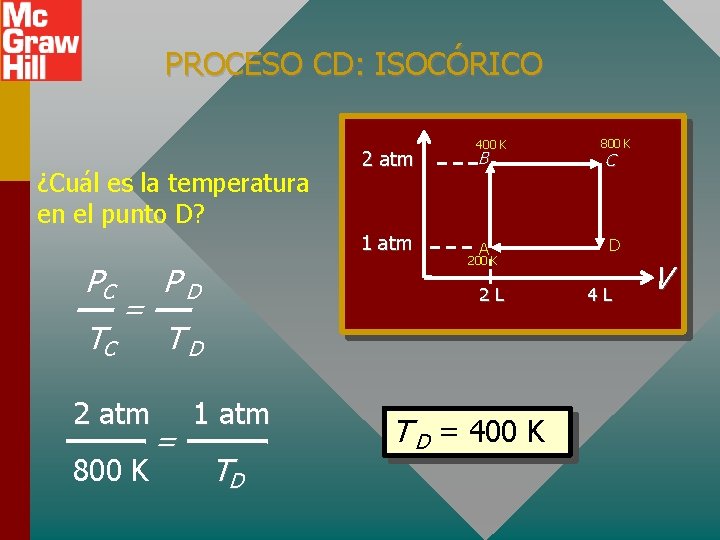
PROCESO CD: ISOCÓRICO ¿Cuál es la temperatura en el punto D? 2 atm 1 atm PC TC = 2 atm 800 K PD 400 K B A 200 K 2 L TD = 1 atm TD T D = 400 K 800 K C D 4 L V

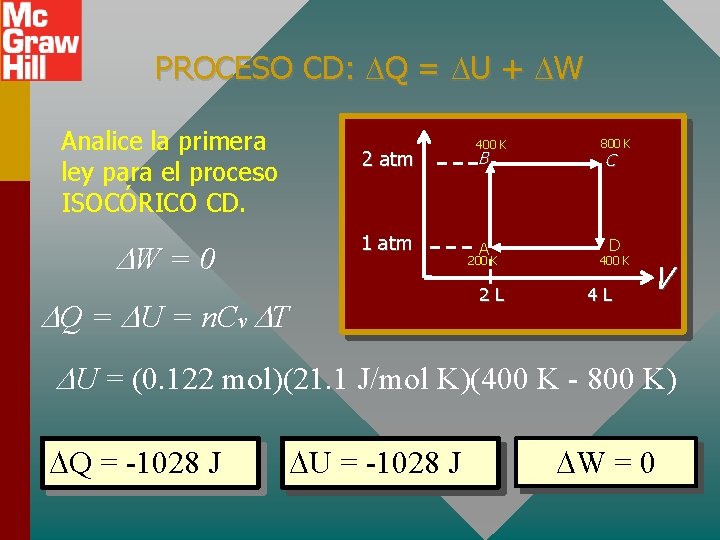
PROCESO CD: Q = U + W Analice la primera ley para el proceso ISOCÓRICO CD. 2 atm 1 atm W = 0 Q = U = n. Cv T 400 K B A 200 K 2 L 800 K C D 400 K 4 L V U = (0. 122 mol)(21. 1 J/mol K)(400 K - 800 K) Q = -1028 J U = -1028 J W = 0

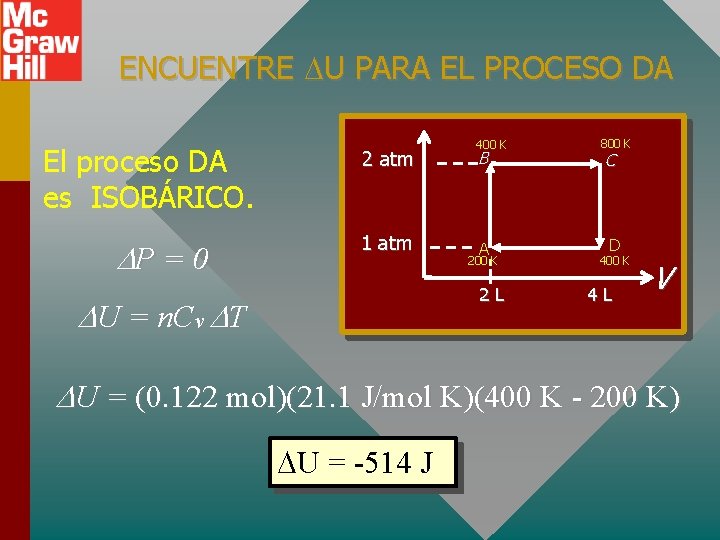
ENCUENTRE U PARA EL PROCESO DA El proceso DA es ISOBÁRICO. P = 0 2 atm 1 atm 400 K B A 200 K 2 L U = n. Cv T 800 K C D 400 K 4 L V U = (0. 122 mol)(21. 1 J/mol K)(400 K - 200 K) U = -514 J

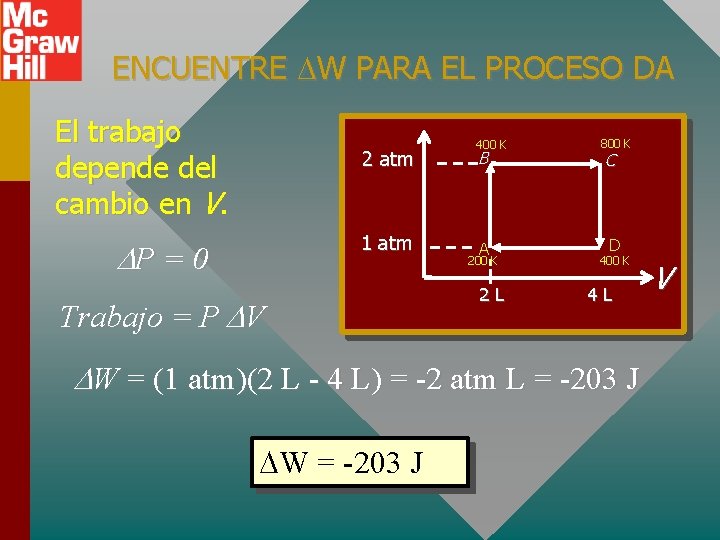
ENCUENTRE W PARA EL PROCESO DA El trabajo depende del cambio en V. 2 atm 1 atm P = 0 Trabajo = P V 400 K B A 200 K 2 L 800 K C D 400 K 4 L W = (1 atm)(2 L - 4 L) = -2 atm L = -203 J W = -203 J V

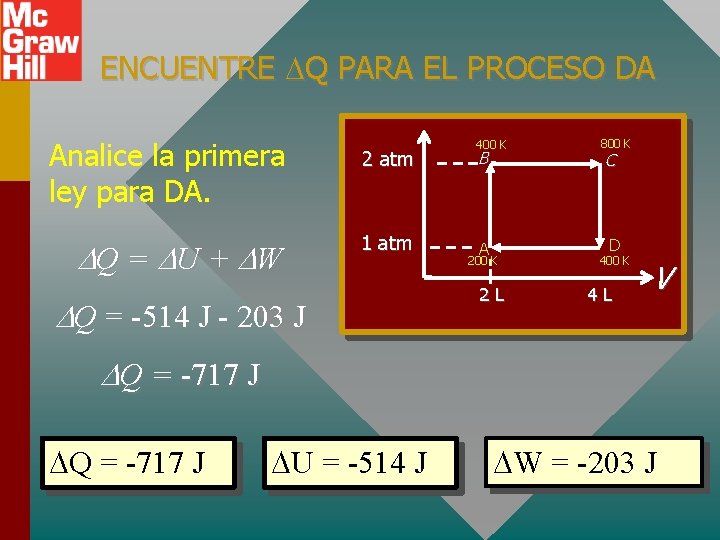
ENCUENTRE Q PARA EL PROCESO DA Analice la primera ley para DA. Q = U + W 2 atm 1 atm Q = -514 J - 203 J 400 K B A 200 K 2 L 800 K C D 400 K 4 L V Q = -717 J U = -514 J W = -203 J

RESUMEN DEL PROBLEMA Para todos Q = U + W los procesos:

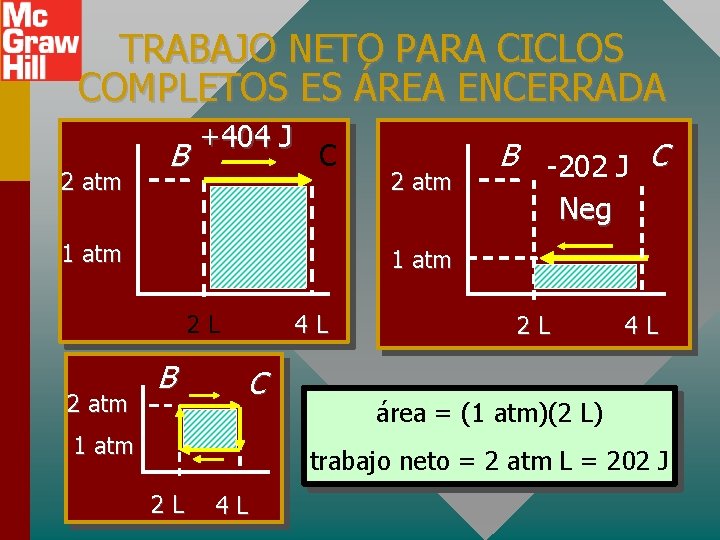
TRABAJO NETO PARA CICLOS COMPLETOS ES ÁREA ENCERRADA 2 atm B +404 J C 1 atm Neg 1 atm 2 L 2 atm B -202 J C B 4 L C 1 atm 2 L 4 L área = (1 atm)(2 L) trabajo neto = 2 atm L = 202 J 2 L 4 L

EJEMPLO ADIABÁTICO: Ejemplo 2: Un gas diatómico a 300 K y 1 atm se comprime adiabáticamente, lo que disminuye su volumen por 1/12. (VA = 12 VB). ¿Cuáles son la nueva presión y temperatura? ( = 1. 4) PB B Q = 0 VB PA V A PBV B PA V A = P BV B A PA VA TA = TB

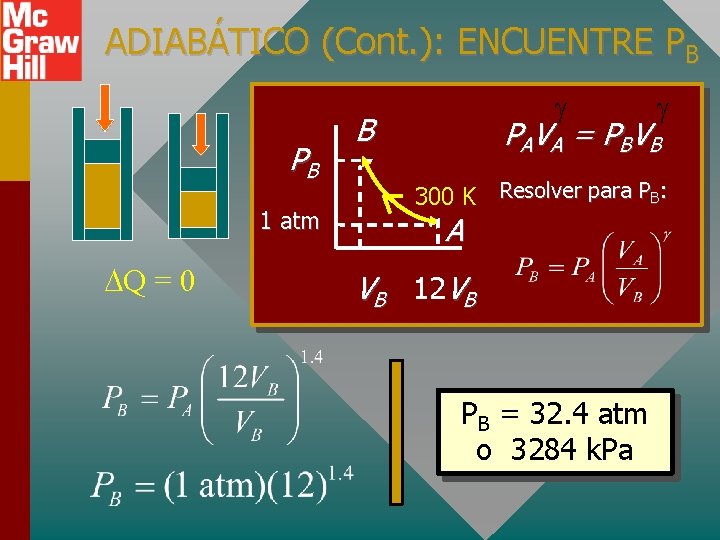
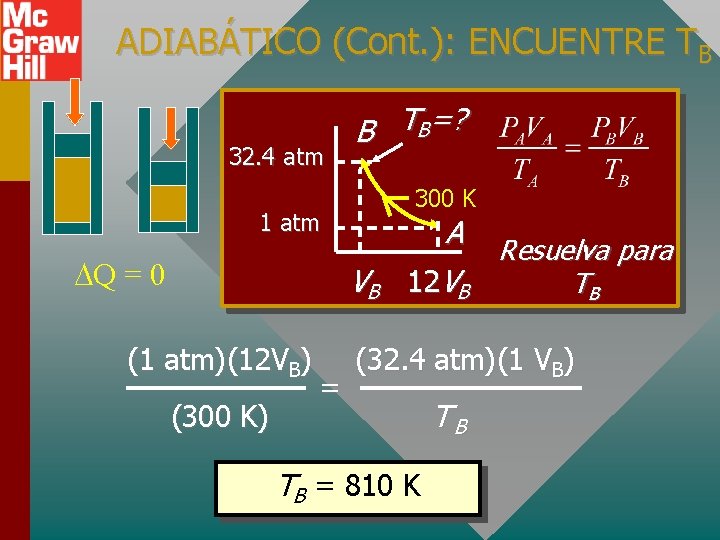
ADIABÁTICO (Cont. ): ENCUENTRE PB PB 1 atm Q = 0 B PA V A = P BV B 300 K Resolver para PB: A VB 12 VB PB = 32. 4 atm o 3284 k. Pa

ADIABÁTICO (Cont. ): ENCUENTRE TB 32. 4 atm B TB=? 300 K 1 atm Q = 0 VB (1 atm)(12 VB) (300 K) = A Resuelva para 12 VB TB (32. 4 atm)(1 VB) TB = 810 K TB

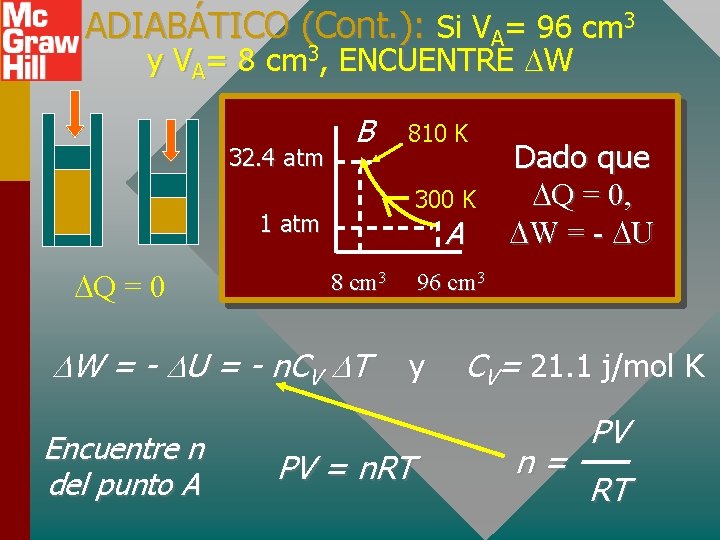
ADIABÁTICO (Cont. ): Si VA= 96 cm 3 y VA= 8 cm 3, ENCUENTRE W 32. 4 atm B 810 K 300 K 1 atm Q = 0 A 8 cm 3 W = - U = - n. CV T Encuentre n del punto A Dado que Q = 0, W = - U 96 cm 3 y PV = n. RT CV= 21. 1 j/mol K n= PV RT

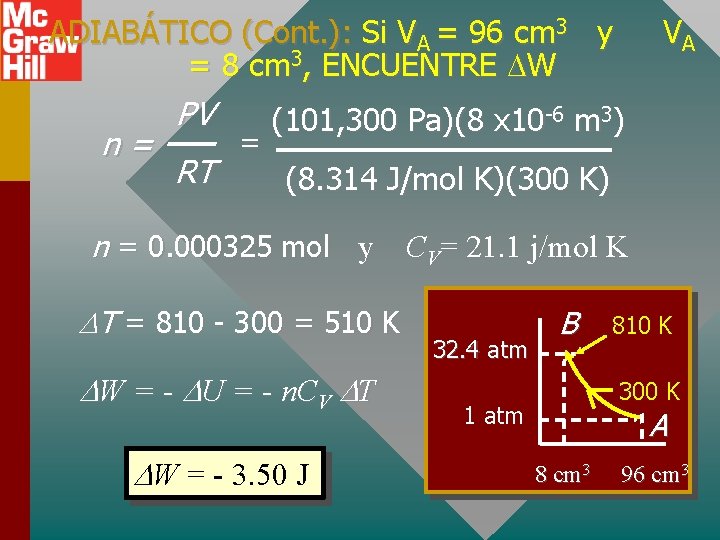
ADIABÁTICO (Cont. ): Si VA = 96 cm 3 y = 8 cm 3, ENCUENTRE W n= PV RT = VA (101, 300 Pa)(8 x 10 -6 m 3) (8. 314 J/mol K)(300 K) n = 0. 000325 mol y CV= 21. 1 j/mol K T = 810 - 300 = 510 K W = - U = - n. CV T W = - 3. 50 J 32. 4 atm B 810 K 300 K 1 atm A 8 cm 3 96 cm 3

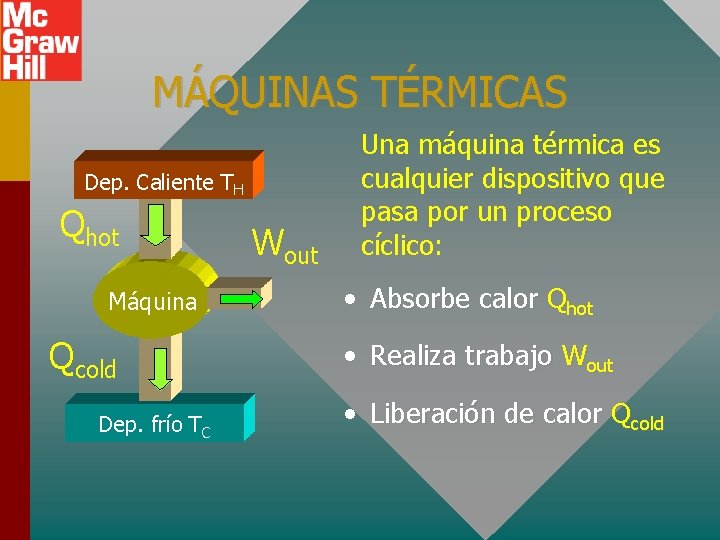
MÁQUINAS TÉRMICAS Dep. Caliente TH Qhot Máquina Qcold Dep. frío TC Wout Una máquina térmica es cualquier dispositivo que pasa por un proceso cíclico: • Absorbe calor Qhot • Realiza trabajo Wout • Liberación de calor Qcold

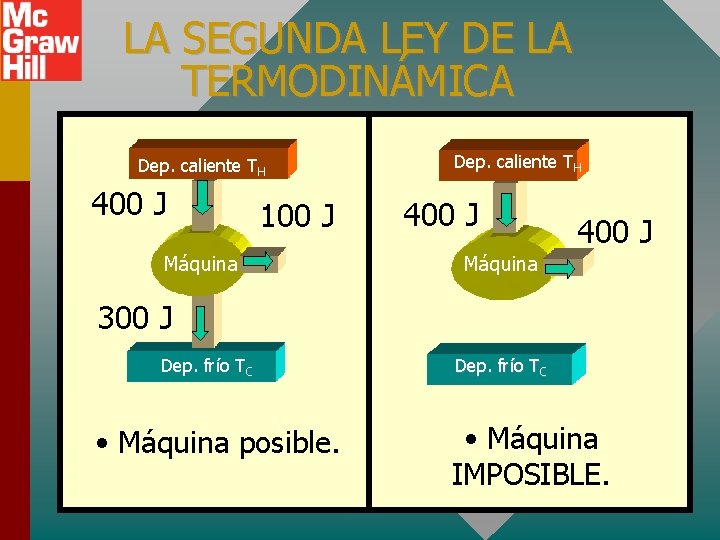
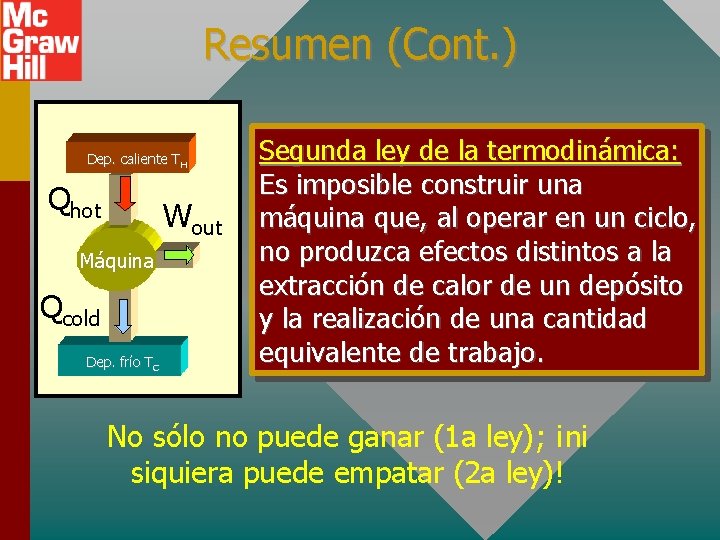
LA SEGUNDA LEY DE LA TERMODINÁMICA Dep. caliente TH Qhot Wout Máquina Qcold Dep. frío TC Es imposible construir una máquina que, al operar en un ciclo, no produzca efectos distintos a la extracción de calor de un depósito y la realización de una cantidad equivalente de trabajo. No sólo no puede ganar (1 a ley); ¡ni siquiera puede empatar (2 a ley)!

LA SEGUNDA LEY DE LA TERMODINÁMICA Dep. caliente TH 400 J 100 J Máquina Dep. caliente TH 400 J Máquina 300 J Dep. frío TC • Máquina posible. Dep. frío TC • Máquina IMPOSIBLE.

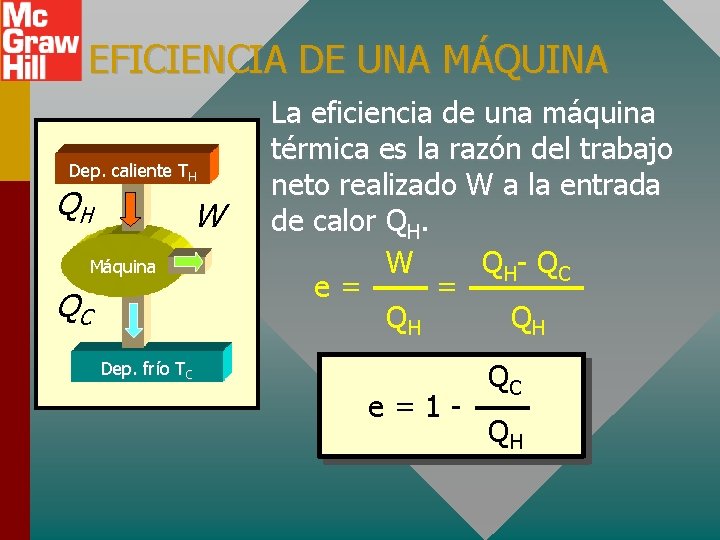
EFICIENCIA DE UNA MÁQUINA Dep. caliente TH QH W Máquina QC La eficiencia de una máquina térmica es la razón del trabajo neto realizado W a la entrada de calor QH. W Q H- Q C e= = QH QH Dep. frío TC e=1 - QC QH

EJEMPLO DE EFICIENCIA Dep. caliente TH 800 J Máquina 600 J Dep. frío TC W Una máquina absorbe 800 J y desecha 600 J cada ciclo. ¿Cuál es la eficiencia? QC e=1 QH e=1 - 600 J 800 J e = 25% Pregunta: ¿Cuántos joules de trabajo se realizan?

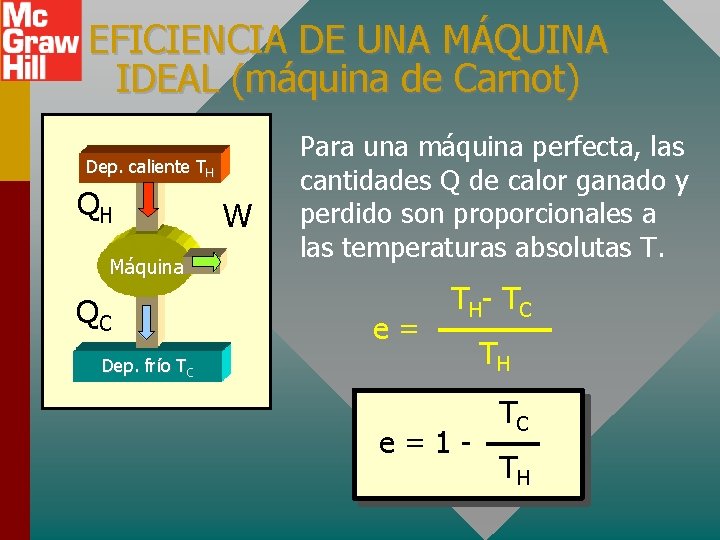
EFICIENCIA DE UNA MÁQUINA IDEAL (máquina de Carnot) Dep. caliente TH QH Máquina QC W Para una máquina perfecta, las cantidades Q de calor ganado y perdido son proporcionales a las temperaturas absolutas T. e= T H- T C Dep. frío TC e=1 - TH TC TH

Ejemplo 3: Una máquina de vapor absorbe 600 J de calor a 500 K y la temperatura de escape es 300 K. Si la eficiencia real sólo es la mitad de la eficiencia ideal, ¿cuánto trabajo se realiza durante cada ciclo? e=1 e=1 - TC e real = 0. 5 ei = 20% TH W 300 K 500 K e = 40% e= QH W = e. QH = 0. 20 (600 J) Trabajo = 120 J

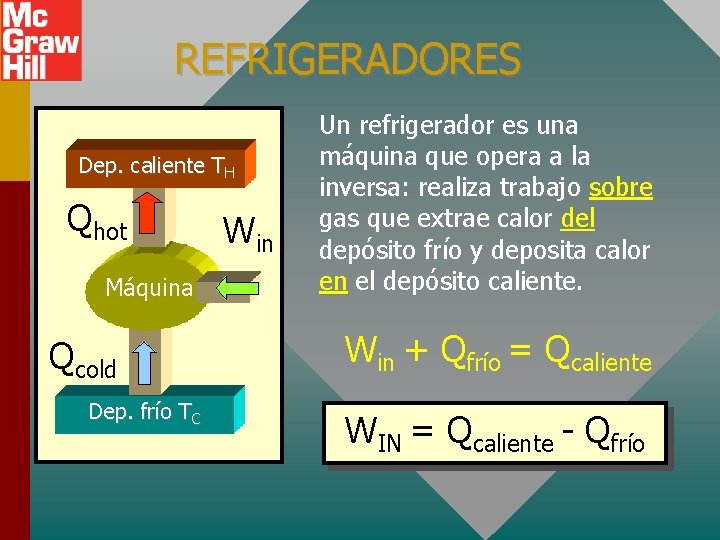
REFRIGERADORES Dep. caliente TH Qhot Máquina Qcold Dep. frío TC Win Un refrigerador es una máquina que opera a la inversa: realiza trabajo sobre gas que extrae calor del depósito frío y deposita calor en el depósito caliente. Win + Qfrío = Qcaliente WIN = Qcaliente - Qfrío

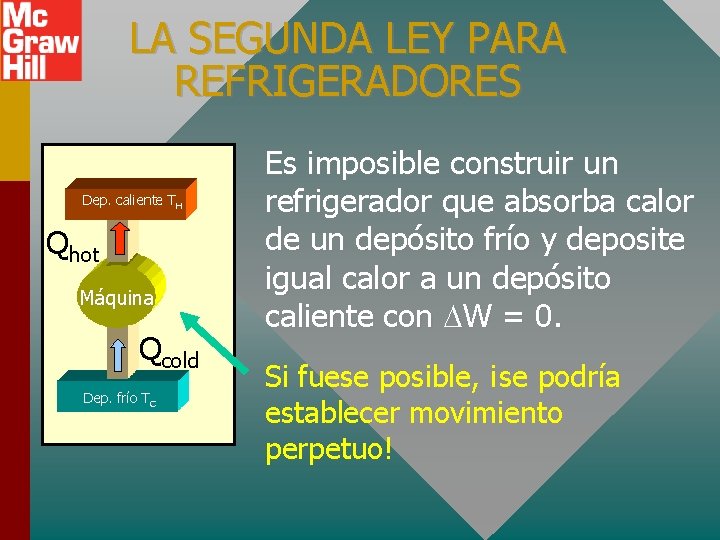
LA SEGUNDA LEY PARA REFRIGERADORES Dep. caliente TH Qhot Máquina Qcold Dep. frío TC Es imposible construir un refrigerador que absorba calor de un depósito frío y deposite igual calor a un depósito caliente con W = 0. Si fuese posible, ¡se podría establecer movimiento perpetuo!

COEFICIENTE DE RENDIMIENTO (COP) Dep. caliente TH QH W Máquina El COP (K) de una máquina térmica es la razón del CALOR Qc extraído al TRABAJO neto realizado W. QC K= Dep. frío TC Para un refrigerador IDEAL: QC W K= = QH Q H- Q C TH T H- T C

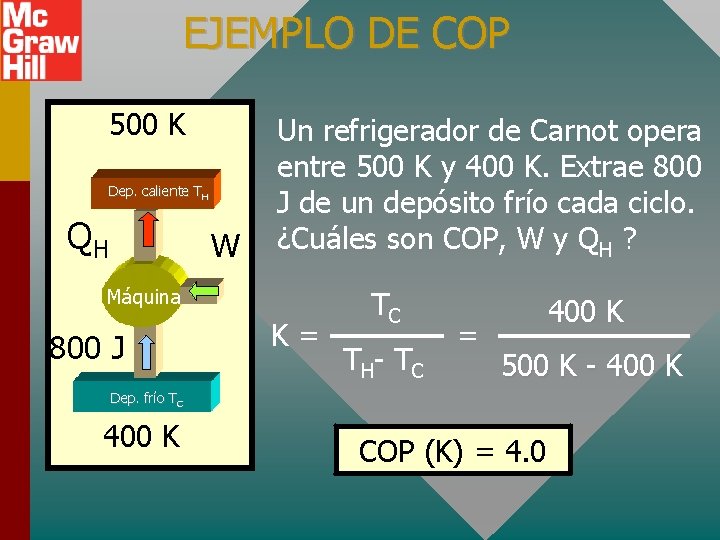
EJEMPLO DE COP 500 K Dep. caliente TH QH W Un refrigerador de Carnot opera entre 500 K y 400 K. Extrae 800 J de un depósito frío cada ciclo. ¿Cuáles son COP, W y QH ? Máquina 800 J K= TC T H- T C = 400 K 500 K - 400 K Dep. frío TC 400 K COP (K) = 4. 0

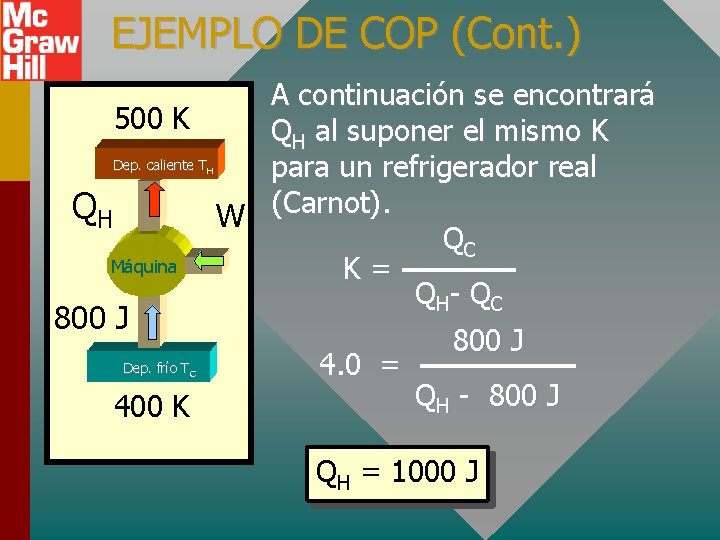
EJEMPLO DE COP (Cont. ) A continuación se encontrará 500 K QH al suponer el mismo K Dep. caliente T para un refrigerador real QH W (Carnot). QC Máquina K= Q H- Q C H 800 J Dep. frío TC 400 K 4. 0 = 800 J QH - 800 J QH = 1000 J

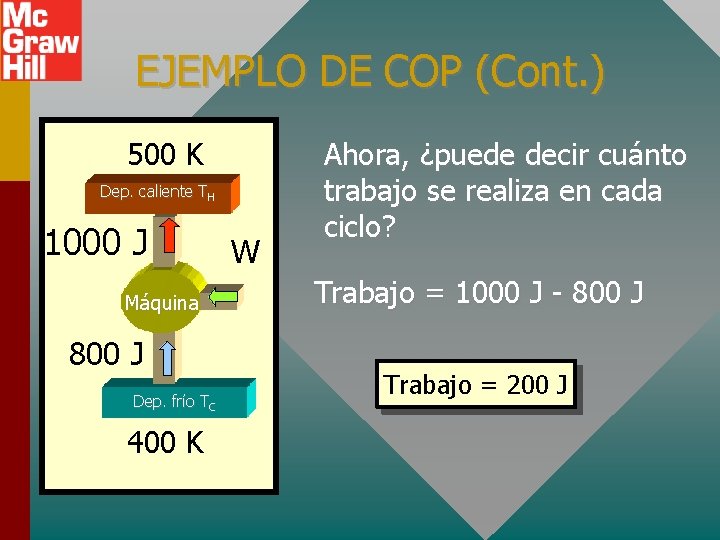
EJEMPLO DE COP (Cont. ) 500 K Dep. caliente TH 1000 J Máquina 800 J Dep. frío TC 400 K W Ahora, ¿puede decir cuánto trabajo se realiza en cada ciclo? Trabajo = 1000 J - 800 J Trabajo = 200 J

Resumen Primera ley de la termodinámica: el calor neto que toma un sistema es igual a la suma del cambio en energía interna y el trabajo realizado por el sistema. Q = U + W • Proceso isocórico: • Proceso isobárico: final - inicial) V = 0, W = 0 P = 0 • Proceso isotérmico: T = 0, U = 0 • Proceso adiabático: Q = 0

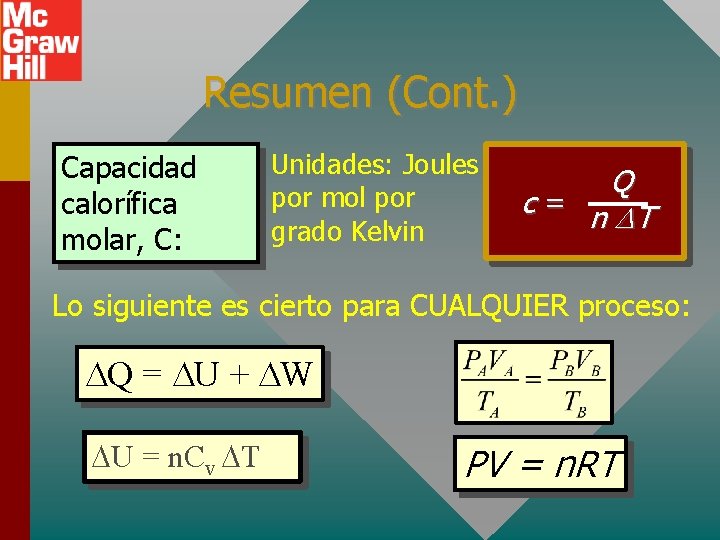
Resumen (Cont. ) Capacidad calorífica molar, C: Unidades: Joules por mol por grado Kelvin Q c = n T Lo siguiente es cierto para CUALQUIER proceso: Q = U + W U = n. Cv T PV = n. RT

Resumen (Cont. ) Dep. caliente TH Qhot Wout Máquina Qcold Dep. frío TC Segunda ley de la termodinámica: Es imposible construir una máquina que, al operar en un ciclo, no produzca efectos distintos a la extracción de calor de un depósito y la realización de una cantidad equivalente de trabajo. No sólo no puede ganar (1 a ley); ¡ni siquiera puede empatar (2 a ley)!

Resumen (Cont. ) La eficiencia de una máquina térmica: QC e=1 - Q H e=1 - TC TH El coeficiente de rendimiento de un refrigerador:

CONCLUSIÓN: Capítulo 20 Termodinámica