Segunda Lei da Termodinmica Segunda Lei da Termodinmica














- Slides: 24

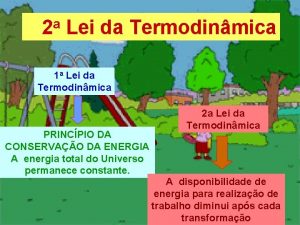
Segunda Lei da Termodinâmica

Segunda Lei da Termodinâmica Os processos naturais são Irreversíveis Isto é, eles seguem a flecha do Tempo (atrito; reações químicas; equilíbrio térmico; mistura. . . ) Apenas processos ideais de quase-equilíbrio são reversíveis Será preciso introduzir o conceito de Entropia para o estudo da irreversibilidade. . . mas inicialmente vamos entender o significado da segunda lei para máquinas térmicas e refrigeradores =>

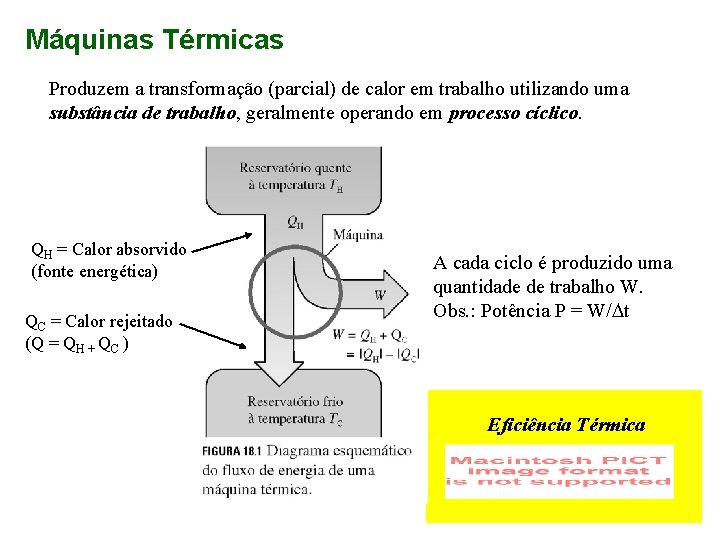
Máquinas Térmicas Produzem a transformação (parcial) de calor em trabalho utilizando uma substância de trabalho, geralmente operando em processo cíclico. QH = Calor absorvido (fonte energética) QC = Calor rejeitado (Q = QH + QC ) A cada ciclo é produzido uma quantidade de trabalho W. Obs. : Potência P = W/Dt Eficiência Térmica

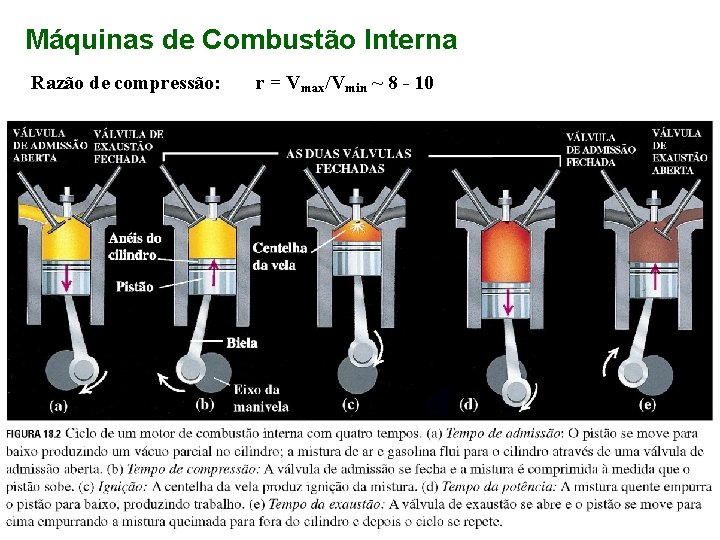
Máquinas de Combustão Interna Razão de compressão: r = Vmax/Vmin ~ 8 - 10


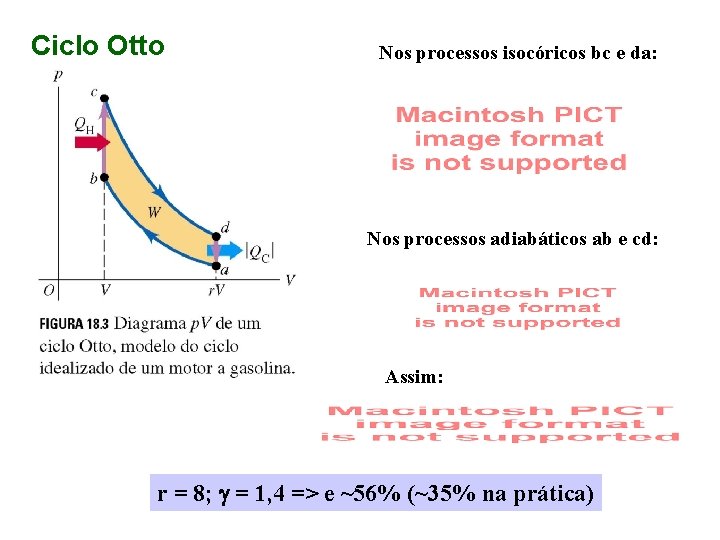
Ciclo Otto Nos processos isocóricos bc e da: Nos processos adiabáticos ab e cd: Assim: r = 8; g = 1, 4 => e ~56% (~35% na prática)

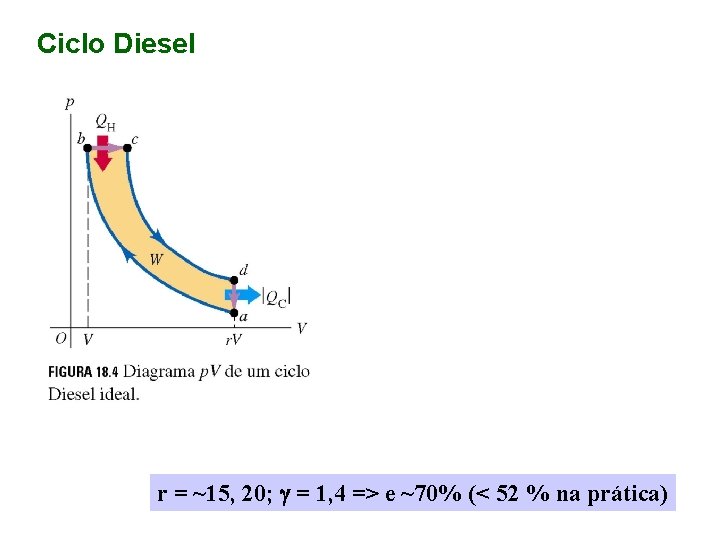
Ciclo Diesel r = ~15, 20; g = 1, 4 => e ~70% (< 52 % na prática)

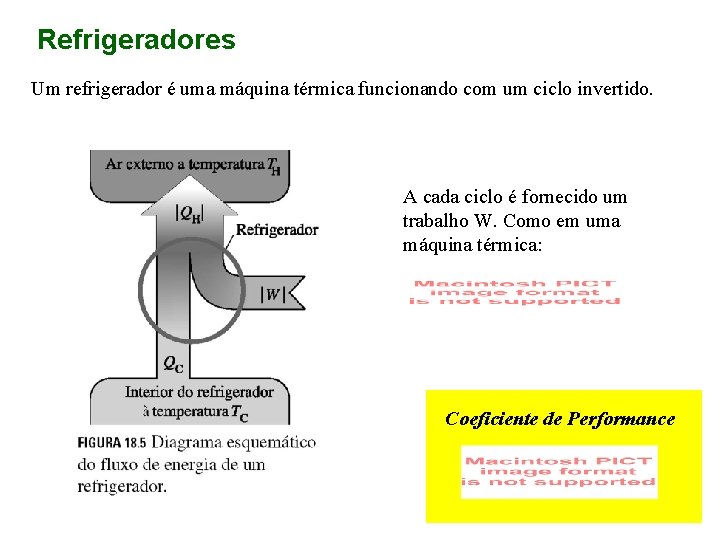
Refrigeradores Um refrigerador é uma máquina térmica funcionando com um ciclo invertido. A cada ciclo é fornecido um trabalho W. Como em uma máquina térmica: Coeficiente de Performance

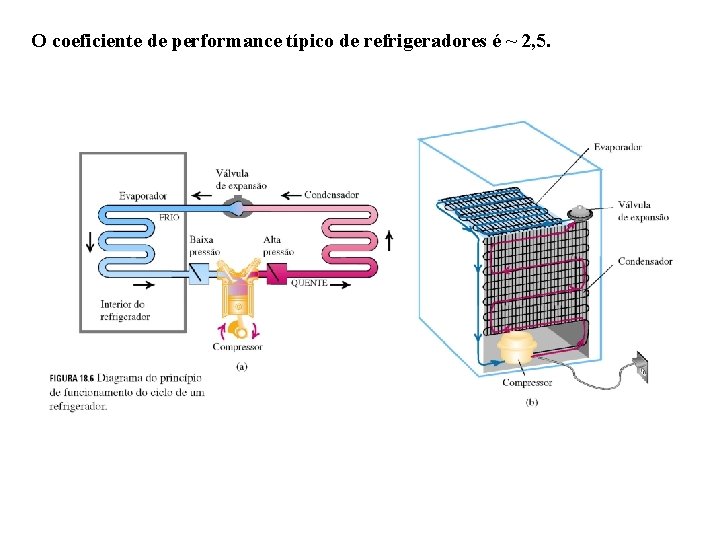
O coeficiente de performance típico de refrigeradores é ~ 2, 5.


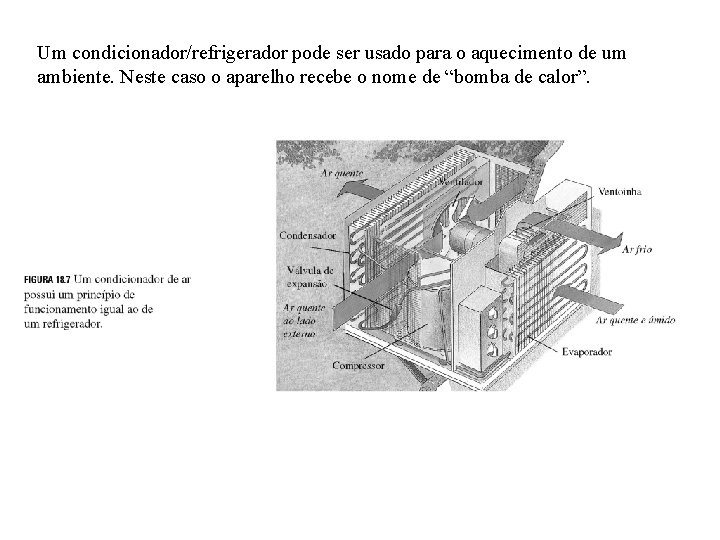
Um condicionador/refrigerador pode ser usado para o aquecimento de um ambiente. Neste caso o aparelho recebe o nome de “bomba de calor”.

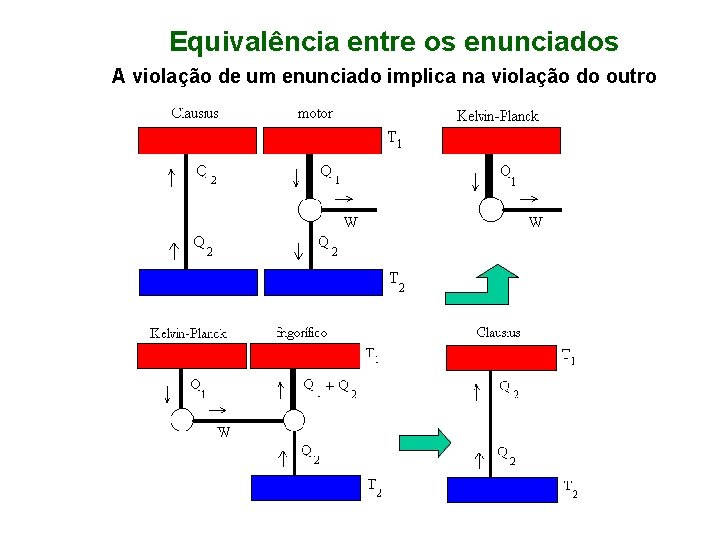
Segunda Lei da Termodinâmica / Impossibilidade de Máquinas Perfeitas Enunciado de Kelvin-Plank (máquinas térmicas): É impossível um processo cíclico de conversão completa de calor em trabalho a partir de um único reservatório térmico. (eficiência e < 1) Enunciado de Clausius (refrigeradores): É impossível um processo cíclico que resulte na transferência completa de calor de um corpo frio para um corpo quente. (desempenho Kp < ∞)

Equivalência entre os enunciados A violação de um enunciado implica na violação do outro

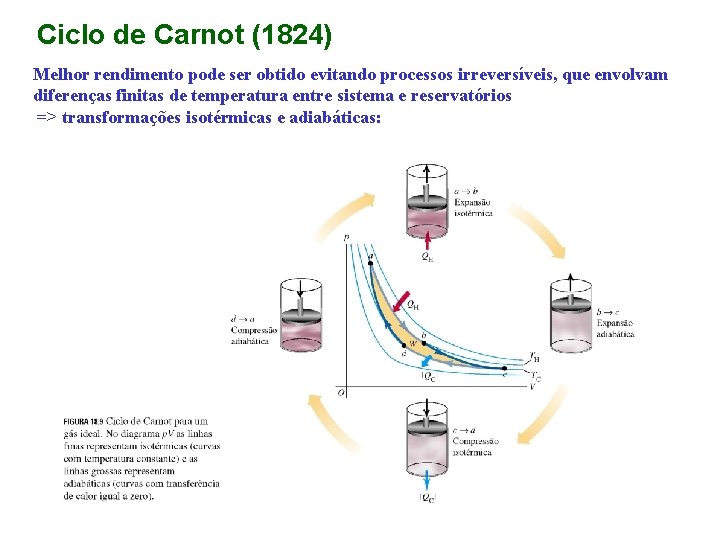
Ciclo de Carnot (1824) Melhor rendimento pode ser obtido evitando processos irreversíveis, que envolvam diferenças finitas de temperatura entre sistema e reservatórios => transformações isotérmicas e adiabáticas:

Nos processos isotérmicos ab e cd: Nos processos adiabáticos bc e da: Assim:

Ciclo de Carnot e a Segunda Lei Enunciado de Carnot (rendimento máximo): Nenhuma máquina térmica pode ter eficiência superior à da máquina de Carnot operando entre as mesmas temperaturas extremas. (Vale analogamente para refrigeradores) Corolário e escala Kelvin: • Toda máquina de Carnot funcionando entre dadas temperaturas tem a mesma eficiência, independentemente da substância de trabalho. • A razão entre 2 temperaturas pode ser definida, independentemente da substância termométrica, como a razão entre os calores absorvido e rejeitado em um ciclo de Carnot operando entre tais temperaturas.

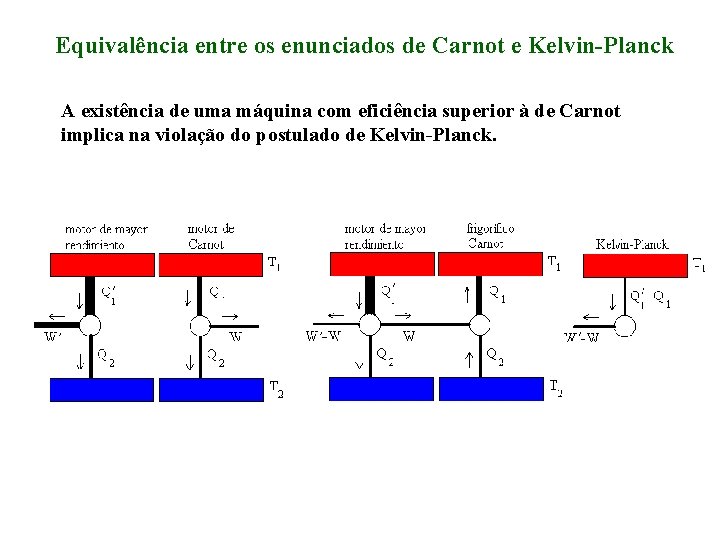
Equivalência entre os enunciados de Carnot e Kelvin-Planck A existência de uma máquina com eficiência superior à de Carnot implica na violação do postulado de Kelvin-Planck.

Entropia e Desordem Um gás ideal em expansão isotérmica não muda sua energia interna, mas aumenta sua desordem uma vez que suas moléculas se espalham em um volume maior. O aumento da desordem está ligado ao aumento relativo do volume e ao número de moléculas presentes. Definimos o aumento de entropia S como medida do aumento da desordem em um processo REVERIVEL como: (unidades : J/K)

Entropia e aquecimento (processos isobáricos e isocóricos) Entropia e o Ciclo de Carnot Em um processo isotérmico Em um processo adiabático No ciclo de Carnot

Entropia e Processos Cíclicos Reversíveis para qualquer ciclo reversível. Então conclui-se que a entropia é uma variável de estado. (Sua variação não depende da trajetória)

Entropia e Processos Irreversíveis / Expansão Livre

Entropia e Processos Irreversíveis / Diferenças Térmicas Quando há uma diferença de temperaturas, a transferência de calor é irreversível e

Entropia e Segunda Lei A soma das variações de entropia do sistema e vizinhanças em processos irreversíveis cresce ( permanece constante para processos reversíveis). Se existisse uma máquina térmica perfeita, a entropia do reservatório térmico diminuiria de DS = –Q/T, violando também este enunciado ( a entropia da máquina não varia. . . ).

Diagrama T-S e calor Como d. S = d. Q/T, temos o calor fornecido a um sistema como: A “área sob a curva” em um diagrama T-S é o calor fornecido. No ciclo de Carnot, constituído pelas isotermas a-b e c-d e adiabáticas b -c e d-a, o diagrama aparece como um retângulo: T TH a b Q = QH-QC TC d c S
 Segunda lei de newton
Segunda lei de newton Primeira lei de gossen
Primeira lei de gossen Terceira lei de newton
Terceira lei de newton Um casal ambos polidáctilos
Um casal ambos polidáctilos Segunda lei de ohm
Segunda lei de ohm Segunda lei de mendel
Segunda lei de mendel Segunda lei da termodinamica enunciado
Segunda lei da termodinamica enunciado Qual a segunda lei de ohm
Qual a segunda lei de ohm Segunda lei de newton
Segunda lei de newton Lei de ohm
Lei de ohm Ciclo de carnot
Ciclo de carnot Lei de coulomb e lei da gravitação universal
Lei de coulomb e lei da gravitação universal Termodinmica
Termodinmica Para que sirve la energía potencial
Para que sirve la energía potencial Termodinmica
Termodinmica 2 principio della termodinamica formula
2 principio della termodinamica formula Termodinmica
Termodinmica Cv=du/dt
Cv=du/dt Termodinmica
Termodinmica Termodinmica
Termodinmica Calor y trabajo
Calor y trabajo Termodinmica
Termodinmica Cambio de energia interna en un proceso adiabatico
Cambio de energia interna en un proceso adiabatico Pv = nrt valor de r
Pv = nrt valor de r Energia de ionizacion
Energia de ionizacion