Montoya Qu es la Termodinmica La termodinmica es















































- Slides: 57

Montoya. -

¿Qué es la Termodinámica? La termodinámica es una rama de la física que estudia los fenómenos relacionados con el trabajo y el calor. Se ocupa de las propiedades macroscópicas de la materia, especialmente las que son afectadas por el calor y la temperatura, así como de la transformación de unas formas de energía en otras. Es importante saber que la termodinámica estudia los sistemas que se encuentran en equilibrio. Esto significa que la presión, temperatura, volumen y la masa, que se conocen como variables termodinámicas, son constantes.

Relación entre trabajo y calor Tanto el calor como el trabajo son modos en que los cuerpos y los sistemas transforman su energía. Esto permite establecer un equivalente mecánico del calor. Ejemplo: De trabajo mecánico a calor: Frota dos bloques de hielo, y comprobarás que se derriten, aún cuando estés en una cámara frigorífica a una temperatura menor de 0 ºC. De calor a trabajo mecánico: En una máquina de vapor, la expansión del vapor de agua que se calienta produce el desplazamiento del pistón. Trabajo y calor son métodos de transferencia de energía. Utilizan la misma unidad de medida en el Sistema Internacional, el julio (J). Además, es habitual utilizar la caloría (cal) para medir el calor. La conversión entre calorías y julios viene dada por: 1 cal = 4. 184 J ⇔ 1 J = 0. 24 cal Esta relación entre trabajo y calor, que hoy vemos de manera clara, no lo fue hasta el S. XIX. El estudio del trabajo y del calor eran disciplinas separadas: la mecánica y la termología respectivamente. Así también las unidades en que se medían cada uno, julio y caloría. A mediados del S. XIX el científico inglés James Prescott Joule diseñó un dispositivo capaz de medir el equivalente mecánico del calor, logrando la equivalencia anterior

Experimento de Joule ideó una máquina conformada por una pesa unida a unas aspas por medio de un sistema de poleas, que se encuentran sumergidas en un recipiente de vidrio lleno de agua. Cuando se deja caer la pesa desde la posición A hasta B, tal y como se muestra en la figura, esta pierde su energía potencial invirtiéndose en girar las aspas dentro del líquido. La fricción de las aspas con el agua provoca un aumento de la temperatura del mismo. A partir de los resultados obtenidos con esta máquina se obtuvo la equivalencia 1 cal = 4. 184 J ⇔ 1 J = 0. 24 cal

¿Qué estudia la termodinámica? La termodinámica es la parte de la física que estudia las transferencias de calor, la conversión de la energía y la capacidad de los sistemas para producir trabajo. Las leyes de la termodinámica explican los comportamientos globales de los sistemas macroscópicos en situaciones de equilibrio. Tiene las siguientes características: 1. Se aplica al estudio de sistemas que contienen muchas partículas y no al estudio de moléculas, átomos o partículas subatómicas 2. Estudia el sistema en situaciones de equilibrio, que son aquellas a las que sistema tiende a evolucionar y caracterizadas porque en ellas todas las propiedades del sistema quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas 3. Sus postulados son indemostrables, están basados en las experiencias y no en razonamientos teóricos

Componentes de un sistema termodinámico Sistema El sistema es la parte del universo que vamos a estudiar. Por ejemplo, un gas, nuestro cuerpo o la atmósfera son ejemplos de sistemas que podemos estudiar desde el punto de vista termodinámico. Los sistemas se clasifican en:

Componentes de un sistema termodinámico Entorno o ambiente Todo aquello que no es sistema y que se sitúa alrededor de él, se denomina ambiente o entorno. Los sistemas interaccionan con el entorno transfiriendo masa, energía o las dos cosas. Frontera o paredes del sistema A través de ellas se comunica el sistema con el entorno. Existen los siguientes tipos: Fijas: Mantienen el volumen constante Móviles: El volumen es variable y depende de la presión en el lado del sistema y de la del entorno Conductoras o diatérmanas: Al conducir calor permiten que la temperatura a . . ambos lados de la misma sea igual Adiabáticas: No conducen calor. Son los aislantes térmicos

Variables y ecuación de estado

Gases ideales

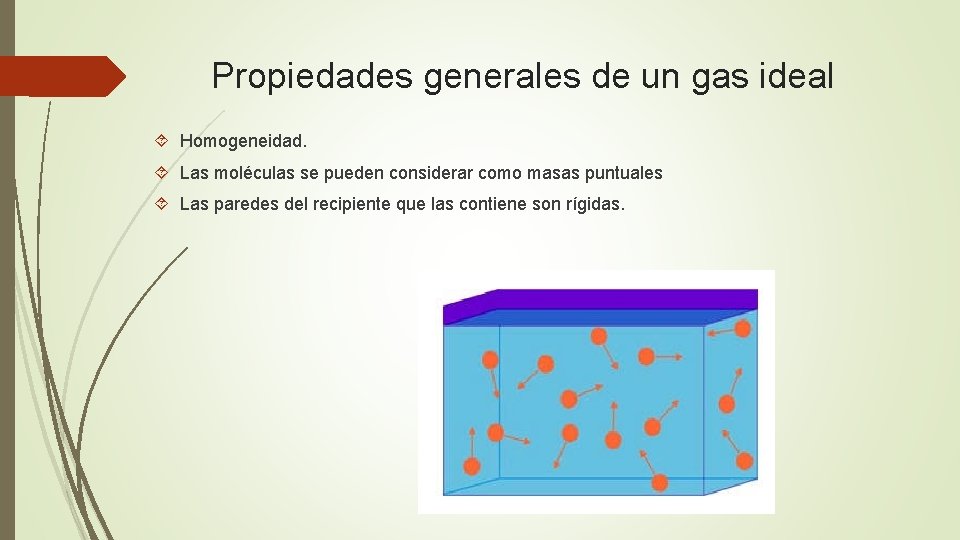
Propiedades generales de un gas ideal Homogeneidad. Las moléculas se pueden considerar como masas puntuales Las paredes del recipiente que las contiene son rígidas.

Condiciones físicas A presiones bajas o moderadas y a temperatura No muy bajas , se comportan matemáticamente del mismo modo, por tanto obedecen a las mismas leyes.

Variables de estado

Propiedades de los gases El estado gaseoso es un estado disperso de la materia, es decir , que las moléculas del gas están separadas unas de otras por distancias mucho mayores del tamaño del diámetro real de las moléculas. Resuelta entonces, que el volumen ocupado por el gas (V) depende de la presión (P) , la temperatura (T) y de la cantidad o numero de moles ( n). Las propiedades de la materia en estado gaseoso son: 1. Se adaptan a la forma y el volumen del recipiente que los contiene. Un gas, al cambiar de recipiente, se expande o se comprime, de manera que ocupa todo el volumen y toma la forma de su nuevo recipiente. 2. Se dejan comprimir fácilmente. Al existir espacios intermoleculares, las moléculas se pueden acercar unas a otras reduciendo su volumen, cuando aplicamos una presión. 3. Se difunden fácilmente. Al no existir fuerza de atracción intermolecular entre sus partículas, los gases se esparcen en forma espontánea. 4. Se dilatan, la energía cinética promedio de sus moléculas es directamente proporcional a la temperatura aplicada.

Variables que afectan el comportamiento de los gases PRESIÓN: Es la fuerza ejercida por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente. La presión atmosférica es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la superficie terrestre. Se origina del peso del aire que la forma. Mientras más alto se halle un cuerpo menos aire hay por encima de él, por consiguiente la presión sobre él será menor. TEMPERATURA: Es una medida de la intensidad del calor, y el calor a su vez es una forma de energía que podemos medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío. La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas. A mayor energía cinética mayor temperatura y viceversa. La temperatura de los gases se expresa en grados kelvin. CANTIDAD: La cantidad de un gas se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el sistema de unidades SI, la cantidad también se expresa mediante el número de moles de sustancia, esta puede calcularse dividiendo el peso del gas por su peso molecular. VOLUMEN: Es el espacio ocupado por un cuerpo. DENSIDAD: Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros.

Variables y ecuación de estado Variables Intensivas: Son aquellas que no dependen del tamaño del sistema. Por ejemplo la presión, la temperatura, la concentración o la densidad. Variables Extensivas: Son aquellas que dependen del tamaño del sistema. Por ejemplo el volumen, la masa o la energía.

El cero absoluto

pregunta Considere los siguientes gases en condiciones TPE 2 kg de Hidrogeno 32 Kg de oxigeno 28 Kg de nitrógeno ¿Qué volumen ocupa cada uno de ellos bajo estas condiciones?

Gases


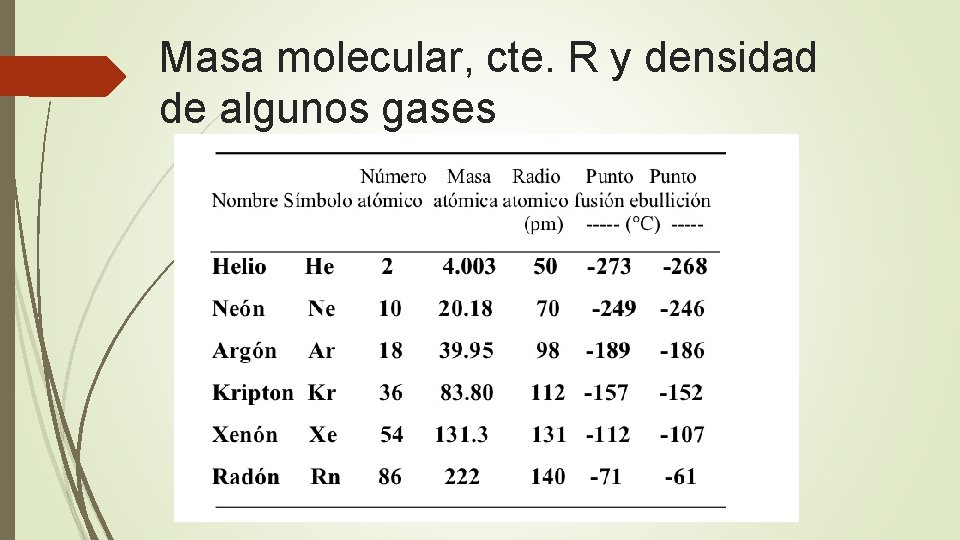
Masa molecular, cte. R y densidad de algunos gases

Número de Avogadro


Capacidad calorífica de un gas ideal Para un gas ideal se definen dos capacidades caloríficas molares: a volumen constante (CV), y a presión constante (Cp). CV: es la cantidad de calor que es necesario suministrar a un mol de gas ideal para elevar su temperatura un grado mediante una transformación isócora. Cp: es la cantidad de calor que es necesario suministrar a un mol de gas ideal para elevar su temperatura un grado mediante una transformación isóbara. El valor de ambas capacidades caloríficas puede determinarse con ayuda de la teoría cinética de los gases ideales. Los valores respectivos para gases monoatómicos y diatómicos se encuentran en la siguiente tabla: R es la constante universal de los gases ideales, R = 8. 31 J/mol K.

Leyes de los gases Eventos físicos que alteran el comportamiento de los gases y que son: Temperatura (T): Ejerce gran influencia sobre el estado de las moléculas de un gas aumentando o disminuyendo la velocidad de las mismas. Para trabajar con nuestras fórmulas siempre expresaremos la temperatura en grados Kelvin. Cuando la escala usada esté en grados Celsius, debemos hacer la conversión, sabiendo que 0º C equivale a 273, 15 º Kelvin. Presión (P): Se define como la relación que existe entre una fuerza (F) y la superficie (S) sobre la que se aplica, y se calcula con la fórmula

Leyes de los gases Volumen: Recordemos que volumen es todo el espacio ocupado por algún tipo de materia. En el caso de los gases, estos ocupan todo el volumen disponible del recipiente que los contiene. Hay muchas unidades para medir el volumen, pero en nuestras fórmulas usaremos el litro (L) Cantidad de gas: Otro parámetro que debe considerarse al estudiar el comportamiento de los gases tiene que ver con la cantidad de un gas la cual se relaciona con el número total de moléculas que la componen. Para medir la cantidad de un gas usamos como unidad de medida el mol. 1 mol de (moléculas o átomos) = 6, 022 • 10 23

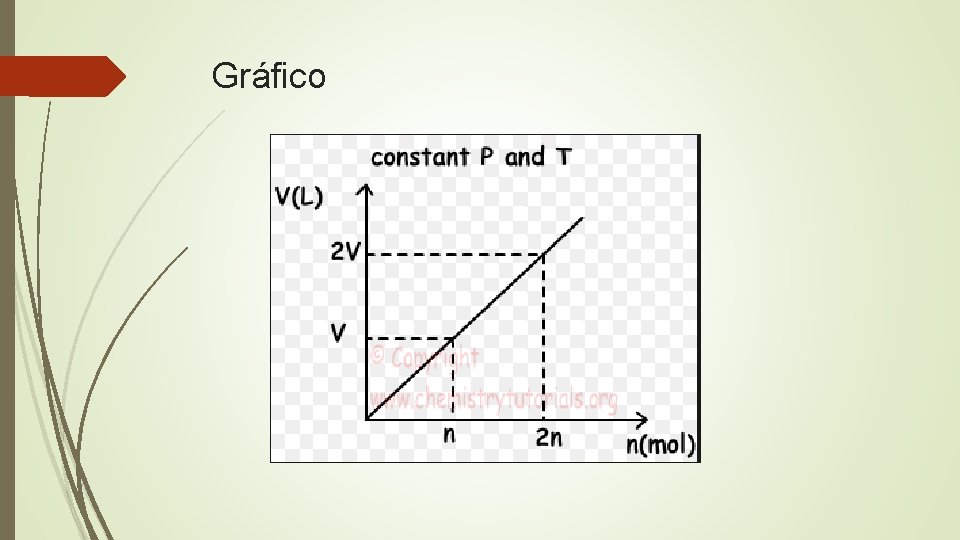
Ley de Avogadro Esta ley relaciona la cantidad de gas (n, en moles) con su volumen en litros (L), considerando que la presión y la temperatura permanecen constantes. El enunciado de la ley dice que: El volumen de un gas es directamente proporcional a la cantidad del mismo. Esto significa que: Si aumentamos la cantidad de gas, aumentará el volumen del mismo. Si disminuimos la cantidad de gas, disminuirá el volumen del mismo. Podemos expresarlo con la siguiente fórmula:

Gráfico

Aplicando la ley de Avogadro Tenemos 3, 50 L de un gas que, sabemos, corresponde a 0, 875 mol. Inyectamos gas al recipiente hasta llegar a 1, 40 mol, ¿cuál será el nuevo volumen del gas? (la temperatura y la presión las mantenemos constantes). Solución Datos: V 1: 3, 50 L N 1: 0. 875 mol V 2: ? N 2: 1, 40 mol L

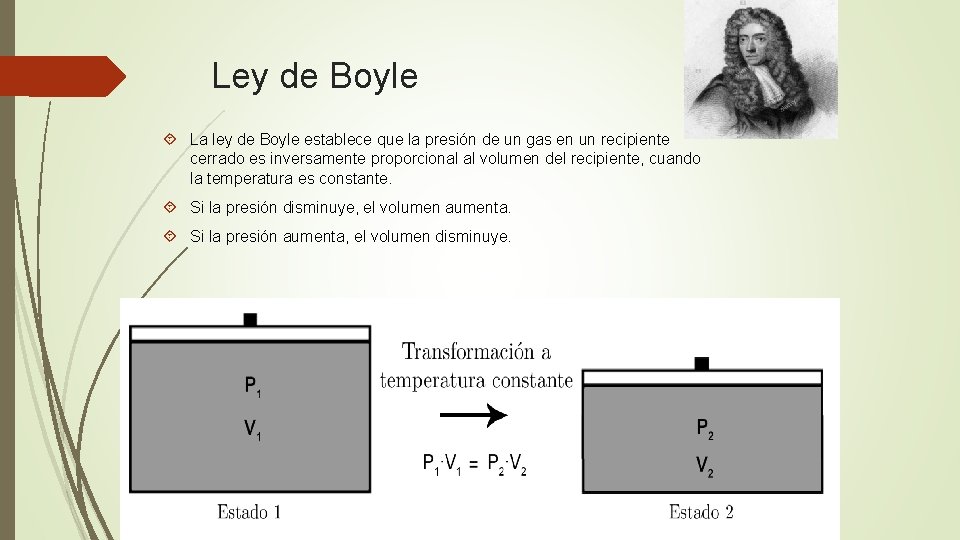
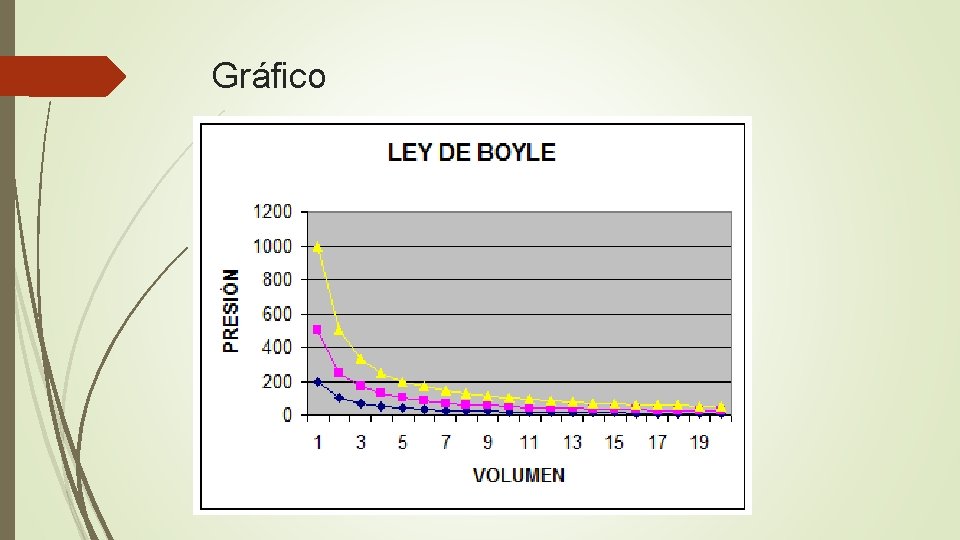
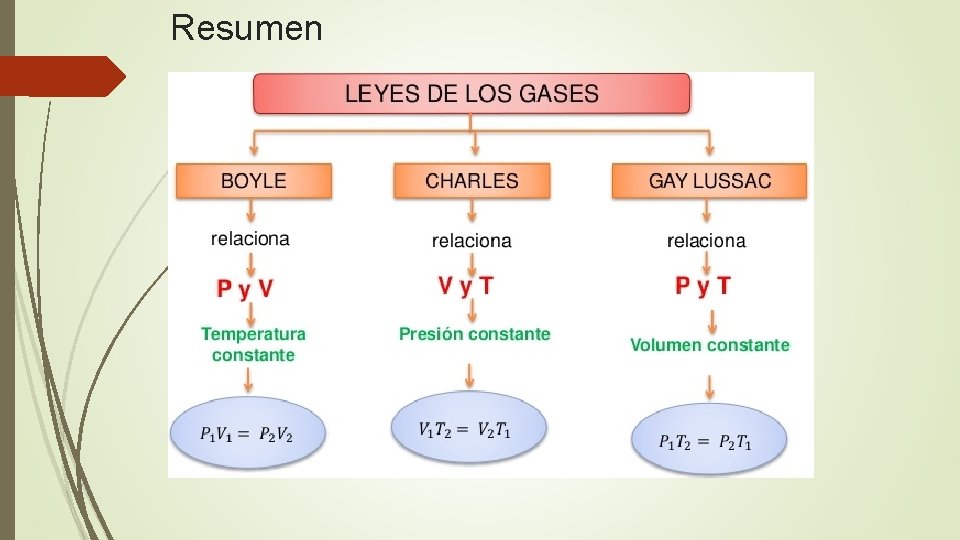
Ley de Boyle La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. Si la presión disminuye, el volumen aumenta. Si la presión aumenta, el volumen disminuye.

Gráfico

¿Por qué ocurre esto?

Aplicando la ley de Boyle Un tanque contiene 200 litros de aire y soporta una presión de 1 atm. ¿Cuál será el volumen si la presión varía a 2 atm? Datos: V 1: 200 L P 1: 1 atm P 2: 2 atm V 2: ?

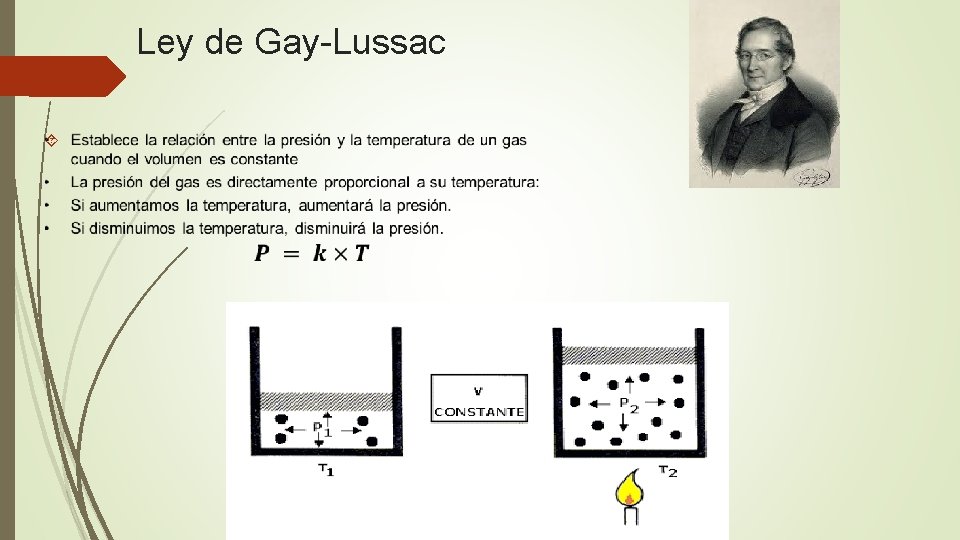
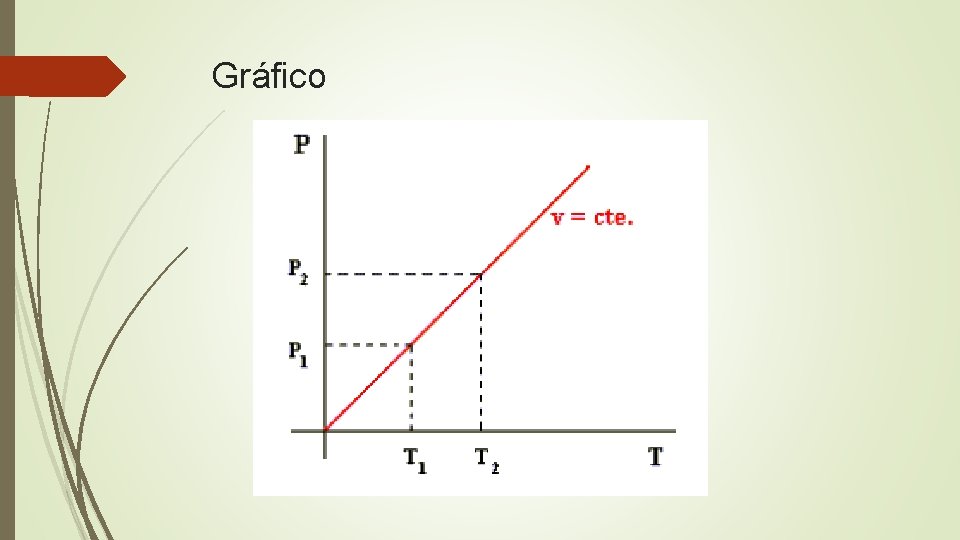
Ley de Gay-Lussac

Gráfico

¿Por qué ocurre esto?

Aplicando la ley de Gay-Lussac Un gas ideal se encuentra en un recipiente cerrado de volumen constante, a la presión de 2 atmosferas y 75°C de temperatura. ¿Cuál sería su nueva presión si la temperatura bajo a 50°C? Datos: T 1: 75°C 348 Kelvin T 2: 50°C 323 Kelvin P 1: 2 atm P 2: ?

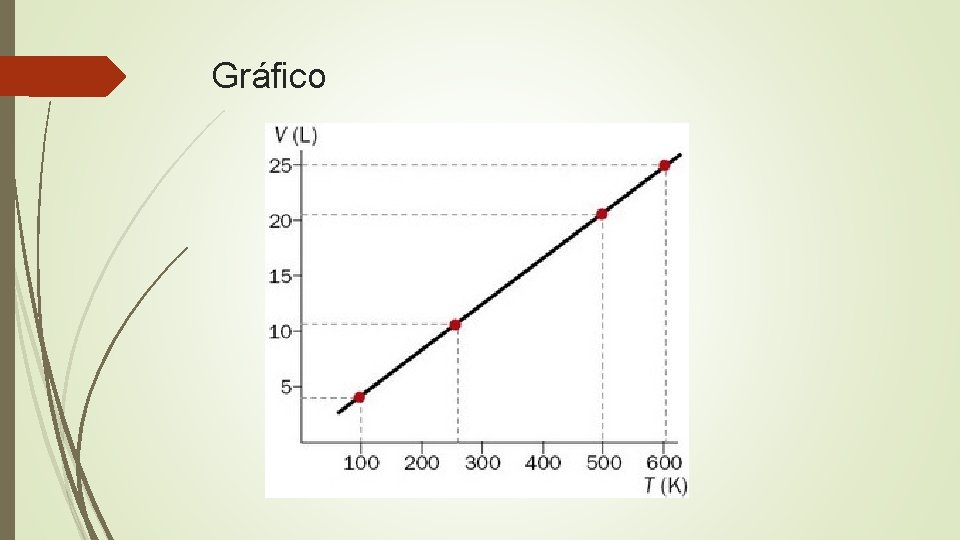
Ley de Charles

Gráfico

¿Por qué ocurre esto?

Aplicando la ley de Charles Un gas ideal ocupa un volumen de 1, 28 litros a 25°C, si aumentamos la temperatura a 50°C ¿Cuál es el nuevo volumen si la presión permanece constante? Datos: T 1: 25°C 298 Kelvin T 2: 50°C 323 Kelvin V 1: 1, 28 Litros V 2: ?

En resumen “Pancho Villa no toca rancheras”

Ley de Dalton de las presiones parciales. La presión parcial del componente de una mezcla de gases se define como la presión que ejercería el gas componente , si ocupara solo el volumen completo. Entonces , la presión total de la mezcla de gases ideales , es la suma de las presiones parciales de los gases que la componen.



Resumen


Constante de Planck La constante de Planck es la relación entre la cantidad de energía y de frecuencia asociadas a un cuanto o a una partícula elemental. Es una constante física que desempeña un papel central en la teoría de la mecánica cuántica y recibe su nombre de su descubridor, Max Planck, uno de los padres de dicha teoría. La constante de Planck (representada por la letra h) relaciona la energía (E) de los fotones con la frecuencia (ν)de la onda lumínica (letra griega nu) según la fórmula:

Constante de Planck En el año 1901, el físico alemán Max Planck afirmó que sólo era posible describir la radiación del cuerpo negro con una fórmula matemática que correspondiera con las medidas experimentales, si se aceptaba la suposición de que la materia sólo puede tener estados de energía discretos y no continuos. Esto quiere decir que ciertas propiedades físicas sólo toman valores múltiplos de valores fijos en vez de un espectro continuo de valores. La idea era que la radiación electromagnética emitida por un cuerpo negro se podía modelar como una serie de osciladores armónicos con una energía cuántica. Relacionando la energía (E) de los fotones de la radiación, con su frecuencia y con su momento angular, se obtiene:

Constante de Planck Este modelo se mostró muy exacto y desde entonces se denomina ley de Planck y significa que el universo es cuántico y no continuo. A nivel macroscópico no parece ser así, pues el valor de la constante de Planck es tan pequeño que el efecto de esta "cuantización" de los valores de la energía de cualquier sistema aparentemente varían de forma continua. La constante de Planck es uno de los números más importantes del universo y ha dado lugar a que la mecánica cuántica ha sustituido a la física tradicional. La constante de Planck aparece igualmente dentro del enunciado del principio de incertidumbre de Heisenberg.

EJEMPLOS DE LA LEY DE PLANCK 1. La aplicación de la Ley de Planck al Sol con una temperatura superficial de unos 6000 K nos lleva a que el 99% de la radiación emitida está entre las longitudes de onda 0, 15 μm (micrómetros o micras) y 4 micras y su máximo (Ley de Wien) ocurre a 0, 475 micras. Como 1 nanómetro 1 nm = 10 -9 m=10 -4 micras resulta que el Sol emite en un rango de 150 nm hasta 4000 nm y el máximo ocurre a 475 nm. La luz visible se extiende desde 400 nm a 740 nm. La radiación ultravioleta u ondas cortas iría desde los 150 nm a los 400 nm y la radiación infrarroja u ondas largas desde las 0, 74 micras a 4 micras. 2. La aplicación de la Ley de Planck a la Tierra con una temperatura superficial de unos 288 K (15 °C) nos lleva a que el 99% de la radiación emitida está entre las longitudes de onda 3 μm (micrómetros o micras) y 80 micras y su máximo ocurre a 10 micras. La estratosfera de la Tierra con una temperatura entre 210 y 220 K radia entre 4 y 120 micras con un máximo a las 14, 5 micras.

Aplicaciones

3. - La presión manométrica en la llanta de un automóvil es de 305 Kpa cuando su temperatura es de 15ºC. Después de correr a alta velocidad , el neumático se calentó y su presión subió a 360 Kpa. ¿Cual es entonces la temperatura del gas en la llanta? 4. - un gas a temperatura y presión ambiente esta contenido en un cilindro por medio de un pistón. Este es empujado de modo que su volumen se reduce a una octava parte de su valor inicial. Después de que la temperatura del gas ha vuelto a ser igual a la del ambiente. ¿Cuál será la presión manométrica del gas? (La presión atmosférica es de 740 mm de Hg)


10. - 200 gramos de Helio están confinados en un estanque de 20 litros. La presión manométrica del estanque es de 4 atmosferas cuando la presión atmosférica del lugar es de 1, 02 atmosferas. Calcular A)La temperatura a que se encuentra el gas. B) Suponga que el estanque puede variar su volumen por algún mecanismo, determine la presión manométrica del “nuevo estanque” cuando su volumen a disminuido en un 30ª y la temperatura a aumentado en 40ºC

11. - Con el extremo abierto hacia abajo , un tubo de ensayo cilíndrico de 15 cm de largo es sumergido en un lago. ¿Qué tan profundo en el lago debe estar el tubo para que el volumen de aire en el sea de un tercio de cuando fue introducido? 12. - Un estanque contiene 18 gramos de gas Nitrógeno a una presión de 4, 50 atm. ¿Qué cantidad de gas de hidrogeno a 3, 5 atm contendría el mismo depósito?


Montoya. -
 Bicicletas montoya murcia
Bicicletas montoya murcia Miguel treviño morales
Miguel treviño morales Juliana montoya cardona
Juliana montoya cardona Briana montoya
Briana montoya Danilo montoya
Danilo montoya Oscar danilo montoya giraldo
Oscar danilo montoya giraldo Cambridge program juanita high school
Cambridge program juanita high school Inigo montoya introduction
Inigo montoya introduction Geraldi montoya
Geraldi montoya Teorema carnot
Teorema carnot Dorothea puente serial killer
Dorothea puente serial killer Termodinmica
Termodinmica Procesos termodinamicos
Procesos termodinamicos Termodinâmica
Termodinâmica 2 principio della termodinamica formula
2 principio della termodinamica formula Ley de gay lussac
Ley de gay lussac Termodinamica
Termodinamica Termodinmica
Termodinmica Para que sirve la energía potencial
Para que sirve la energía potencial Termodinmica
Termodinmica Calor en sistema ingles
Calor en sistema ingles Maquina de thomas newcomen
Maquina de thomas newcomen Equilibrio termodinamico
Equilibrio termodinamico