INTRODUCCIN A LA TERMODINMICA es La termodinmica Autor


- Slides: 5

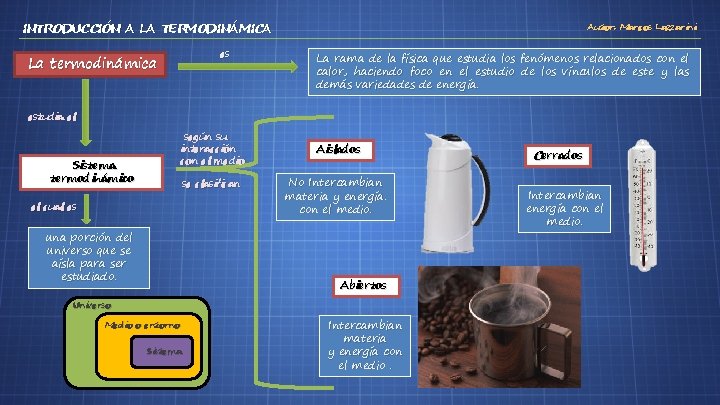
INTRODUCCIÓN A LA TERMODINÁMICA es La termodinámica Autor: Marcos Lazzarini La rama de la física que estudia los fenómenos relacionados con el calor, haciendo foco en el estudio de los vínculos de este y las demás variedades de energía. estudia el según su interacción con el medio Sistema termodinámico se clasifican el cual es una porción del universo que se aísla para ser estudiado. Aislados No Intercambian materia y energía. con el medio. Abiertos Universo Medio o entorno Sistema Intercambian materia y energía con el medio. Cerrados Intercambian energía con el medio.

CONCEPTOS BÁSICO DE TERMODINÁMICA Autor: Marcos Lazzarini ENERGÍA (E) : se define como “la capacidad que tiene un cuerpo CALOR (Q): “Es energía en transito” entre dos sistemas con diferentes para realizar trabajo“. temperatura o “Energía cinética media” , la dirección del calor siempre es TRABAJO (W): En física se define trabajo como “la fuerza que se desde el cuerpo que tiene mayor temperatura al de menor temperatura, ejerce sobre un cuerpo para producirle un movimiento, en una es decir del cuerpo más caliente al más frío. A este tipo de energía se la determinada distancia” conoce como energía térmica o calórica. Su fórmula es W (trabajo)= = F(fuerza) x d (distancia) ¿CON QUÉ UNIDADES DE ENERGÍA SE MIDE EL CALOR? Su unidad es el Joule se simboliza con la letra “J” Las unidad de energía es el Julio se simboliza por la letra “J “. Por lo tanto hablar de trabajo es lo mismo que hablar de energía y El “CALOR” o energía calórica, tiene su equivalente de energía , la viceversa. Entonces cualquier energía se puede expresar en “Joule” “CALORÍA” , se simboliza ”cal” TEMPERATURA (T): “Es una medida de la energía cinética promedio Se define como “la cantidad de calor que se necesita aportar a un 1 g de todas las moléculas de un sistema”. de agua para que eleve su temperatura en 1°C” ENERGÍA INTERNA (U): “Es la suma de las energías cinéticas y 1 CALORÍA = 4, 18 Joule , en símbolos 1 cal = 4, 18 J potenciales de todas las moléculas que componen a un sistema”. Un múltiplo muy utilizado es la kilocaloría 1 Kcal = 1000 cal Energía Interna (U) = Energía cinética (Ec) + Energía potencial (Ep) Hay tres tipos de energía cinética: de traslación, rotación y vibración. Hay diferentes Energía potenciales ( elástica, gravitatoria, eléctrica, química y nuclear). A Q A→B TA > T B B

ANÁLISIS DE LA RELACIÓN DE CALOR, ENERGÍA INTERNA Y TEMPERATURA Autor: Marcos Lazzarini En el siguiente ejemplo se tiene dos sistemas “A” y ”B” con las siguientes condiciones: ü Cada sistema posee sustancias diferentes, gaseosas y monoatómicas. ü Los dos sistemas tienen igual masa. ü Las moléculas del sistema “A” tienen el doble de tamaño que las moléculas del sistema “B”. ü Solo considera solamente la energía cinética de traslación. ü El sistema “A” formado por 10 moléculas y el sistema “B” por 20 moléculas. ü Se entrega a ambos sistemas 200 J de calor. Energía Cinética media 20 J ∆U A = 10 moléculas x 20 J = 200 J Energía Cinética media 10 J MA = M B A 10 moléculas ∆UA = ∆UB B 20 moléculas TA > T B ∆U B = 20 moléculas x 10 J = 200 J ECm_A < ECm_B Q = 200 J ü Conclusión: A sustancias diferentes de igual masa al entregarle una misma cantidad de calor aumentarán su energía interna en la misma proporción pero tendrán diferentes temperaturas.

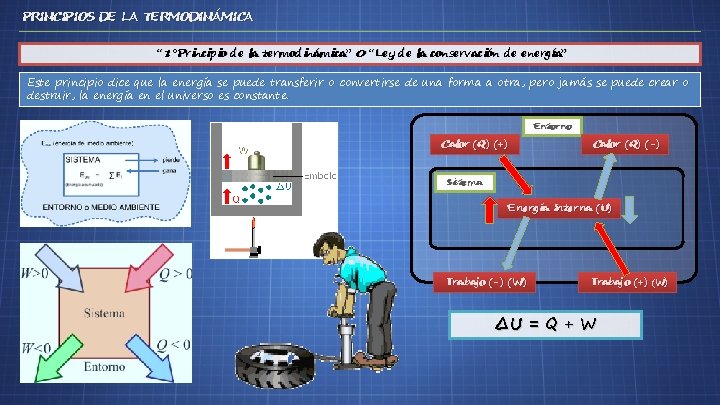
PRINCIPIOS DE LA TERMODINÁMICA “ 1°Principio de la termodinámica” 0 “Ley de la conservación de energía” Este principio dice que la energía se puede transferir o convertirse de una forma a otra, pero jamás se puede crear o destruir, la energía en el universo es constante. Entorno Calor (Q) (+) Calor (Q) (-) Sistema Energía Interna (U) Trabajo (-) (W) Trabajo (+) (W) ∆U = Q + W

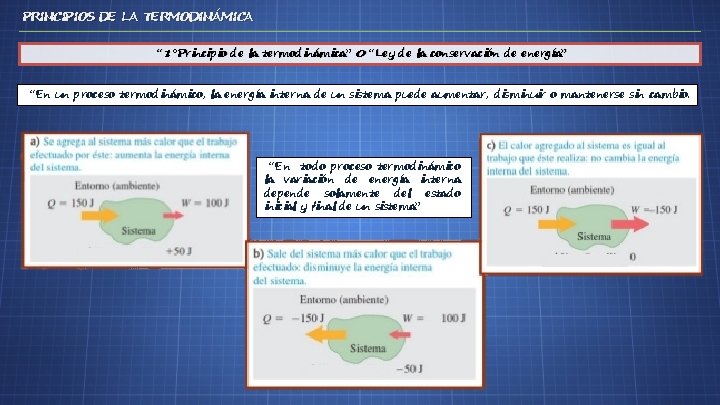
PRINCIPIOS DE LA TERMODINÁMICA “ 1°Principio de la termodinámica” 0 “Ley de la conservación de energía” “En un proceso termodinámico, la energía interna de un sistema puede aumentar, disminuir o mantenerse sin cambio. “En todo proceso termodinámico la variación de energía interna depende solamente del estado inicial y final de un sistema”









