A sejtadhzi a sejtek kapcsolata Dr Darvas Zsuzsanna












- Slides: 60

A sejtadhézió a sejtek kapcsolata Dr. Darvas Zsuzsanna Ph. D Genetikai, Sejt- és Immunbiológiai Intézet 1

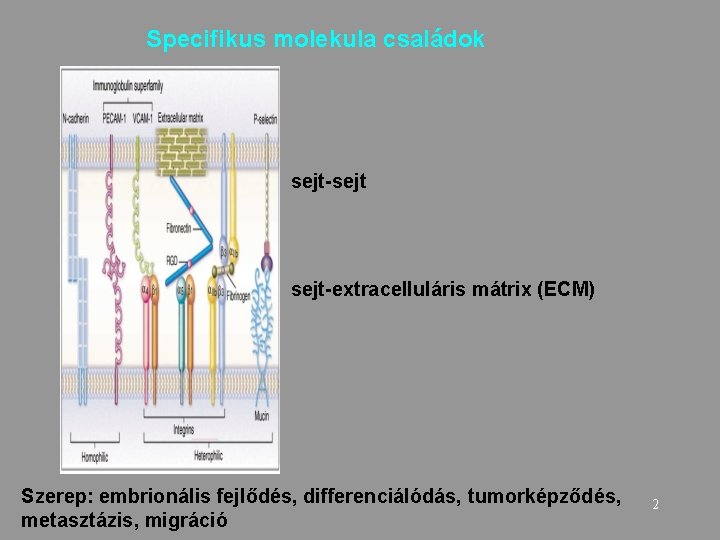
Specifikus molekula családok sejt-sejt-extracelluláris mátrix (ECM) Szerep: embrionális fejlődés, differenciálódás, tumorképződés, metasztázis, migráció 2

Adhéziós molekulák jellemzése Sejt-sejt vagy sejt-mátrix Ion (Ca++, Mg++) függőség Homofil v. heterofil kapcsolódás Együttműködés a sejtváz komponensel Időleges vagy állandósult struktúra része 3

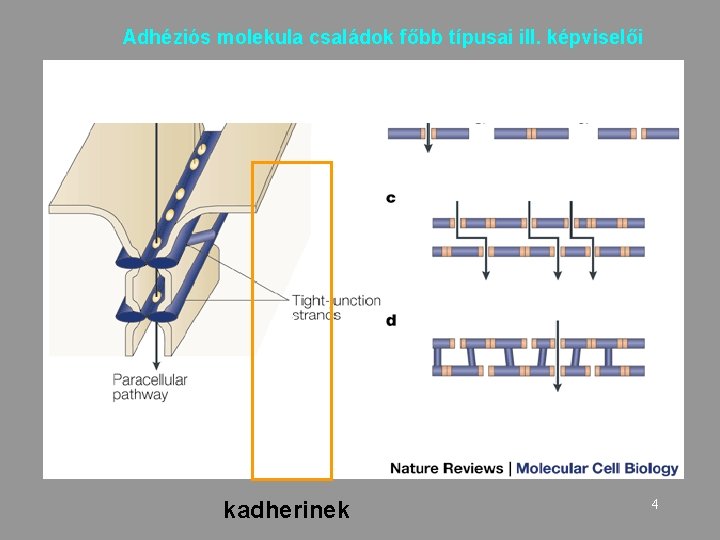
Adhéziós molekula családok főbb típusai ill. képviselői 3 kadherinek 4

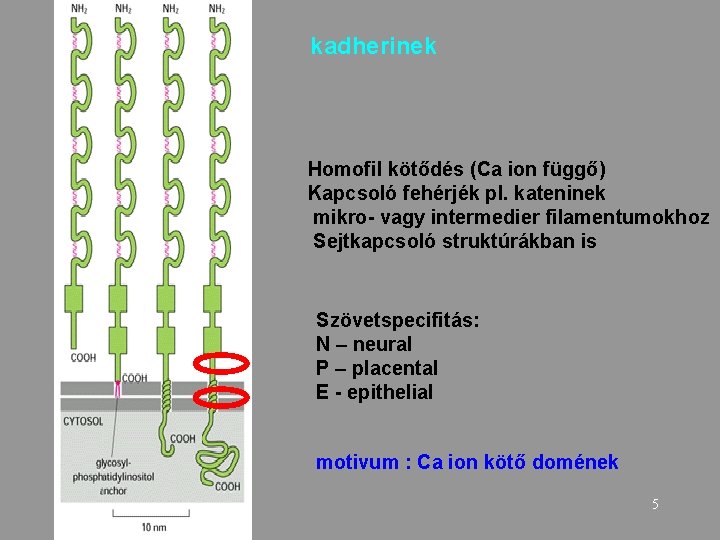
kadherinek Homofil kötődés (Ca ion függő) Kapcsoló fehérjék pl. kateninek mikro- vagy intermedier filamentumokhoz Sejtkapcsoló struktúrákban is Szövetspecifitás: N – neural P – placental E - epithelial motivum : Ca ion kötő domének 5

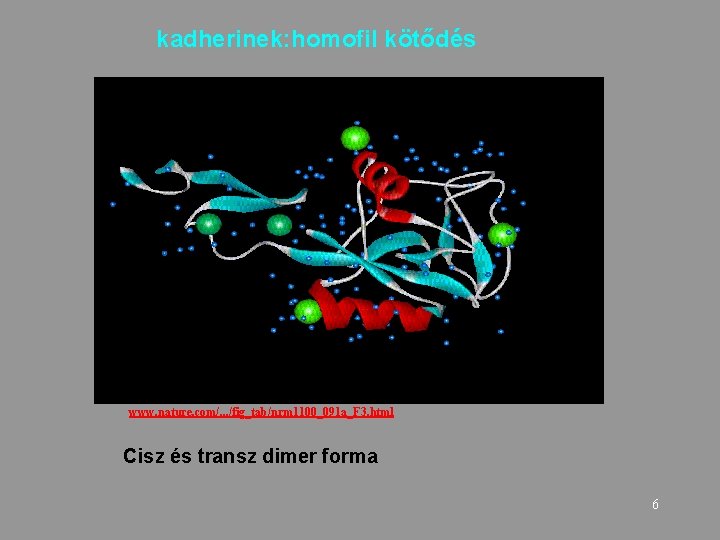
kadherinek: homofil kötődés www. nature. com/. . . /fig_tab/nrm 1100_091 a_F 3. html Cisz és transz dimer forma 6

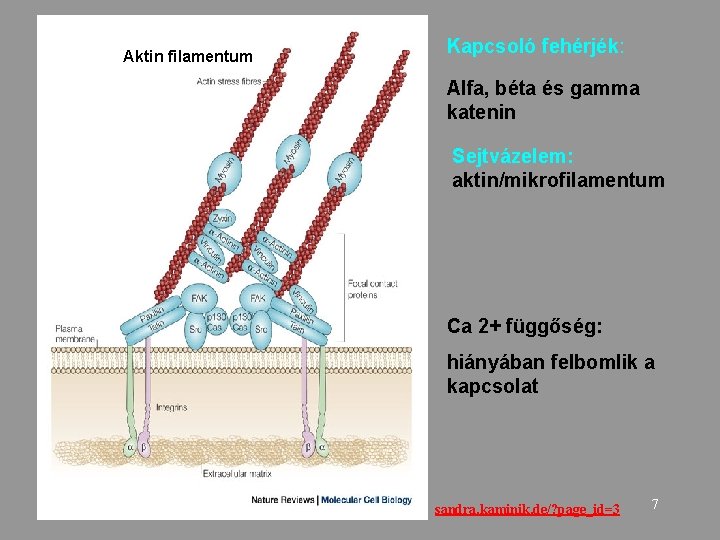
Aktin filamentum Kapcsoló fehérjék: Alfa, béta és gamma katenin Sejtvázelem: aktin/mikrofilamentum Ca 2+ függőség: hiányában felbomlik a kapcsolat sandra. kaminik. de/? page_id=3 7

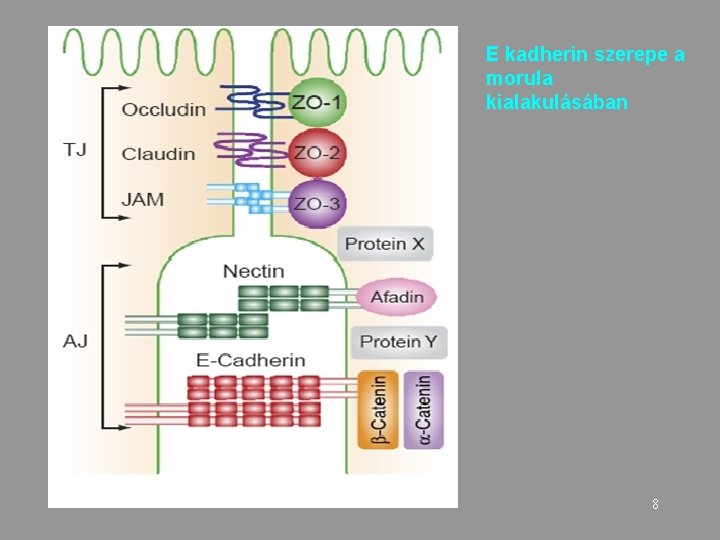
E kadherin szerepe a morula kialakulásában 8

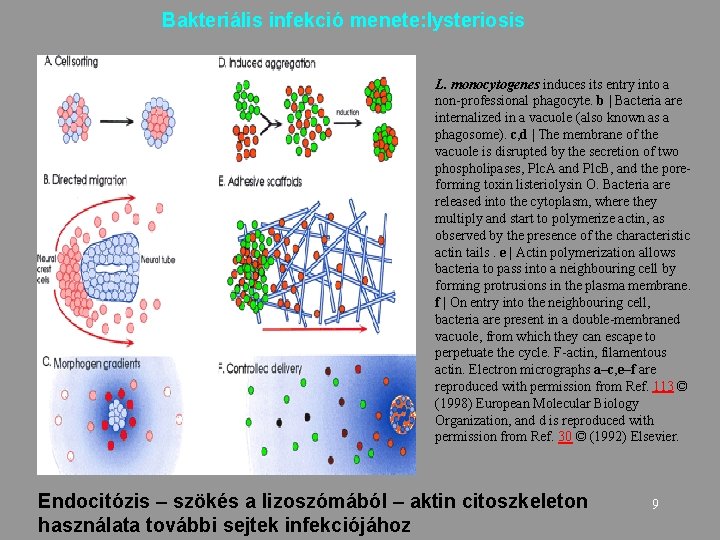
Bakteriális infekció menete: lysteriosis L. monocytogenes induces its entry into a non-professional phagocyte. b | Bacteria are internalized in a vacuole (also known as a phagosome). c, d | The membrane of the vacuole is disrupted by the secretion of two phospholipases, Plc. A and Plc. B, and the poreforming toxin listeriolysin O. Bacteria are released into the cytoplasm, where they multiply and start to polymerize actin, as observed by the presence of the characteristic actin tails. e | Actin polymerization allows bacteria to pass into a neighbouring cell by forming protrusions in the plasma membrane. f | On entry into the neighbouring cell, bacteria are present in a double-membraned vacuole, from which they can escape to perpetuate the cycle. F-actin, filamentous actin. Electron micrographs a–c, e–f are reproduced with permission from Ref. 113 © (1998) European Molecular Biology Organization, and d is reproduced with permission from Ref. 30 © (1992) Elsevier. Endocitózis – szökés a lizoszómából – aktin citoszkeleton használata további sejtek infekciójához 9

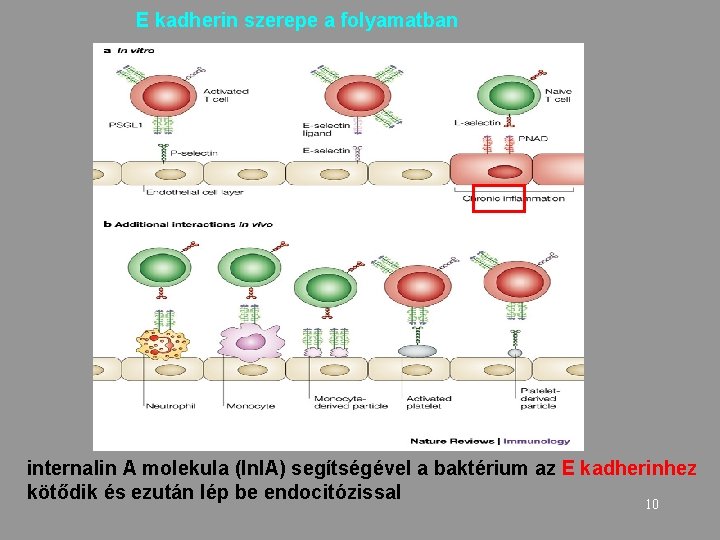
E kadherin szerepe a folyamatban internalin A molekula (Inl. A) segítségével a baktérium az E kadherinhez kötődik és ezután lép be endocitózissal 10

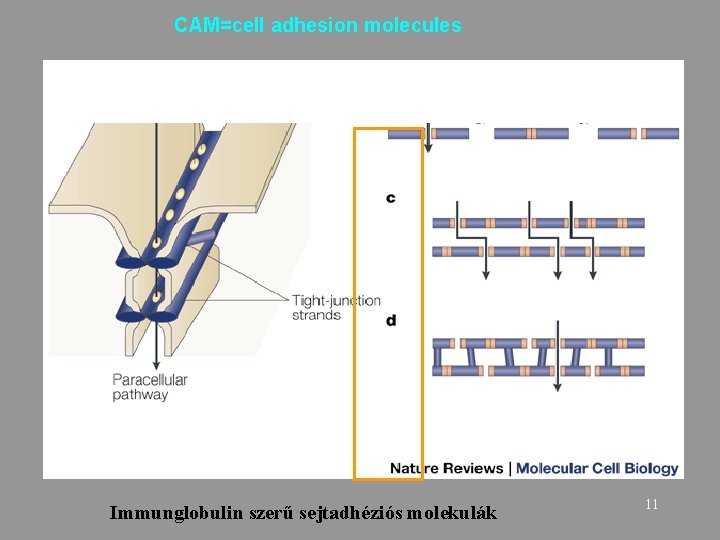
CAM=cell adhesion molecules Immunglobulin szerű sejtadhéziós molekulák 11

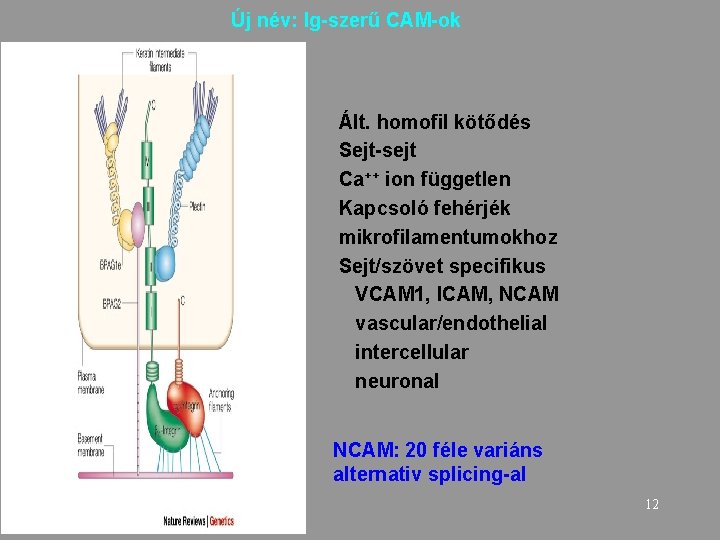
Új név: Ig-szerű CAM-ok Ált. homofil kötődés Sejt-sejt Ca++ ion független Kapcsoló fehérjék mikrofilamentumokhoz Sejt/szövet specifikus VCAM 1, ICAM, NCAM vascular/endothelial intercellular neuronal NCAM: 20 féle variáns alternativ splicing-al 12

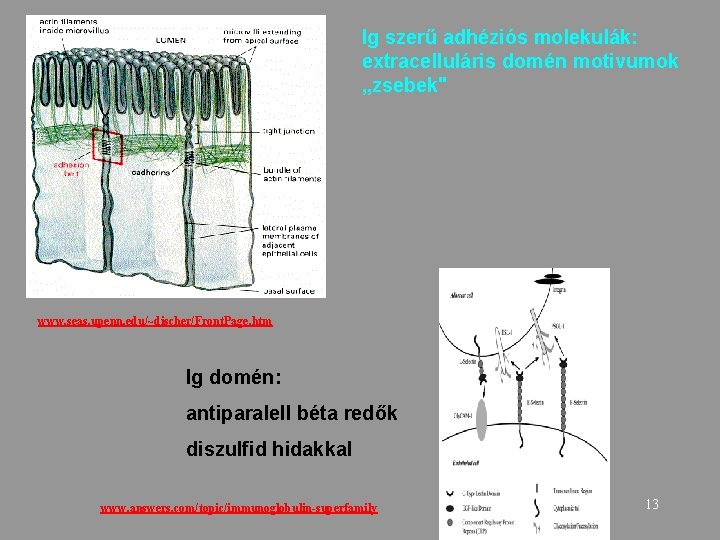
Ig szerű adhéziós molekulák: extracelluláris domén motivumok „zsebek" www. seas. upenn. edu/~discher/Front. Page. htm Ig domén: antiparalell béta redők diszulfid hidakkal www. answers. com/topic/immunoglobulin-superfamily 13

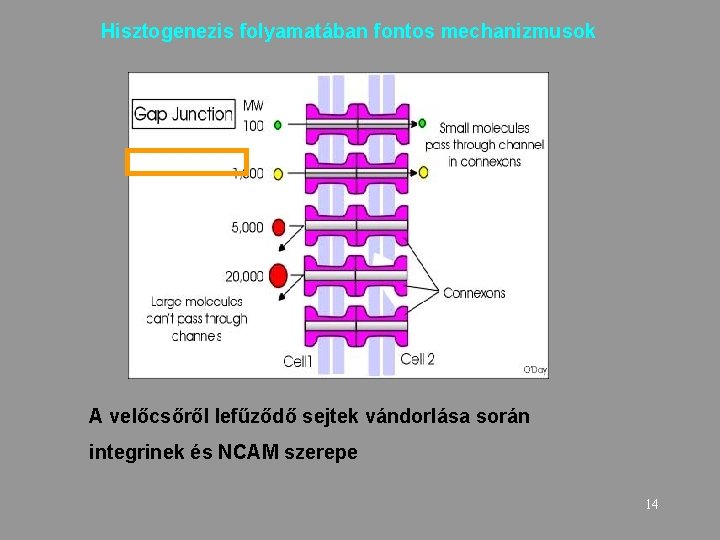
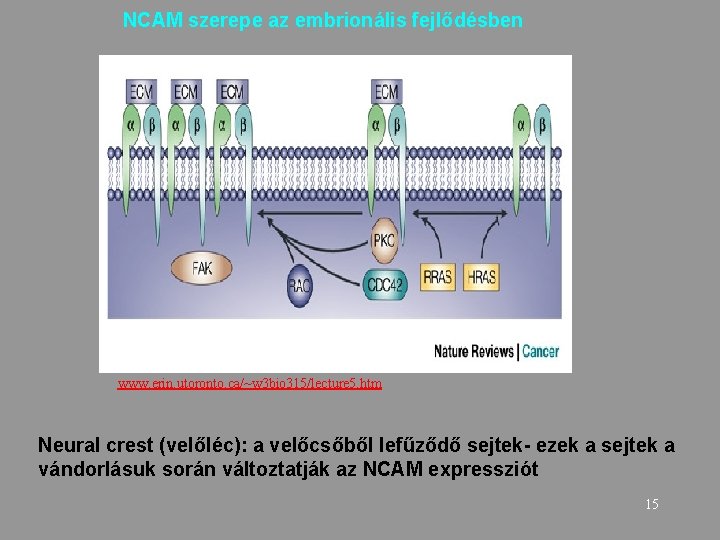
Hisztogenezis folyamatában fontos mechanizmusok A velőcsőről lefűződő sejtek vándorlása során integrinek és NCAM szerepe 14

NCAM szerepe az embrionális fejlődésben www. erin. utoronto. ca/~w 3 bio 315/lecture 5. htm Neural crest (velőléc): a velőcsőből lefűződő sejtek- ezek a sejtek a vándorlásuk során változtatják az NCAM expressziót 15

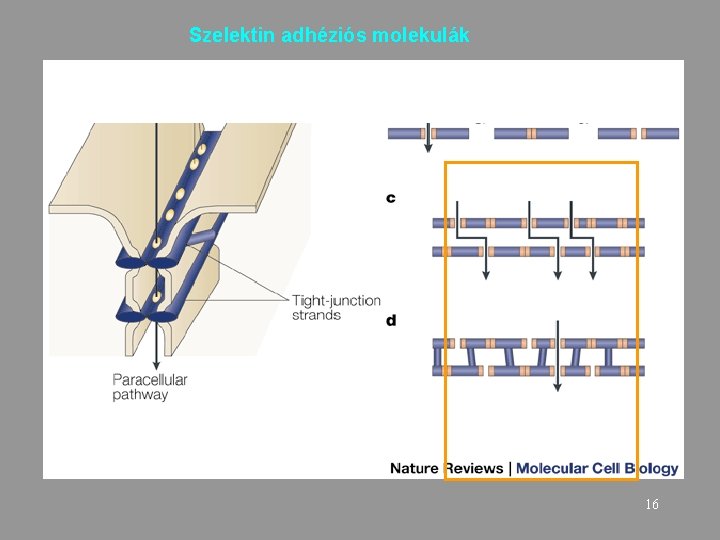
Szelektin adhéziós molekulák 16

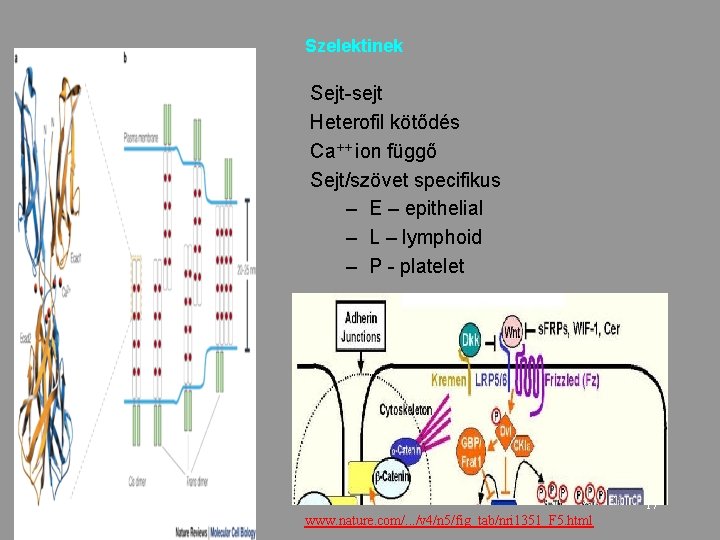
Szelektinek Sejt-sejt Heterofil kötődés Ca++ ion függő Sejt/szövet specifikus – E – epithelial – L – lymphoid – P - platelet 17 www. nature. com/. . . /v 4/n 5/fig_tab/nri 1351_F 5. html

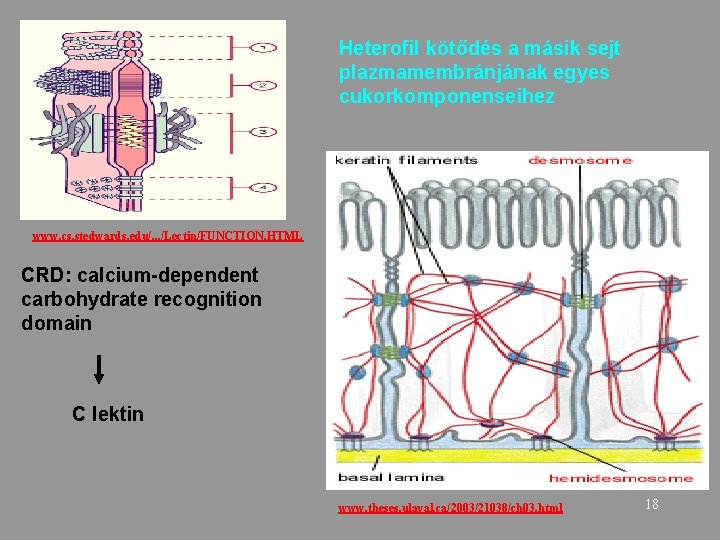
Heterofil kötődés a másik sejt plazmamembránjának egyes cukorkomponenseihez www. cs. stedwards. edu/. . . /Lectin/FUNCTION. HTML CRD: calcium-dependent carbohydrate recognition domain C lektin www. theses. ulaval. ca/2003/21038/ch 03. html 18

P szelektin ligandja: PSGL-1 ( P selectin glycoprotein ligand 1) bme. virginia. edu/ley/psgl-1. html P-selectin glycoprotein ligand-1 is a 240 k. Da homodimer consisting of two 120 k. Da polypeptide chains. PSGL-1 is constitutively expressed on all leukocytes. PSGL-1 is primarily found on the tips of the microvilli. PSGL-1 can bind to P-selectin on the endothelium when decorated with appropriate sugars. The structure of functional PSGL-1 includes the sialyl-Lewisx component. The PSGL-1 gene encodes a transmembrane polypeptide rich in proline, serine and threonine residues typical of mucin-type glycoproteins. The O-linked glycans displayed by PSGL-1 must undergo two specific post-translational modifications in order for it to function as a counter-receptor for P-selectin: a(1, 3) fucosylation and a(2, 3) sialylation. Bonds between P-selectin and PSGL-1 primarily mediate the rolling phase 19 of the adhesion cascade

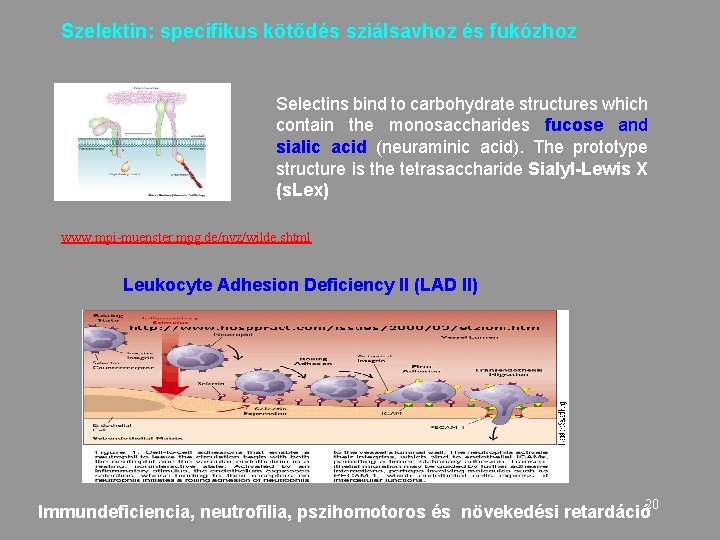
Szelektin: specifikus kötődés sziálsavhoz és fukózhoz Selectins bind to carbohydrate structures which contain the monosaccharides fucose and sialic acid (neuraminic acid). The prototype structure is the tetrasaccharide Sialyl-Lewis X (s. Lex) www. mpi-muenster. mpg. de/nvz/wilde. shtml Leukocyte Adhesion Deficiency II (LAD II) Immundeficiencia, neutrofilia, pszihomotoros és növekedési retardáció 20

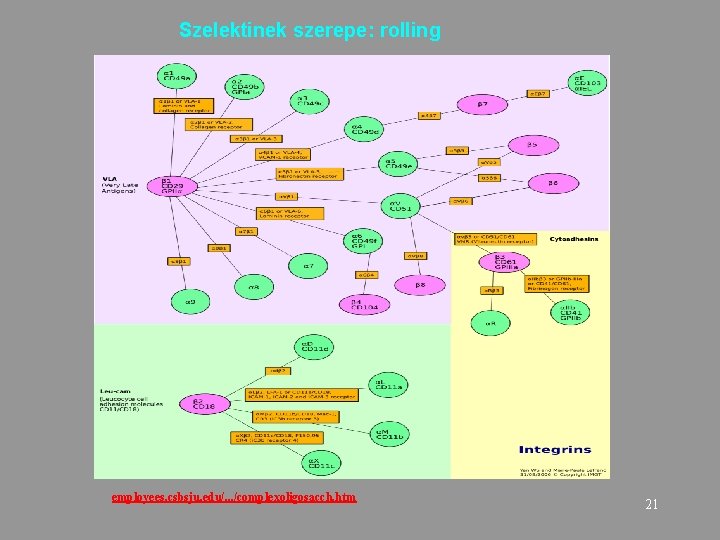
Szelektinek szerepe: rolling employees. csbsju. edu/. . . /complexoligosacch. htm 21

Integrinek 22

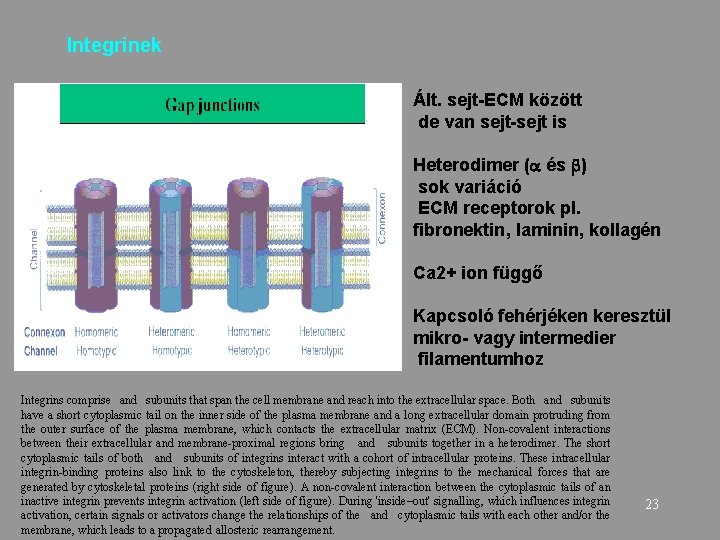
Integrinek Ált. sejt-ECM között de van sejt-sejt is Heterodimer ( és ) sok variáció ECM receptorok pl. fibronektin, laminin, kollagén Ca 2+ ion függő Kapcsoló fehérjéken keresztül mikro- vagy intermedier filamentumhoz Integrins comprise and subunits that span the cell membrane and reach into the extracellular space. Both and subunits have a short cytoplasmic tail on the inner side of the plasma membrane and a long extracellular domain protruding from the outer surface of the plasma membrane, which contacts the extracellular matrix (ECM). Non-covalent interactions between their extracellular and membrane-proximal regions bring and subunits together in a heterodimer. The short cytoplasmic tails of both and subunits of integrins interact with a cohort of intracellular proteins. These intracellular integrin-binding proteins also link to the cytoskeleton, thereby subjecting integrins to the mechanical forces that are generated by cytoskeletal proteins (right side of figure). A non-covalent interaction between the cytoplasmic tails of an inactive integrin prevents integrin activation (left side of figure). During 'inside–out' signalling, which influences integrin activation, certain signals or activators change the relationships of the and cytoplasmic tails with each other and/or the membrane, which leads to a propagated allosteric rearrangement. 23

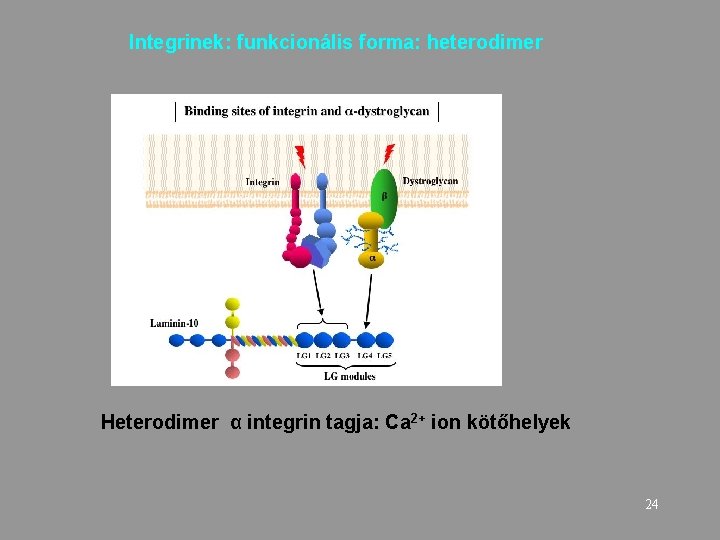
Integrinek: funkcionális forma: heterodimer Heterodimer α integrin tagja: Ca 2+ ion kötőhelyek 24

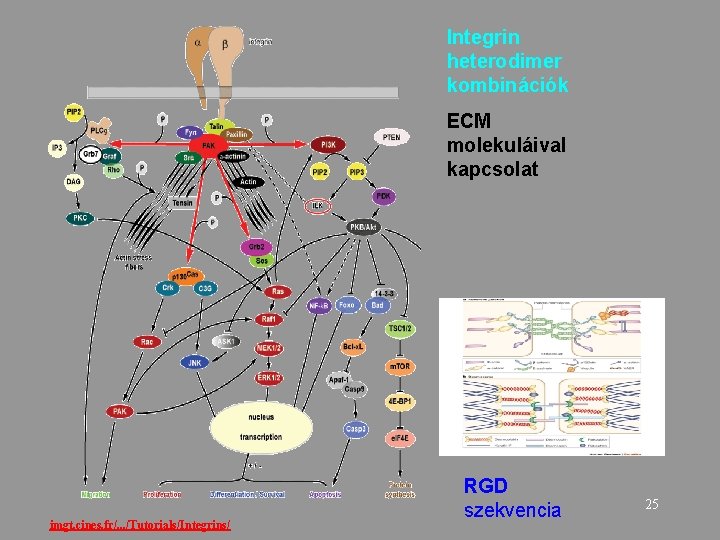
Integrin heterodimer kombinációk ECM molekuláival kapcsolat imgt. cines. fr/. . . /Tutorials/Integrins/ RGD szekvencia 25

Integrin és ECM molekula kapcsolat szabályozása: kis G fehérjék Integrin α and β adhesiveness to extracellular matrix (ECM) components is regulated by altering the integrin's affinity for its ECM ligands and/or by altering the integrin's avidity. Small GTP-binding proteins seem to have a prevalent role in these processes. The activation of the small GTP-binding protein RRAS can lead to increases in integrin affinity for the ECM, whereas HRAS activation can lead to decreases in integrin affinity (no ECM binding). Similarly, activation of the small GTP-binding proteins RAC and CDC 42, and protein kinase C (PKC), can lead to clustering of integrins, thereby increasing integrin avidity. The careful regulation of each of these events is necessary for efficient cell migration. 26

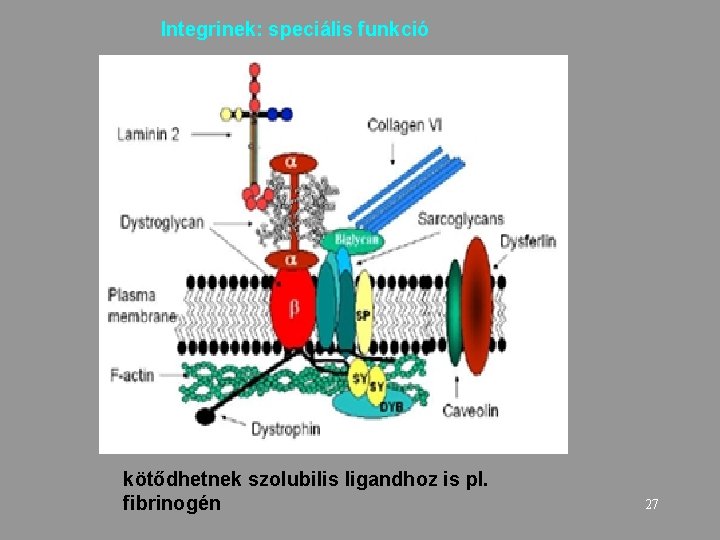
Integrinek: speciális funkció kötődhetnek szolubilis ligandhoz is pl. fibrinogén 27

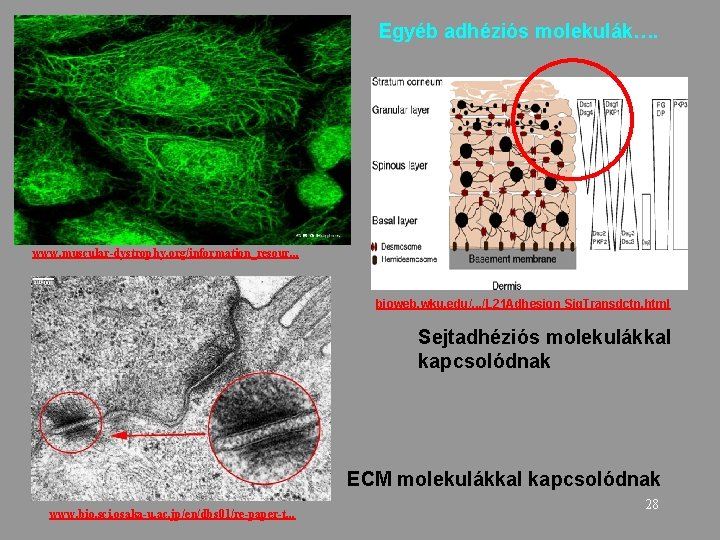
Egyéb adhéziós molekulák…. www. muscular-dystrophy. org/information_resour. . . bioweb. wku. edu/. . . /L 21 Adhesion Sig. Transdctn. html Sejtadhéziós molekulákkal kapcsolódnak ECM molekulákkal kapcsolódnak www. bio. sci. osaka-u. ac. jp/en/dbs 01/re-paper-t. . . 28

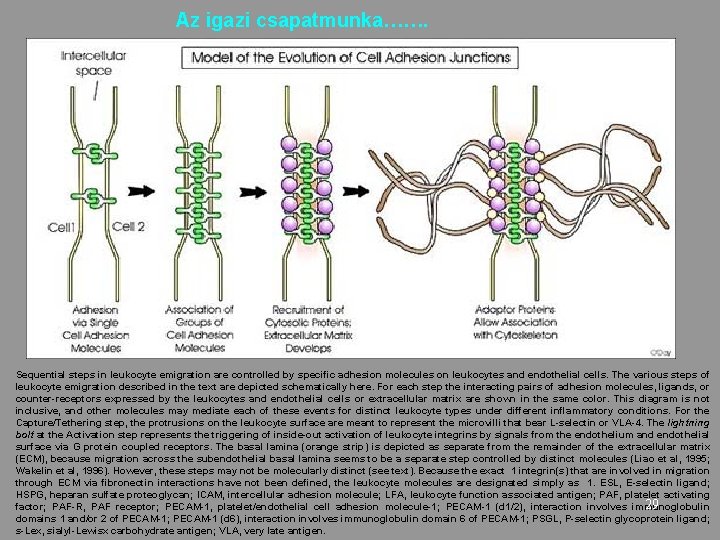
Az igazi csapatmunka……. Sequential steps in leukocyte emigration are controlled by specific adhesion molecules on leukocytes and endothelial cells. The various steps of leukocyte emigration described in the text are depicted schematically here. For each step the interacting pairs of adhesion molecules, ligands, or counter-receptors expressed by the leukocytes and endothelial cells or extracellular matrix are shown in the same color. This diagram is not inclusive, and other molecules may mediate each of these events for distinct leukocyte types under different inflammatory conditions. For the Capture/Tethering step, the protrusions on the leukocyte surface are meant to represent the microvilli that bear L-selectin or VLA-4. The lightning bolt at the Activation step represents the triggering of inside-out activation of leukocyte integrins by signals from the endothelium and endothelial surface via G protein coupled receptors. The basal lamina (orange strip) is depicted as separate from the remainder of the extracellular matrix (ECM), because migration across the subendothelial basal lamina seems to be a separate step controlled by distinct molecules (Liao et al, 1995; Wakelin et al, 1996). However, these steps may not be molecularly distinct (see text). Because the exact 1 integrin(s) that are involved in migration through ECM via fibronectin interactions have not been defined, the leukocyte molecules are designated simply as 1. ESL, E-selectin ligand; HSPG, heparan sulfate proteoglycan; ICAM, intercellular adhesion molecule; LFA, leukocyte function associated antigen; PAF, platelet activating 29 factor; PAF-R, PAF receptor; PECAM-1, platelet/endothelial cell adhesion molecule-1; PECAM-1 (d 1/2), interaction involves immunoglobulin domains 1 and/or 2 of PECAM-1; PECAM-1 (d 6), interaction involves immunoglobulin domain 6 of PECAM-1; PSGL, P-selectin glycoprotein ligand; s-Lex, sialyl-Lewisx carbohydrate antigen; VLA, very late antigen.

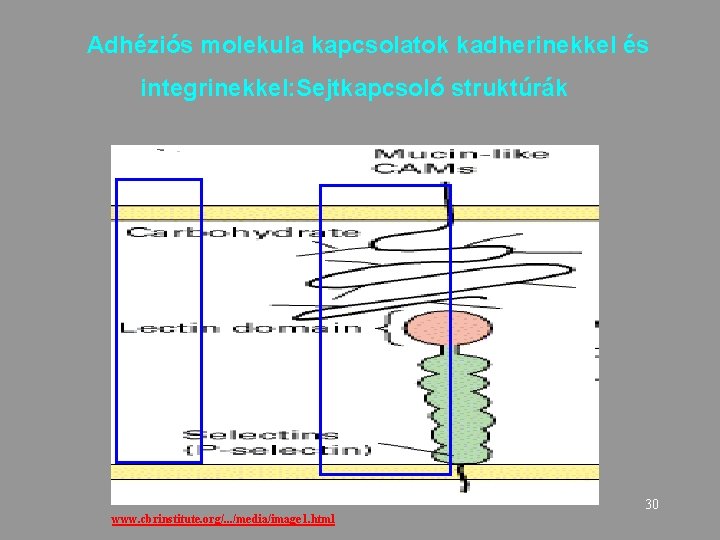
Adhéziós molekula kapcsolatok kadherinekkel és integrinekkel: Sejtkapcsoló struktúrák 30 www. cbrinstitute. org/. . . /media/image 1. html

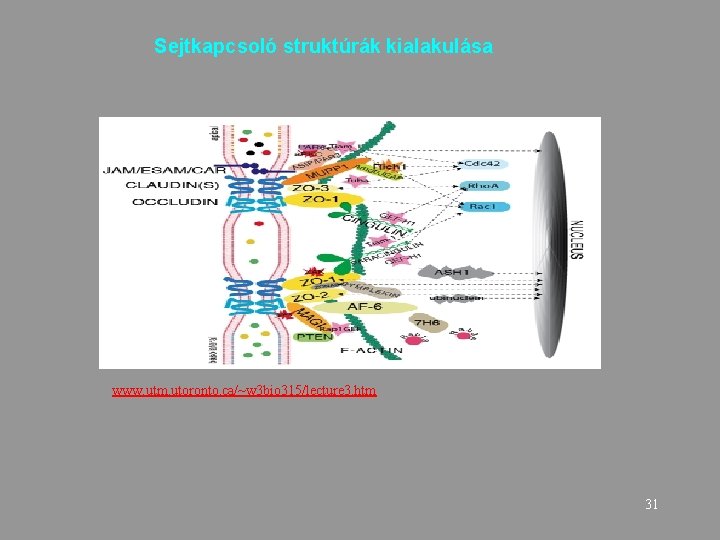
Sejtkapcsoló struktúrák kialakulása www. utm. utoronto. ca/~w 3 bio 315/lecture 3. htm 31

A sejtkapcsoló struktúrák jellemzése Sejt-sejt, sejt-mátrix Ion (Ca++, Mg++) függőség Állandó vagy időleges Kapcsolódó sejtváz elemek Funkció: Lezárás és mechanikai kapcsolás Mechanikai kapcsolás Kommunikáció 32

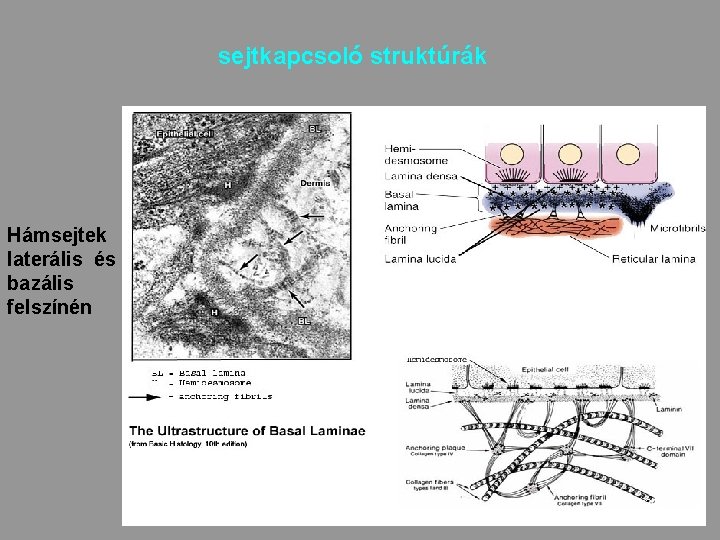
sejtkapcsoló struktúrák Hámsejtek laterális és bazális felszínén 33

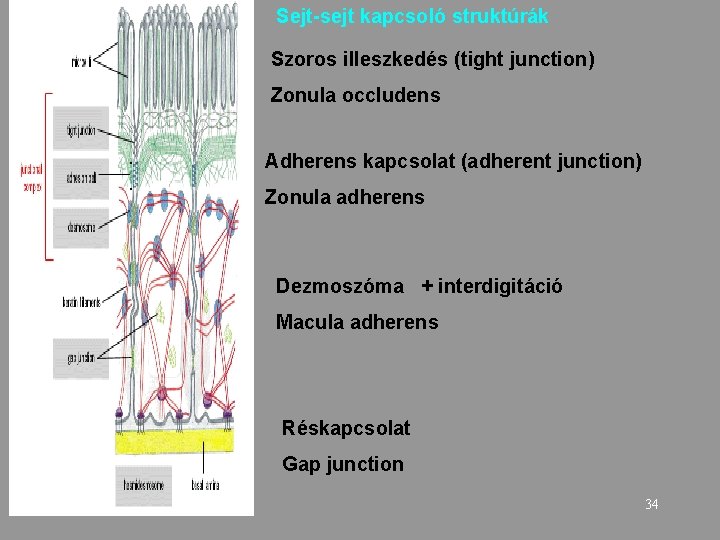
Sejt-sejt kapcsoló struktúrák Szoros illeszkedés (tight junction) Zonula occludens Adherens kapcsolat (adherent junction) Zonula adherens Dezmoszóma + interdigitáció Macula adherens Réskapcsolat Gap junction 34

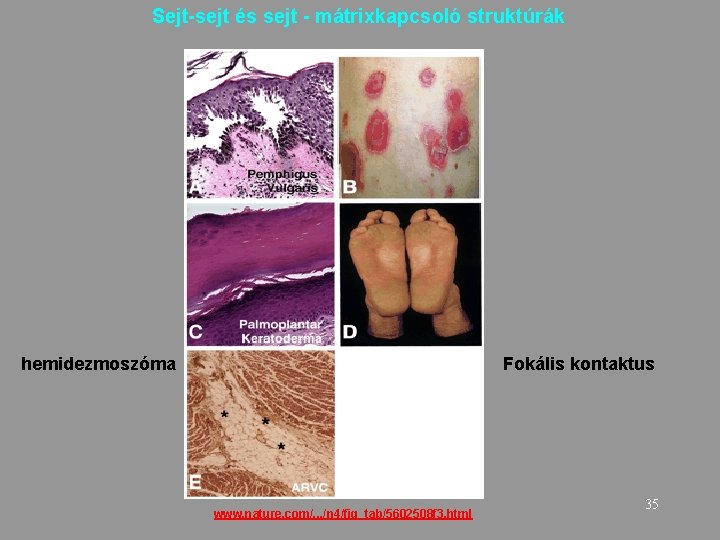
Sejt-sejt és sejt - mátrixkapcsoló struktúrák hemidezmoszóma Fokális kontaktus www. nature. com/. . . /n 4/fig_tab/5602508 f 3. html 35

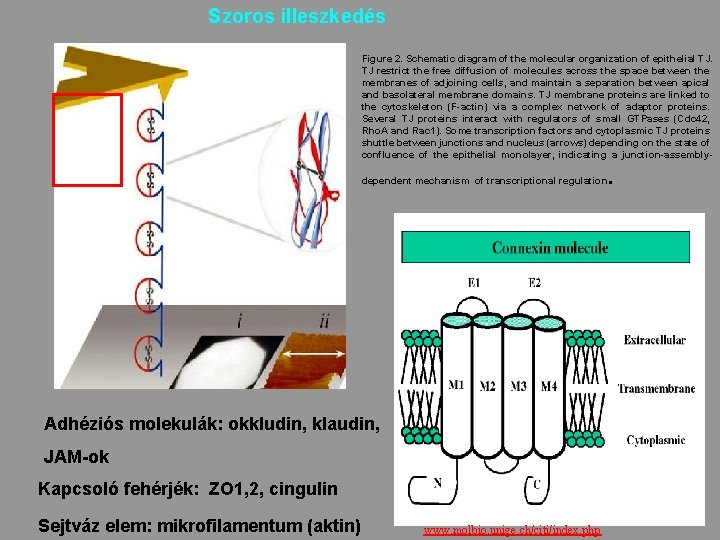
Szoros illeszkedés Figure 2. Schematic diagram of the molecular organization of epithelial TJ. TJ restrict the free diffusion of molecules across the space between the membranes of adjoining cells, and maintain a separation between apical and basolateral membrane domains. TJ membrane proteins are linked to the cytoskeleton (F-actin) via a complex network of adaptor proteins. Several TJ proteins interact with regulators of small GTPases (Cdc 42, Rho. A and Rac 1). Some transcription factors and cytoplasmic TJ proteins shuttle between junctions and nucleus (arrows) depending on the state of confluence of the epithelial monolayer, indicating a junction-assembly- . dependent mechanism of transcriptional regulation Adhéziós molekulák: okkludin, klaudin, JAM-ok Kapcsoló fehérjék: ZO 1, 2, cingulin Sejtváz elem: mikrofilamentum (aktin) 36 www. molbio. unige. ch/citi/index. php

37

Szoros illeszkedés szerepe -mechanikai kapcsolat - paracelluláris transzport szabályozása -apikális és laterális membrán domének megtartása 38

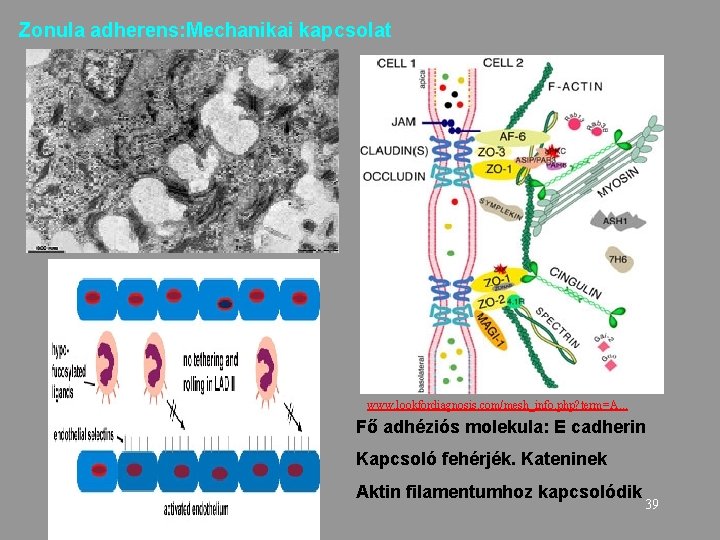
Zonula adherens: Mechanikai kapcsolat www. lookfordiagnosis. com/mesh_info. php? term=A. . . Fő adhéziós molekula: E cadherin Kapcsoló fehérjék. Kateninek Aktin filamentumhoz kapcsolódik 39

Adherens sejtkapcsolat és egy szignalizációs útvonal Howard et al. BMC Musculoskeletal Disorders 2003 4: 16 doi: 10. 1186/147 1 -2474 -4 -16 Canonical Wnt/β-catenin pathway. β-catenin is a component of cell-cell adhesion structures (adherens junctions) [20 -22] and a key signaling factor in the Wnt pathway [10]. As shown here canonical Wnt signalling (Wnt/β-catenin) is defined by its inhibition of glycogen synthase kinase -3β (GSK-3β) catalyzed phosphorylation of β-catenin. Several factors, including Cer (cerebrus), WIF-1 (wnt-interacting protein), and s. FRPs (secreted frizzled related proteins) and dickkopf-1 (Dkk) are known to antagonize Wnt signalling [63 -69]. However, upon Wnt stimulation several Fz-LRP downstream signalling components, including the phosphoprotein dishevelled (Dvl) [70 -72], GBP/Frat 1 (GSK-3β Binding Protein) [73] and casein kinase I (CKIε) [74, 75], somehow co-operate to inhibit GSK-3β. This ultimately this leads to an increase in the cytosolic 'free' levels of β-catenin (uncomplexed to cadherin), and its accumulation within the nucleus where it binds to members of the Tcf/Lef (T-cell factor-lymphoid enhancer factor) transcription factor family to activate gene transcription in a cell-context dependent manner [28 -34]. In the absence of Wnt signalling, Axin/conductin [76, 77] in co-operation with the product of the tumour suppressor gene adenomatous polyposis coli (APC) [78, 79] facilitate GSK-3β mediated phosphorylation of β-catenin on N-terminal serine and threonine residues [80]. 40 This hyperphosphorylated form of β-catenin then binds to the F-box protein β Tr. CP, which targets β-catenin for degradation via the ubiquitin-proteosome pathway [81 -84].

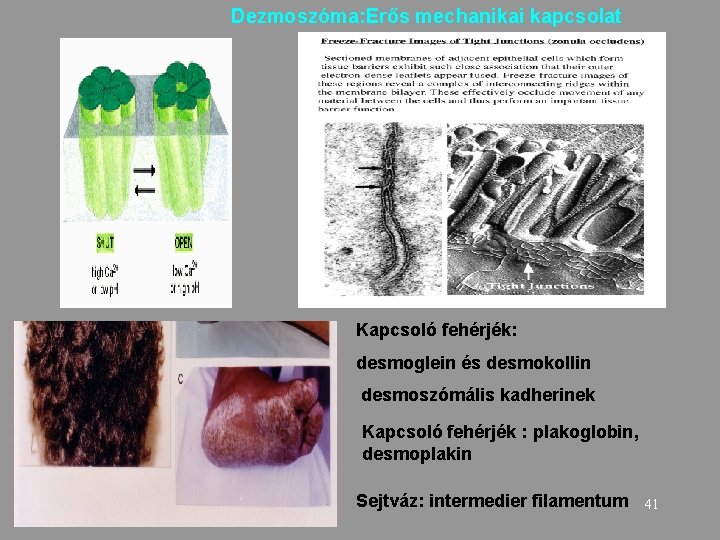
Dezmoszóma: Erős mechanikai kapcsolat Kapcsoló fehérjék: desmoglein és desmokollin desmoszómális kadherinek Kapcsoló fehérjék : plakoglobin, desmoplakin Sejtváz: intermedier filamentum 41

Stratum spinosum dezmoszóma 42

Réskapcsolat (gap junction) Kommunikációs sejt-sejt kapcsolat 100 -1000 konnexon Fehérje: konnexinek Connexin molekula elhelyezkedése a membránban 43

A réskapcsolat felépülése konnexin fehérjékből Példa kombinációkra 44

Homo- és heterotpikus réskapcsolatok a retina sejtjei között The presence of gap junction coupling as a result of connexin 36 (CX 36) expression has been shown between cones 81, and are also assumed to contain CX 36, on the cone side, between cones and rods 81. CX 36 -containing gap junction channels also occur beween the dendrites of OFF cone bipolar cells (OFF CB)81. Horizontal cells (H) are coupled by CX 57 -containing gap junctions 29. During scotopic light conditions, the network of AII amacrine cells (AII), which are connected to each other by CX 36 -containing gap junctions, mediates signalling from the rod to the cone signal transmission pathway by heterotypic electrical synapses between AII amacrine cells (CX 36) and ON cone bipolar cells (CX 45)28. Homotypic CX 36 gap junction channels have been reported to be present between alpha ganglion cells ( GC)82, 84. Note that the schematic topology of all the electrical synapses shown needs to be verified by further research. C, cone photoreceptor cell; CB, cone bipolar cell; GC, ganglion cell; GCL, ganglion cell layer; INL, inner nuclear layer; IPL, inner plexiform layer; IS, inner segment; NFL, optic nerve fibre layer; ONL, outer 45 nuclear layer; OPL, outer plexiform layer; OS, outer segment; R, rod photoreceptor cell; RB, rod bipolar cell.

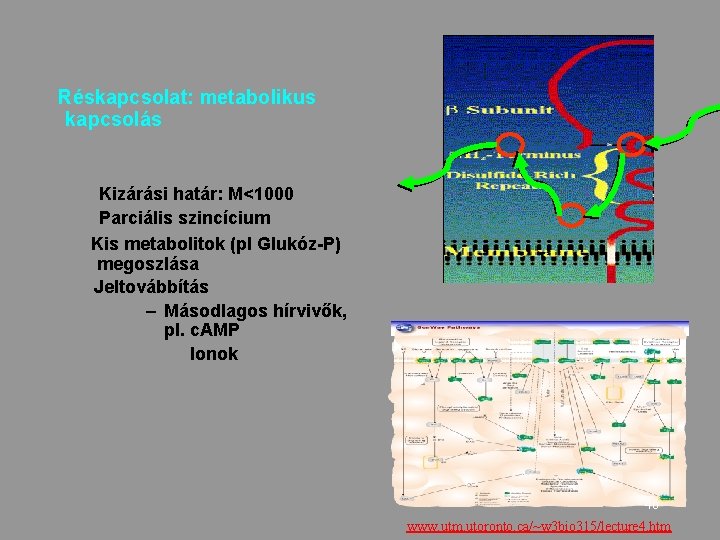
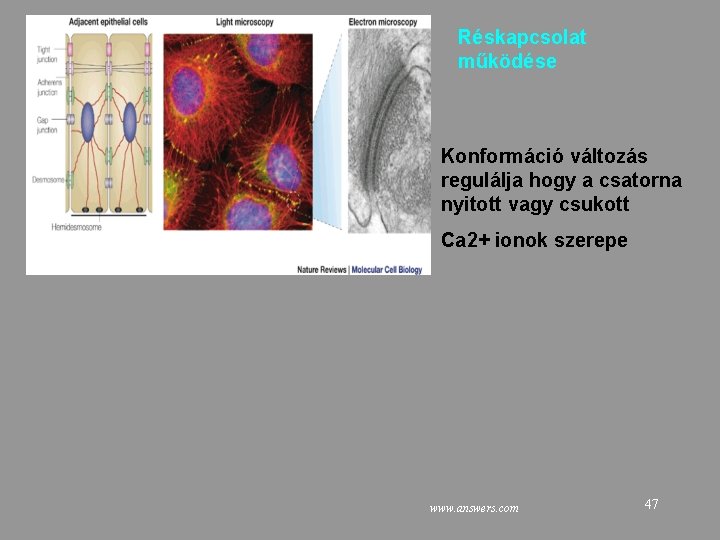
Réskapcsolat: metabolikus kapcsolás Kizárási határ: M<1000 Parciális szincícium Kis metabolitok (pl Glukóz-P) megoszlása Jeltovábbítás – Másodlagos hírvivők, pl. c. AMP Ionok 46 www. utm. utoronto. ca/~w 3 bio 315/lecture 4. htm

Réskapcsolat működése Konformáció változás regulálja hogy a csatorna nyitott vagy csukott Ca 2+ ionok szerepe www. answers. com 47

Réskapcsolat és szignál útvonalak kapcsolata 48

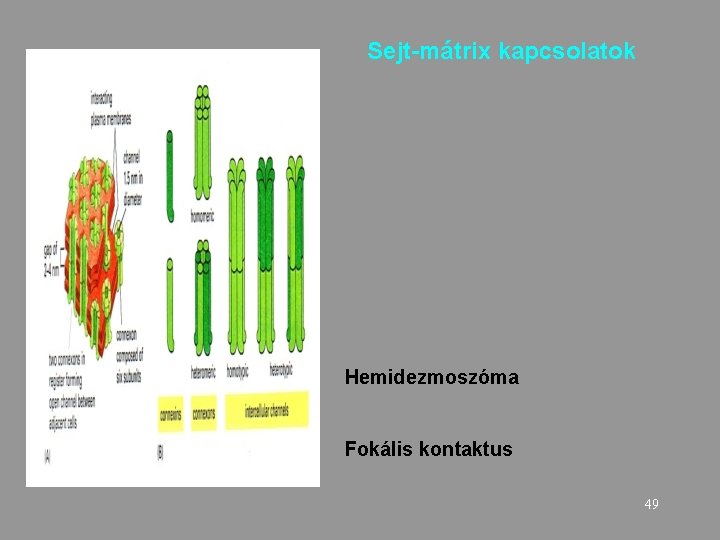
Sejt-mátrix kapcsolatok Hemidezmoszóma Fokális kontaktus 49

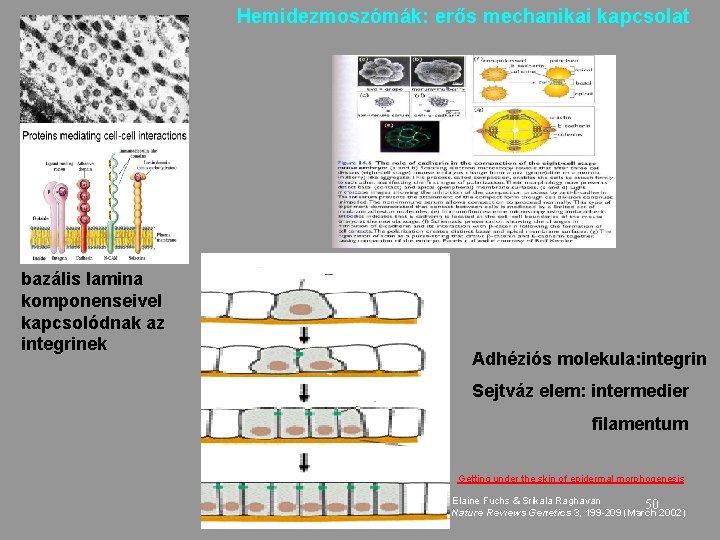
Hemidezmoszómák: erős mechanikai kapcsolat bazális lamina komponenseivel kapcsolódnak az integrinek Adhéziós molekula: integrin Sejtváz elem: intermedier filamentum Getting under the skin of epidermal morphogenesis Elaine Fuchs & Srikala Raghavan 50 Nature Reviews Genetics 3, 199 -209 (March 2002)

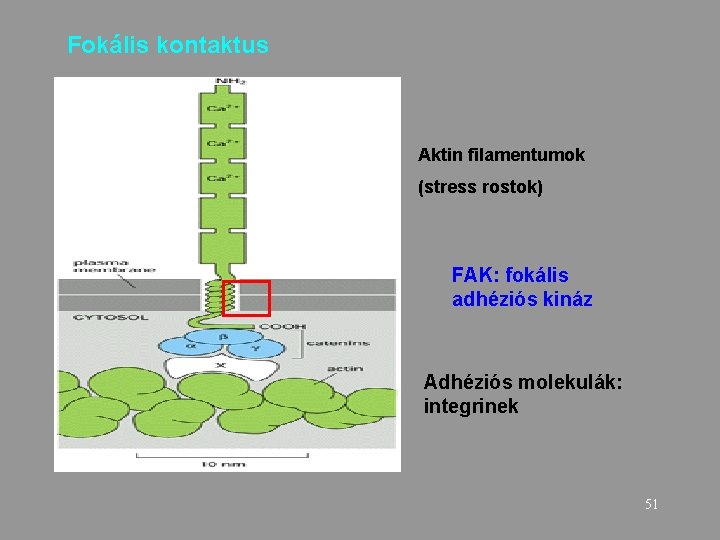
Fokális kontaktus Aktin filamentumok (stress rostok) FAK: fokális adhéziós kináz Adhéziós molekulák: integrinek 51

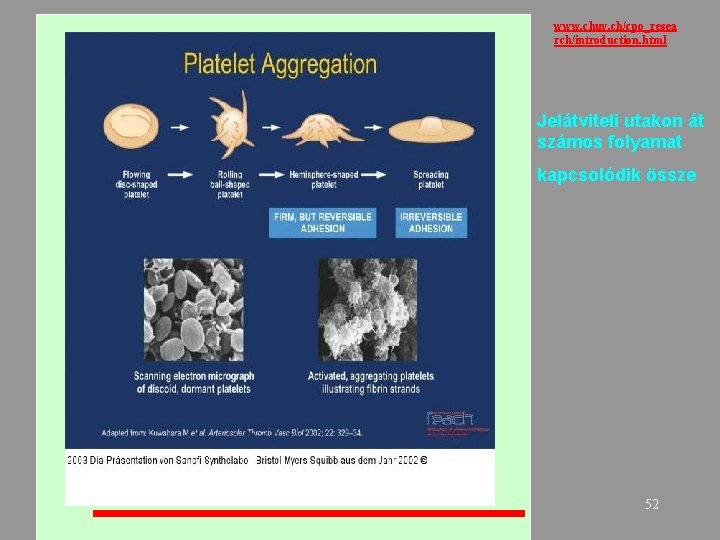
www. chuv. ch/cpo_resea rch/introduction. html Jelátviteli utakon át számos folyamat kapcsolódik össze 52

Dezmoszómális betegségek, kórképek 3 típusú betegség: 1. Autoimmun eredetű : pl. pemphigus vulgaris 2. öröklött ioncsatorna betegségek: Hailey-Hailey disease and Darier disease 3. Öröklött dezmoszóma fehérje mutációk okozta betegségek Speciális eset: baktérium toxin kiváltotta kórkép : Staphylococcus scalded-skin syndrome 53

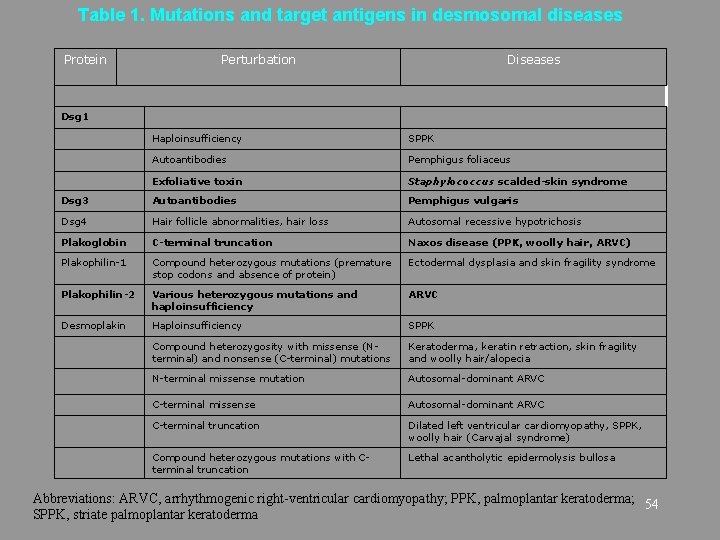
Table 1. Mutations and target antigens in desmosomal diseases Protein Perturbation Diseases Dsg 1 Haploinsufficiency SPPK Autoantibodies Pemphigus foliaceus Exfoliative toxin Staphylococcus scalded-skin syndrome Dsg 3 Autoantibodies Pemphigus vulgaris Dsg 4 Hair follicle abnormalities, hair loss Autosomal recessive hypotrichosis Plakoglobin C-terminal truncation Naxos disease (PPK, woolly hair, ARVC) Plakophilin-1 Compound heterozygous mutations (premature stop codons and absence of protein) Ectodermal dysplasia and skin fragility syndrome Plakophilin-2 Various heterozygous mutations and haploinsufficiency ARVC Desmoplakin Haploinsufficiency SPPK Compound heterozygosity with missense (Nterminal) and nonsense (C-terminal) mutations Keratoderma, keratin retraction, skin fragility and woolly hair/alopecia N-terminal missense mutation Autosomal-dominant ARVC C-terminal missense Autosomal-dominant ARVC C-terminal truncation Dilated left ventricular cardiomyopathy, SPPK, woolly hair (Carvajal syndrome) Compound heterozygous mutations with Cterminal truncation Lethal acantholytic epidermolysis bullosa Abbreviations: ARVC, arrhythmogenic right-ventricular cardiomyopathy; PPK, palmoplantar keratoderma; 54 SPPK, striate palmoplantar keratoderma

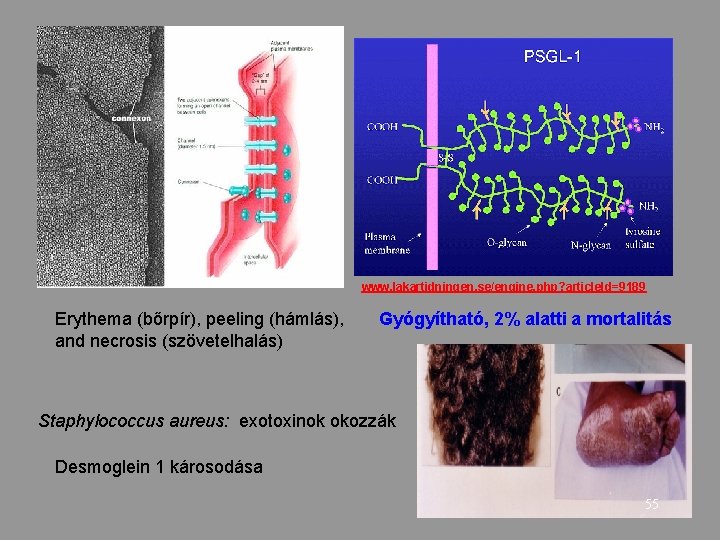
www. lakartidningen. se/engine. php? article. Id=9189 Erythema (bőrpír), peeling (hámlás), and necrosis (szövetelhalás) Gyógyítható, 2% alatti a mortalitás Staphylococcus aureus: exotoxinok okozzák Desmoglein 1 károsodása 55

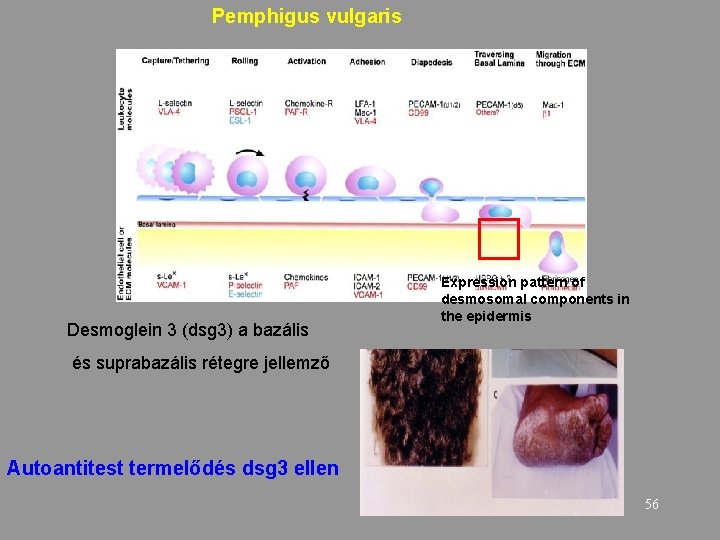
Pemphigus vulgaris Desmoglein 3 (dsg 3) a bazális Expression pattern of desmosomal components in the epidermis és suprabazális rétegre jellemző Autoantitest termelődés dsg 3 ellen 56

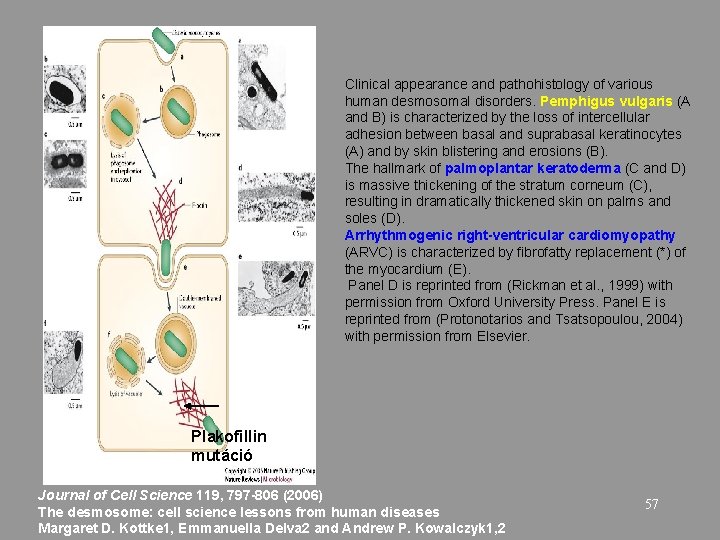
Clinical appearance and pathohistology of various human desmosomal disorders. Pemphigus vulgaris (A and B) is characterized by the loss of intercellular adhesion between basal and suprabasal keratinocytes (A) and by skin blistering and erosions (B). The hallmark of palmoplantar keratoderma (C and D) is massive thickening of the stratum corneum (C), resulting in dramatically thickened skin on palms and soles (D). Arrhythmogenic right-ventricular cardiomyopathy (ARVC) is characterized by fibrofatty replacement (*) of the myocardium (E). Panel D is reprinted from (Rickman et al. , 1999) with permission from Oxford University Press. Panel E is reprinted from (Protonotarios and Tsatsopoulou, 2004) with permission from Elsevier. Plakofillin mutáció Journal of Cell Science 119, 797 -806 (2006) The desmosome: cell science lessons from human diseases Margaret D. Kottke 1, Emmanuella Delva 2 and Andrew P. Kowalczyk 1, 2 57

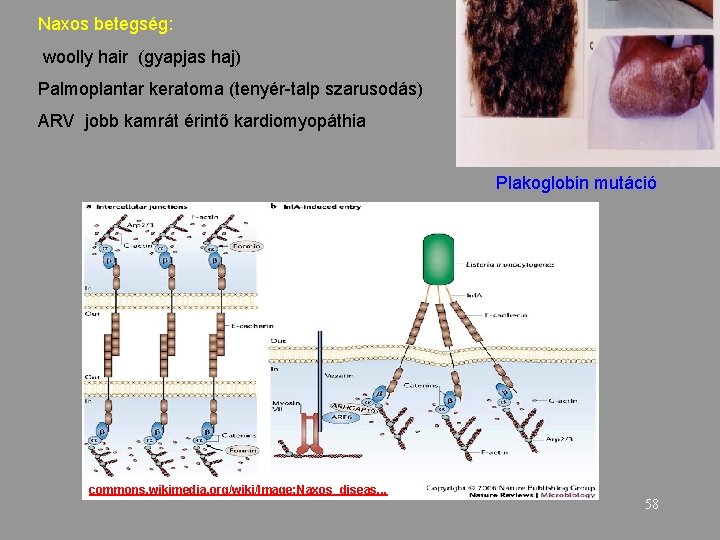
Naxos betegség: woolly hair (gyapjas haj) Palmoplantar keratoma (tenyér-talp szarusodás) ARV jobb kamrát érintő kardiomyopáthia Plakoglobin mutáció commons. wikimedia. org/wiki/Image: Naxos_diseas. . . 58

Colon tumor és katenin Gyomor tumor és E kadherin Ovárium tumor és E kadherin 59

vinkulin talin lpmt 090. biomed. uni-erlangen. de/~gdiez/index. html www. rothamsted. ac. uk/cpi/wdi/sk. html citokeratin E kadherin Ez is N CAM: North Cadbury Academy of Music www. ii. bham. ac. uk/. . . /Cytoplasmic%20 fibres. htm www. uib. no/. . . /gallery/pages/E-cadherin-2. html 60
 Transzlokon
Transzlokon L'adoration des mages bruegel
L'adoration des mages bruegel Varsányi egri csillagok
Varsányi egri csillagok Remeterák tengeri rózsa kapcsolata
Remeterák tengeri rózsa kapcsolata Plica vestibularis
Plica vestibularis Clara sejtek
Clara sejtek Retikulumsejt
Retikulumsejt Fragilis x szindróma
Fragilis x szindróma Bartalos zsuzsanna
Bartalos zsuzsanna Dombi zsuzsanna
Dombi zsuzsanna Replsi
Replsi Móric beňovský anna zsuzsanna hönsch
Móric beňovský anna zsuzsanna hönsch Farkasné egyed zsuzsanna
Farkasné egyed zsuzsanna Dr tóth zsuzsanna eszter
Dr tóth zsuzsanna eszter Tóth zsuzsanna eszter
Tóth zsuzsanna eszter Dusa zsuzsanna
Dusa zsuzsanna Zsuzsanna kocsis
Zsuzsanna kocsis Dr valkusz zsuzsanna
Dr valkusz zsuzsanna Petrovics zsuzsanna
Petrovics zsuzsanna Eseti gondnok
Eseti gondnok Bukta zsuzsanna
Bukta zsuzsanna Galambos zsuzsanna
Galambos zsuzsanna Dr. bácsi zsuzsanna ágnes közjegyző
Dr. bácsi zsuzsanna ágnes közjegyző Zsuzsanna gyenes
Zsuzsanna gyenes Pörczi zsuzsanna
Pörczi zsuzsanna Egészséghiedelem modell
Egészséghiedelem modell Endomitózis
Endomitózis Bolla zsuzsanna
Bolla zsuzsanna Makai zsuzsanna
Makai zsuzsanna Ipsilateralis
Ipsilateralis Dr. papp zsuzsanna
Dr. papp zsuzsanna Rátai attila
Rátai attila




















































