A pharmacovigilancia hatsgi oldalrl Plink Linda Orszgos Gygyszerszeti



















- Slides: 24

A pharmacovigilancia hatósági oldalról Pálinkó Linda Országos Gyógyszerészeti Intézet 2009. május 26.

Definíciók • Pharmacovigilancia mindazon tevékenységek összessége, amelyek a szer gyógyszerbiztonsági adatainak folyamatos gyűjtése és értékelése révén hozzájárulnak a készítmény mind részletesebb, pontosabb biztonságossági profiljának megismeréséhez, így biztosítva a betegek lehető leghatékonyabb és legbiztonságosabb kezelését.

Forgalomba hozatal előtt… Mivel… • Állatkísérletek humán toxicitási relevanciája nem mindig megítélhető • Klinikai vizsgálatban szelektált és viszonylag kis számú beteg vesz részt • Kezelési körülmények eltérőek a mindennapi gyakorlattól (pl. több gyógyszer egyidejű szedése nem megengedett, alkalmazás időtartama rövidebb),

Forgalomba hozatal előtt… Ezért kevés információ áll rendelkezésre… • ritkán előforduló mellékhatásokról, • a speciális betegcsoportokra (beszűkült vesefunkciójú betegek, idősek, gyermekek, terhes, illetve szoptató nők, stb. ) jellemző mellékhatásokról, • gyógyszerinterakciókról, • krónikus szedés során kialakuló mellékhatásokról, • hosszú látenciájú mellékhatásokról • a mellékhatások előfordulásának valós gyakoriságáról. Tehát… • a gyógyszer biztonságossági profilja csak részben térképezhető fel.

Forgalomba hozatalt követően… Spontán / piaci körülmények között: • Megnövekszik a gyógyszerexpozíció ritka mellékhatások felderítése, ill. az ismert mellékhatások valódi gyakoriságáról többet tudunk meg. • Mindennapi alkalmazás körülményei miatt a forg. ba hozatal előtti korlátozott ismeretek bővülnek. A szer biztonságossági profiljáról egyre több ismeretünk lesz („haszon-kockázat arány” / risk-benefit balance ).

Definíciók • Haszon-kockázat arány (risk-benefit balance): A gyógyszer alkalmazásából származó előnyök és alkalmazásából származó hátrányok, lehetséges kockázatok egymáshoz való viszonya.

Jelentési kötelezettség 52/2005. (XI. 18. ) EüM rendelet az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról 37. § (9) A gyógyszert alkalmazó orvos, illetve a kiszolgáltatást végző gyógyszerész az általa észlelt vagy tudomására jutott súlyos vagy váratlan mellékhatást, illetve annak gyanúját haladéktalanul, de legkésőbb a tudomására jutást követő 15 napon belül jelenti az OGYI-nak. (13) Az oltóanyagok alkalmazásával kapcsolatos fokozott oltási reakciók, szövődmények, balesetek bejelentéséről külön jogszabály rendelkezik.

Jelentési kötelezettség 18/1998. (VI. 3. ) NM rendelet a fertőző betegségek és járványok megelőzése érdekében szükséges járványügyi intézkedésekről 13. § (7) A védőoltásokkal kapcsolatban előforduló fokozott oltási reakciót, szövődményt, balesetet a) az oltó-, illetve észlelő orvos a kistérségi intézetnek, b) a kistérségi intézet a regionális intézetnek, c) a regionális intézet az OEK-nek haladéktalanul jelenti.

Súlyosság Súlyos: • halálos kimenetelű, • életveszélyes jellegű, • kórházi kezelést, ill. meghosszabbított kórházi kezelést igényel, • maradandó rokkantságot /fogyatékosságot vagy jelentős egészségkárosodást okoz • veleszületett rendellenességben, születési hibában nyilvánul meg, • orvosilag jelentős: azaz a fentebb felsorolt súlyossági ismérvek egyikének sem felel meg, de beavatkozás nélkül az ismérvek valamelyikének megjelenéséhez vezetne.

Vártság • Váratlan: Olyan nemkívánatos esemény/mellékhatás, amelynek jellege, intenzitása vagy kimenetele nem felel meg a megfelelő forrásdokumentációban leírtaknak. Forrásdokumentáció: Alkalmazási előírás.

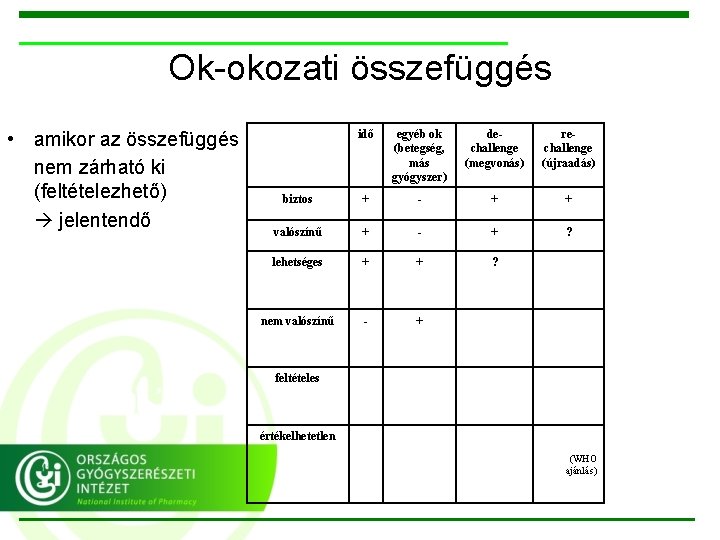
Ok-okozati összefüggés • amikor az összefüggés nem zárható ki (feltételezhető) jelentendő idő egyéb ok (betegség, más gyógyszer) dechallenge (megvonás) rechallenge (újraadás) biztos + - + + valószínű + - + ? lehetséges + + ? nem valószínű - + feltételes értékelhetetlen (WHO ajánlás)

Definíciók • Nemkívánatos esemény: a beteg vagy a vizsgálati alany szervezetében fellépő minden olyan kedvezőtlen (klinikai, laboratóriumi vagy egyéb) változás, mely az adott gyógyszer alkalmazása során jelentkezett, függetlenül attól, hogy volt-e összefüggés a gyógyszer alkalmazása és az esemény között. • Mellékhatás: az a nemkívánatos esemény, melynél a gyógyszer alkalmazása és az esemény fellépte között ok-okozati összefüggés van, vagy legalábbis ez nem zárható ki teljes bizonyossággal.

Érvényes bejelentés: • Minimum 4 adat megléte: 1. bejelentő (név / név kezdőbetűi / cím / végzettség) 2. beteg (pl. név / név kezdőbetűi / hivatkozási szám / kor / születési dátum / nem) 3. gyanúsított gyógyszer 4. feltételezett mellékhatás • Fenti adatok megléte esetén haladéktalan (ill. 15 napon belüli) továbbítás • Utánkövető jelentés

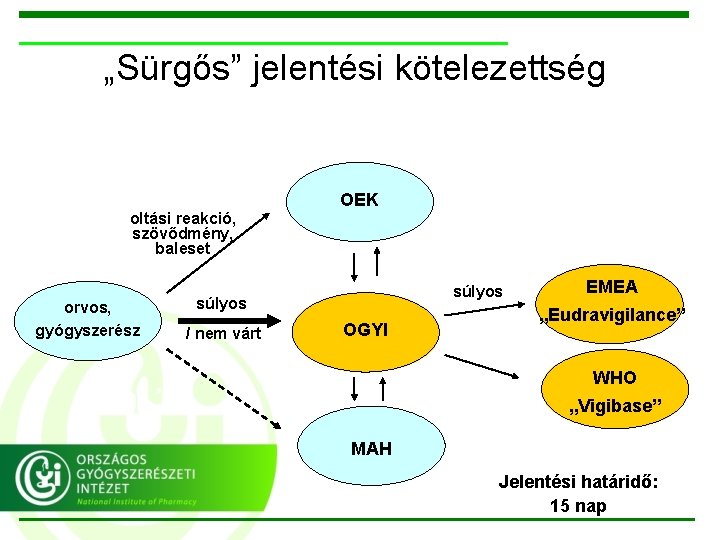
„Sürgős” jelentési kötelezettség oltási reakció, szövődmény, baleset orvos, gyógyszerész OEK súlyos / nem várt OGYI EMEA „Eudravigilance” WHO „Vigibase” MAH Jelentési határidő: 15 nap

Szignál • Egy új mellékhatás (vagy ismert mellékhatás gyakoriságbeli változásának) felfedezését „szignál detekció”-nak nevezzük. • Az egyedi bejelentések alapját képezik a szignál detekciónak. • Egyedi bejelentéseket gyűjtő nagyobb adatbázisa van pl. EMEA, WHO-nak. Ezek a nagy mennyiségű adatot tartalmazó adatbázisok igen alkalmasak szignál generálására.

Definíció - szignál • Szignál: „Egy nemkívánatos esemény és a gyógyszer közötti olyan okokozati összefüggésre utaló információ, amely korábban ismeretlen vagy nem megfelelően dokumentált volt. ” • Általában több egyedi bejelentés szükséges egy szignál generálásához. • Szignál detektálásához a spontán mellékhatás-bejelentési rendszerből származó adatokat használják fel elsősorban (pl. EMEA és WHO adatbázis).

Begyűjtött biztonságosságra vonatkozó információk feldolgozása után… szükségessé válhat… • Alkalmazási előírás / betegtájékoztató módosítása (új mellékhatás, interakció, vagy figyelmeztetés beiktatása; az indikáció, adagolás, vagy a speciális betegpopulációkra vonatkozó utasítások módosítása) • Felfüggesztés • Forgalomból történő kivonás (minőségi hiba esetén az érintett gyártási tételek kivonása) • DHPC (Dear Healthcare Professional Communication) szétküldése

Bejelentés módja • OGYI-hoz: bejelentőlap: www. ogyi. hu „Formanyomtatványok” „Mellékhatás-bejelentő sárgalap” • és / vagy a forg. eng. jog. képviseletére (pl. orvoslátogatón keresztül) • vakcinák esetén OEK-hez: bejelentőlap: www. oek. hu Módszertani levelek Szakmai irányelv az oltást követő nemkívánatos események felügyeletéről 2. melléklet



Bejelentőlap

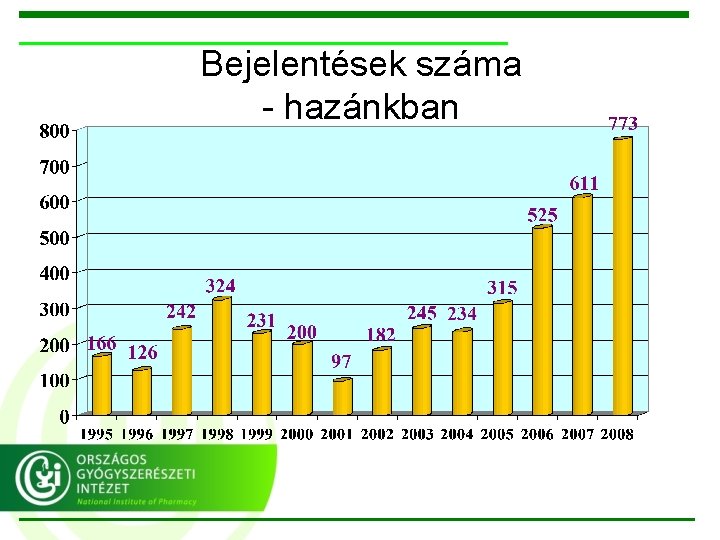
Bejelentések száma - hazánkban

Bejelentések száma… • Ideálisnak tartott bejelentési szám: 200 -500 / 1 millió lakos / év • Magyarország: 70 -80

Összefoglalva… Jelenteni kell… • orvos, gyógyszerész • minden súlyos / nem várt feltételezett mellékhatást • haladéktalanul / 15 napon belül • OGYI-nak / OEK-nek • az OGYI / OEK honlapján megtalálható bejelentőlapon • emailben / faxon / postai úton
 Pharmacovigilancia
Pharmacovigilancia Plink exercise
Plink exercise Linda grahn
Linda grahn Para celebrar tu dia se abrieron todas las flores
Para celebrar tu dia se abrieron todas las flores Grant writers in oklahoma
Grant writers in oklahoma Linda is than helen
Linda is than helen Rqms score
Rqms score Linda coney
Linda coney Hans christian andersen bibliografia
Hans christian andersen bibliografia Moroz jakub
Moroz jakub List of leavening agents
List of leavening agents Linda barraza
Linda barraza Linda tisdale
Linda tisdale Lennart nooij
Lennart nooij Linda cornwall
Linda cornwall Linda parsley
Linda parsley Linda li intervention
Linda li intervention Fantzia
Fantzia Linda lapiņa
Linda lapiņa Y1st youtube downloader
Y1st youtube downloader Linda eling lee
Linda eling lee Linda hillen
Linda hillen Linda magno
Linda magno Linda cornwall
Linda cornwall Duwbak linda
Duwbak linda