1 Definizione di ARRHENIUS 1887 Un acido in

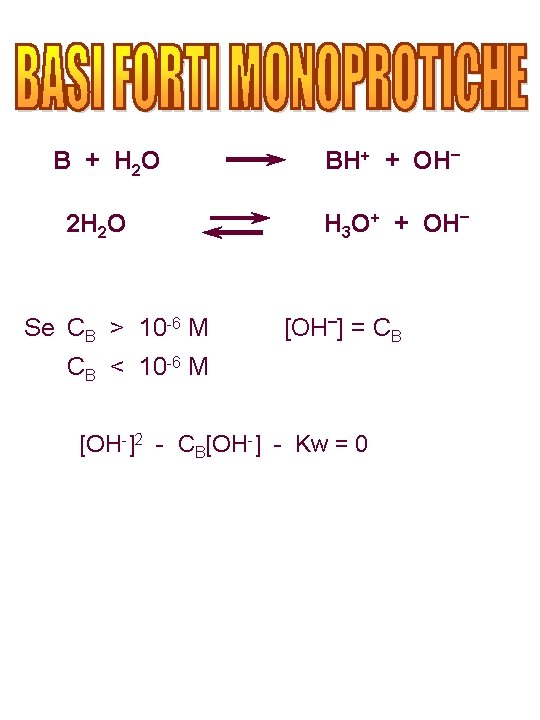

![segue CASO IV Poiché: [H 3 O+] << [NH 4+] e [OH– ] << segue CASO IV Poiché: [H 3 O+] << [NH 4+] e [OH– ] <<](https://slidetodoc.com/presentation_image_h2/82aff8807829a215f7350ba370c8367d/image-17.jpg)
![p. H C 1 Rapporto [A–]/[HA] ~ 1 C 2 Zona di p. H p. H C 1 Rapporto [A–]/[HA] ~ 1 C 2 Zona di p. H](https://slidetodoc.com/presentation_image_h2/82aff8807829a215f7350ba370c8367d/image-22.jpg)
![– HIn + H 2 O [H 3 O+] = KHIn H 3 O+ – HIn + H 2 O [H 3 O+] = KHIn H 3 O+](https://slidetodoc.com/presentation_image_h2/82aff8807829a215f7350ba370c8367d/image-24.jpg)

![Zona I : Eccesso di Acido Forte [H 3 O+] = V 1 N Zona I : Eccesso di Acido Forte [H 3 O+] = V 1 N](https://slidetodoc.com/presentation_image_h2/82aff8807829a215f7350ba370c8367d/image-29.jpg)

- Slides: 32

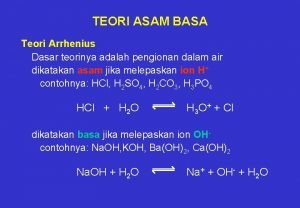
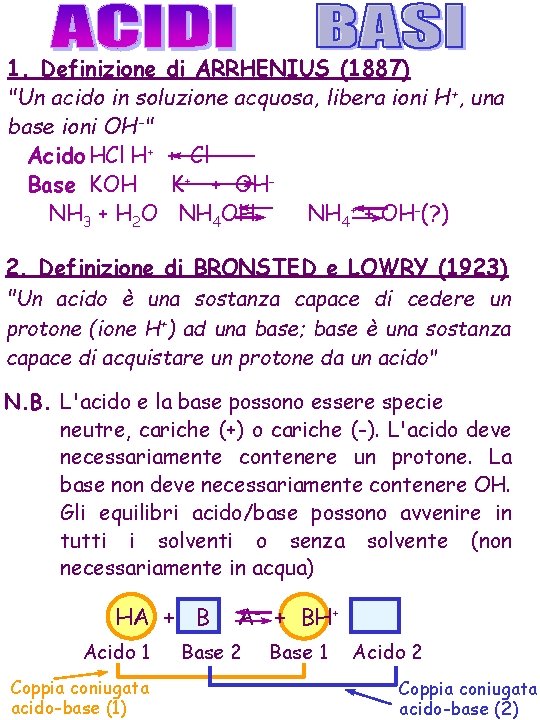
1. Definizione di ARRHENIUS (1887) "Un acido in soluzione acquosa, libera ioni H+, una base ioni OH-" Acido HCl H+ + Cl Base KOH K+ + OHNH 3 + H 2 O NH 4 OH NH 4+ + OH-(? ) 2. Definizione di BRONSTED e LOWRY (1923) "Un acido è una sostanza capace di cedere un protone (ione H+) ad una base; base è una sostanza capace di acquistare un protone da un acido" N. B. L'acido e la base possono essere specie neutre, cariche (+) o cariche (-). L'acido deve necessariamente contenere un protone. La base non deve necessariamente contenere OH. Gli equilibri acido/base possono avvenire in tutti i solventi o senza solvente (non necessariamente in acqua) HA + B Acido 1 Coppia coniugata acido-base (1) A- + BH+ Base 2 Base 1 Acido 2 Coppia coniugata acido-base (2)

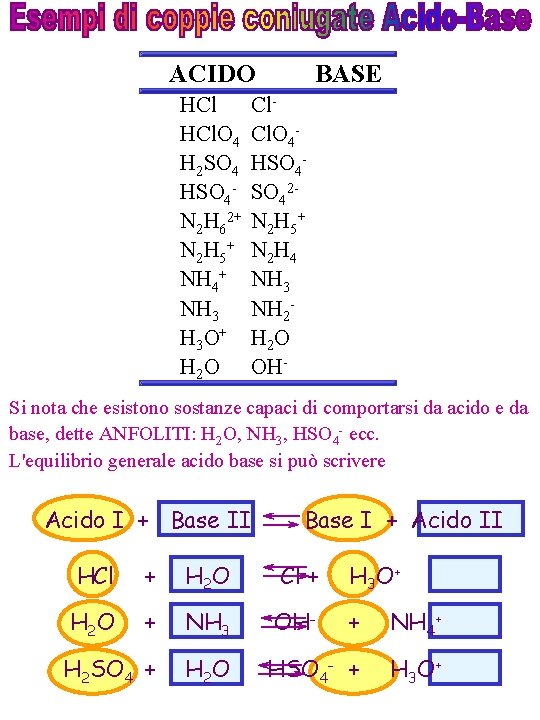
ACIDO HCl. O 4 H 2 SO 4 HSO 4 N 2 H 62+ N 2 H 5+ NH 4+ NH 3 H 3 O+ H 2 O BASE Cl. O 4 HSO 42 N 2 H 5+ N 2 H 4 NH 3 NH 2 H 2 O OH- Si nota che esistono sostanze capaci di comportarsi da acido e da base, dette ANFOLITI: H 2 O, NH 3, HSO 4 - ecc. L'equilibrio generale acido base si può scrivere Acido I + Base II Base I + Acido II HCl + H 2 O Cl-+ H 3 O + H 2 O + NH 3 OH- + NH 4+ H 2 SO 4 + H 2 O HSO 4 - + H 3 O +

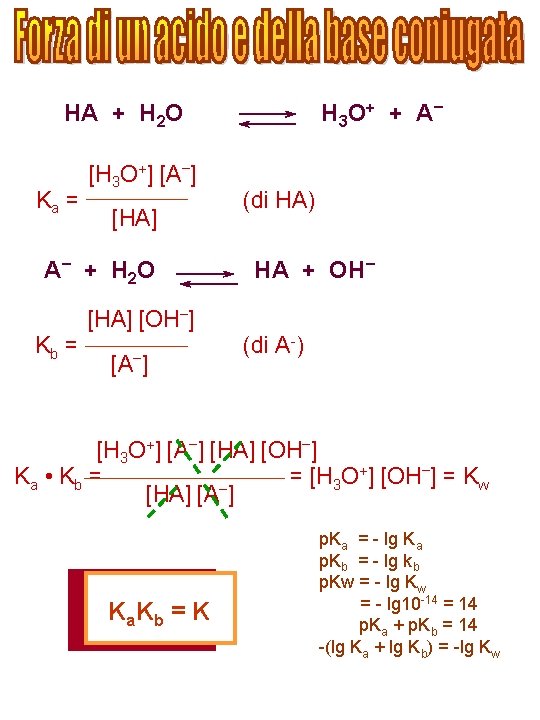
Si prende in generale come coppia di riferimento la coppia coniugata acido/base H 3 O+/H 2 O. La forza di un acido è allora misurata dalla costante di equilibrio della reazione: HA + H 2 O A - + H 3 O + Acido 1 + Base campione = Base 1 Acido campione [H 3 O+] [A-] K= [HA] [H 2 O] Ka = K [H 2 O] = 55, 5 moli/l [H 3 O+] [A-] [HA] Se l'acido è molto forte, l'equilibrio HA + H 2 O A - + H 3 O + È tutto spostato a destra, per cui da una mole di acido si ottiene una mole di H 3 O+. Quindi tutte le soluzioni di acidi avente forza maggiore dell'acido H 3 O+ si comportano nello stesso modo (Effetto Livellante dell'Acqua). dell'Acqua Quindi per misurare la forza di acidi molto forti occorre un'altra base campione meno forte dell'acqua, per esempio l'acido acetico: HA + CH 3 COOH Acido 1 + Base campione A- + CH 3 COOH 2+ = Base 1 Acido campione

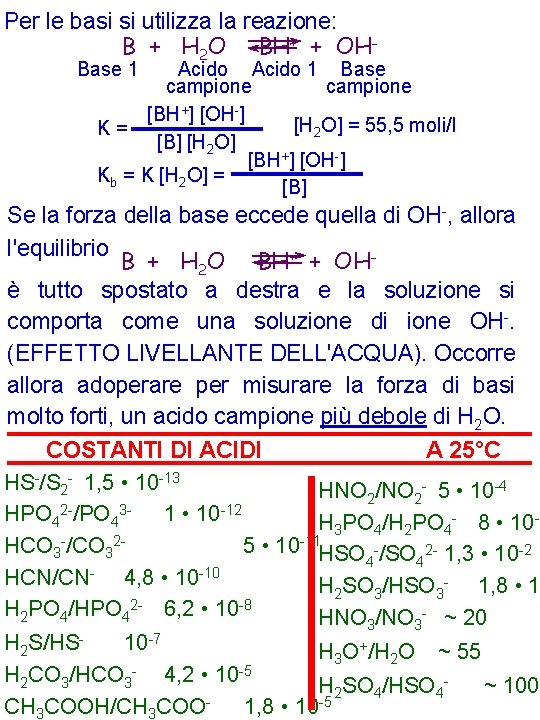
Per le basi si utilizza la reazione: B + H 2 O BH+ + OHBase 1 Acido 1 Base campione [BH+] [OH-] [H 2 O] = 55, 5 moli/l K= [B] [H 2 O] [BH+] [OH-] Kb = K [H 2 O] = [B] Se la forza della base eccede quella di OH-, allora l'equilibrio B + H 2 O BH+ + OHè tutto spostato a destra e la soluzione si comporta come una soluzione di ione OH-. (EFFETTO LIVELLANTE DELL'ACQUA). Occorre allora adoperare per misurare la forza di basi molto forti, un acido campione più debole di H 2 O. COSTANTI DI ACIDI A 25°C HS-/S 2 - 1, 5 • 10 -13 HNO 2/NO 2 - 5 • 10 -4 HPO 42 -/PO 43 - 1 • 10 -12 H 3 PO 4/H 2 PO 4 - 8 • 10 -3 HCO 3 -/CO 325 • 10 -11 HSO -/SO 2 - 1, 3 • 10 -2 4 4 -10 HCN/CN 4, 8 • 10 H 2 SO 3/HSO 3 - 1, 8 • 1 H 2 PO 4/HPO 42 - 6, 2 • 10 -8 HNO 3/NO 3 - ~ 20 H 2 S/HS 10 -7 H 3 O+/H 2 O ~ 55 H 2 CO 3/HCO 3 - 4, 2 • 10 -5 H 2 SO 4/HSO 4~ 100 -5 CH 3 COOH/CH 3 COO 1, 8 • 10

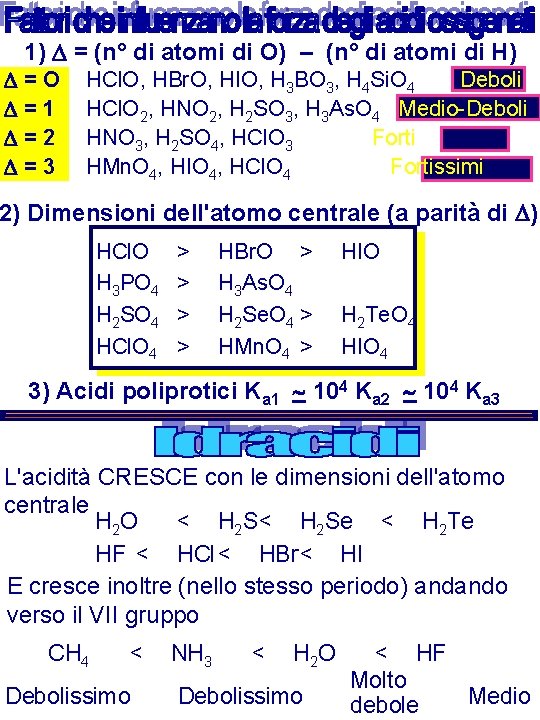
1) D = (n° di atomi di O) – (n° di atomi di H) D=O D=1 D=2 D=3 HCl. O, HBr. O, HIO, H 3 BO 3, H 4 Si. O 4 Deboli HCl. O 2, HNO 2, H 2 SO 3, H 3 As. O 4 Medio-Deboli HNO 3, H 2 SO 4, HCl. O 3 Forti HMn. O 4, HIO 4, HCl. O 4 Fortissimi 2) Dimensioni dell'atomo centrale (a parità di D) HCl. O H 3 PO 4 H 2 SO 4 HCl. O 4 > > HBr. O > H 3 As. O 4 H 2 Se. O 4 > HMn. O 4 > HIO H 2 Te. O 4 HIO 4 3) Acidi poliprotici Ka 1 104 Ka 2 104 Ka 3 L'acidità CRESCE con le dimensioni dell'atomo centrale H 2 O < H 2 Se < H 2 Te HF < HCl < HBr< HI E cresce inoltre (nello stesso periodo) andando verso il VII gruppo CH 4 < Debolissimo NH 3 < H 2 O Debolissimo < HF Molto Medio debole

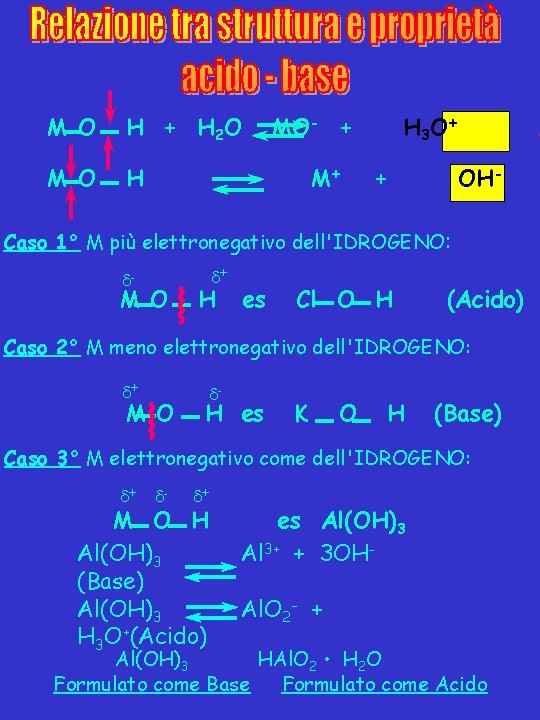
M O H + H 2 O M O H MO- + M+ H 3 O + + A OH- Caso 1° M più elettronegativo dell'IDROGENO: - M O + H es Cl O H (Acido) Caso 2° M meno elettronegativo dell'IDROGENO: + M O - H es K O H (Base) Caso 3° M elettronegativo come dell'IDROGENO: + - + M O H Al(OH)3 (Base) Al(OH)3 H 3 O+(Acido) es Al(OH)3 Al 3+ + 3 OHAl. O 2 - + Al(OH)3 HAl. O 2 • H 2 O Formulato come Base Formulato come Acido

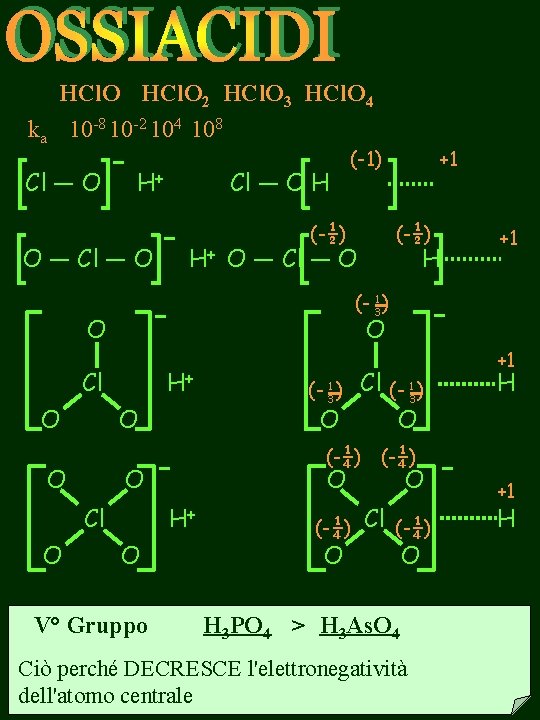
HCl. O 2 HCl. O 3 HCl. O 4 ka 10 -8 10 -2 104 108 Cl — O H+ O — Cl — O H H+ (-1) (-½) O H+ O V° Gruppo Cl (- 1 ) 3 O O (- 31 ) +1 H (-¼) O Cl O H +1 (- 31 ) Cl O (-½) O — Cl — O O O +1 O Cl (-¼) O O (-¼) H 3 PO 4 > H 3 As. O 4 Ciò perché DECRESCE l'elettronegatività dell'atomo centrale +1 H

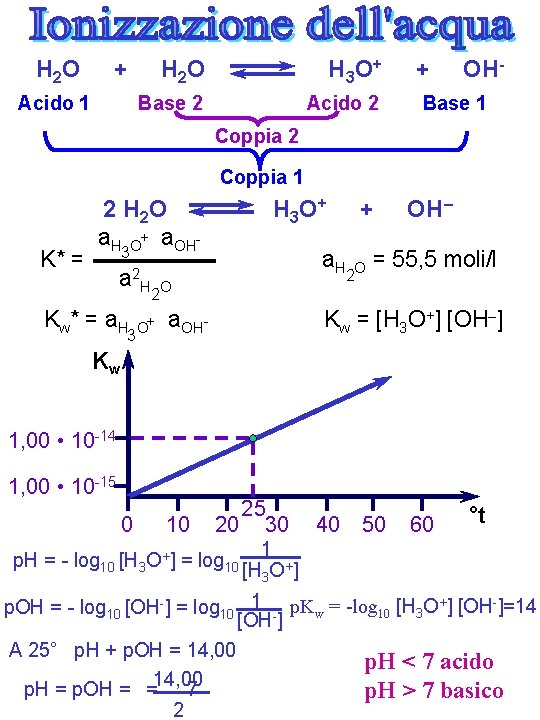
H 2 O + Acido 1 H 2 O H 3 O + Base 2 Acido 2 + OH- Base 1 Coppia 2 Coppia 1 K* = 2 H 2 O a. H O+ a. OH- H 3 O + 3 a 2 K w* = a H 3 + a. H O 2 H O OH– = 55, 5 moli/l 2 O+ a. OH- Kw = [H 3 O+] [OH–] Kw 1, 00 • 10 -14 1, 00 • 10 -15 0 10 25 20 30 p. H = - log 10 [H 3 O+] = log 10 40 50 60 °t 1 [H 3 O+] p. OH = - log 10 [OH-] = log 10 1 - p. Kw = -log 10 [H 3 O+] [OH-]=14 [OH ] A 25° p. H + p. OH = 14, 00 p. H = p. OH = =14, 00 7 2 p. H < 7 acido p. H > 7 basico

H 3 O + + A – HA + H 2 O Ka = [H 3 O+] [A–] [HA] A – + H 2 O (di HA) HA + OH– [HA] [OH–] Kb = [A–] (di A-) [H 3 O+] [A–] [HA] [OH–] +] [OH–] = K Ka • K b = = [H O 3 w [HA] [A–] K a. K b = K p. Ka = - lg Ka p. Kb = - lg kb p. Kw = - lg 10 -14 = 14 p. Ka + p. Kb = 14 -(lg Ka + lg Kb) = -lg Kw

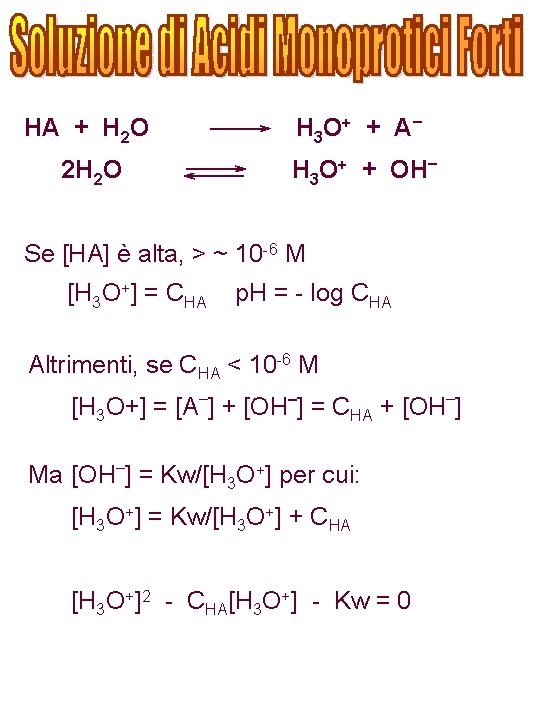
HA + H 2 O H 3 O + + A – 2 H 2 O H 3 O+ + OH– Se [HA] è alta, > ~ 10 -6 M [H 3 O+] = CHA p. H = - log CHA Altrimenti, se CHA < 10 -6 M [H 3 O+] = [A–] + [OH–] = CHA + [OH–] Ma [OH–] = Kw/[H 3 O+] per cui: [H 3 O+] = Kw/[H 3 O+] + CHA [H 3 O+]2 - CHA[H 3 O+] - Kw = 0
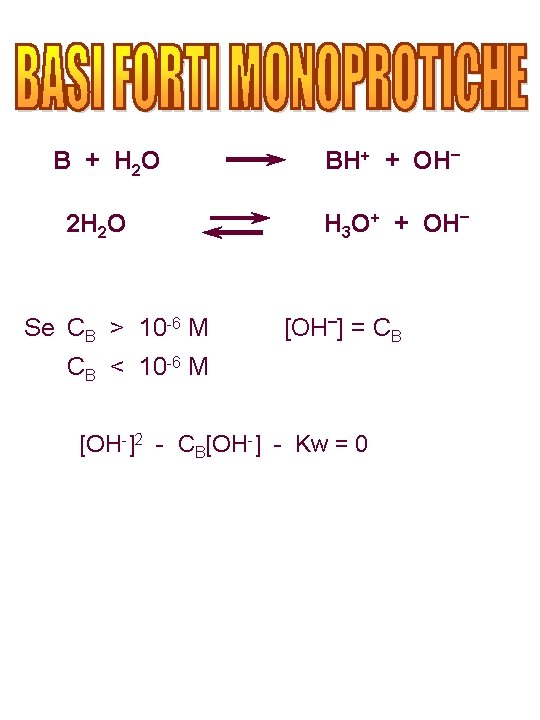
B + H 2 O 2 H 2 O Se CB > 10 -6 M BH+ + OH– H 3 O+ + OH– [OH–] = CB CB < 10 -6 M [OH-]2 - CB[OH-] - Kw = 0

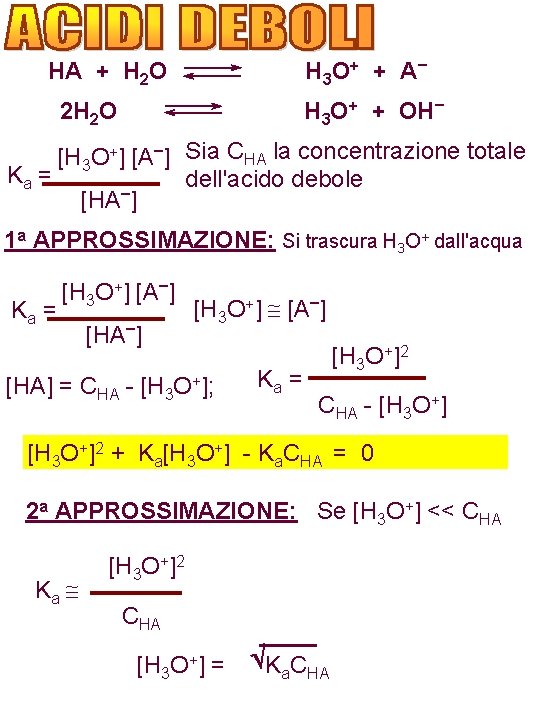
H 3 O + + A – HA + H 2 O H 3 O+ + OH– 2 H 2 O [H 3 O+] [A–] Sia CHA la concentrazione totale Ka = dell'acido debole – [HA ] 1 a APPROSSIMAZIONE: Si trascura H 3 O+ dall'acqua Ka = [H 3 O+] [A–] [H 3 O+] [A–] [HA] = CHA - [H 3 O+]; Ka = [H 3 O+]2 CHA - [H 3 O+]2 + Ka[H 3 O+] - Ka. CHA = 0 2 a APPROSSIMAZIONE: Se [H 3 O+] << CHA Ka [H 3 O+]2 CHA [H 3 O+] = Ka. CHA

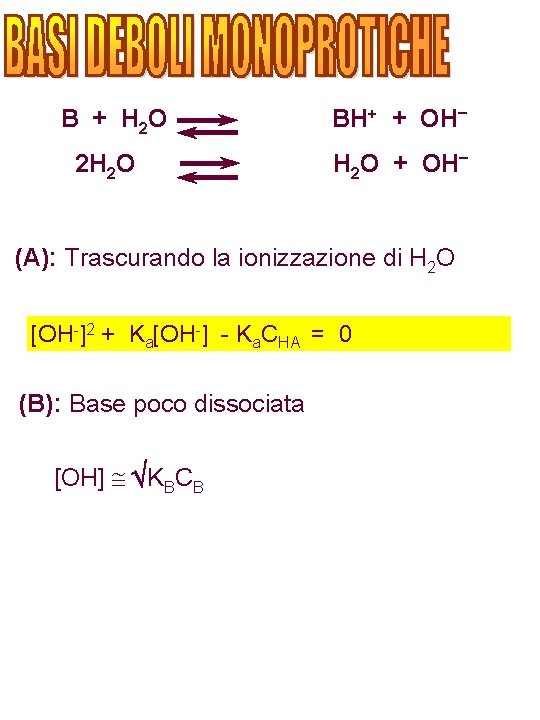
B + H 2 O 2 H 2 O BH+ + OH– H 2 O + OH– (A): Trascurando la ionizzazione di H 2 O [OH-]2 + Ka[OH-] - Ka. CHA = 0 (B): Base poco dissociata [OH] KBCB

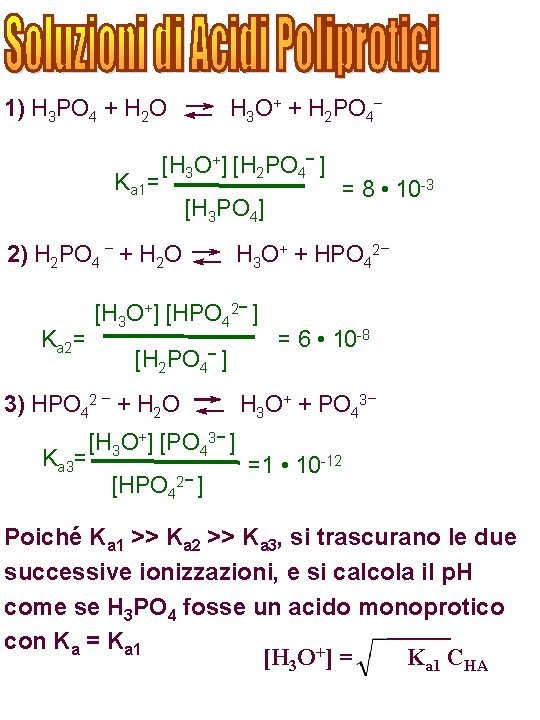
H 3 O+ + H 2 PO 4– 1) H 3 PO 4 + H 2 O Ka 1= [H 3 O+] [H 2 PO 4– ] [H 3 PO 4] 2) H 2 PO 4 – + H 2 O Ka 2= 3) HPO 42 – + H 2 O Ka 3= H 3 O+ + HPO 42– [H 3 O+] [HPO 42– ] [H 2 PO 4– ] [H 3 O+] [PO 43– ] [HPO 42– ] = 8 • 10 -3 = 6 • 10 -8 H 3 O+ + PO 43– =1 • 10 -12 Poiché Ka 1 >> Ka 2 >> Ka 3, si trascurano le due successive ionizzazioni, e si calcola il p. H come se H 3 PO 4 fosse un acido monoprotico con Ka = Ka 1 [H 3 O+] = Ka 1 CHA

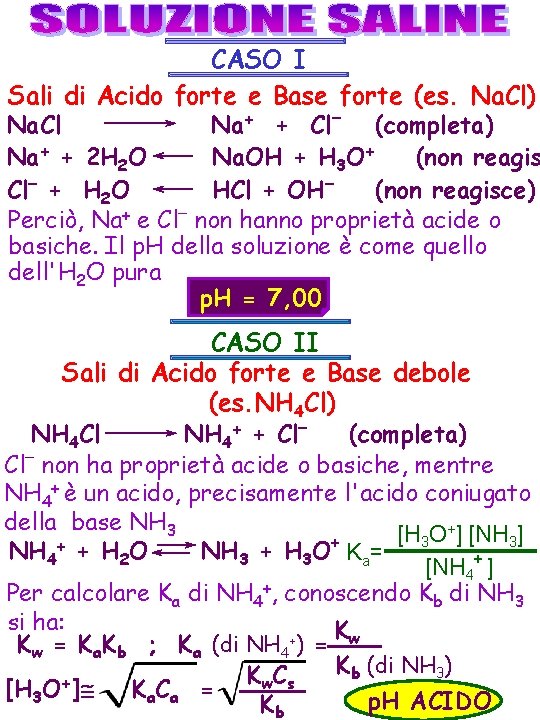
CASO I Sali di Acido forte e Base forte (es. Na. Cl) Na. Cl Na+ + Cl– (completa) Na+ + 2 H 2 O Na. OH + H 3 O+ (non reagis Cl– + H 2 O HCl + OH– (non reagisce) Perciò, Na+ e Cl– non hanno proprietà acide o basiche. Il p. H della soluzione è come quello dell'H 2 O pura p. H = 7, 00 CASO II Sali di Acido forte e Base debole (es. NH 4 Cl) NH 4 Cl NH 4+ + Cl– (completa) Cl– non ha proprietà acide o basiche, mentre NH 4+ è un acido, precisamente l'acido coniugato della base NH 3 +] [NH ] [H O 3 3 NH 4+ + H 2 O NH 3 + H 3 O+ Ka= + [NH 4 ] Per calcolare Ka di NH 4+, conoscendo Kb di NH 3 si ha: Kw + Kw = Ka. Kb ; Ka (di NH 4 ) = Kb (di NH 3) K C w s [H 3 O+] K a. C a = p. H ACIDO Kb

CASO III Sali di Acido debole e Base forte (es. Na. Ac) Na. Ac Na+ + Ac– (totale) Na+ non è acido né basico, ma Ac– è la base – coniugata di HAc, acido debole [HAc] [OH ] – – Ac + H 2 O HAc + OH K b= [Ac– ] Per calcolare Kb di Ac, conoscendo Ka di HA–, si ha: Kw – Kw = Ka. Kb ; Kb (di Ac )= ; [OH– ] Kb. CB Ka (di HAc) K w [OH– ] Ka Cs (il p. H è BASICO) CASO IV Sali di Acido debole e Base debole (es. NH 4 Ac) NH 4 Ac NH 4+ + Ac– NH 4+ si comporta da acido (acido coniugato di NH 3) e Ac– da base (base coniugata di HAc). Deve essere: NH 4+ + H 2 O NH 3 + H 3 O+; Ac– + H 2 O HAc + OH– [NH 4+] + [H 3 O+] = [OH – ] + [Ac – ] (neutralità elettrica)
![segue CASO IV Poiché H 3 O NH 4 e OH segue CASO IV Poiché: [H 3 O+] << [NH 4+] e [OH– ] <<](https://slidetodoc.com/presentation_image_h2/82aff8807829a215f7350ba370c8367d/image-17.jpg)
segue CASO IV Poiché: [H 3 O+] << [NH 4+] e [OH– ] << [Ac– ], si ha: [NH 4+] [Ac– ] (I) Si ha inoltre, detta Cs la concentrazione del sale [NH 4+] + [NH 3] = Cs = [HAc ] + [Ac– ], segue da (I) [NH 3] [Ac. H ] (II) [H 3 O+] [Ac– ] [NH 4+] [OH– ] Ka = Kb = [NH 3] (di HAc) [HAc] (di NH 3) Si moltiplica Ka per Kw e si divida per Kb – Ka [H 3 O+] [Ac ] [NH 3] +][OH– ] x [H O Kw x = 3 – + Kb [HAc][NH 4 ] [OH ] Poiché : [NH 4+ ] [Ac– ], [NH 3] [HAc] (da (I) e (II)) Si ha: Ka Kw = [H 3 O+]2 ; [H 3 O+] Kb Kw Ka Kb

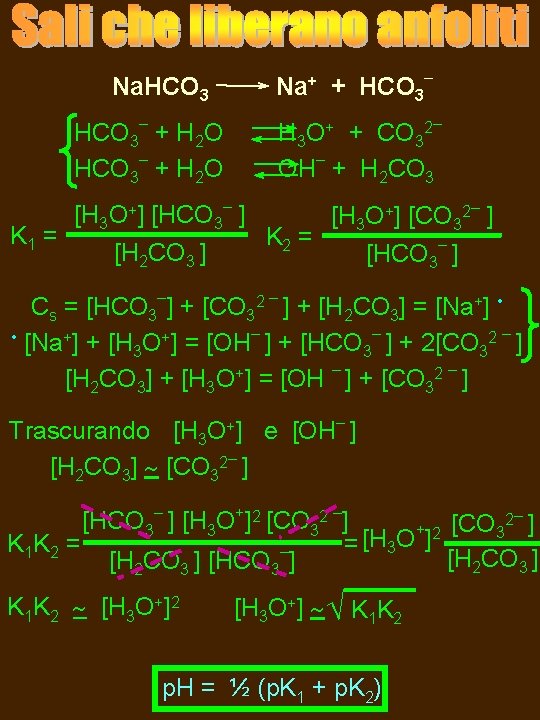
Na+ + HCO 3– Na. HCO 3– + H 2 O K 1 = H 3 O+ + CO 32– OH– + H 2 CO 3 [H 3 O+] [HCO 3– ] [H 2 CO 3 ] K 2 = [H 3 O+] [CO 32– ] [HCO 3– ] Cs = [HCO 3–] + [CO 32 – ] + [H 2 CO 3] = [Na+] • • [Na+] + [H O+] = [OH– ] + [HCO – ] + 2[CO 2 – ] 3 3 3 [H 2 CO 3] + [H 3 O+] = [OH – ] + [CO 32 – ] Trascurando [H 3 O+] e [OH– ] [H 2 CO 3] [CO 32– ] 2– [HCO 3– ] [H 3 O+]2 [CO 32 –] + 2 [CO 3 ] K 1 K 2 = = [H 3 O ] – [H 2 CO 3 ] [HCO 3 ] K 1 K 2 [H 3 O+]2 [H 3 O+] K 1 K 2 p. H = ½ (p. K 1 + p. K 2)

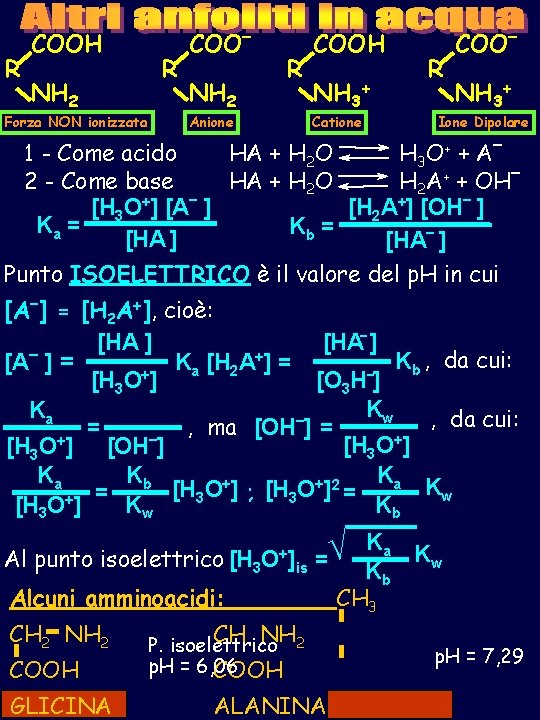
R COOH NH 2 Forza NON ionizzata R COO– NH 2 R Anione COOH NH 3+ Catione R COO– NH 3+ Ione Dipolare 1 - Come acido HA + H 2 O H 3 O + + A – 2 - Come base HA + H 2 O H 2 A+ + OH– [H 3 O+] [A– ] [H 2 A+] [OH– ] Ka = Kb = [HA ] [HA– ] Punto ISOELETTRICO è il valore del p. H in cui [A–] = [H 2 A+], cioè: -] [HA +] = Kb , da cui: [A– ] = K [H A a 2 + [H 3 O ] [O 3 H ] Kw Ka – , da cui: , ma [OH ] = = [H 3 O+] [OH–] Ka Kb Ka + + 2 Kw [H 3 O ] ; [H 3 O ] = = + [H 3 O ] Kw Kb Al punto isoelettrico [H 3 O+] = is Alcuni amminoacidi: CH 2 NH 2 COOH GLICINA CH NH 2 P. isoelettrico p. H = 6, 06 COOH ALANINA Ka Kw Kb CH 3 p. H = 7, 29

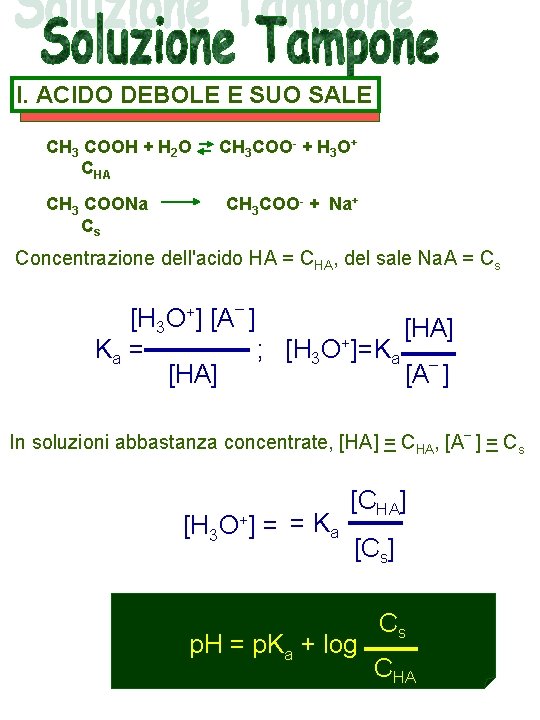
I. ACIDO DEBOLE E SUO SALE CH 3 COOH + H 2 O CHA CH 3 COONa Cs CH 3 COO- + H 3 O+ CH 3 COO- + Na+ Concentrazione dell'acido HA = CHA, del sale Na. A = Cs [H 3 O+] [A– ] [HA] + Ka = ; [H 3 O ]=Ka – [HA] [A ] In soluzioni abbastanza concentrate, [HA] = CHA, [A– ] = Cs [H 3 O+] = = Ka [CHA] [Cs] p. H = p. Ka + log Cs CHA

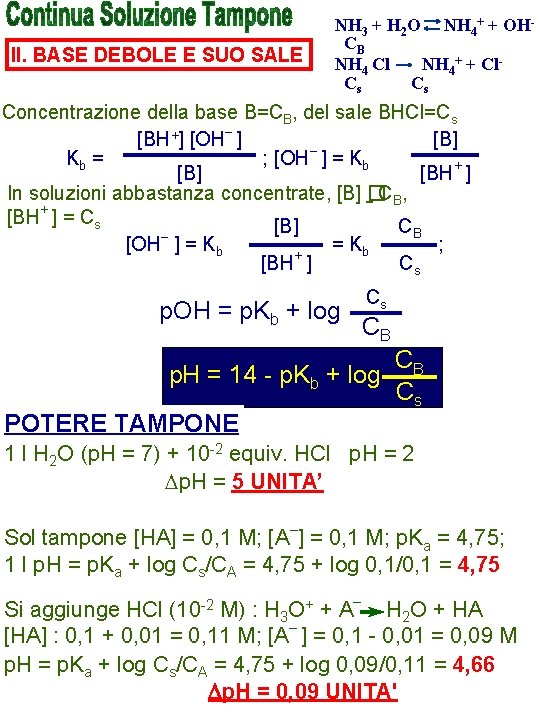
II. BASE DEBOLE E SUO SALE NH 3 + H 2 O NH 4+ + OHCB NH 4 Cl NH 4+ + Cl. Cs Cs Concentrazione della base B=CB, del sale BHCl=Cs [BH+] [OH– ] [B] – Kb = ; [OH ] = Kb [B] [BH+ ] In soluzioni abbastanza concentrate, [B] �CB, [BH+ ] = Cs [B] CB – [OH ] = Kb ; + [BH ] Cs p. OH = p. Kb + log Cs CB p. H = 14 - p. Kb + log POTERE TAMPONE CB Cs 1 l H 2 O (p. H = 7) + 10 -2 equiv. HCl p. H = 2 Dp. H = 5 UNITA’ Sol tampone [HA] = 0, 1 M; [A–] = 0, 1 M; p. Ka = 4, 75; 1 l p. H = p. Ka + log Cs/CA = 4, 75 + log 0, 1/0, 1 = 4, 75 Si aggiunge HCl (10 -2 M) : H 3 O+ + A– H 2 O + HA [HA] : 0, 1 + 0, 01 = 0, 11 M; [A– ] = 0, 1 - 0, 01 = 0, 09 M p. H = p. Ka + log Cs/CA = 4, 75 + log 0, 09/0, 11 = 4, 66 Dp. H = 0, 09 UNITA'
![p H C 1 Rapporto AHA 1 C 2 Zona di p H p. H C 1 Rapporto [A–]/[HA] ~ 1 C 2 Zona di p. H](https://slidetodoc.com/presentation_image_h2/82aff8807829a215f7350ba370c8367d/image-22.jpg)
p. H C 1 Rapporto [A–]/[HA] ~ 1 C 2 Zona di p. H = p. Ka massimo potere tampone Eccesso [A–] Aggiunta Basi [A–] = [HA] Eccesso [A–] Aggiunta Acidi

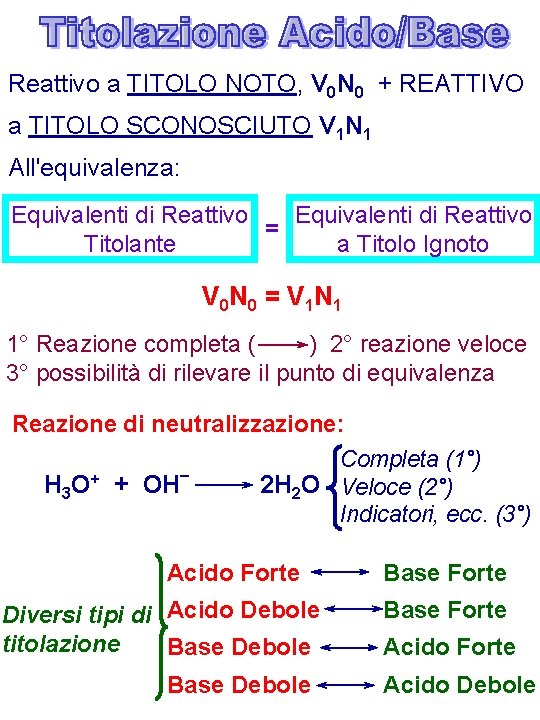
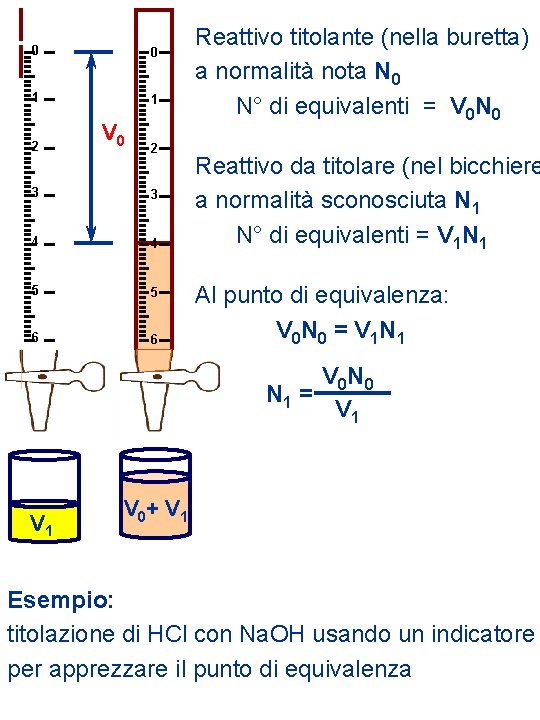
Reattivo a TITOLO NOTO, V 0 N 0 + REATTIVO a TITOLO SCONOSCIUTO V 1 N 1 All'equivalenza: Equivalenti di Reattivo = Titolante a Titolo Ignoto V 0 N 0 = V 1 N 1 1° Reazione completa ( ) 2° reazione veloce 3° possibilità di rilevare il punto di equivalenza Reazione di neutralizzazione: Completa (1°) H 3 O+ + OH– 2 H 2 O Veloce (2°) Indicatori, ecc. (3°) Acido Forte Diversi tipi di Acido Debole titolazione Base Debole Base Forte Acido Debole
![HIn H 2 O H 3 O KHIn H 3 O – HIn + H 2 O [H 3 O+] = KHIn H 3 O+](https://slidetodoc.com/presentation_image_h2/82aff8807829a215f7350ba370c8367d/image-24.jpg)
– HIn + H 2 O [H 3 O+] = KHIn H 3 O+ + In KHIn= – [H 3 O+] [In ] [HIn] – [In ] – Se [H 3 O+] = KHIn, cioè p. H = p. KHIn, [HIn] = [In ] (PUNTO di viraggio) Preso KHIn = 10 -6 (p. KHIn = 6), si ha: p. H = 2 3 4 5 6 10 -4 10 -3 10 -2 0, 1 7 8 9 10 – [In ] [HIn] Prevale [HIn] 1, 0 10 Punto di viraggio 102 103 1 – Prevale [In ] (colore azzurro) Campo di viraggio (colore rosso)

Violetto di Metile 0 1, 6 Blu di Timolo 1, 2 2, 8 Metilarancio 3, 2 4, 4 Blu di Bromotimolo 6, 0 Fenolftaleina 8, 2 10, 2 7, 6

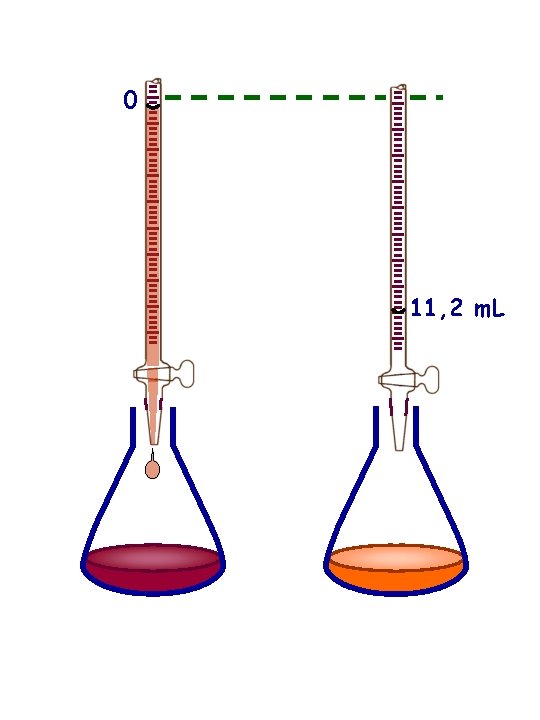
0 11, 2 m. L

0 0 1 1 2 V 0 2 3 3 4 4 5 5 6 6 Reattivo titolante (nella buretta) a normalità nota N 0 N° di equivalenti = V 0 N 0 Reattivo da titolare (nel bicchiere a normalità sconosciuta N 1 N° di equivalenti = V 1 N 1 Al punto di equivalenza: V 0 N 0 = V 1 N 1 V 0 N 0 N 1 = V 1 V 0+ V 1 Esempio: titolazione di HCl con Na. OH usando un indicatore per apprezzare il punto di equivalenza

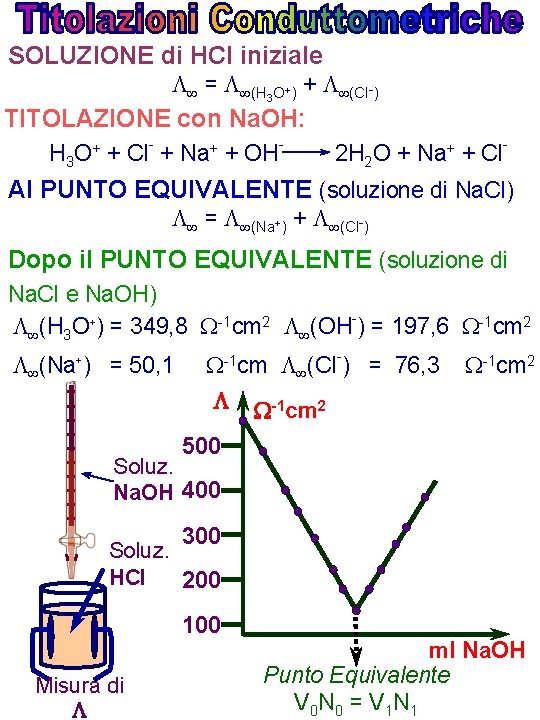
SOLUZIONE di HCl iniziale = (H 3 O+) + (Cl-) TITOLAZIONE con Na. OH: H 3 O+ + Cl- + Na+ + OH- 2 H 2 O + Na+ + Cl- Al PUNTO EQUIVALENTE (soluzione di Na. Cl) = (Na+) + (Cl-) Dopo il PUNTO EQUIVALENTE (soluzione di Na. Cl e Na. OH) (H 3 O+) = 349, 8 -1 cm 2 (OH ) = 197, 6 -1 cm 2 (Na+) = 50, 1 -1 cm (Cl-) = 76, 3 -1 cm 2 500 Soluz. Na. OH 400 300 Soluz. HCl 200 100 Misura di ml Na. OH Punto Equivalente V 0 N 0 = V 1 N 1
![Zona I Eccesso di Acido Forte H 3 O V 1 N Zona I : Eccesso di Acido Forte [H 3 O+] = V 1 N](https://slidetodoc.com/presentation_image_h2/82aff8807829a215f7350ba370c8367d/image-29.jpg)
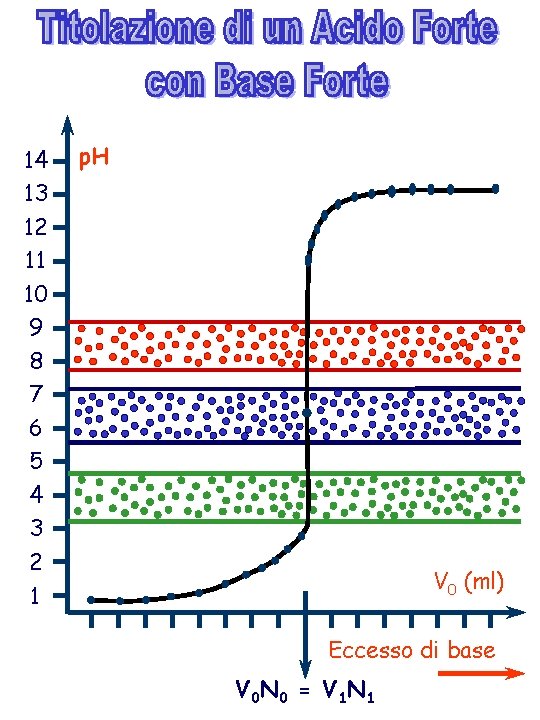
Zona I : Eccesso di Acido Forte [H 3 O+] = V 1 N 1 - V 0 N 0 V 1 + V 0 Equivalenza : [H 3 O+] = [OH- ] = 10 -7 M Zona II : Eccesso di Base [OH- ] = V 0 N 0 - V 1 N 1 V 0 + V 1

14 13 12 11 10 9 8 7 6 5 4 3 2 1 p. H V 0 (ml) Eccesso di base V 0 N 0 = V 1 N 1

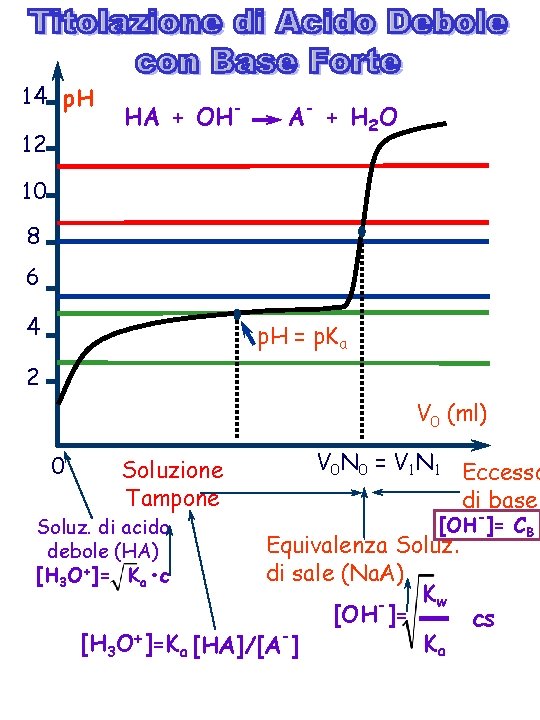
14 p. H 12 HA + OH- A - + H 2 O 10 8 6 4 p. H = p. Ka 2 V 0 (ml) 0 Soluzione Tampone Soluz. di acido debole (HA) [H 3 O+]= Ka • c V 0 N 0 = V 1 N 1 Eccesso di base [OH-]= CB Equivalenza Soluz. di sale (Na. A) Kw [OH ]= cs Ka [H 3 O+]=Ka [HA]/[A-]

ACIDO: qualunque sostanza che forma un legame dativo funzionando da accettore della coppia di elettroni BASE: qualunque sostanza che forma un legame dativo funzionando da donatore della coppia di elettroni N. B. L'acido può anche non contenere H, perciò un acido di Lewis può NON ESSERE un acido di Brønsted (e di Arrhenius). Invece, una BASE di Lewis, avendo un lone pair, può legare un protone ed è perciò anche base di Brønsted (non però necessariamente di Arrhenius).
 Acidi di arrhenius
Acidi di arrhenius Base di arrhenius
Base di arrhenius Arrhenius acido
Arrhenius acido How to identify arrhenius acids and bases
How to identify arrhenius acids and bases Acido y bases de arrhenius
Acido y bases de arrhenius Acidi di lewis
Acidi di lewis Wann wurde das grammophon erfunden
Wann wurde das grammophon erfunden First appearance of sherlock holmes
First appearance of sherlock holmes Juan gris (1887–1927)
Juan gris (1887–1927) Sherlock holmes was first written in 1887 by
Sherlock holmes was first written in 1887 by Foto elektrisch effect
Foto elektrisch effect Grievances
Grievances Layunin ni rizal sa pagsulat ng noli me tangere
Layunin ni rizal sa pagsulat ng noli me tangere Personbas
Personbas Dawes severalty act of 1887
Dawes severalty act of 1887 1887 torrent
1887 torrent Evaluation of types of long term memory
Evaluation of types of long term memory Sherlock holmes 1887
Sherlock holmes 1887 Dawes severalty act of 1887
Dawes severalty act of 1887 Ramanujan's magic square
Ramanujan's magic square H4si nomenclatura
H4si nomenclatura Por que a lâmpada acende
Por que a lâmpada acende H2so4+na
H2so4+na Teoria da dissociação iônica de arrhenius
Teoria da dissociação iônica de arrhenius Teoria de arrhenius
Teoria de arrhenius Acid strength chart
Acid strength chart Arrhenius definition
Arrhenius definition Solvente diferenciador
Solvente diferenciador Eyring equation and arrhenius equation
Eyring equation and arrhenius equation Teori asam basa arrhenius
Teori asam basa arrhenius Ionisasi elektrolit poliprotik
Ionisasi elektrolit poliprotik Amphoteric species
Amphoteric species Fattore pre esponenziale
Fattore pre esponenziale