Teoria Eletroltica de Arrhenius 1 parte Quem foi



















![Propriedades dos sais HBr + Na. OH Na. Br + H 2 O [H+][Br-] Propriedades dos sais HBr + Na. OH Na. Br + H 2 O [H+][Br-]](https://slidetodoc.com/presentation_image_h/fe69ec11c07d5c81b591dc98d3a54025/image-33.jpg)












- Slides: 48

Teoria Eletrolítica de Arrhenius (1. ª parte)

Quem foi Arrhenius? Físico e químico sueco, nasceu em Wijk. Aos 22 anos, já havia realizado muitas experiências relacionadas com a passagem da eletricidade através de soluções aquosas. Formulou a hipótese, de que as soluções aquosas contêm partículas carregadas, isto é, íons. Svante August Arrhenius (1859 -1927)

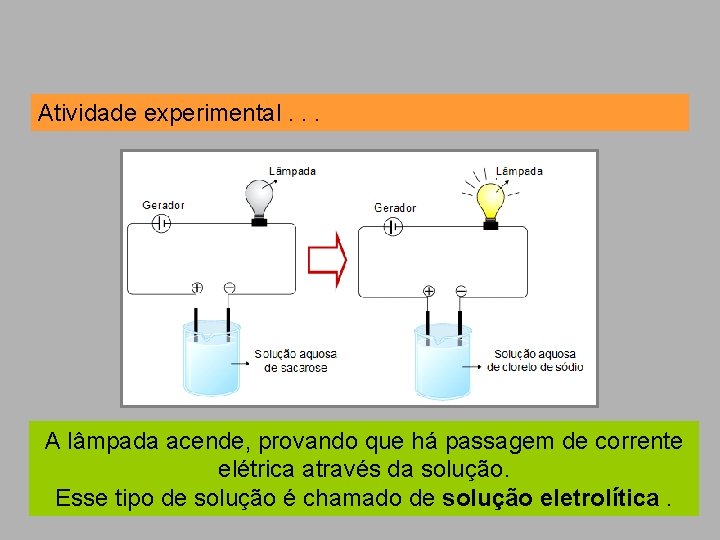
Atividade experimental. . . A lâmpada acende, provando que há passagem de corrente elétrica através da solução. Esse tipo de solução é chamado de solução eletrolítica.

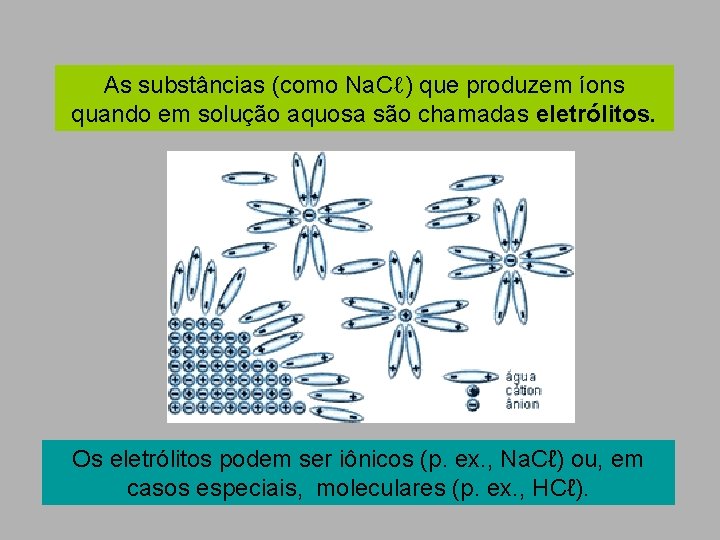
As substâncias (como Na. Cℓ) que produzem íons quando em solução aquosa são chamadas eletrólitos. Os eletrólitos podem ser iônicos (p. ex. , Na. Cℓ) ou, em casos especiais, moleculares (p. ex. , HCℓ).

Dissociação x ionização Quando um eletrólito é iônico, a sua dissolução em água possibilita a separação dos íons do retículo cristalino. Esse fenômeno é chamado dissociação iônica. Na. Cℓ água Na+(aq) + Cℓ-(aq)

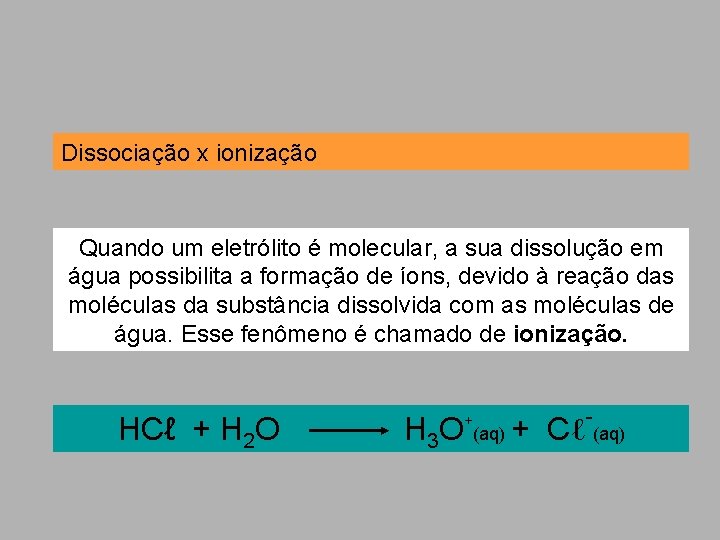
Dissociação x ionização Quando um eletrólito é molecular, a sua dissolução em água possibilita a formação de íons, devido à reação das moléculas da substância dissolvida com as moléculas de água. Esse fenômeno é chamado de ionização. - HCℓ + H 2 O H 3 O (aq) + Cℓ (aq) +

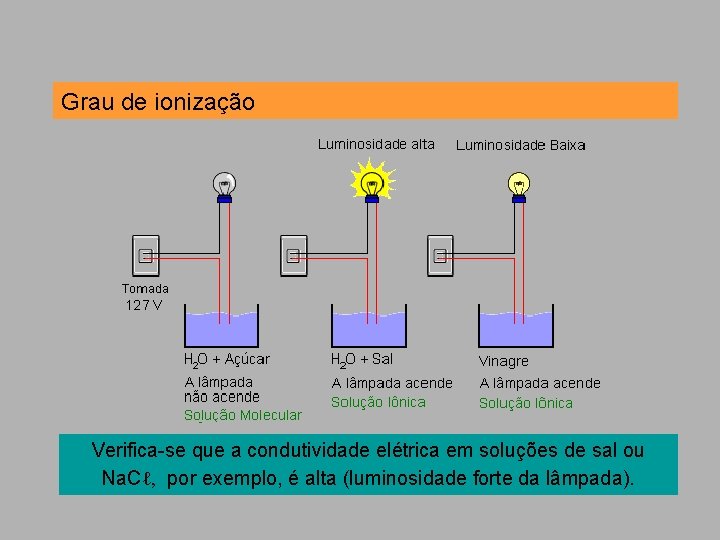
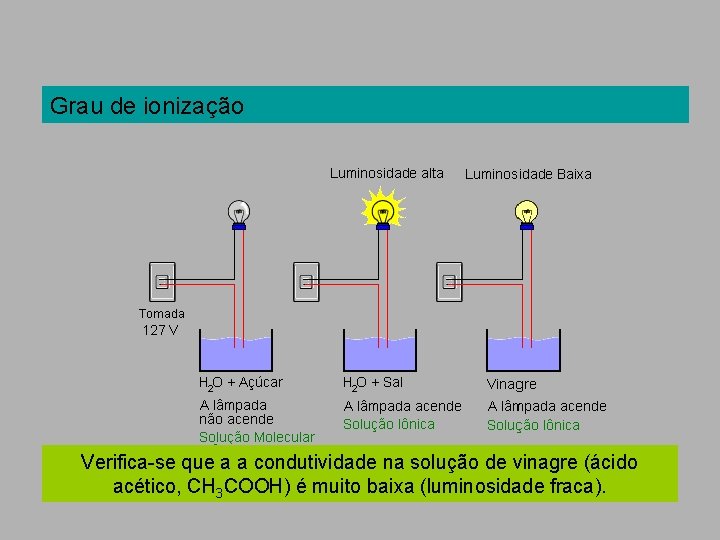
Grau de ionização Verifica-se que a condutividade elétrica em soluções de sal ou Na. Cℓ, por exemplo, é alta (luminosidade forte da lâmpada).

Grau de ionização Verifica-se que a a condutividade na solução de vinagre (ácido acético, CH 3 COOH) é muito baixa (luminosidade fraca).

Grau de ionização Isso nos leva a concluir que poucas moléculas de ácido acético estão ionizadas. Daí. . . – Eletrólitos fortes: existem somente (ou praticamente) como íons em solução. Exemplo: Na. Cℓ – Eletrólitos fracos: existem como uma mistura de íons e moléculas não-ionizadas em solução. Exemplo: CH 3 COOH

Grau de ionização A grandeza que mede a quantidade em porcentagem das moléculas que sofrem ionização é chamada grau de ionização ( ).

As funções inorgânicas Chama-se função química o conjunto ou grupo de substâncias com propriedades químicas semelhantes. Para “enquadrar” uma substância em determinado grupo é necessário escolher um critério. É o caso da Teoria Eletrolítica de Arrhenius.

As funções inorgânicas Com base na Teoria Eletrolítica de Arrhenius, as substâncias ditas inorgânicas são classificadas em. . . Á c i d o s B a s e s S a i s

As funções inorgânicas Considerando-se outros critérios, há também outras funções inorgânicas. . . Ó x i d o s H i d r e t o s

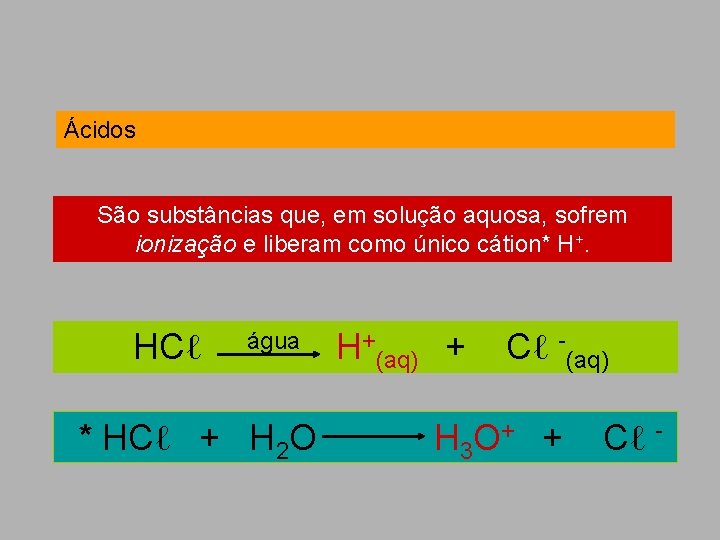
Ácidos São substâncias que, em solução aquosa, sofrem ionização e liberam como único cátion* H+. HCℓ água * HCℓ + H 2 O H+(aq) + Cℓ -(aq) H 3 O+ + Cℓ -

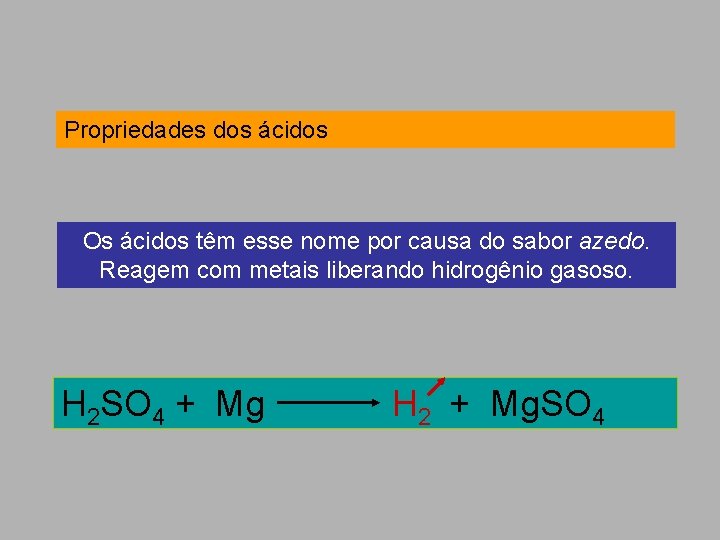
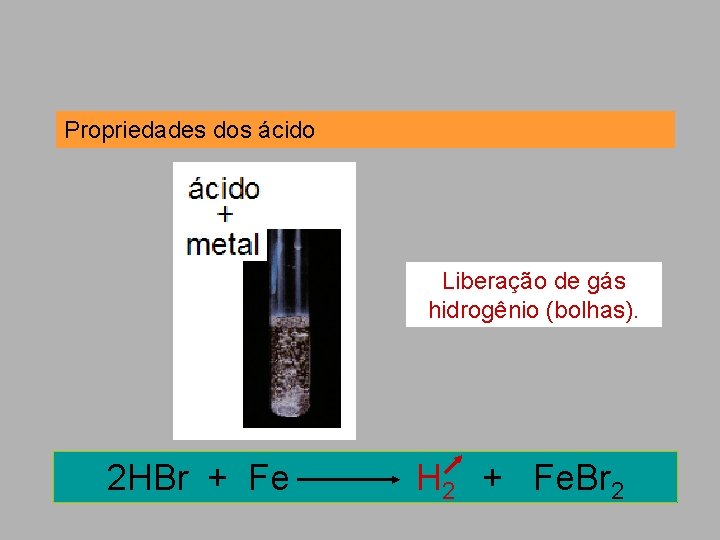
Propriedades dos ácidos Os ácidos têm esse nome por causa do sabor azedo. Reagem com metais liberando hidrogênio gasoso. H 2 SO 4 + Mg H 2 + Mg. SO 4

Propriedades dos ácido Liberação de gás hidrogênio (bolhas). 2 HBr + Fe H 2 + Fe. Br 2

Alguns ácidos e seus usos Acidulante Presente no suco gástrico. de refrigerantes. Eletrólito de baterias.

Nomenclatura (hidrácidos, i. é. , sem oxigênio) Ácido ____________________ (nome do ânion*) . Exemplo: HBr é o ácido bromídrico *Consultando a tabela de cátions e ânions, troca-se “eto” por “ídrico”

Nomenclatura (oxiácidos, i. é. , com oxigênio) Ácido ____________________ (nome do ânion*) . Exemplo: HNO 2 é o ácido nitroso 1. º caso: *troca “ito” por “oso”

Nomenclatura (oxiácidos, i. é. , com oxigênio) Ácido ____________________ (nome do ânion*) . Exemplo: HNO 3 é o ácido nítrico 2. º caso: *troca “ato” por “ico” e tornando proparoxítono.

Nomenclatura (oxiácidos, i. é. , com oxigênio) Cuidado com sulfito, sulfato, fosfito, … Exemplos: H 2 SO 3 é o ácido sulfuroso H 2 SO 4 é o ácido sulfúrico . H 3 PO 3 é o ácido fosforoso H 3 PO 4 é o ácido fósfórico

FIM DA PRIMEIRA PARTE ! Vêm aí bases, sais, hidretos. .

. Teoria Eletrolítica de Arrhenius (2. ª parte)

Bases São substâncias que, em solução aquosa, sofrem dissociação e liberam como único ânion* OH-. Na. OH água Na+(aq) + OH -(aq) Em geral, bases tem como cátion metal; NH 4 OH é excessão.

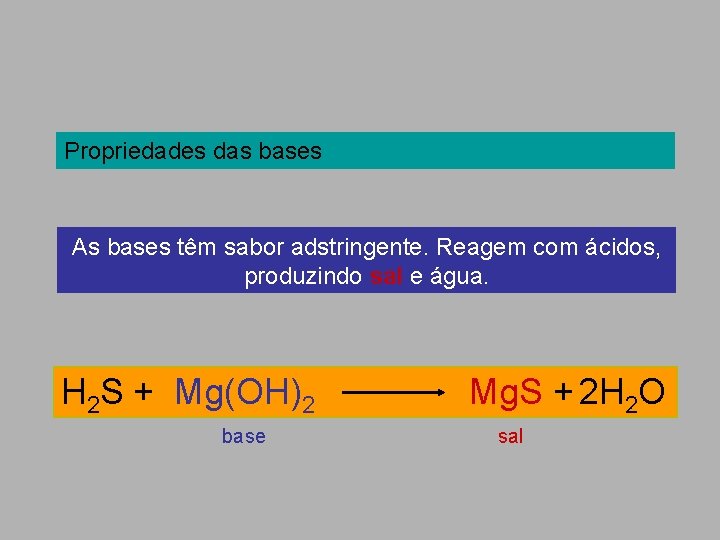
Propriedades das bases As bases têm sabor adstringente. Reagem com ácidos, produzindo sal e água. H 2 S + Mg(OH)2 base Mg. S + 2 H 2 O sal

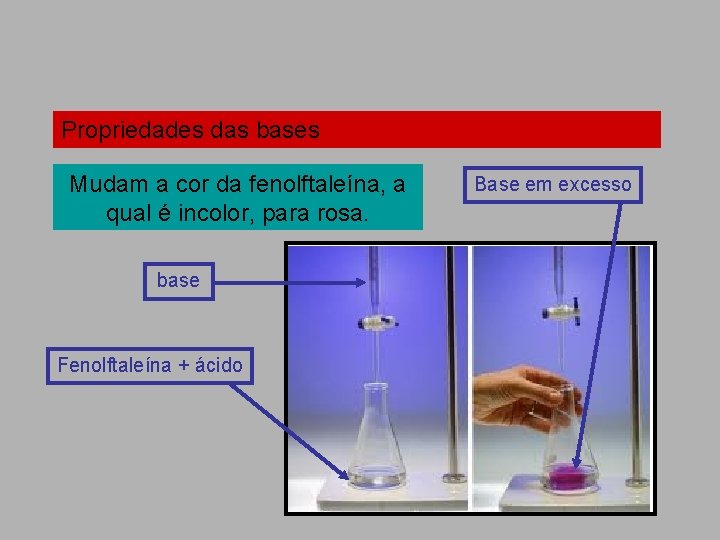
Propriedades das bases Mudam a cor da fenolftaleína, a qual é incolor, para rosa. base Fenolftaleína + ácido Base em excesso

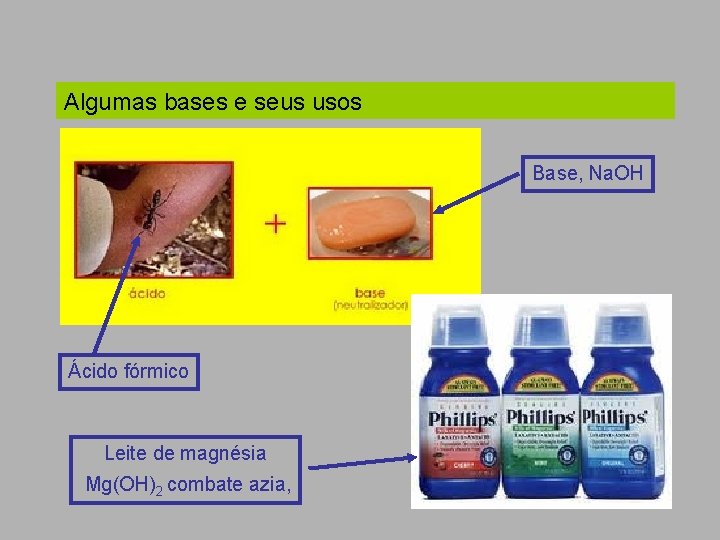
Algumas bases e seus usos Base, Na. OH Ácido fórmico Leite de magnésia Mg(OH)2 combate azia,

Algumas bases e seus usos Desinfectante/alvejantes são fortemente básicos A cal ou Ca(OH)2 é muito utilizada em construções

Nomenclatura das bases Hidróxido de ________________ (nome do cátion*) Exemplos: Na. OH é o hidróxido de sódio Fe(OH)2 é o hidróxido de ferro II *Cuidado que, às vezes, há mais de um tipo de cátion para o mesmo metal

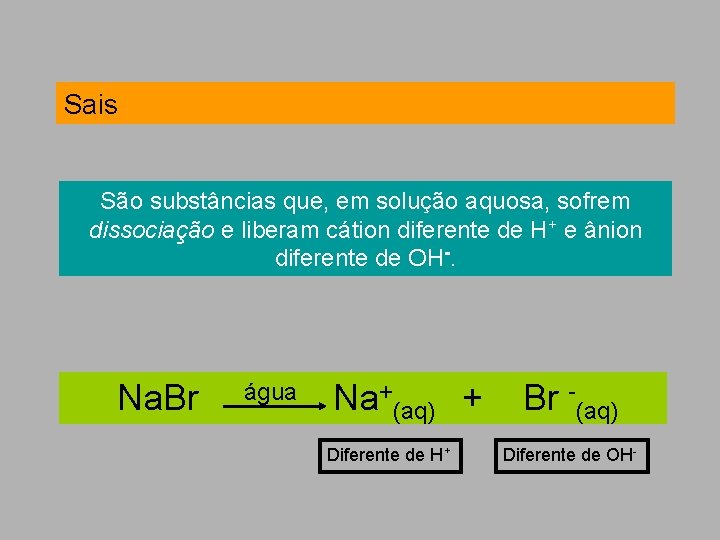
Sais São substâncias que, em solução aquosa, sofrem dissociação e liberam cátion diferente de H+ e ânion diferente de OH-. Na. Br água Na+(aq) + Br -(aq) Diferente de H+ Diferente de OH-

Propriedades dos sais Os sais têm sabor salgado. Cuidado! Jamais prove substâncias químicas. Muitas delas são venenosas*. KCN* água K+(aq) + CN -(aq) Cianureto ou cianeto de potássio é tóxico. Um livro interessantepara ler nas férias, de Agatha Christie: Um Brinde de Cianureto.

Propriedades dos sais Na verdade, os sais podem ser considerados como produto da reação de um ácido como uma base, ou seja, … ÁCIDO + BASE → SAL + ÁGUA
![Propriedades dos sais HBr Na OH Na Br H 2 O HBr Propriedades dos sais HBr + Na. OH Na. Br + H 2 O [H+][Br-]](https://slidetodoc.com/presentation_image_h/fe69ec11c07d5c81b591dc98d3a54025/image-33.jpg)
Propriedades dos sais HBr + Na. OH Na. Br + H 2 O [H+][Br-] [Na+][OH-] = [Na+][Br-] [H+][OH-]

Alguns sais e seus usos Sal de cozinha, Na. Cℓ Sal de frutas, Na. HCO 3

Alguns sais e seus usos Cálcio dental, Ca 3(PO 4)2 Giz, Ca. SO 4

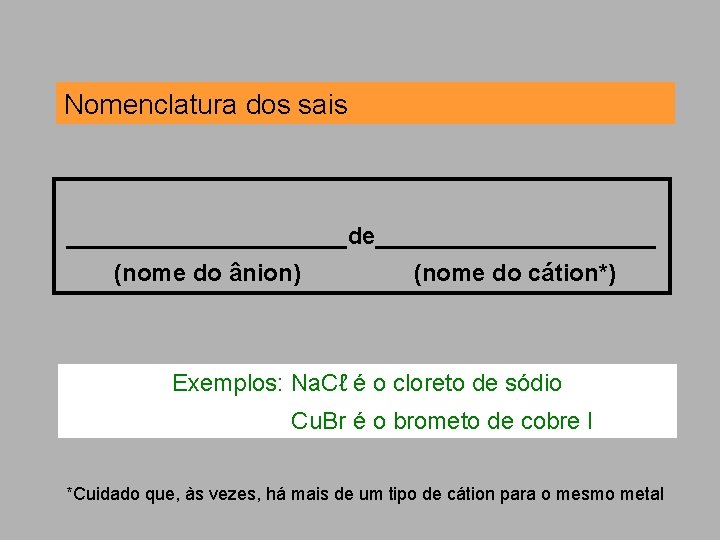
Nomenclatura dos sais ___________de___________ (nome do ânion) (nome do cátion*) Exemplos: Na. Cℓ é o cloreto de sódio Cu. Br é o brometo de cobre I *Cuidado que, às vezes, há mais de um tipo de cátion para o mesmo metal

Solubilidade dos sais Há sais solúveis ou insolúveis* em água. *Importante saber, quando se quer prever se há ou não reação química.

Óxidos e hidretos Óxidos são compostos binários (dois elementos) em que o oxigênio é o mais eletronegativo. Hidretos são compostos hidrogenados, que apresentam o hidrogênio como o elemento mais eletronegativo. Exemplo de óxido: CO é o óxido de carbono II Exemplo de hidreto: Na. H é o hidreto de sódio *monóxido de carbono

Óxidos e seus usos Magnetita, ímã natural, Fe 3 O 4 Extintor de incendio, CO 2

Minério de ferro, hematita, Fe 2 O 3 Óxidos e seus usos

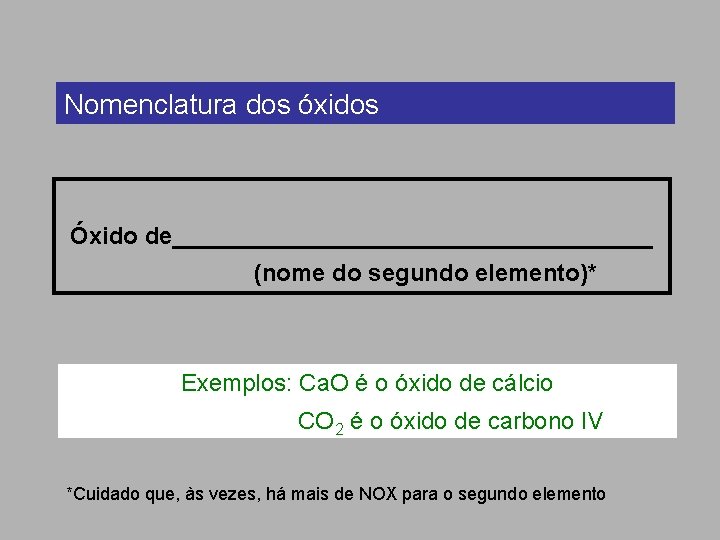
Nomenclatura dos óxidos Óxido de__________________ (nome do segundo elemento)* Exemplos: Ca. O é o óxido de cálcio CO 2 é o óxido de carbono IV *Cuidado que, às vezes, há mais de NOX para o segundo elemento

Classificação dos óxidos 1. Óxidos básicos são aqueles que apresentam metal com NOX ≤ 2. Exemplos; Na 2 O, Ca. O, … Reage com água, formando base ou com ácido, formando sal e água. Na 2 O + H 2 O → 2 Na. OH Na 2 O + 2 HBr → 2 Na. Br + H 2 O

Classificação dos óxidos 2. Óxidos ácidos são aqueles que apresentam não-metal com NOX ≥ 4. Exemplos; SO 2, CO 2, … Reage com água, formando ácido ou com base, formando sal e água. SO 2 + H 2 O → H 2 SO 3 CO 2 + 2 Na. OH → Na 2 CO 3 + H 2 O

Classificação dos óxidos e “chuva ácida” Chaminés de certas fábricas, caminhões, ônibus liberam para atmosfera os gases SO 2 e CO 2 em demasia, os quais reagem com a água da chuva. É a chuva ácida! SO 2 + H 2 O → H 2 SO 3(aq) Ácido sulfuroso CO 2 + H 2 O → H 2 CO 3(aq) Ácido carbônico

Classificação dos óxidos 3. Óxidos neutros são aqueles que apresentam não-metal com NOX < 4. Exemplos; NO, CO, …

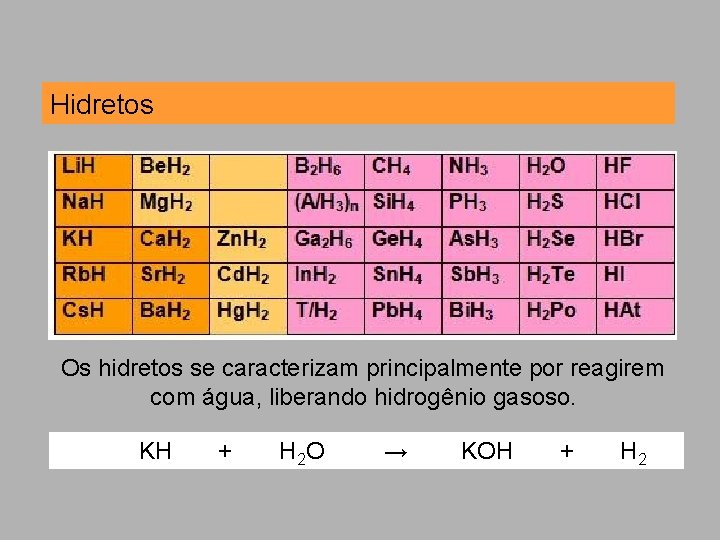
Hidretos Os hidretos se caracterizam principalmente por reagirem com água, liberando hidrogênio gasoso. KH + H 2 O → KOH + H 2

NH 3 (amônia), um hidreto importante Obtenção da amônia … N 2 + 3 H 2 → 2 NH 3 (do ar) Processo Haber-Boch Aplicação … NH 3 + HX → NH 4 X (fertilizantes) NH 3 + 2 O 2 → H 2 O + HNO 3 (fertilizantes e explosivos)

FIM