TEHNOLOGIJA SUMPORNE KISELINE H 2 SO 4 Pripremio
























- Slides: 34

TEHNOLOGIJA SUMPORNE KISELINE H 2 SO 4 Pripremio: Varga Ištvan HEMIJSKO-PREHRAMBENA SREDNJA ŠKOLA ČOKA varga. i@neobee. net

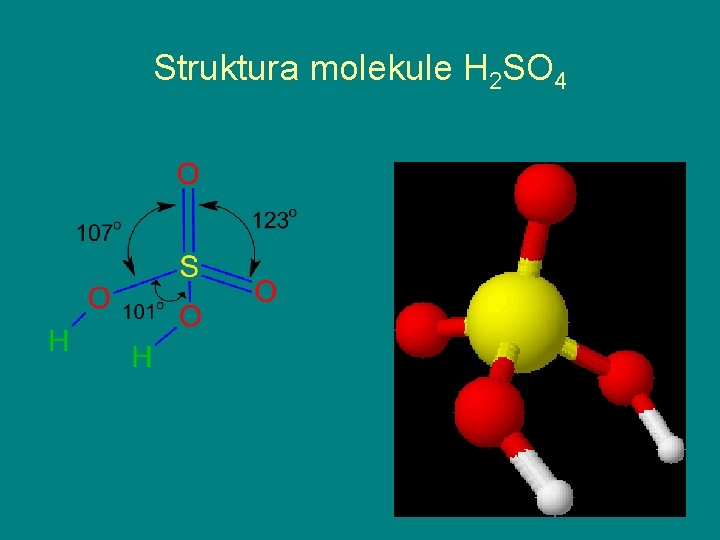
Osobine sumporne kiseline Uljasta tečnost bez boje i mirisa, otrovna je; Sa vodom se meša u svim odnosima uz oslobađanje velike kolićine toplote; Azeotropska smeša kiseline i vode sadrži 98, 3 % H 2 SO 4 i 1, 7 % H 2 O ključa na 338 o. C gustina takve kiseline je 1, 843 g/cm 3 ; Na temperaturi od oko 450 o. C potpuno se razlaže na SO 3 i H 2 O; Vrlo je higroskopna, u dodiru sa organskim materijama dehidratiše ih; U dodiru sa kožom izaziva opekotine; Spada u najjača oksidaciona sredstva;

Ø Sumporna kiselina je jedna od najjačih neorganskih kiselina; Ø Disosuje u dva stepena, te gradi dve vrste soli: - Hidrogensulfate i - Sulfate. Ø Metale sa negativnim redoks potencijalom razara uz oslobađanje vodonika; Ø Bakar, živu ili srebro razara uz oslobađanje SO 2 Ø Liveno gvožđe pasivizuje, zato se koncentrovana kiselina čuva u gvozdenim rezervoarima.

Struktura molekule H 2 SO 4

Značaj i upotreba Sumporna kiselina spada u strateške materije. Spada u najvažnije proizvode hemijske industrije. Njena proizvodnja i danas služi kao indikator industrijske aktivnosti zemlje. Ona je najvažnija neorganska kiselina. Svetska proizvodnja iznosi oko 50 miliona tona godišnje.

UPOTREBLJAVA SE : • U industriji veštačkih đubriva; • Za dobijanje raznih sulfata, na pr. Cu. SO 4 x 5 H 2 O • Za proizvodnju: - Hlorovodonika, - Mineralnih boja, - Veštačkih vlakana, - Eksploziva, • • Za punjenje akumulatora; Za rafinaciju mineralnih ulja; Kao dehidrataciono sredstvo; Pri organskim procesima: Nitrovanju, esterifikaciji, sulfoniranju; • U metalurgiji i galvanotehnici i td.

PROIZVODNJA SUMPORNE KISELINE Proizvodi se na dva načina: 1. Postupkom tornjeva (nitrozni postupak) i 2. Kontaktnim postupkom. Ovi postupci se međusobno razlikuju u načinu oksidacije SO 2 i apsorpcije nastalog SO 3. Kontaktni postupak se više primenjuje jer je ekonomičniji i omogućuje dobijanje 100 % -ne kiseline.

Faze proizvodnje Kod oba postupka razlikujemo tri faze proizvodnje: 1. Proizvodnja SO 2 i njegovo prečišćavanje 2. Oksidacija SO 2 u SO 3 i 3. Apsorpcija SO 3.

SIROVINE ZA DOBIJANJE SO 2 Postoje razne sirovine kao što su: q. Elementarni sumpor (najbolja sirovina) q. Pirit - Fe. S 2 (sa sadržajem sumpora od 50 % ) q Sulfidne rude, kao što su Zn. S, Cu. S, Pb. S i td. q Sulfati kao na primer Ca. SO 4 i Mg. SO 4 koji se retko koriste. Kod na se SO 2 proizvodi iz PIRITA prženjem.

Kristalna struktura pirita

Prženje pirita Prženje se može prikazati sledećim zbirnim reakcijama: 4 Fe. S 2 + 11 O 2 2 Fe 2 O 3 + 8 SO 2 3 Fe. S 2 + 8 O 2 Fe 3 O 4 + 6 SO 2 Reakcije su jako egzotermne! Ove reakcije služe za proračun materijalnog i toplotnog bilansa. Prženje se izvodi vazduhom sa viškom od 5 % od teorijski potrebne količine na temperaturi od 850 - 900 o. C.

Peći za prženje pirita Pirit se prži u raznim tipovima peći : • • Rotacionim; Etažnim; Sa lebdećim (uskovitlanim) i Fluidizovanim slojem. Tokom prženja sumpor iz pirita sa kiseonikom iz vazduha daje SO 2. Pored sumpordioksida nastaju još oksidi primesa kao što su: As 2 O 3, Se. O 2 (gasovi) i čvrsti oksidi Fe. O, Fe 2 O 3, Cu 2 O, Cu. O, Zn. O, Ca. O i td.

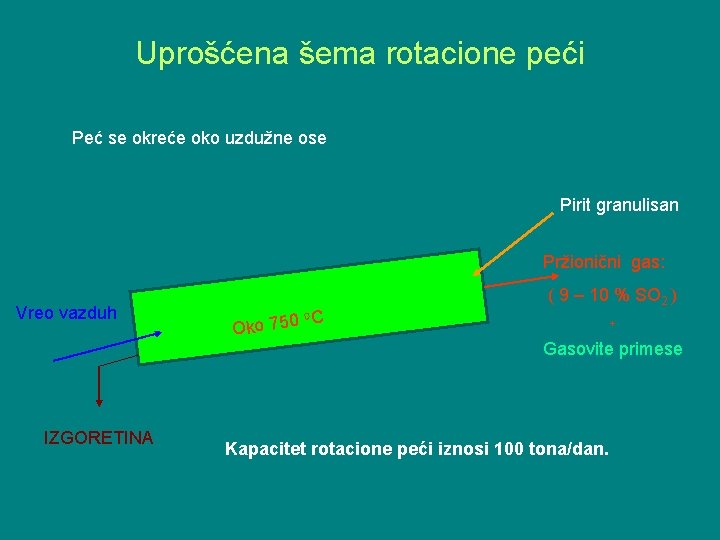
Uprošćena šema rotacione peći Peć se okreće oko uzdužne ose Pirit granulisan Pržionični gas: Vreo vazduh IZGORETINA ( 9 – 10 % SO 2 ) o. C 0 5 7 Oko + Gasovite primese Kapacitet rotacione peći iznosi 100 tona/dan.

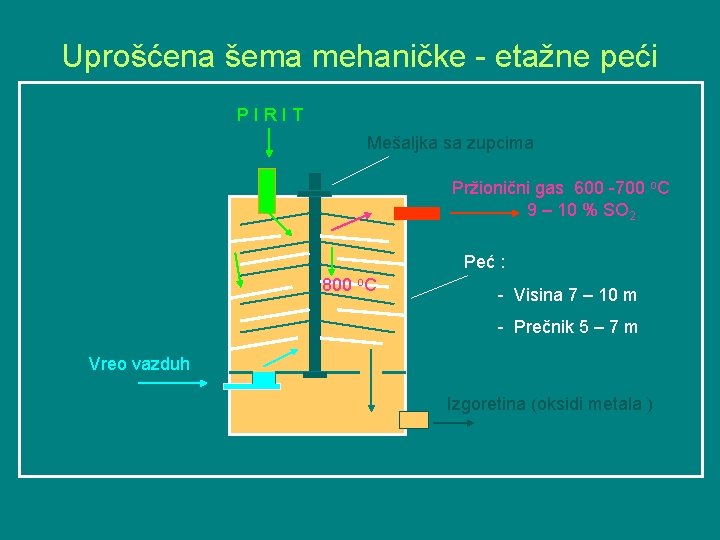
Uprošćena šema mehaničke - etažne peći PIRIT Mešaljka sa zupcima Pržionični gas 600 -700 o. C 9 – 10 % SO 2 Peć : 800 o. C - Visina 7 – 10 m - Prečnik 5 – 7 m Vreo vazduh Izgoretina (oksidi metala )


Prečišćavanje pržioničnog gasa Pržionični gas sadrži svega 10 – 15 % SO 2. Ostatak gasa čine: • Vazduh; • Prašina od izgoretine ( razni oksidi metala ); • Se. O 2 ; • As 2 O 3 ; • HF ; • Druge gasovite primese u tragovima. Pržionični gas po izlasku iz peći ima temperaturu od oko 700 o. C.

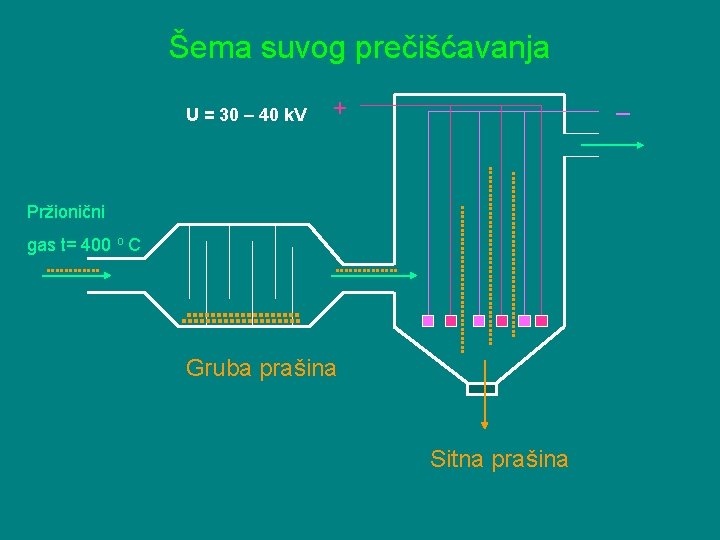
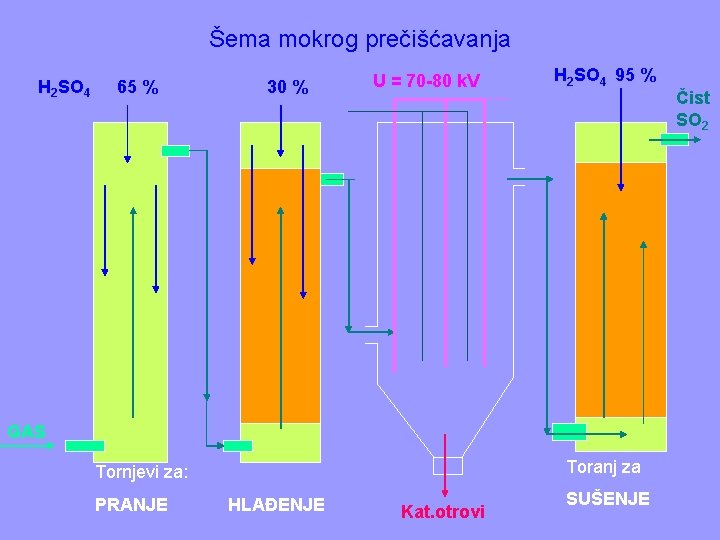
Prečišćavanje se vrši SUVIM i MOKRIM postupkom. § SUVO prečišćavanje se izvodi u prašnim komorama i elektrostatičkim filtrima. Tu se odstranjuju mehaničke nečistoće. § MOKRO prečišćavanje se izvodi u mokrim elektrostatičkim filtrima i tornjevima za pranje i hlađenje gasne smeše. Ovde se odstranjuju gasovite primese arsena, selena i fluora (katalitički otrovi).

Šema suvog prečišćavanja U = 30 – 40 k. V _ + Pržionični gas t= 400 o C Gruba prašina Sitna prašina

Šema mokrog prečišćavanja H 2 SO 4 65 % 30 % U = 70 -80 k. V H 2 SO 4 95 % GAS Toranj za Tornjevi za: PRANJE HLAĐENJE Kat. otrovi SUŠENJE Čist SO 2

Dobijanje sumporne kiseline kontaktnim postupkom Prečišćen gas odvodi se u proces dobijanja sumportrioksida. Kod KONTAKTNOG postupka, katalizator i reagensi su u različitim agregatnim stanjima (čvrsto i gasovito) pa se kataliza vrši na površini katalizatora - heterogena kataliza. Ovaj postupak je uveden početkom XX. veka, a naziv je dobio po tome što se SO 2 oksidiše vazdušnim kiseonikom u kontaktu sa površinom čvrstog katalizatora. Ovim postupkom dobija se čista koncentrovana 99, 5 % H 2 SO 4.

KONTAKTNI POSTUPAK Kontaktni postupak sastoji se iz dve faze: 1. Oksidacija SO 2 u SO 3 i 2. Apsorpcija SO 3 u sumpornoj kiselini.

Oksidacija SO 2 u SO 3 Oksidacija se vrši vazdušnim kiseonikom u prisustvu katalizatora, a teče prema seledećoj povratnoj reakciji: 2 SO 2 + O 2 2 SO 3 Reakcija je egzotermna ( oslobađa se 94, 5 k. J / mol. toplote)! Na prinos SO 3 utiče: Temperatura; Ø Pritisak i Ø Koncentracija reagujućih gasova. Ø

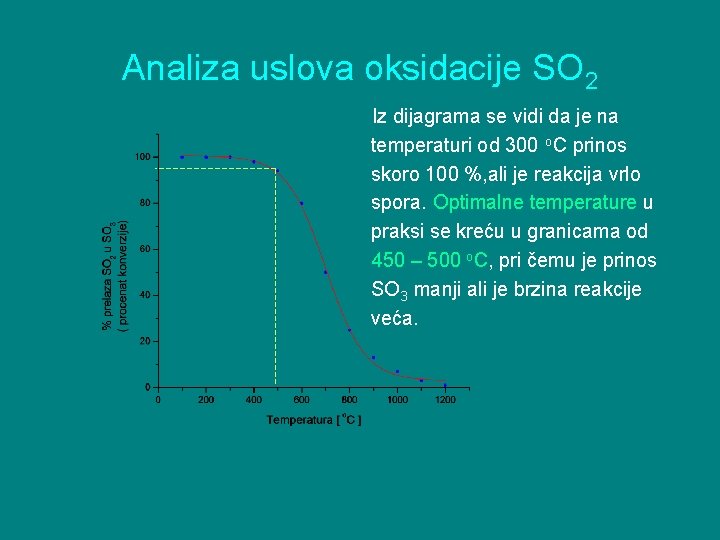
Analiza uslova oksidacije SO 2 Iz dijagrama se vidi da je na temperaturi od 300 o. C prinos skoro 100 %, ali je reakcija vrlo spora. Optimalne temperature u praksi se kreću u granicama od 450 – 500 o. C, pri čemu je prinos SO 3 manji ali je brzina reakcije veća.

Upotrebom katalizatora proces konverzije se ubrzava. Kao katalizator najviše je u upotrebi V 2 O 5. Mehanizam delovanja je: 2 V 2 O 5 + 2 SO 2 2 VOSO 4 + V 2 O 4 2 V 2 O 4 + O 2 2 VOSO 4 + V 2 O 4 2 V 2 O 4 + 2 SO 3 2 V 2 O 5 Tokom vremena katalizator gubi katalitičku aktivnost, stoga mora s vremena na vreme da se menja delimično ili potpuno. Temperatura nesme da prelazi 620 o. C. Nosač katalizatora može da bude Si. O 2 , silikagel.

Transformacijom izraza za konstantu ravnoteže reakcije oksidacije SO 2 , dobijamo: Prinos SO 3 na bilo kojoj temperaturi veći ako je veća koncentracija kiseonika. To se u praksi realizuje viškom vazduha.

Konverzija SO 2 u SO 3 sa međuapsorpcijom Suština je u tome da se oksidacija i apsorpcija odvijaju u dva stepena. • U prvom stepenu se po dostizanju konverzije od oko 90 % nastali SO 3 vodi na apsorpciju. • Gas koji izlazi iz apsorbera vraća na konverziju u drugom stepenu. Ovakvim načinom vođenja procesa ukupna konverzija dostiže 99, 5 %.

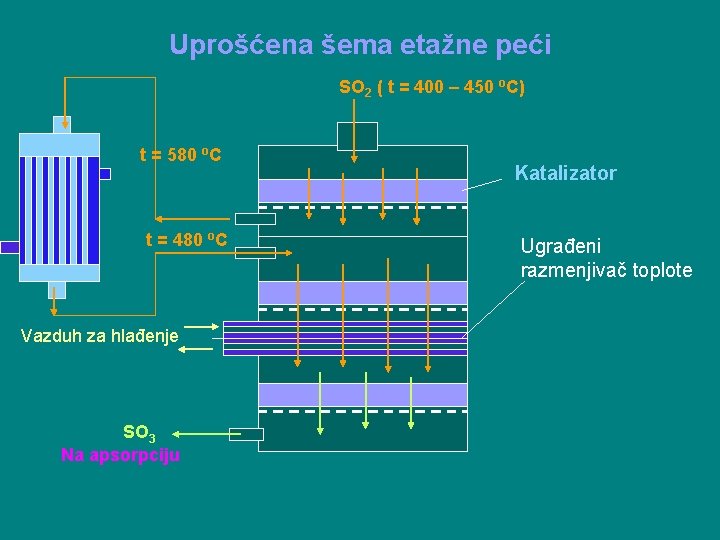
Tehničko izvodjenje konverzije Izvodi se u kontaktnim pećima različite konstrukcije. Najčešće se primenjuju: 1. Etažne i 2. Cevne peći. Kod prvih se kontaktna masa nalazi na etažama a kod drugih u cevima. Kontaktno odeljenje čine predgrejač, kontaktni reaktor i razmenjivači toplote.

Uprošćena šema etažne peći SO 2 ( t = 400 – 450 o. C) t = 580 o. C t = 480 o. C Vazduh za hlađenje SO 3 Na apsorpciju Katalizator Ugrađeni razmenjivač toplote

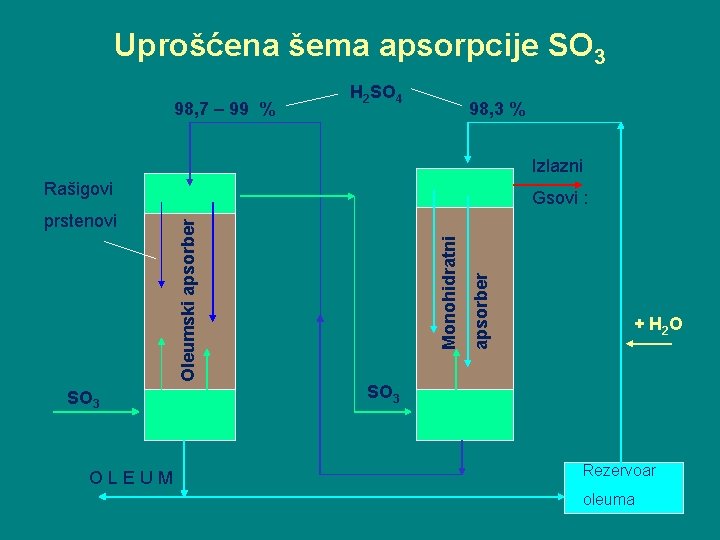
Apsorpcija SO 3 U proizvodnim uslovima SO 3 se apsorbuje u 98, 6 % -tnoj sumpornoj kiselini. Apsorpcija se izvodi u dva apsorbera: 1. Oleumski apsorber (tu se dobija oleum) i 2. Monohidratni apsorber (dobija se koncentrovana sumporna kiselina sa 99, 5 % H 2 SO 4). Stepen apsorpcije SO 3 ne sme da bude manji od 99, 95 %. Temperatura kiseline na izlazu iz apsorbera ne treba da je viša od 60 o. C.

Uprošćena šema apsorpcije SO 3 98, 7 – 99 % H 2 SO 4 98, 3 % Izlazni Rašigovi SO 3 OLEUM apsorber Monohidratni Oleumski apsorber prstenovi Gsovi : + H 2 O SO 3 Rezervoar oleuma

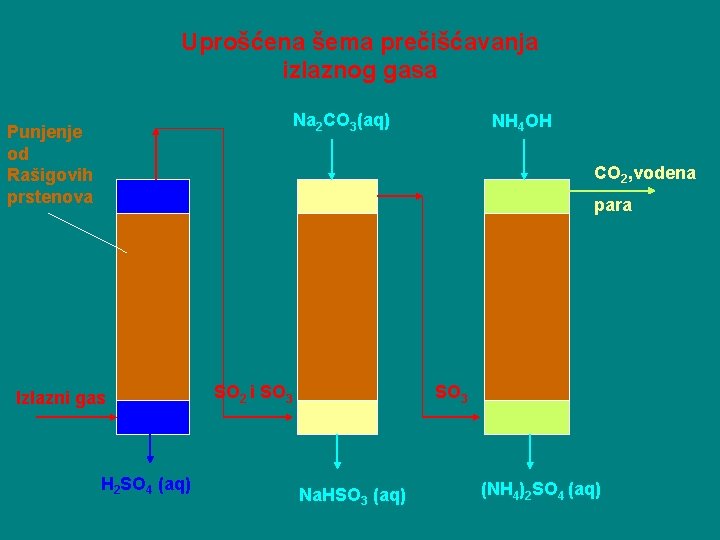
Prečišćavanje izlaznog gasa Gasna smeša koja napušta apsorber sadrži oko: - 0, 15 % ili 4 g/m 3 SO 2 ; - 0, 007 % ili 0, 3 g/m 3 SO 3 i - Sitne kapljice sumporne kiseline. Propuštanjem gasa kroz toranj sa punjenjem najpre se uklanjaju kapljice H 2 SO 4. Uklanjanje SO 2 i SO 3 se takođe vrši u tornjevima koji se orošavaju takvim reagensima koji sa navedenim supstancama daju rastvor soli koji se sliva na dno tornja.

Uprošćena šema prečišćavanja izlaznog gasa Na 2 CO 3(aq) Punjenje od Rašigovih prstenova NH 4 OH CO 2, vodena para Izlazni gas H 2 SO 4 (aq) SO 2 i SO 3 Na. HSO 3 (aq) (NH 4)2 SO 4 (aq)

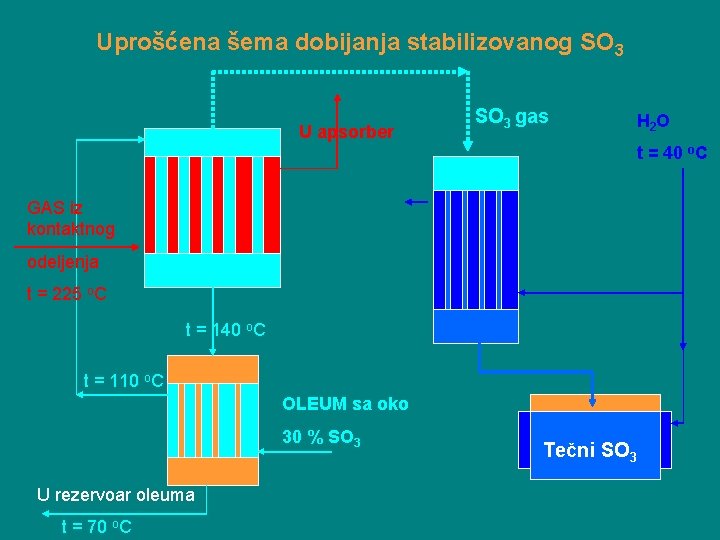
Dobijanje stabilizovanog SO 3 Kao sirovina koristi se OLEUM sa 25 -30 % slobodnog SO 3. Suština proizvodnje je da se oleum dobijen u oleumskom apsorberu u pogodnom azmenjivaču toplote podvrgava isparavanju na temperaturi od oko 140 o. C, pri čemu se oslobađa SO 3 –gas. Gasoviti SO 3 se po tom kondenzuje u kondenzatoru gde nastaje tečni SO 3. Tečni SO 3 se prihvata u rezervoaru gde se održava temperatura od 30 -40 o. C radi sprečavanja očvršćavanja 100 %-nog SO 3. Kako bi se sav SO 3 održao u tečnom stanju i na nižim temperaturama vrši se njegova stabilizacija dodavanjem B 2 O 3 ili Na 2 SO 4.

Uprošćena šema dobijanja stabilizovanog SO 3 U apsorber SO 3 gas H 2 O t = 40 o. C GAS iz kontaktnog odeljenja t = 225 o. C t = 140 o. C t = 110 o. C OLEUM sa oko 30 % SO 3 U rezervoar oleuma t = 70 o. C Tečni SO 3
 Dobijanje sumporne kiseline
Dobijanje sumporne kiseline Informaciono komunikacione tehnologije
Informaciono komunikacione tehnologije Kaj je informacijska tehnologija
Kaj je informacijska tehnologija Tehnologija mleka
Tehnologija mleka žica za zavarivanje punjena prahom
žica za zavarivanje punjena prahom Farmaceutska tehnologija 1
Farmaceutska tehnologija 1 Tehnologija zavarivanja
Tehnologija zavarivanja Obrazovna tehnologija
Obrazovna tehnologija Gymko
Gymko Mehanicki period
Mehanicki period Kriterijumi ocenjivanja tehnika i tehnologija
Kriterijumi ocenjivanja tehnika i tehnologija Pasta zinci receptura
Pasta zinci receptura Tehnologija livenja
Tehnologija livenja Mag zavarivanje gasa
Mag zavarivanje gasa Dobavljaci interneta
Dobavljaci interneta Tehnika i tehnologija
Tehnika i tehnologija Obrada rezanjem
Obrada rezanjem Grafički fakultet titula
Grafički fakultet titula Me motronic
Me motronic Prolazna tvrdoca vode
Prolazna tvrdoca vode Izrada acidi borici
Izrada acidi borici Hemijska tehnologija
Hemijska tehnologija Cloud tehnologija
Cloud tehnologija Tehnologija proizvodnje bijelog vina
Tehnologija proizvodnje bijelog vina Primena informacionih tehnologija
Primena informacionih tehnologija Cmos invertor
Cmos invertor Aluminotermijsko zavarivanje
Aluminotermijsko zavarivanje Informaciona tehnologija
Informaciona tehnologija Zelena tehnologija
Zelena tehnologija Sta su informacione tehnologije
Sta su informacione tehnologije Ikt tehnologija
Ikt tehnologija Romadur sir
Romadur sir Tehnologija obrade i montaže
Tehnologija obrade i montaže Dehidrogenizacija
Dehidrogenizacija Titracija slabe kiseline jakom bazom
Titracija slabe kiseline jakom bazom