Tasakaal keskne miste keemias Toomas Kaevand Viitna 2019





















- Slides: 25

Tasakaal – keskne mõiste keemias Toomas Kaevand Viitna 2019

Mida võiks tähendada tasakaal? ● Võrrandite tasakaalustamist? C 2 H 5 OH + 3 O 2 → 2 CO 2 + 3 H 2 O ● Võrrandite tasakaalustamine tähendab reaktsioonis osalevate ainete kvantitatiivsete suhete paika sättimist ● Võrrandite tasakaalustamine on osa stöhhiomeetriast, mis tähendab keemiliste valemite ja reaktsioonivõrrandite tuletamist, koos neil põhinevate ainehulkade arvutustega 2

Tasakaalu mõiste ● Tasakaal on dünaamilise süsteemi olek, kus normaaltingimustele vastava kiiruste juures toimuvad pidevad üleminekud selle süsteemi võimalike seisundite vahel ● Teiste sõnadega: tasakaal on süsteemi seisund, kus reaktsiooni edasi ja tagasi toimumise kiirused on samad Oluline märkus: Tasakaal ei tähenda, et mingi protsessi lähteained ja saadused peaksid olema omavahel ideaalses vahekorras 3

Natroni soolajärv Tansaanias Natroni järve vesi ja järve setted sisaldavad suures koguses naatrium karbonaati (Na 2 CO 3) ehk soodat, mis on tekkinud kaltsium karbonaadist (Ca. CO 3) ja naatrium kloriidist (Na. Cl) ehk “soolast” Natroni järv, vaade kosmosest ja kohapeal Pildid: NASA (vasakul) ja Wikipedia 4

Veider reaktsioon ● Kuidas tekib sooda lubjakivist? ○ 2 Na. Cl + Ca. CO 3 → Na 2 CO 3 + Ca. Cl 2 ● Reaktsioonid võivad olla pööratavad ○ Na 2 CO 3 + Ca. Cl 2 ⇌ 2 Na. Cl + Ca. CO 3 Claude Louis Berthollet (1748 - 1822) Pilt: Wikipedia 5

Rosetta kivi Pilt: Wikipedia, Hans Hillewaert 6

Kuidas väljendada tasakaalu ● 7

Tasakaalu tüübid ● Homogeenne tasakaal Kõik reaktandid ja saadused on samas faasis ● Heterogeenne tasakaal Reaktandid ja saadused võivad olla erinevates faasides 8

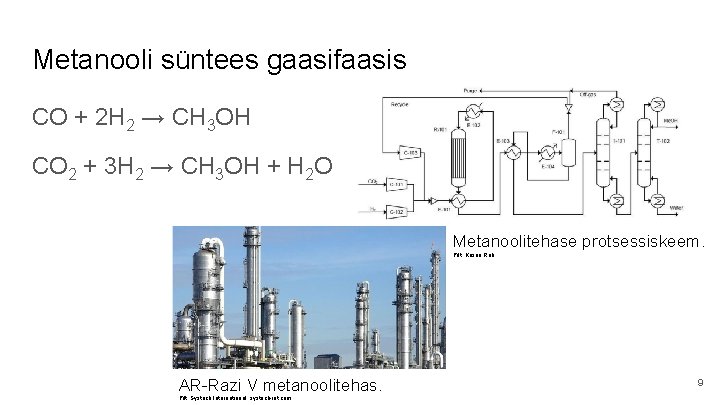
Metanooli süntees gaasifaasis CO + 2 H 2 → CH 3 OH CO 2 + 3 H 2 → CH 3 OH + H 2 O Metanoolitehase protsessiskeem. Pilt: Kosan Roh AR-Razi V metanoolitehas. Pilt: Systech International, systech-int. com 9

Tasakaal ei ole. . . ● Tasakaal ei ole: ○ Lähteainete ja saaduste ideaalne vahekord ○ Stabiilsus ● Tasakaal võib olla äärmiselt ebastabiilne 10

Tasakaal ja vaba energiaga ● 1873 pakkus Josiah Willard Gibbs välja, et süsteem on tasakaalus siis, kui selle vaba energia on minimaalne ΔG = - RT ln K Kus G - Gibbsi vaba energia, ΔG - Gibbsi vabaenergia muut, R - ideaalne gaasikonstant, T - absoluutne temperatuur, K - tasakaalu konstant J. W. Gibbs (1839 - 1903) Pilt: Wikipedia 11

Stress ja tasakaal ● Stress - välis- ja sisekeskkonna muutumisel tekkiv pingeseisund ● Ehk teisisõnu, muutused süsteemis põhjustavad stressi ● Stress sunnib tasakaalu muutuma 12

Le Chatelier' printsiip ● Tasakaalus süsteemile stressi rakendamine sunnib süsteemi liikuma seisu, mis vähemalt osaliselt vähendab stressi ● Le Chatelier' printsiibi saab formuleerida järgnevalt: Kui keemilise tasakaalu korral muutub mingi osapoole kontsentratsioon, temperatuur, ruumala või rõhk, siis keemilise reaktsiooni toimumise suund on vastupidine selle teguri muutusele 13

Le Chatelier' printsiip ● Le Chatelier' printsiibi formuleerisid 19. sajandi lõpul üksteisest sõltumatult Henry Louis Le Chatelier ja Karl Ferdinand Braun Henry Louis Le Chatelier (1850 -1936) ja Karl Ferdinand Braun (1850 -1918) Fotod: Wikipedia 14

Ammoniaagi süntees ● Ammoniaak, NH 3, lämmastikust ja vesinikust koosnev lihtne aine, mida ei ole tavatingimustel lihtne sünteesida ● N 2 + 3 H 2 → 2 NH 3 ○ Eksotermiline reaktsioon ○ ΔH 0 (N 2 + 3 H 2) = 0 k. J/mol ○ ΔH 0 (NH 3) = -91. 8 k. J/mol ● Haber-Bosch protsess ○ 20 MPa ja 500 °C ○ Raudkatalüsaator Üks esimestest BASF ammoniaagi reaktoritest (1921) Pilt: Wikipedia 15

Fritz Haber (1868 -1934) ja Carl Bosch (1874 -1940) Pildi: Wikipedia 16

Kunstväetised ● Makroväetised: ○ N - lämmastikväetised ○ P - fosforväetised ○ K - kaaliumväetised Justus von Liebig (1803 - 1873) Pilt: Wikipedia 17

Happe-aluse tasakaal, p. H ● p. H – vesinikuioonide (H+, tegelikult enamasti H 3 O+ kujul) sisaldus lahuses ● Happelisus ei ole alati p. H 18

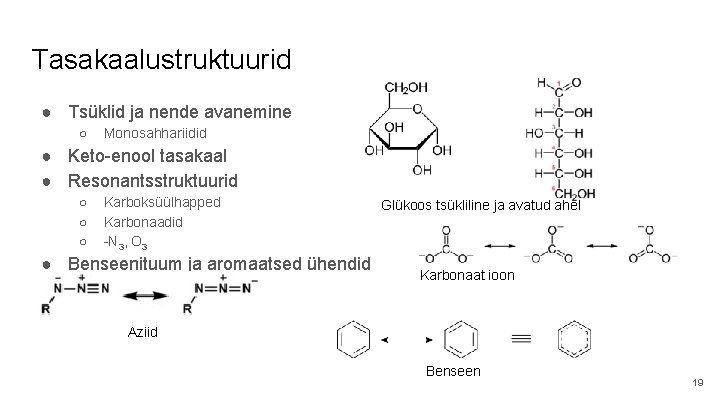
Tasakaalustruktuurid ● Tsüklid ja nende avanemine ○ Monosahhariidid ● Keto-enool tasakaal ● Resonantsstruktuurid ○ ○ ○ Karboksüülhapped Karbonaadid -N 3, O 3 ● Benseenituum ja aromaatsed ühendid Glükoos tsükliline ja avatud ahel Karbonaat ioon Aziid Benseen 19

Kvantmehhaanikast sõltuv tasakaal ● Aatomi ehitus ● Keemiline side ● Molekuli ehtius 20

Keemiline side ● Peamised keemiliste sidemete tüübid: ○ Kovalentne side ○ Iooniline side ○ Metalliline side ● Kovalentne ja metalliline side on eelkõige tasakaalulise loomusega 21

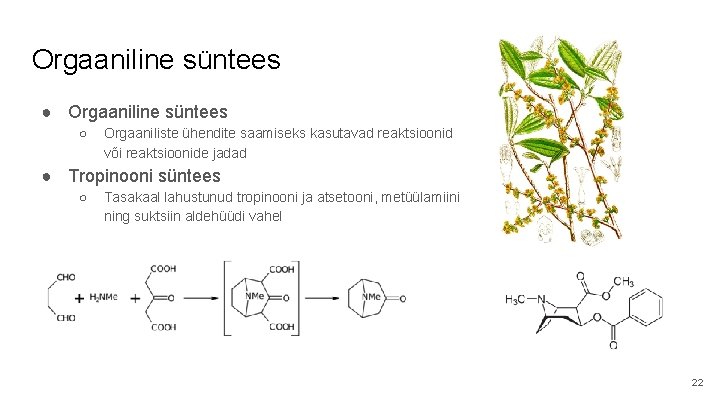
Orgaaniline süntees ● Orgaaniline süntees ○ Orgaaniliste ühendite saamiseks kasutavad reaktsioonid või reaktsioonide jadad ● Tropinooni süntees ○ Tasakaal lahustunud tropinooni ja atsetooni, metüülamiini ning suktsiin aldehüüdi vahel 22

Tasakaal ja kord ● Kord ei ole alati tasakaalu seisund 23

Tasakaal on keskne ● Tasakaal on keemias keskne mõiste ● Keemilised süsteemid üritavad alati jõuda tasakaaluni 24

Tänan tähelepanu eest! 25
 Miste of misde
Miste of misde Forme di governo miste
Forme di governo miste Průměrná cena dřeva na odvozním místě 2021
Průměrná cena dřeva na odvozním místě 2021 Prověrka výpovědi na místě
Prověrka výpovědi na místě Soojusliku tasakaalu võrrand
Soojusliku tasakaalu võrrand Tootjad
Tootjad Estonia pisa
Estonia pisa Toomas danneberg
Toomas danneberg Toomas jürgenstein
Toomas jürgenstein Patogenees
Patogenees Gailiti romaanid
Gailiti romaanid Toomas lepikult
Toomas lepikult Toomas laigna
Toomas laigna Toomas toots
Toomas toots Toomas timmusk
Toomas timmusk Toomas saal
Toomas saal Toomas lepikult
Toomas lepikult Toomas kink
Toomas kink Toomas lepik
Toomas lepik Toomas lepikult
Toomas lepikult Toomas lepikult
Toomas lepikult Lairiba internet
Lairiba internet Toomas adson
Toomas adson Toomas rätsep
Toomas rätsep Edl 2019
Edl 2019 Que son los desempeños de aprendizaje
Que son los desempeños de aprendizaje