STATISZTIKUS TERMODINAMIKA ALKALMAZSOK P W Atkins Fizikai kmia

































- Slides: 35

STATISZTIKUS TERMODINAMIKA: ALKALMAZÁSOK • P. W. Atkins: Fizikai kémia II. - Szerkezet (Tankönyvkiadó, Budapest, 2002), 20. fejezet • Keszei Ernő: Bevezetés a kémiai termodinamikába (ELTE egyetemi jegyzet, 2007), 10. fejezet

Statisztikus termodinamika: alkalmazások • A termodinamikát, spektroszkópiát és kvantummechanikát összekötő híd az állapotösszeg. Ha ezt ismerjük, akkor • a különféle termodinamikai függvényeket, • a hőkapacitást, • az entrópiát, • az egyensúlyi állandót meghatározhatjuk. • Feladatok: • Termodinamikai függvények meghatározása az állapotösszegből. • Állapotösszeg meghatározása spektroszkópiai adatokból. q

Termodinamikai függvények (4. előadás) • Belső energia: • Entrópia: • Független részecskék tárgyalásakor q és Q között összefüggés van: Megkülönböztethető Megkülönböztethetetlen részecskék • Minden további termodinamikai függvény is kapcsolatban van U-val vagy S-sel, így ezek alakja is meghatározható.

Termodinamikai függvények TD Levezetés Kanonikus függvény alapja állapotösszeggel kifejezve Előző (4. ) előadás Független, megkülönböztethetetlen Független, megkülönböztethető

Állapotösszeg • Adott molekula energiája a különböző mozgásfajtákból származó energiák összege: ahol T a haladó mozgást (transzlációt), R a forgást (rotációt), V a rezgést (vibrációt), E az elektronoktól származó hozzájárulást jelöli. • Mivel az egyes mozgásfajták (a T kivételével) nem teljesen függetlenek egymástól, ez az elkülönítés csak közelítő jellegű. • Az állapotösszeg ez alapján szintén tényezőkre bontható: • Ez azt jelenti, hogy az egyes hozzájárulásokat külön-külön vizsgálhatjuk meg.

Állapotösszeg a) A haladó mozgás hozzájárulása • A V tértfogatú edénybe zárt, m tömegű részecske haladó mozgásának állapotösszege (4. előadás): és • T → ∞ esetében q. T → ∞, mert végtelen sok állapot válik elérhetővé.

Állapotösszeg b) A forgási hozzájárulás • Aszimmetrikus lineáris molekulák forgására (pl. HCl): és Lineáris molekulák forgási energiaszintjei. Mindegyik J szinthez 2 J + 1 degenerált állapot tartozik. ahol B a forgási álladó, J az impulzusmomentum nagysága. • A q. R mennyiséget közvetlenül úgy adhatjuk meg, hogy a kísérletileg meghatározott E(J) energiaszinteket az egyenletbe helyettesítjük és a sort numerikusan összegezzük.

Állapotösszeg b) A forgási hozzájárulás • Aszimmetrikus lineáris molekulák forgására (pl. HCl): és Lineáris molekulák forgási energiaszintjei. Mindegyik J szinthez 2 J + 1 degenerált állapot tartozik. ahol B a forgási álladó, J az impulzusmomentum nagysága. • Szobahőmérsékleten k. T/hc ≈ 200 cm– 1. A molekulák jó részénél sok forgási energiaszint van betöltve, mert a forgási állandó kis érték: B/cm– 1 CO 2 I 2 HI HCl (H 2) 0, 39 0, 037 6, 5 10, 6 (60, 9) • Ilyen esetekben az összegzés integrálással helyettesíthető:

Állapotösszeg b) A forgási hozzájárulás • Aszimmetrikus lineáris molekulák forgására: • Szimmetrikus lineáris molekulákra (mivel a 180°-os elforgatás eredményeként a molekula az eredetitől megkülönböztethetetlen állapotba kerül: ahol σ a szimmetriaszám (a vizsgált molekula meg nem különböztethető orientációinak a száma).

Állapotösszeg b) A forgási hozzájárulás • Az A, B, C forgási állandókkal bíró nemlineáris molekuláknál: • Általános képlet nemlineáris molekuláknál: ahol σ a szimmetriaszám (a vizsgált molekula meg nem különböztethető orientációinak a száma). σ CO 2 C 2 H 2 O NH 3 CH 4 C 6 H 6 2 2 2 3 12 12

Állapotösszeg c) A rezgési hozzájárulás • Egy molekula rezgési állapotösszegének a meghatározásához a definícióban szereplő exponenciális függvényekbe be kell írni a mért rezgési energiaszinteket, majd numerikusan összegezni. • Ha a többatomos molekula anharmonicitása kicsiny, akkor a normálrezgések egymástól függetlenek, és minden rezgésnek saját állapotösszege van. A teljes rezgési állapotösszeg az egyedi állapotösszegek szorzata: ahol q. V(K) a K-adik normálrezgés állapotösszege, melyet a megfigyelt spektroszkópiai energiaszintek közvetlen összegzésével határozhatunk meg.

Állapotösszeg c) A rezgési hozzájárulás • Nem túl nagy rezgési gerjesztettségnél használhatjuk a harmonikus közelítést, így a rezgési energiaszintek: ahol 0, 1, 2, … • Ha az energiát a zérusponti energiától mérjük, akkor a • Többatomos molekuláknál mindegyik normálrezgésnek ilyen alakú állapotösszege van. adja meg. Az állapotösszeg: Potenciális energia lehetséges értékeket Harmonikus oszcillátor Anharmonikus oszcillátor Kötéstávolság

Állapotösszeg c) A rezgési hozzájárulás • Sok molekulában a rezgési hullámhossz olyan nagy, hogy βhc > 1. Ezekben az esetekben: Ez azt jelenti, hogy csak a zérusponti energiaszint van számottevően betöltve. • k. T >> hc esetén (azaz magas hőmérsékleten): A sorfejtés érvényességére vonatkozó hőmérsékleti határ: ahol ΘV a rezgési karakterisztikus hőmérséklet. A magas hőmérséklet azt jelenti, hogy T >> ΘV. I 2 F 2 HCl H 2 215 892 2990 4400 309 1280 4300 6330

Állapotösszeg d) Az elektronok hozzájárulása • A gerjesztett elektronállapotok energiái általában messze vannak az alapállapotétól, ezért általában q. E = 1. • Fontos kivétel, amikor az atom vagy molekula elektronburkának alapállapota degenerált és q. E = g. E (a degeneráció foka). Az alkálifém-atomok alapállapotának degenerációja (az elektron kétféle orientációjának megfelelően) 2.

Állapotösszeg d) Az elektronok hozzájárulása • Bizonyos atomoknak és molekuláknak vannak kis energiájú gerjesztett állapotaik. L: pályaimpulzus-momentum S: spinmomentum • A kétszeresen degenerált, alacsonyabb energiájú term betöltési száma nagyobb. • Az elektronhoz rendelhető állapotösszeg: • T = 0 esetén q. E = 2, mert csak az alapállapot elérhető. • 25 °C-on q. E = 3, 1. • Nagyobb hőmérsékleten q. E → 4. NO molekula konfiguráció: [N 2]π1

Állapotösszeg e) A teljes állapotösszeg • A teljes állapotösszeg az egyes hozzájárulások szorzata. Kétatomos molekulák esetén pl. : • Az így nyert teljes állapotösszegek közelítő jellegűek, mert tartalmazzák azt a feltevést, hogy o a forgási szintek egymáshoz közel vannak, o a regzési szintek harmonikusak • A közelítés elkerülhető, ha az egyes összegeket közvetlenül spektroszkópiai adatokból határozzuk meg.

Statisztikus termodinamika alkalmazása • A molekulák energiaszintjeinek az ismeretében most már képesek vagyunk arra, hogy bármelyik termodinamikai mennyiséget meghatározzuk. • Négy mennyiség esetében részletesen megnézzük, hogyan is kell elvégezni a számolást: • Átlagos energia • Hőkapacitás • Zéruspont-entrópia • Egyensúlyi állandó q

Statisztikus termodinamika alkalmazása a) Átlagos energia • A különféle mozgásfajták átlagos energiájának ismerete általában hasznos. • Ha az állapotösszeget sikerült az egyes mozgásfajtákhoz tartozó hozzájárulásokra bontanunk, akkor: • Mivel a belső energia az egyes mozgásfajták átlagos energiája, így: ahol és M = T, R, V és E.

Statisztikus termodinamika alkalmazása a) Átlagos energia – haladó mozgás • Vizsgáljuk meg az X hosszúságú 1 D rendszert, melyre q. T = X/Λ. Ekkor: és • 3 D esetében: • Ez egyezésben van a klasszikus ekvipartíciós tétellel, tehát hogy minden négyzetes tag -vel járul hozzá a teljes energiához, az átlagos energia pedig független az edény méretétől. Ennek a TD megfelelője az, hogy a tökéletes gáz belső energiája független a térfogattól.

Statisztikus termodinamika alkalmazása a) Átlagos energia – forgás • A lineáris molekulák átlagos forgási energiája: • Alacsony hőmérsékleten: • Magas hőmérsékleten: • Ez ismét összhangban van az ekvipartíciós tétellel, mivel egy lineáris molekula 2 tengely körül tud forogni.

Statisztikus termodinamika alkalmazása a) Átlagos energia – rezgés • A rezgési állapotösszeget a következő egyenlet adja meg: • Mivel q. V független a térfogattól, így: és • Ha a rezgés zérusponti energiája is lényeges, akkor a jobb oldalhoz energiát kell hozzáadni. • Magas hőmérsékleten: és • Ekvipartíció: a rezgési energia egy 1 D mozgási és egy helyzeti tag összege, ezért a szabadsági fok 2.

Statisztikus termodinamika alkalmazása b) Hőkapacitás • Az állandó térfogathoz tartozó hőkapacitás: • Ugyanakkor: • Mivel a tökéletes gáz belső energiája különböző hozzájárulások összege, így a hőkapacitás is: • Az egyes mozgásfajták hozzájárulása:

Statisztikus termodinamika alkalmazása b) Hőkapacitás – egyedi hozzájárulások • Transzlációs járulék gázokban (ha a hőmérséklet nagy, azaz meghaladja a kondenzációs hőmérsékletet): • Egyatomos gáznál csak haladó mozgás lehetséges: a He mólhője valóban ennyi igen széles hőmérséklettartományban (kb. 2000 K). • Tökéletes gázra: • ezért egyatomos tökéletes gázra: és

Statisztikus termodinamika alkalmazása b) Hőkapacitás – egyedi hozzájárulások • Ha a hőmérséklet elegendően nagy ahhoz, hogy a lineáris molekula forgása jelentősen gerjesztődjön, akkor: • Nemlineáris molekulákra: • Nagyon kis hőmérsékleten csak a legalacsonyabban fekvő forgási állapot van betöltve, és a forgás nem járul hozzá a hőkapacitáshoz:

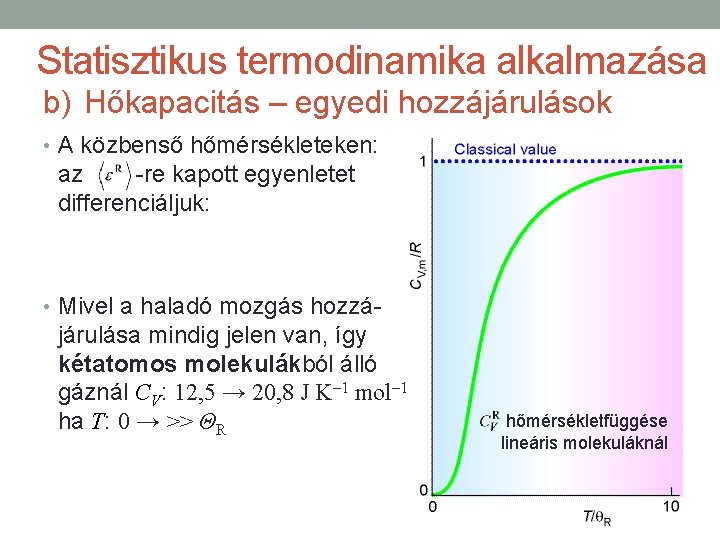
Statisztikus termodinamika alkalmazása b) Hőkapacitás – egyedi hozzájárulások • A közbenső hőmérsékleteken: az -re kapott egyenletet differenciáljuk: • Mivel a haladó mozgás hozzá- járulása mindig jelen van, így kétatomos molekulákból álló gáznál CV: 12, 5 → 20, 8 J K– 1 mol– 1 ha T: 0 → >> ΘR hőmérsékletfüggése lineáris molekuláknál

Statisztikus termodinamika alkalmazása b) Hőkapacitás – egyedi hozzájárulások • A molekularezgések csak akkor járulnak hozzá a hőkapacitáshoz, ha a hőmérséklet elég magas ahhoz, hogy számottevően gerjessze azokat. • Az ekvipartíciónak megfelelő átlagos energia modusonként k. T, így egy modus maximálisan R-rel járul hozzá a moláris hőkapacitáshoz. • Nagyon szokatlan az olyan eset, amikor a rezgések gerjesztési foka az ekvipartíció tételének érvényességéhez elegendő. Helyesebb a teljes formulát használni:

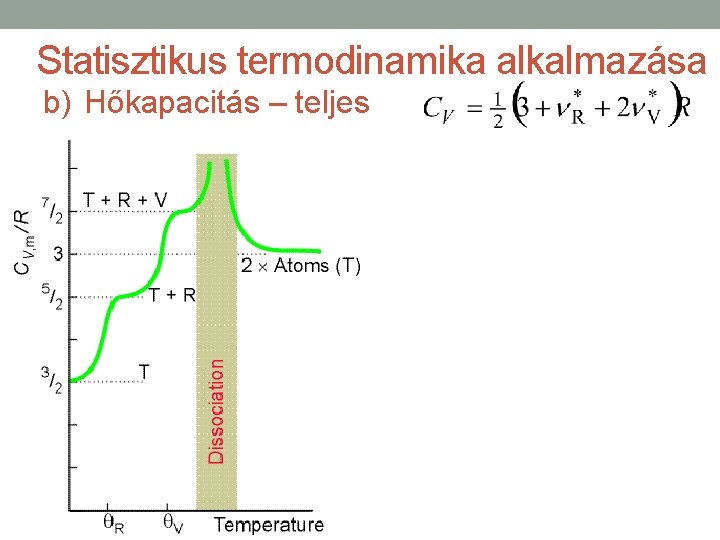
Statisztikus termodinamika alkalmazása b) Hőkapacitás – teljes • A teljes hőkapacitást minden hozzájárulásra kiterjedő összegzéssel kapjuk. • Ha az ekvipartíció tétele érvényes, akkor a hőkapacitást az aktív modusok figyelembe vételével határozhatjuk meg. • Gázokban mindig aktív mindhárom transzlációs modus ( ). • Ha az aktív forgási modusok száma , akkor a forgási hozzájárulás. Szokásos hőmérsékleteken egyatomos gázokra , lineáris molekulákra , nemlineáris molekulákra. • Ha a hőmérséklet elegendően magas, akkor számú rezgési modus is aktívvá válik, és a rezgési hozzájárulás értéke. A legtöbb esetben.

Statisztikus termodinamika alkalmazása b) Hőkapacitás – teljes

Statisztikus termodinamika alkalmazása c) Zéruspont-entrópia • Az entrópia értéke kiszámolható spektroszkópiai adatokból, de más kísérletekből is meghatározható. • Sok esetben jó egyezést tapasztalunk, néha azonban a spektroszkópiai adatokból számolt S nagyobb. Ennek oka: • nem vettünk figyelembe valamilyen fázisátmenetet, • még 0 K-en is van bizonyos mérvű rendezetlenség. • A 0 K-en meglévő entrópiát zéruspont-entrópiának vagy maradékentrópiának nevezzük. • Kristályban két különböző lehetséges orientáció. • N db. CO molekula esetén 2 N db. elrendeződés.

Statisztikus termodinamika alkalmazása c) Zéruspont-entrópia • Az entrópia értéke kiszámolható spektroszkópiai adatokból, de más kísérletekből is meghatározható. • Sok esetben jó egyezést tapasztalunk, néha azonban a spektroszkópiai adatokból számolt S nagyobb. Ennek oka: • nem vettünk figyelembe valamilyen fázisátmenetet, • még 0 K-en is van bizonyos mérvű rendezetlenség. • A 0 K-en meglévő entrópiát zéruspont-entrópiának vagy maradékentrópiának nevezzük. • Kristályban egy O-t négy H vesz körül, 2 kovalens, 2 hidrogénkötéssel.

Statisztikus termodinamika alkalmazása d) Egyensúlyi állandó • A független molekulákból álló rendszer szabadentalpiája: • A standard-szabadentalpia és az egyensúlyi állandó (Kp) kapcsolata: • Az egyensúlyi állandó meghatározásánál ezt a két egyenletet kell kombinálni. • Az egyes komponensek standard moláris szabadentalpiájára van szükségünk. Ehhez ismerni kell a moláris állapotösszeget po = 1 bar nyomáson ( ). Mivel csak a transzlációs állapotösszeg függ a nyomástól:

Statisztikus termodinamika alkalmazása d) Egyensúlyi állandó • Vizsgáljuk a következő reakciót: • A reakció standard moláris szabadentalpiája: • Tökéletes gáznál G(0) = U(0), így: • ΔUo(0) a reaktánsok és termékek sztöchiometriai együtthatókkal súlyozott moláris zérusponti energiájának a különbsége, amire rendszerint a ΔE 0 jelölést használjuk, így: • Tehát:

Statisztikus termodinamika alkalmazása d) Egyensúlyi állandó • Tehát a kapcsolat az egyensúlyi állandó és az állapotösszeg között:

Statisztikus termodinamika alkalmazása d) Egyensúlyi állandó • Tehát a kapcsolat az egyensúlyi állandó és az állapotösszeg között: 2 • A direkt reakció: • Az egyensúlyi állandó: • Az állapotösszeg bevezetésével: ahol ΔE 0 = 2 U(X) – U(X 2) = D(X 2) (a molekula disszociációs energiája).

Statisztikus termodinamika alkalmazása d) Egyensúlyi állandó • Tehát a kapcsolat az egyensúlyi állandó és az állapotösszeg között: 2 • Az atomok moláris állapotösszege csak a haladó mozgástól és az elektronállapotok degenerációjától függ, tehát: ahol • Kétatomos molekuláknál már forgás és rezgés is van, így:
 Atkins fizikai kémia
Atkins fizikai kémia Fizikai evolúció
Fizikai evolúció A fizika ága rejtvény
A fizika ága rejtvény Fizikai felmérő rendőrség 2021
Fizikai felmérő rendőrség 2021 érvelés minta
érvelés minta Fizikai változás fogalma
Fizikai változás fogalma Repülés fizikai alapjai
Repülés fizikai alapjai Fizikai jelek
Fizikai jelek Fizikai evolúció
Fizikai evolúció Pascal fizikus
Pascal fizikus Katonai fizikai alkalmassági ponttáblázat 2021
Katonai fizikai alkalmassági ponttáblázat 2021 Library.uncc.edu
Library.uncc.edu Atkins and murphy reflective model
Atkins and murphy reflective model South beach phase 1 food list
South beach phase 1 food list Atkins lifestyle
Atkins lifestyle Dz atkins
Dz atkins Atkins ford winder
Atkins ford winder Types of ergonomics
Types of ergonomics Nichole atkins
Nichole atkins Atkins or fadkins case study answers
Atkins or fadkins case study answers Polidiszperzitás
Polidiszperzitás Termodinamika
Termodinamika Hukum pertama termodinamika
Hukum pertama termodinamika Proses spontan termodinamika
Proses spontan termodinamika Proses termodinamika adalah
Proses termodinamika adalah Termodinamika 2
Termodinamika 2 Hemijska termodinamika
Hemijska termodinamika Aplikasi hukum termodinamika 2
Aplikasi hukum termodinamika 2 Pengertian hukum termodinamika 2
Pengertian hukum termodinamika 2 Termodinamika főtételei
Termodinamika főtételei Hukum termodinamika disebut juga sebagai
Hukum termodinamika disebut juga sebagai Thermodinamika
Thermodinamika Hukum termodinamik
Hukum termodinamik Termodinamika
Termodinamika Termodinamika ii
Termodinamika ii Pengertian hukum ke nol termodinamika
Pengertian hukum ke nol termodinamika