BAB 1 KONSEP DASAR TERMODINAMIKA adalah satu sains

BAB 1 KONSEP DASAR

TERMODINAMIKA adalah satu sains yang mempelajari tentang penyimpanan (storage), pengubahan (transformation), dan pemindahan (transfer) energi
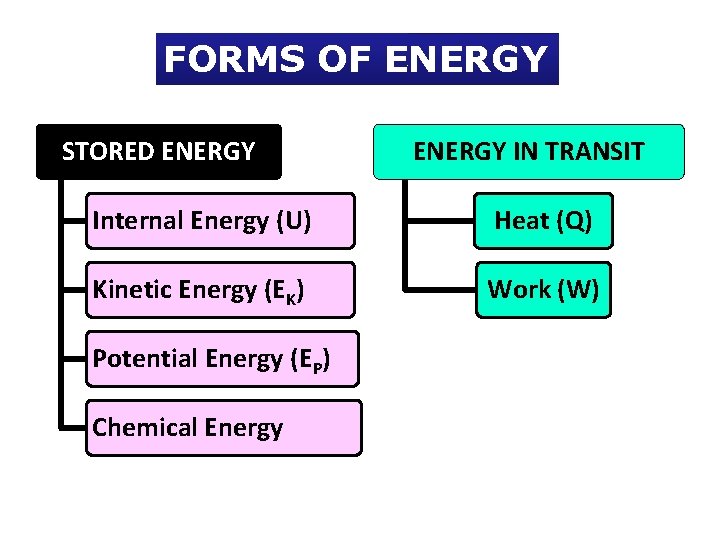
FORMS OF ENERGY STORED ENERGY IN TRANSIT Internal Energy (U) Heat (Q) Kinetic Energy (EK) Work (W) Potential Energy (EP) Chemical Energy

Dalam termodinamika, kita akan menyusun persamaan matematis yang menghubungkan transformasi dan transfer energi dengan variabel makroskopis, seperti temperatur, volume, dan tekanan, yang menggambarkan sistem termodinamis. Hukum-hukum Termodinamika

Hukum-hukum Termodiamika: 1. Hukum ke-0 : mendefinisikan temperatur (T) 2. Hukuj ke-1 : mendefinisikan energi (U) 3. Hukum ke-2 : mendefinisikan entropy (S) 4. Hukum ke-3 : mendefinisikan nilai S pada 0 K
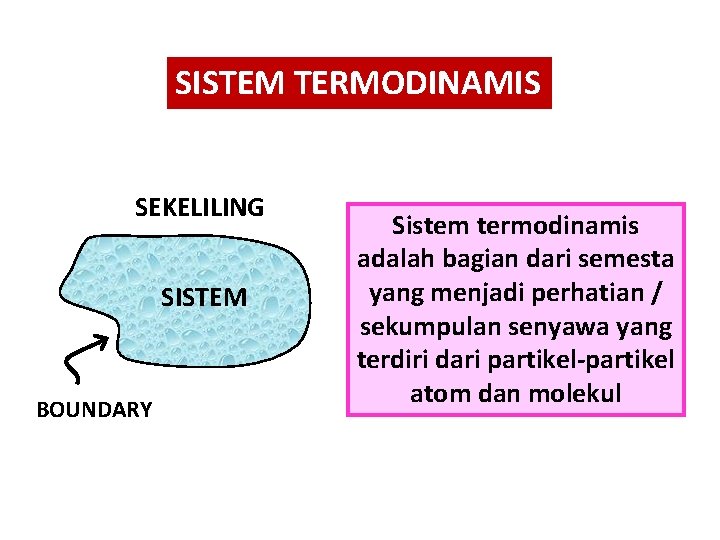
SISTEM TERMODINAMIS SEKELILING SISTEM BOUNDARY Sistem termodinamis adalah bagian dari semesta yang menjadi perhatian / sekumpulan senyawa yang terdiri dari partikel-partikel atom dan molekul
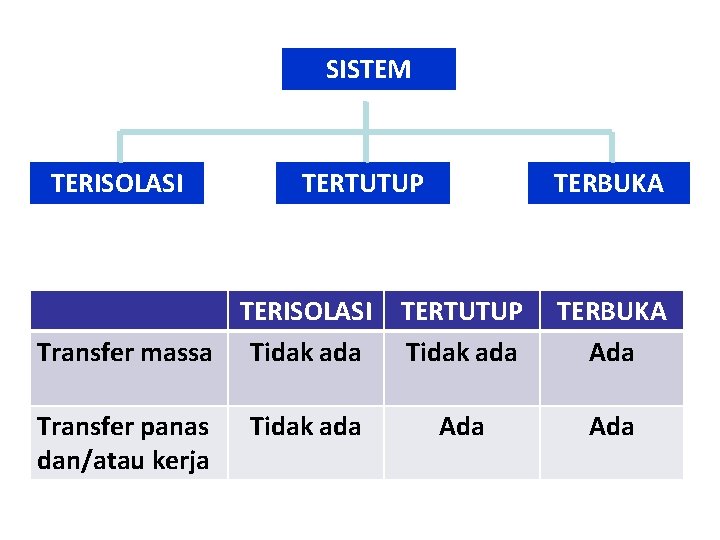
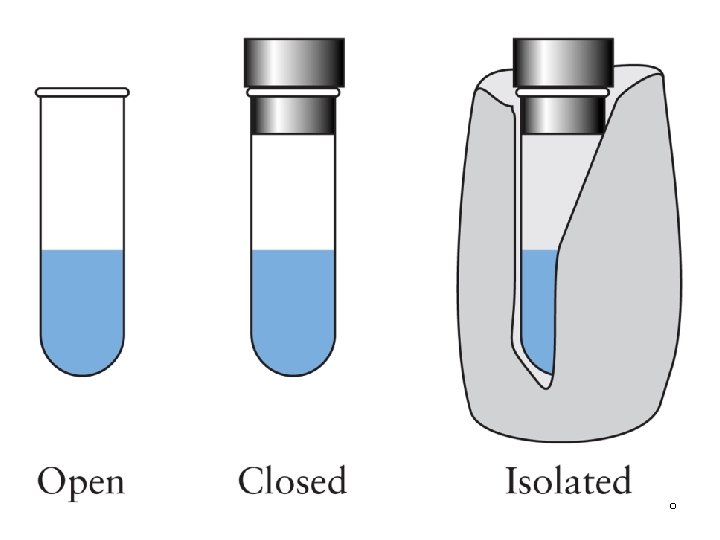
SISTEM TERISOLASI TERTUTUP TERISOLASI Transfer massa Tidak ada Transfer panas dan/atau kerja Tidak ada TERBUKA TERTUTUP Tidak ada TERBUKA Ada Ada
8
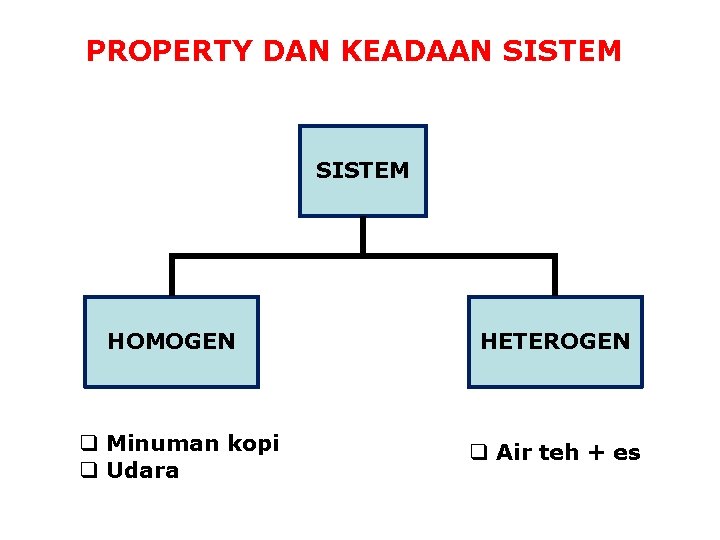
PROPERTY DAN KEADAAN SISTEM HOMOGEN q Minuman kopi q Udara HETEROGEN q Air teh + es

Fasa adalah sejumlah material yang o Memiliki komposisi seragam/homogen o Dapat dibedakan secara fisik dengan fasa lainnya o Dapat dipisahkan secara mekanik dari fasa lainnya Contoh sistem satu fasa ( = 1): o Air murni o Udara (N 2, O 2, Ar, CO 2) Contoh sistem 2 fasa: o Es dalam air o Susu (butiran lemak dalam larutan air)

11

Property adalah besaran yang digunakan untuk meng -gambarkan suatu sistem pada keadaan keseimbangan. State/keadaan suatu sistem adalah kondisi dari sistem tersebut sebagaimana dinyatakan dengan nilai dari propertynya pada suatu saat tertentu. Property yang umum digunakan untuk menggambarkan suatu sistem adalah tekanan (P), temperatur (T), volume (V), internal energy (U), enthalpy (H), entropy (S), jumlah mol (ni), massa (m), kecepatan (u), dan posisi.
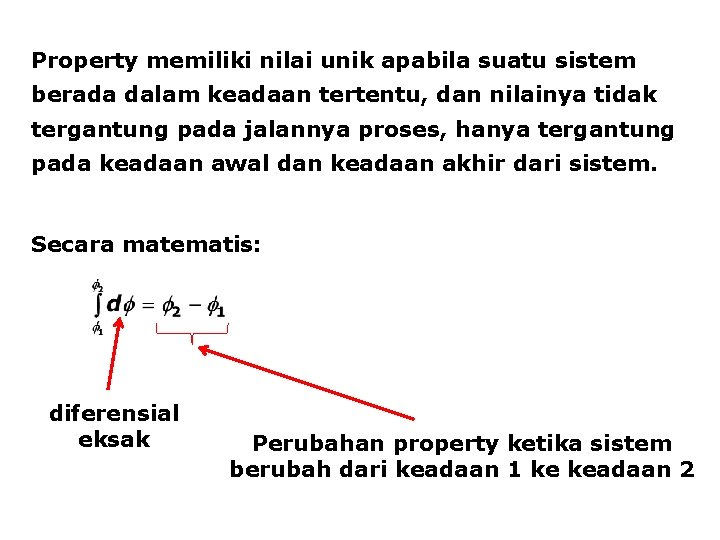
Property memiliki nilai unik apabila suatu sistem berada dalam keadaan tertentu, dan nilainya tidak tergantung pada jalannya proses, hanya tergantung pada keadaan awal dan keadaan akhir dari sistem. Secara matematis: diferensial eksak Perubahan property ketika sistem berubah dari keadaan 1 ke keadaan 2
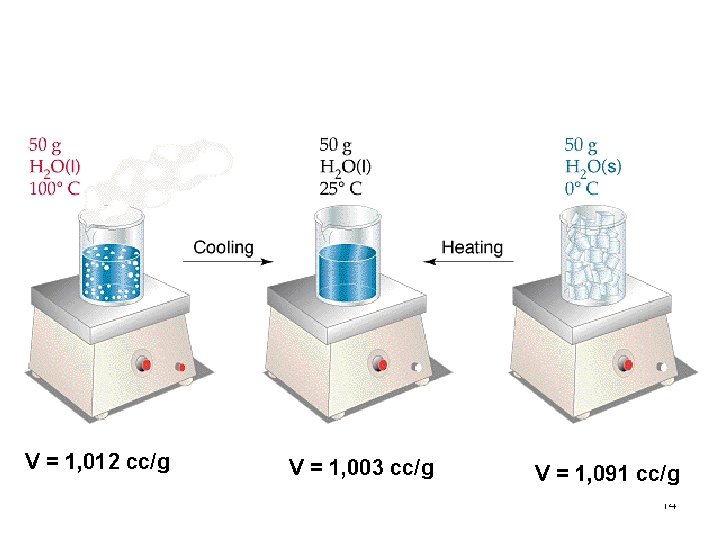
V = 1, 012 cc/g V = 1, 003 cc/g V = 1, 091 cc/g 14
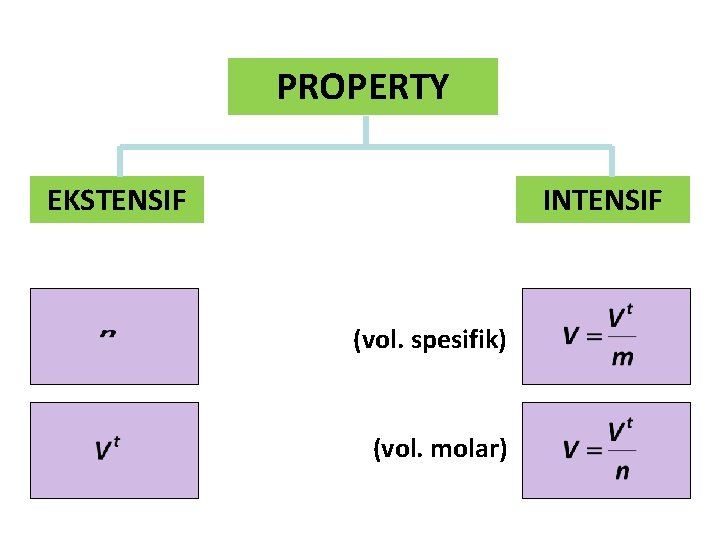
PROPERTY EKSTENSIF INTENSIF (vol. spesifik) (vol. molar)
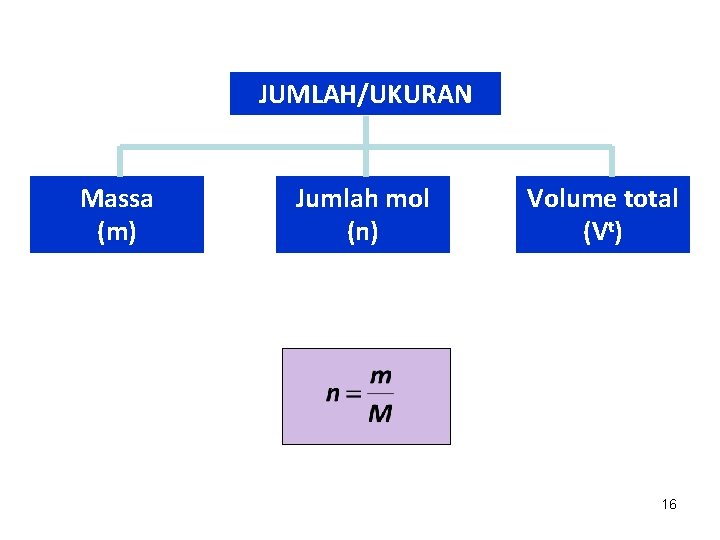
JUMLAH/UKURAN Massa (m) Jumlah mol (n) Volume total (Vt) 16

KESEIMBANGAN TERMODINAMIK: PROSES Keseimbangan adalah suatu keadaan yang statis, tidak ada perubahan, bahkan tidak ada kecenderungan untuk berubah. Suatu sistem berada dalam keseimbangan termodinamik apabila property-nya (T dan P) konstan dari satu titik ke titik lainnya dan tidak ada kecenderungan untuk berubah dengan waktu.

Apabila temperatur sebagian boundary dari sistem tiba-tiba naik, maka akan terjadi redistribusi spontan sampai semua bagian sistem memiliki temperatur yang sama. Ketika suatu sistem berubah dari satu keadaan keseimbangan ke keadaan keseimbangan lainnya, maka lintasan yang dilalui sistem tersebut dinamakan proses.

Jika dalam perjalanannya dari satu keadaan ke keadaan lainnya, sistem melewati keadaan yang hanya sedikit sekali (infinitisimal) menyimpang dari keseimbangan, maka dikatakan bahwa sistem mengalami proses quasiequilibrium, dan setiap keadaan dalam tahapan proses tersebut dapat dianggap sebagai keadaan keseimbangan. Proses kompresi dan ekspansi gas dalam internal combustion engine dapat didekati dengan proses quasiequilibrium. 19
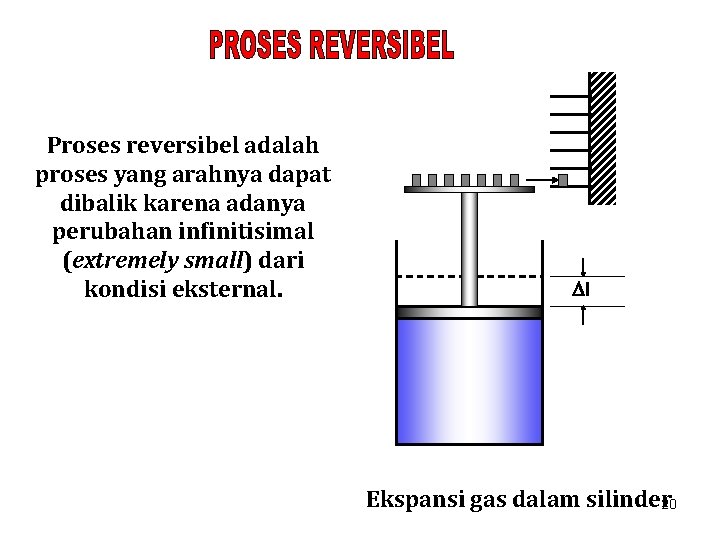
Proses reversibel adalah proses yang arahnya dapat dibalik karena adanya perubahan infinitisimal (extremely small) dari kondisi eksternal. l Ekspansi gas dalam silinder 20
21

RESUME: PROSES REVERSIBEL • Tanpa friksi • Perubahannya dari keadaan keseimbangan adalah kecil sekali (infinitesimal) • Melewati serangkaian keadaan keseimbangan • Disebabkan oleh ketidakseimbangan gaya yang besarnya infinitesimal • Arahnya dapat diubah di sebarang titik oleh adanya perubahan eksternal yang besarnya infinitesimal • Jika arahnya dibalik, maka akan melewati jalur semula dan akan kembali ke keadaan sistem dan sekeliling mula-mula.
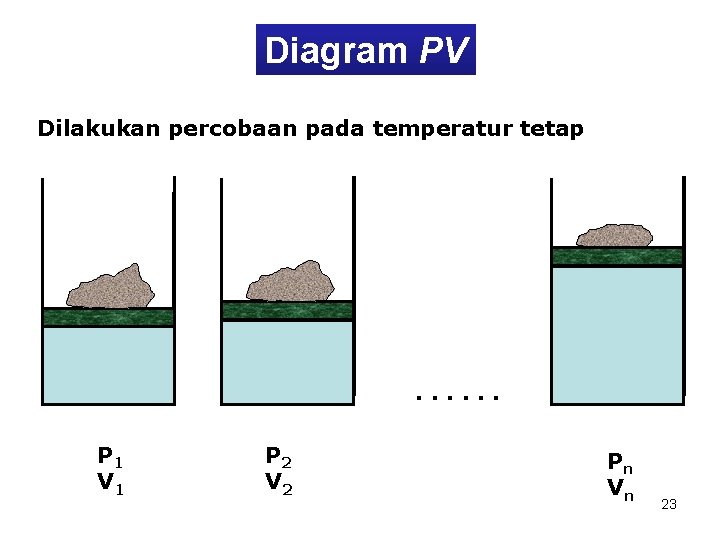
Diagram PV Dilakukan percobaan pada temperatur tetap . . . P 1 V 1 P 2 V 2 Pn Vn 23
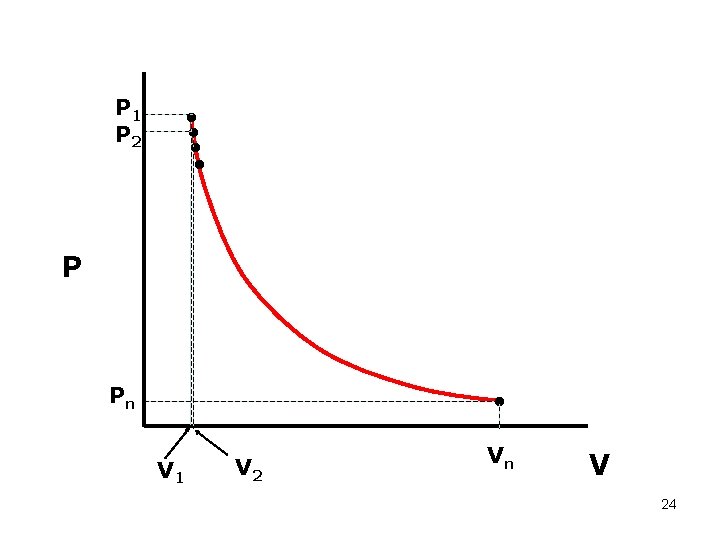
P 1 P 2 • • P Pn • V 1 V 2 Vn V 24
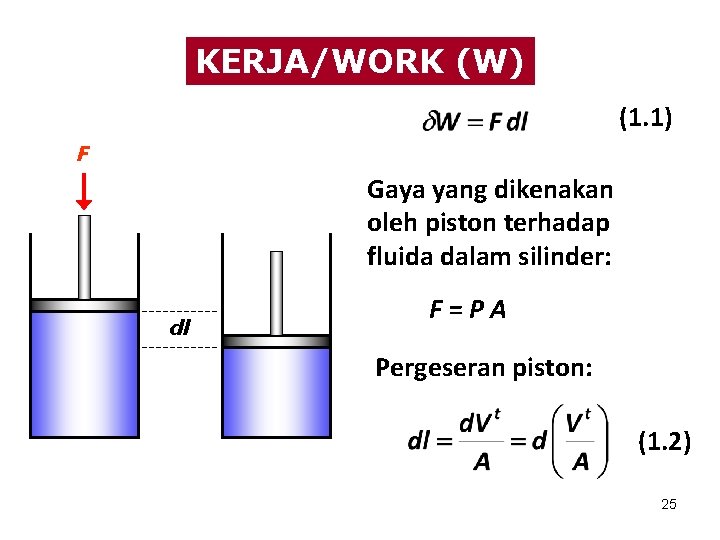
KERJA/WORK (W) (1. 1) F Gaya yang dikenakan oleh piston terhadap fluida dalam silinder: dl F=PA Pergeseran piston: (1. 2) 25
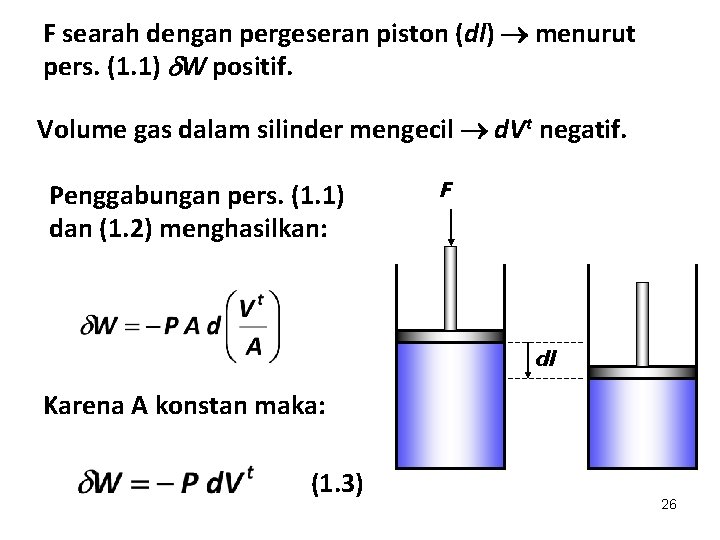
F searah dengan pergeseran piston (dl) menurut pers. (1. 1) W positif. Volume gas dalam silinder mengecil d. Vt negatif. Penggabungan pers. (1. 1) dan (1. 2) menghasilkan: F dl Karena A konstan maka: (1. 3) 26
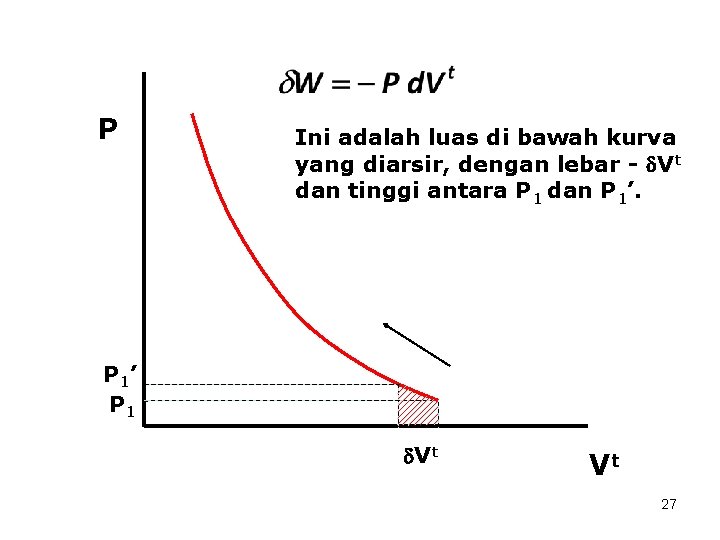
P Ini adalah luas di bawah kurva yang diarsir, dengan lebar - Vt dan tinggi antara P 1 dan P 1’ P 1 Vt Vt 27
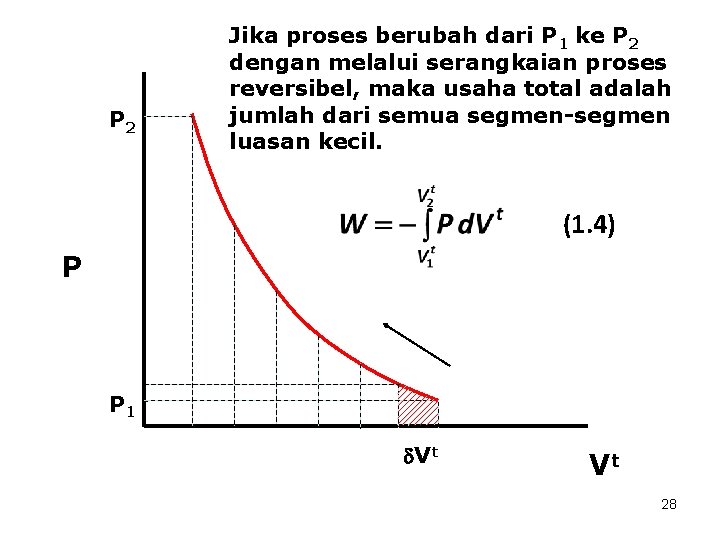
P 2 Jika proses berubah dari P 1 ke P 2 dengan melalui serangkaian proses reversibel, maka usaha total adalah jumlah dari semua segmen-segmen luasan kecil. (1. 4) P P 1 Vt Vt 28
PANAS (HEAT) 29
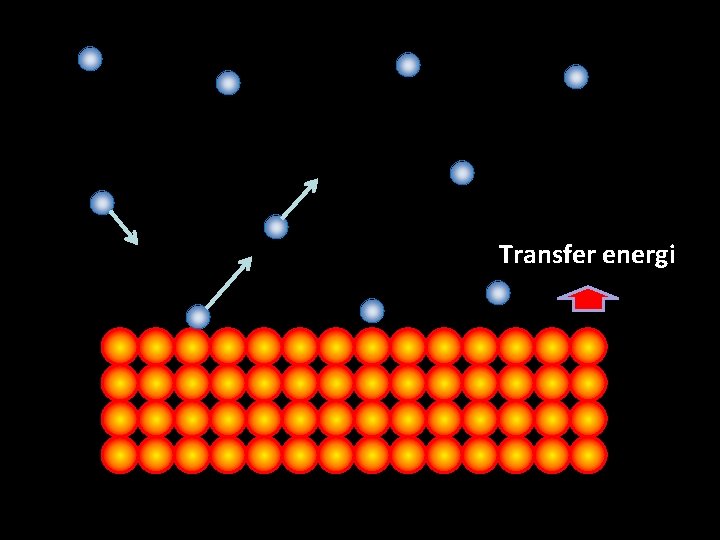
Transfer energi 30 30
Energi ditransfer dalam bentuk kerja: tumbukan antar partikel Secara makroskopis tak teramati Harus ada satu besaran makroskopis yang mewakili transfer energi dalam skala mikroskopis TEMPERATUR 31
- Slides: 31