SICSI VIII Ciclo A A 20082009 SPETTROFOTOMETRIA Corso













- Slides: 27

SICSI VIII Ciclo A. A. 2008/2009 SPETTROFOTOMETRIA Corso di Laboratorio di Chimica Analitica Prof. S. Andini

Spettrofotometria ØIl termine spettrofotometria designa lo studio dell’assorbimento di radiazioni elettromagnetiche da parte della materia. Si tratta di un termine più specifico del termine generale spettroscopia elettromagnetica, in quanto la spettrofotometria si occupa di radiazioni che vanno dal vicino ultravioletto al vicino infrarosso e di luce visibile.

Destinatari ØAlunni iscritti al III anno di un Istituto Tecnico ad Indirizzo Chimico

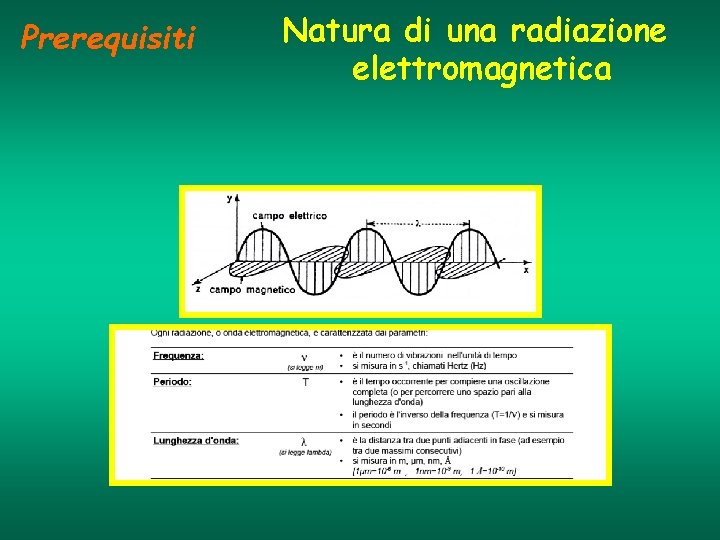
Prerequisiti Natura di una radiazione elettromagnetica

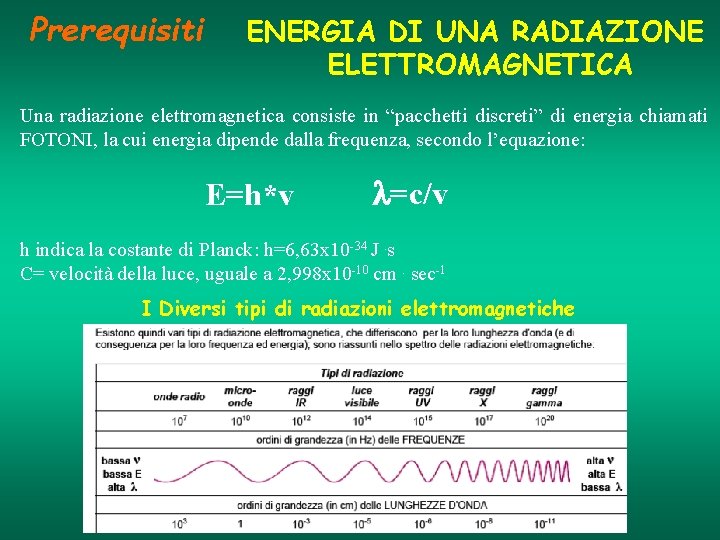
Prerequisiti ENERGIA DI UNA RADIAZIONE ELETTROMAGNETICA Una radiazione elettromagnetica consiste in “pacchetti discreti” di energia chiamati FOTONI, la cui energia dipende dalla frequenza, secondo l’equazione: E=h*v l=c/v h indica la costante di Planck: h=6, 63 x 10 -34 J. s C= velocità della luce, uguale a 2, 998 x 10 -10 cm. sec-1 I Diversi tipi di radiazioni elettromagnetiche

Obiettivi ØRaggiungimeto di un buon livello di conoscenza della spettroscopia UV-Visibile ØComprensione dell’importanza della spettrofotometria come tecnica analitica di determinazione quali-quantitaviva delle diverse sostenze ØApplicazione pratica della legge di Lambert-Beer

Lo Spettro Elettromagnetico ØLo spettro elettromagnetico è costituito dall’ordinata sequenza delle radiazioni secondo la loro lunghezza e frequenza d’onda

Spettri e Colori ØI metodi di analisi spettrochimici sono basati sull’analisi dello spettro elettromagnetico ottenuto da sostanze, esso può essere di emissione o di assorbimento ØUna sostanza investita da luce bianca ci appare colorata perché assorbe alcune radiazioni e ne trasmette delle altre, le quali appariranno con un colore che è la risultane delle radiazioni non assorbite

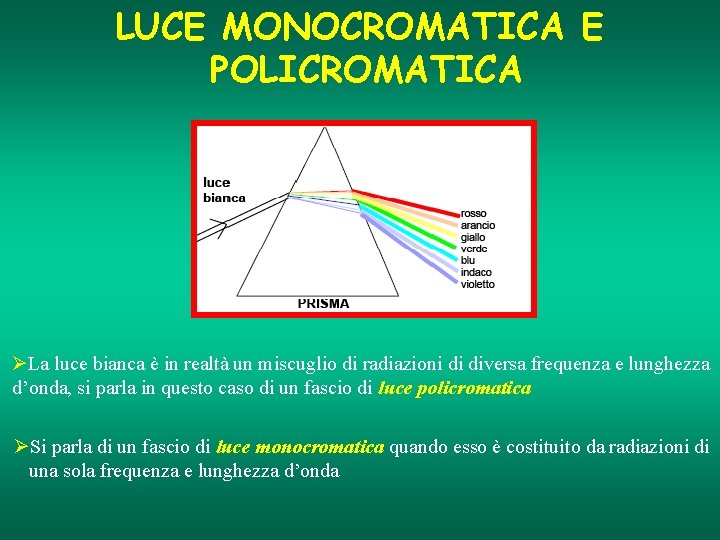
LUCE MONOCROMATICA E POLICROMATICA ØLa luce bianca è in realtà un miscuglio di radiazioni di diversa frequenza e lunghezza d’onda, si parla in questo caso di un fascio di luce policromatica ØSi parla di un fascio di luce monocromatica quando esso è costituito da radiazioni di una sola frequenza e lunghezza d’onda

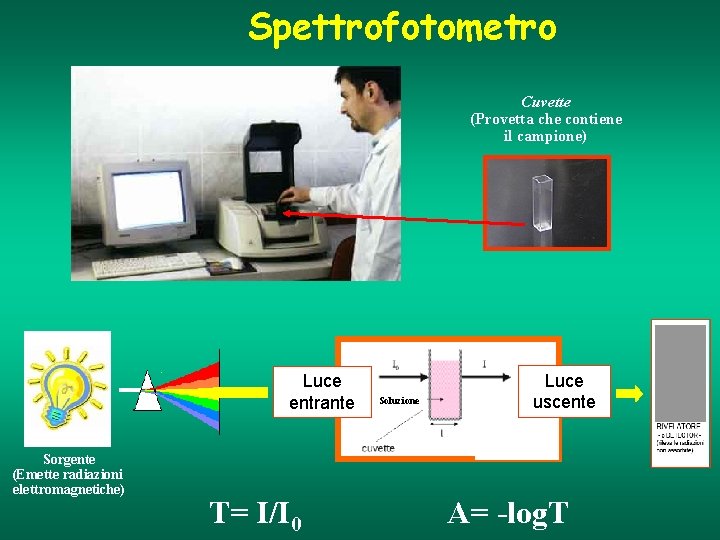
Spettrofotometro Cuvette (Provetta che contiene il campione) Luce entrante Sorgente (Emette radiazioni elettromagnetiche) T= I/I 0 Soluzione Luce uscente A= -log. T

Caratteristiche dell’ assorbimento Ø Assorbimento: processo in cui i fotoni interagendo con atomi e molecole determinano transizioni da uno stato “fondamentale” di energia ad uno “eccitato” M + h → M* Ø Distinguiamo due tipi di assorbimento: – Atomico – Molecolare

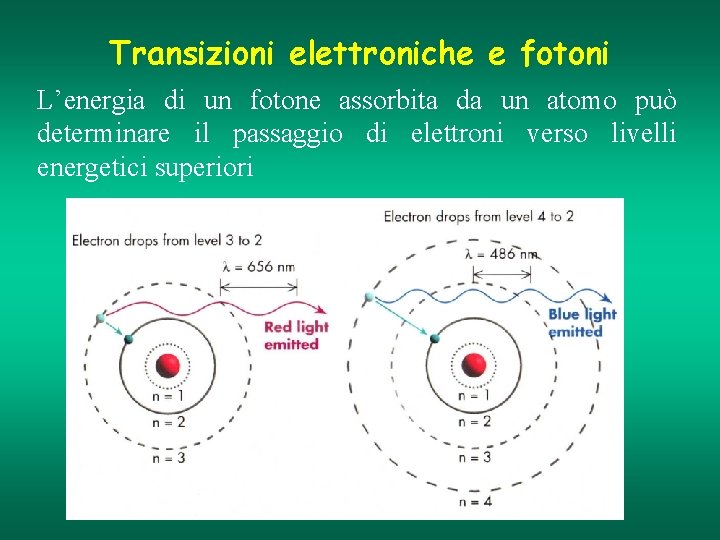
Transizioni elettroniche e fotoni L’energia di un fotone assorbita da un atomo può determinare il passaggio di elettroni verso livelli energetici superiori

Assorbimento Molecolare Ø Più complesso dell’assorbimento atomico perchè in una molecola bisogna considerare: – Transizioni elettroniche – Transizioni vibrazionali – Transizioni rotazionali

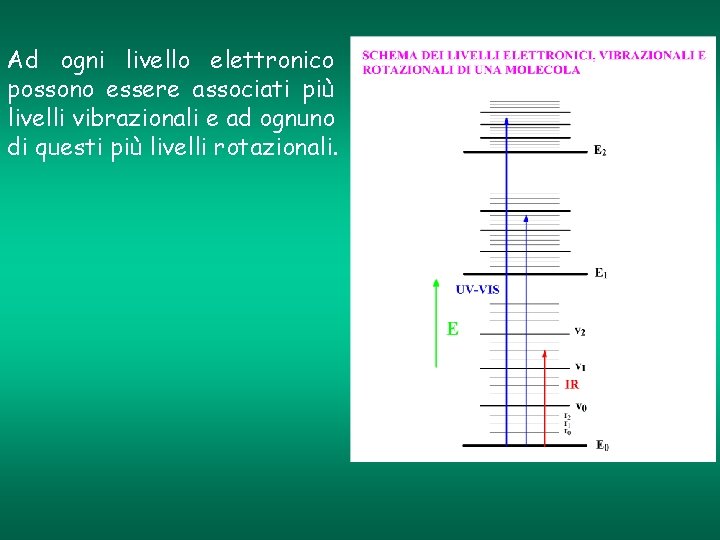
Ad ogni livello elettronico possono essere associati più livelli vibrazionali e ad ognuno di questi più livelli rotazionali.

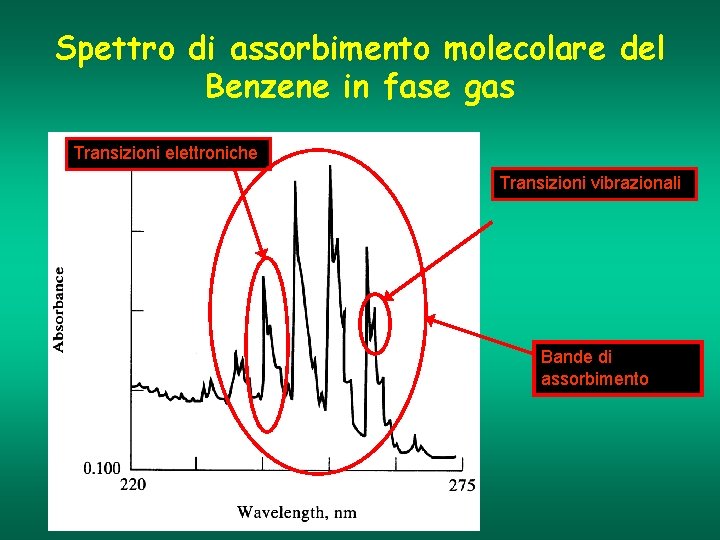
Spettro di assorbimento molecolare del Benzene in fase gas Transizioni elettroniche Transizioni vibrazionali Bande di assorbimento

Legge di Lambert-Beer l l A= ε x l x C C

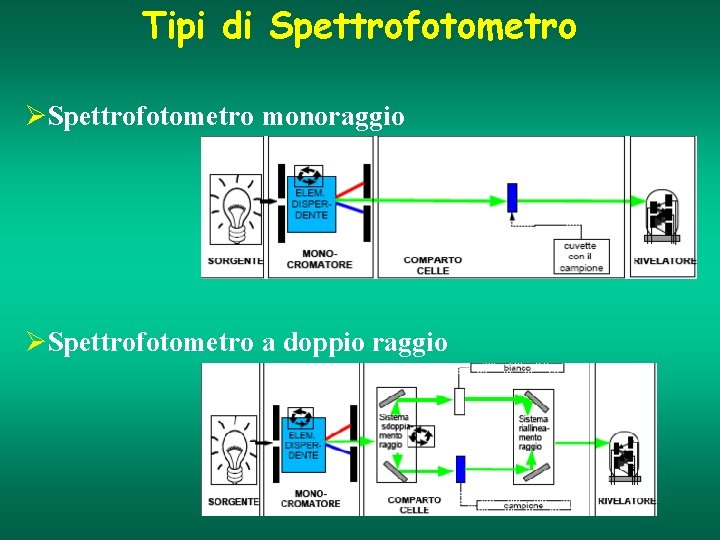
Tipi di Spettrofotometro ØSpettrofotometro monoraggio ØSpettrofotometro a doppio raggio

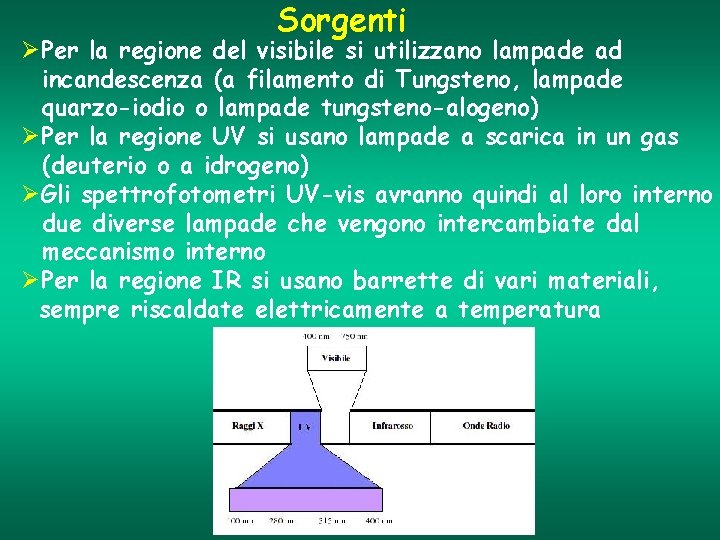
Sorgenti ØPer la regione del visibile si utilizzano lampade ad incandescenza (a filamento di Tungsteno, lampade quarzo-iodio o lampade tungsteno-alogeno) ØPer la regione UV si usano lampade a scarica in un gas (deuterio o a idrogeno) ØGli spettrofotometri UV-vis avranno quindi al loro interno due diverse lampade che vengono intercambiate dal meccanismo interno ØPer la regione IR si usano barrette di vari materiali, sempre riscaldate elettricamente a temperatura

DIVERSI TIPI DI CUVETTE VETRO O PLASTICA (VISIBILE) QUARZO (ULTRAVIOLETTO)

RIVELATORE, RIELABORAZIONE E PRESENTAZIONE DEI DATI ü Il rivelatore è un dispositivo capace di produrre un segnale elettrico che dipende dall'energia delle radiazioni ricevuta. ü Il segnale elettrico (proporzionale all'intensità luminosa) viene opportunamente amplificato ed un amperometro ne rileva l’intensità. ü Tramite un convertitore digitale è possibile ottenere i risultati dell’analisi direttamente su un personal computer che ne elabora i dati.

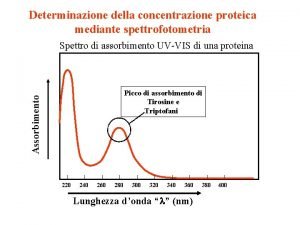
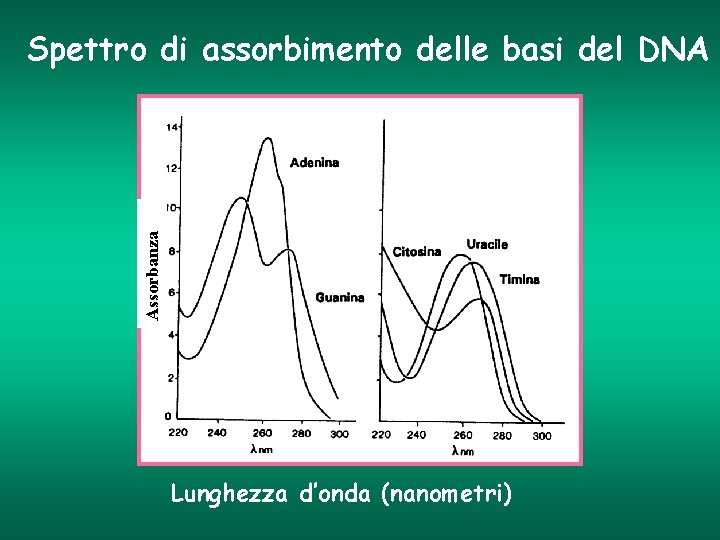
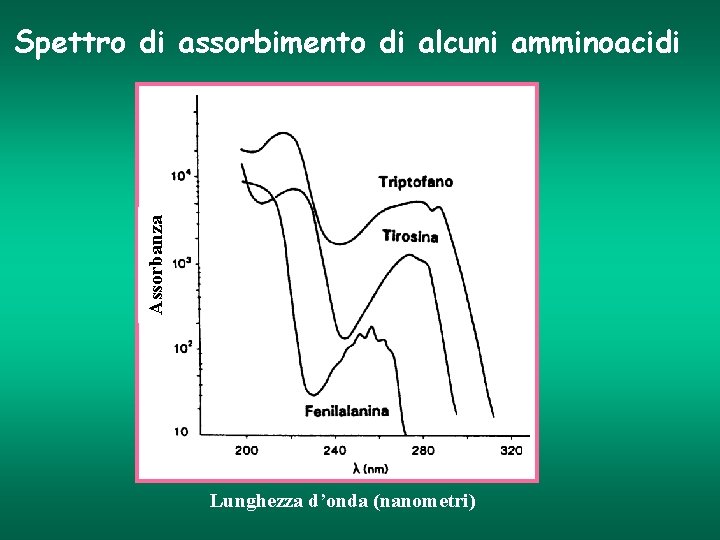
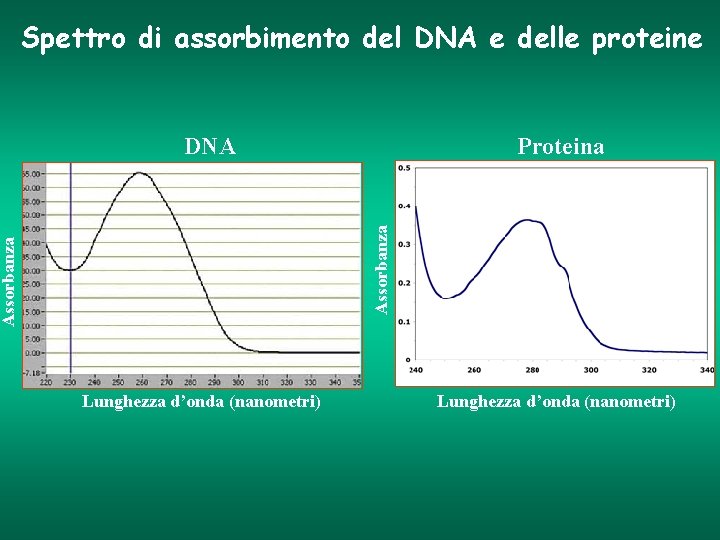
Proprietà di assorbimento delle bio-molecole Molecole con assorbimento nell’UV • Acidi nucleici (DNA, RNA) • Aminoacidi • Proteine Acidi nucleici (DNA, RNA): Assorbimento massimo compreso tra 250 e 270 nm Proteine: I residui amminoacidici Tirosina e Triptofano, contenuti in una proteina, presentano un massimo di assorbimento a 280 nm

Assorbanza Spettro di assorbimento delle basi del DNA Lunghezza d’onda (nanometri)

Assorbanza Spettro di assorbimento di alcuni amminoacidi Lunghezza d’onda (nanometri)

Spettro di assorbimento del DNA e delle proteine Proteina Assorbanza DNA Lunghezza d’onda (nanometri)

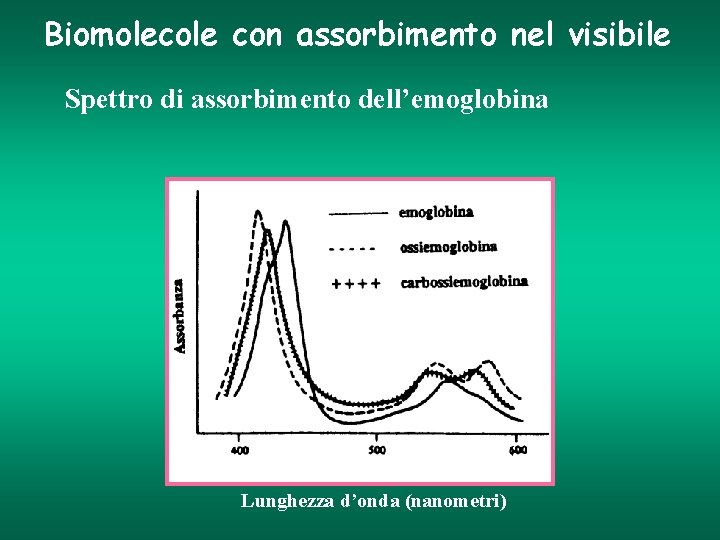
Biomolecole con assorbimento nel visibile Spettro di assorbimento dell’emoglobina Lunghezza d’onda (nanometri)

Determinazione della Concentrazione della Sostanza in Esame METODO DIRETTO l A= ε x l x C C= A/ (ε x l) ε = A 0/(l x C 0) METODO DELLA RETTA DI LAVORO

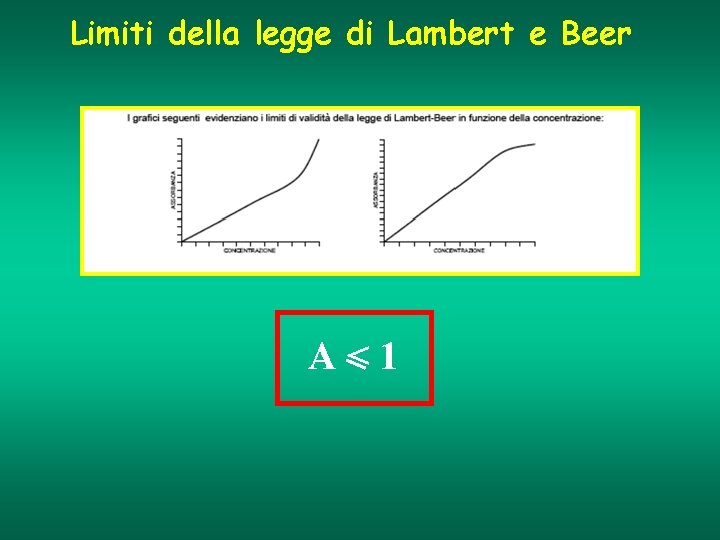
Limiti della legge di Lambert e Beer A<1
 Atomizzatore a fiamma
Atomizzatore a fiamma Spettrofotometria
Spettrofotometria Viii domingo tiempo ordinario ciclo c
Viii domingo tiempo ordinario ciclo c Domingo xviii tiempo ordinario ciclo c
Domingo xviii tiempo ordinario ciclo c Sicsi
Sicsi Sicsi
Sicsi Sicsi
Sicsi Sicsi scuola
Sicsi scuola Fotosintesis ciclo de krebs
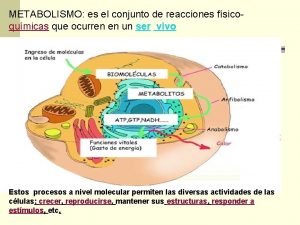
Fotosintesis ciclo de krebs Metabolismo de las proteínas
Metabolismo de las proteínas Ciclo otto ciclo diesel
Ciclo otto ciclo diesel Henry viii great matter
Henry viii great matter Prvky 18. skupiny
Prvky 18. skupiny Nc viii
Nc viii Csric viii
Csric viii Vision area in brain
Vision area in brain Henry viii banquet menu
Henry viii banquet menu Henry viii wives executed
Henry viii wives executed How to remember henry viii wives
How to remember henry viii wives Luther calvin and henry viii
Luther calvin and henry viii Henryk viii
Henryk viii Parafrasi canto 7 inferno
Parafrasi canto 7 inferno Viii encuentro nacional de catalogadores
Viii encuentro nacional de catalogadores Repressurization
Repressurization Article 7 school officials teachers and other personnel
Article 7 school officials teachers and other personnel Standards governing the use of simulators diatur dalam
Standards governing the use of simulators diatur dalam Henry viii foreign policy 1509-1529
Henry viii foreign policy 1509-1529 Viii henrik feleségei
Viii henrik feleségei