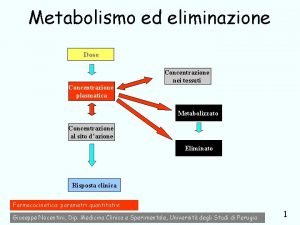
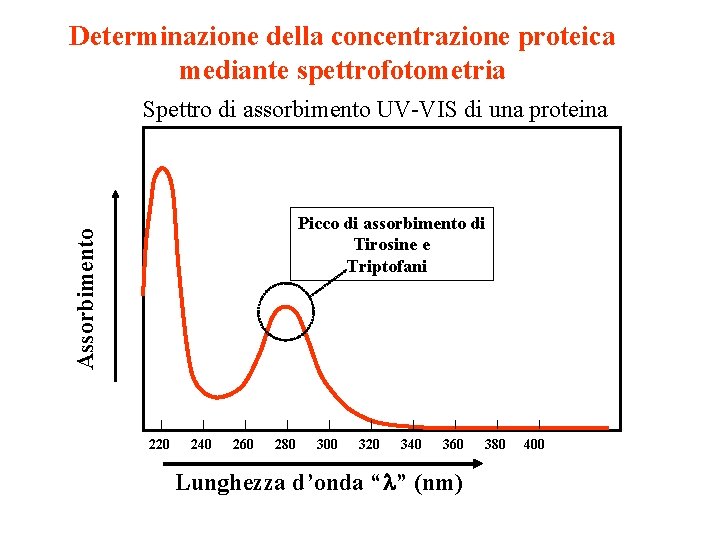
Determinazione della concentrazione proteica mediante spettrofotometria Spettro di








- Slides: 26

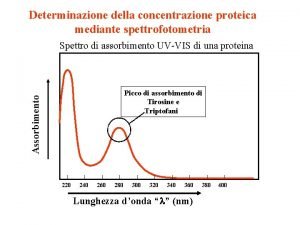
Determinazione della concentrazione proteica mediante spettrofotometria Spettro di assorbimento UV-VIS di una proteina Assorbimento Picco di assorbimento di Tirosine e Triptofani 220 240 260 280 300 320 340 360 Lunghezza d’onda “l” (nm) 380 400

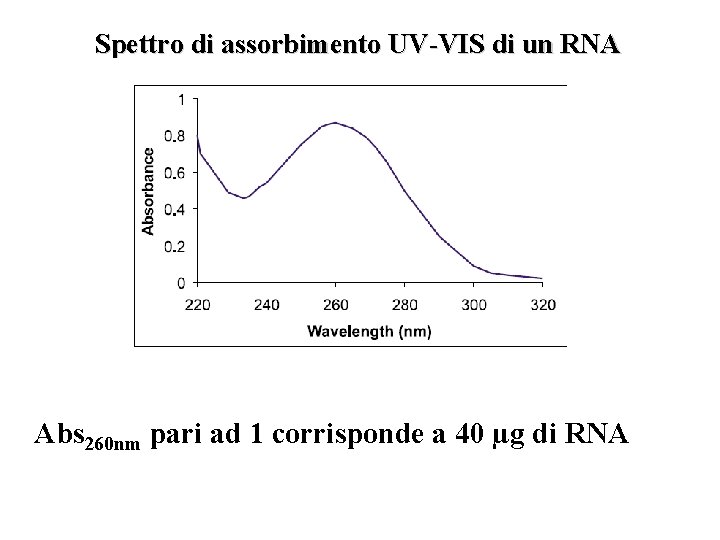
Spettro di assorbimento UV-VIS di un RNA Abs 260 nm pari ad 1 corrisponde a 40 µg di RNA

SAGGIO DI ATTIVITA’ ENZIMATICA • SPECIFICO • QUANTITATIVO

SAGGIO KUNITZ CARATTERISTICHE: • Il substrato è RNA di lievito 0, 5 mg/ml • La reazione avviene ad un p. H pari a 5 • Il saggio è condotto ad una temperatura di 25°C • La durata del saggio è di 1 minuto • La digestione dell’RNA provoca una diminuzione di Abs 300 nm • Tale diminuzione è dovuta alla minore capacità di assorbimento, a tale lunghezza d’onda, dei prodotti di degradazione dell’RNA rispetto all’RNA non degradato.

Nel saggio Kunitz un’unità di attività enzimatica è definita come la quantità di enzima in grado di determinare una variazione di Abs per minuto pari a ∆A 1 min/∆Atot, dove ∆Atot rappresenta la variazione di Abs rilevata in seguito a completa digestione del substrato. Il valore di ∆Atot viene determinato sperimentalmente.

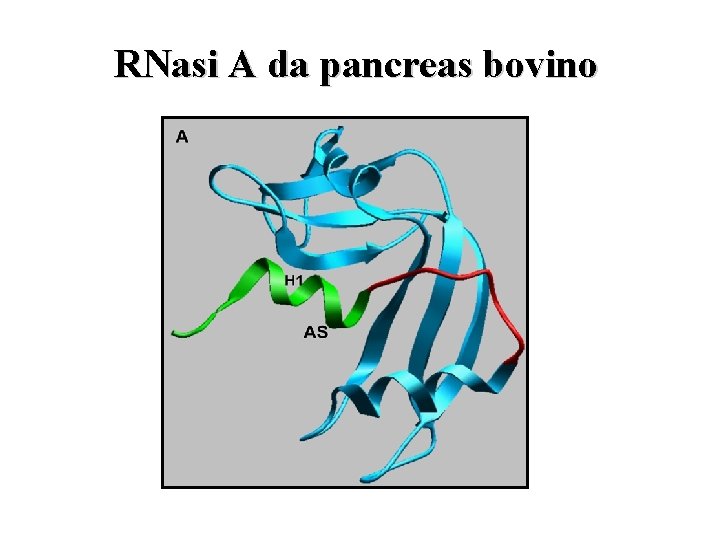
RNasi A da pancreas bovino

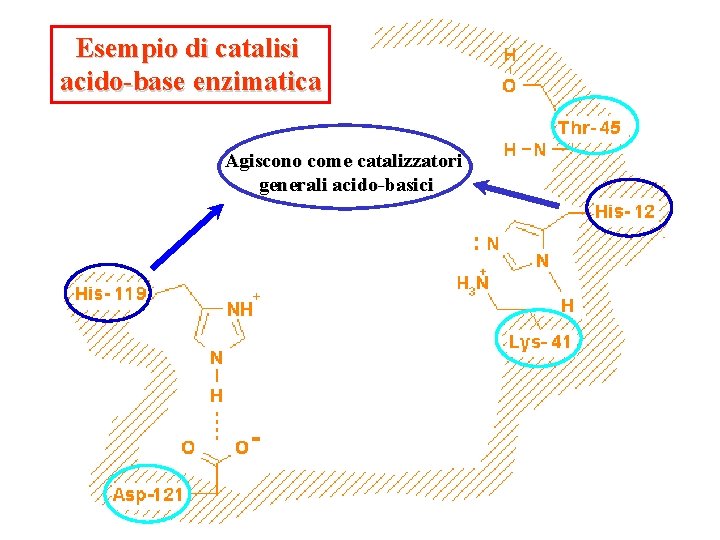
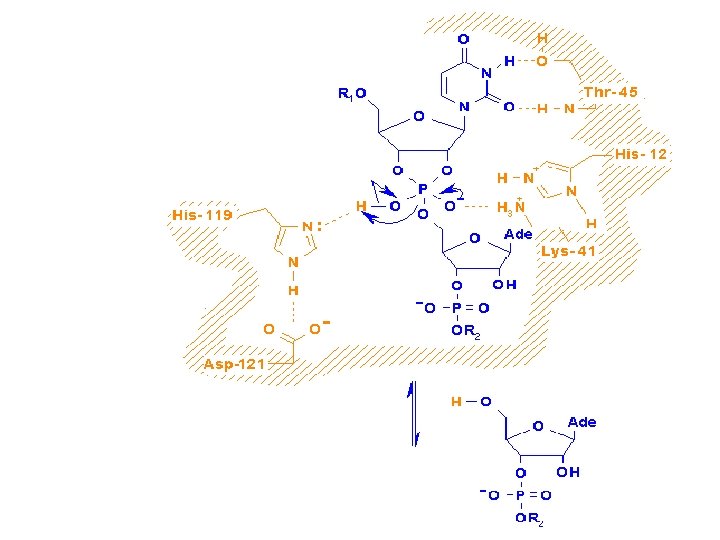
Esempio di catalisi acido-base enzimatica Agiscono come catalizzatori generali acido-basici

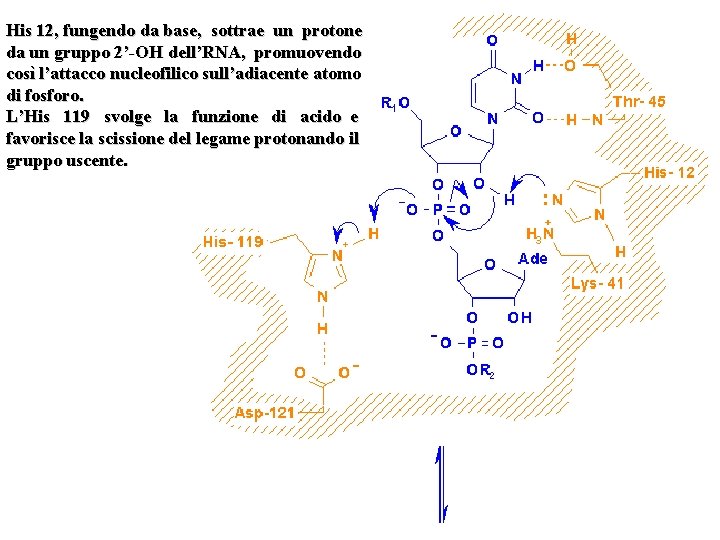
His 12, fungendo da base, sottrae un protone da un gruppo 2’-OH dell’RNA, promuovendo così l’attacco nucleofilico sull’adiacente atomo di fosforo. L’His 119 svolge la funzione di acido e favorisce la scissione del legame protonando il gruppo uscente.


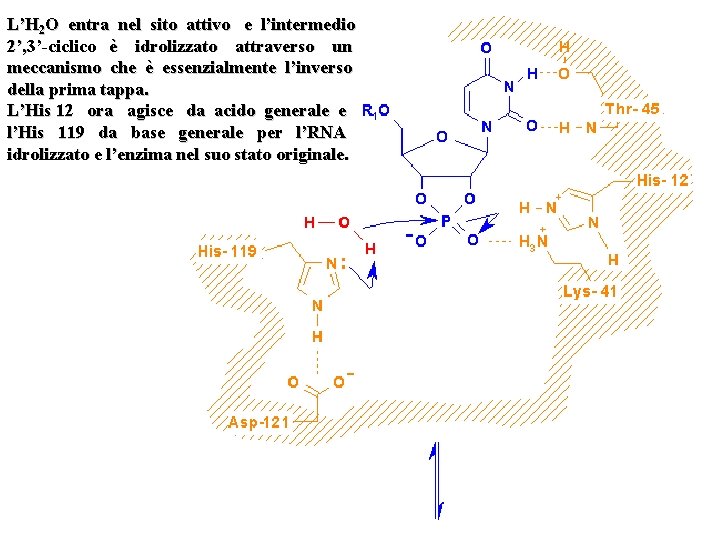
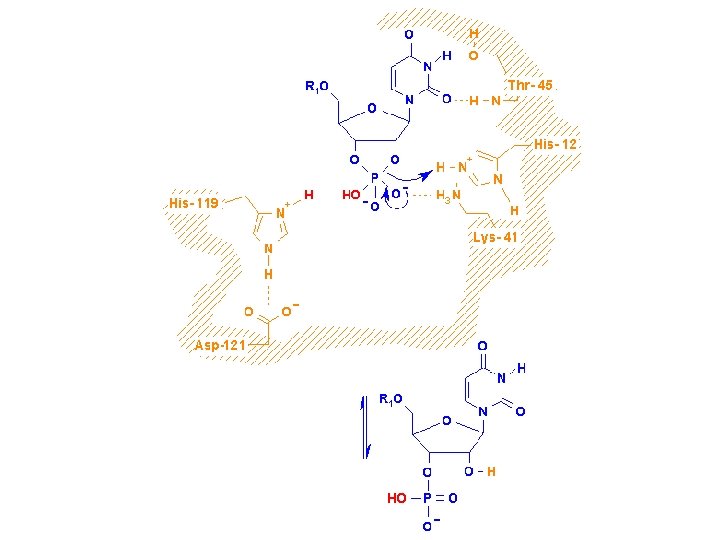
L’H 2 O entra nel sito attivo e l’intermedio 2’, 3’-ciclico è idrolizzato attraverso un meccanismo che è essenzialmente l’inverso della prima tappa. L’His 12 ora agisce da acido generale e l’His 119 da base generale per l’RNA idrolizzato e l’enzima nel suo stato originale.


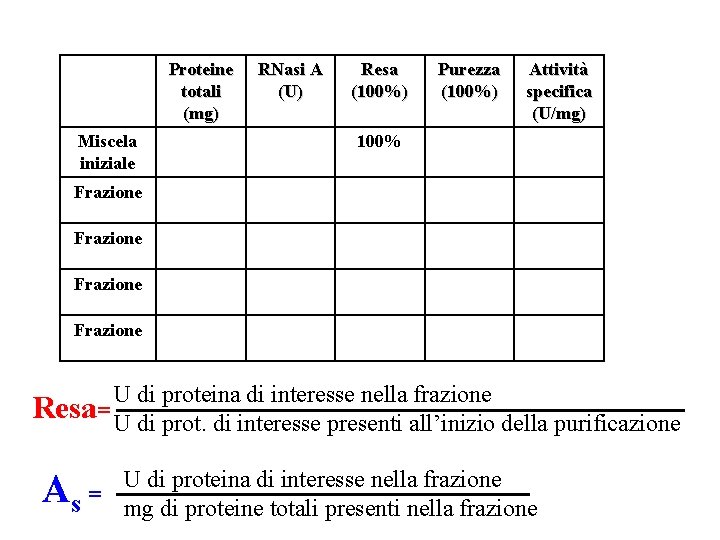
Proteine totali (mg) Miscela iniziale RNasi A (U) Resa (100%) Purezza (100%) Attività specifica (U/mg) 100% Frazione U di proteina di interesse nella frazione Resa= U di prot. di interesse presenti all’inizio della purificazione A U di proteina di interesse nella frazione s = mg di proteine totali presenti nella frazione

• La conoscenza della sequenza amminoacidica di una proteina costituisce il prerequisito per la determinazione della sua struttura tridimensionale ed è essenziale per comprenderne il suo meccanismo d’azione molecolare • I confronti tra le sequenze di proteine analoghe ottenute da specie differenti consentono di approfondire le nostre conoscenze sulla funzione di queste proteine e svelano le relazioni evolutive tra le proteine e gli organismi che le sintetizzano • Numerose malattie ereditarie sono causate da mutazioni che determinano una sostituzione amminoacidica in una proteina → le analisi delle sequenze amminoacidiche possono essere di ausilio nello sviluppo di test diagnostici e di terapie efficaci La proteina da sequenziare deve essere scissa in frammenti sufficientemente brevi da poter essere sequenziati individualmente, poi, partendo dalla sequenza dei tratti sovrapposti, si ricostruisce la struttura primaria della proteina intatta

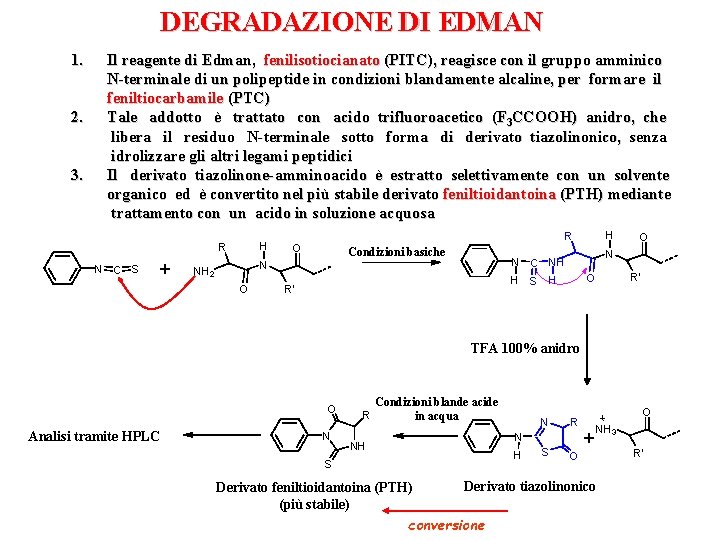
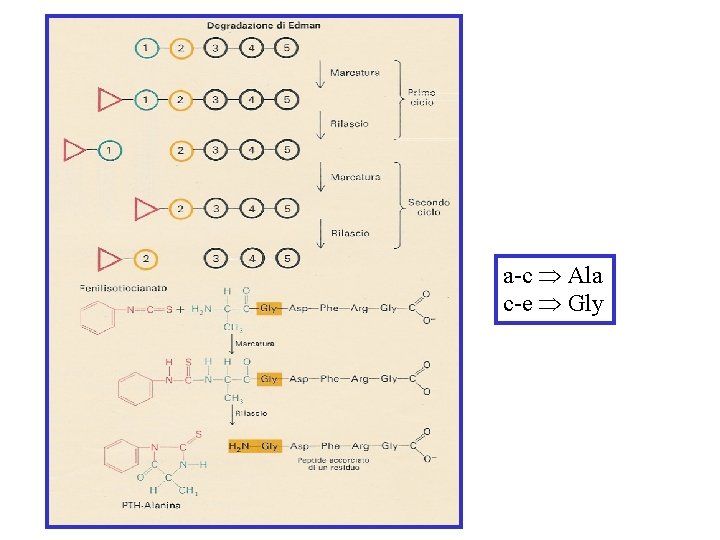
DEGRADAZIONE DI EDMAN 1. 2. 3. Il reagente di Edman, fenilisotiocianato (PITC), reagisce con il gruppo amminico N-terminale di un polipeptide in condizioni blandamente alcaline, per formare il feniltiocarbamile (PTC) Tale addotto è trattato con acido trifluoroacetico (F 3 CCOOH) anidro, che libera il residuo N-terminale sotto forma di derivato tiazolinonico, senza idrolizzare gli altri legami peptidici Il derivato tiazolinone-amminoacido è estratto selettivamente con un solvente organico ed è convertito nel più stabile derivato feniltioidantoina (PTH) mediante trattamento con un acido in soluzione acquosa H R N C S + O Condizioni basiche O H S R' O N N C NH N NH 23 H R R' O H TFA 100% anidro O Analisi tramite HPLC N R Condizioni blande acide in acqua N R S O N NH H S Derivato feniltioidantoina (PTH) (più stabile) O + NH 3 Derivato tiazolinonico conversione R'

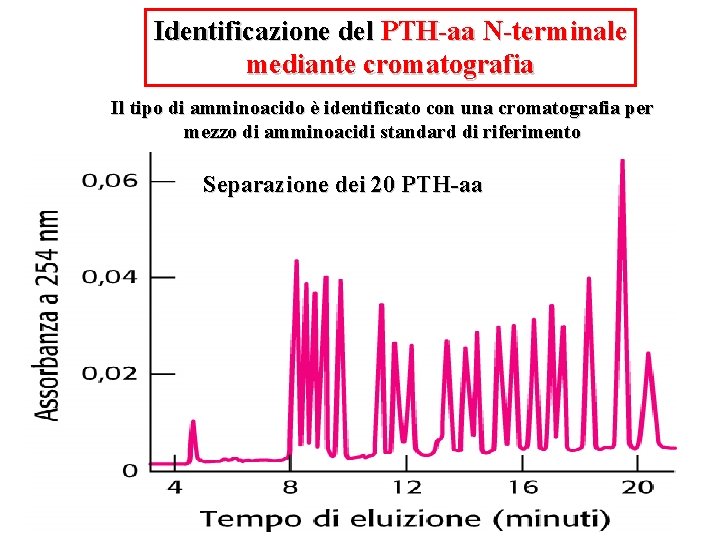
Identificazione del PTH-aa N-terminale mediante cromatografia Il tipo di amminoacido è identificato con una cromatografia per mezzo di amminoacidi standard di riferimento Separazione dei 20 PTH-aa

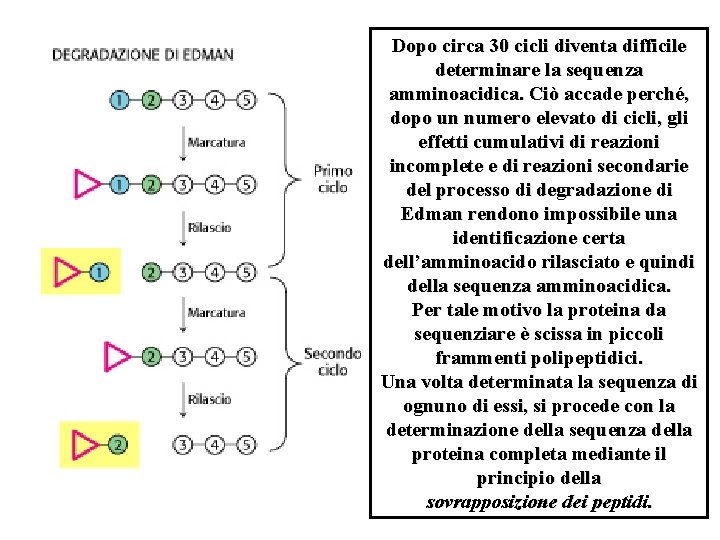
Dopo circa 30 cicli diventa difficile determinare la sequenza amminoacidica. Ciò accade perché, dopo un numero elevato di cicli, gli effetti cumulativi di reazioni incomplete e di reazioni secondarie del processo di degradazione di Edman rendono impossibile una identificazione certa dell’amminoacido rilasciato e quindi della sequenza amminoacidica. Per tale motivo la proteina da sequenziare è scissa in piccoli frammenti polipeptidici. Una volta determinata la sequenza di ognuno di essi, si procede con la determinazione della sequenza della proteina completa mediante il principio della sovrapposizione dei peptidi.

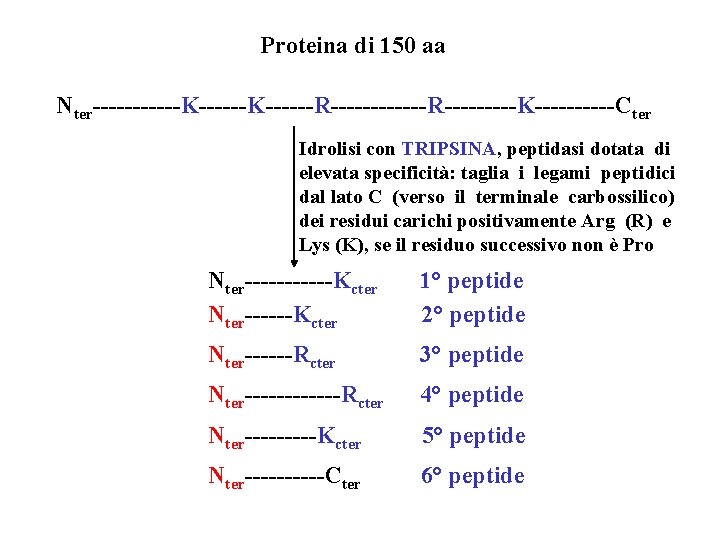
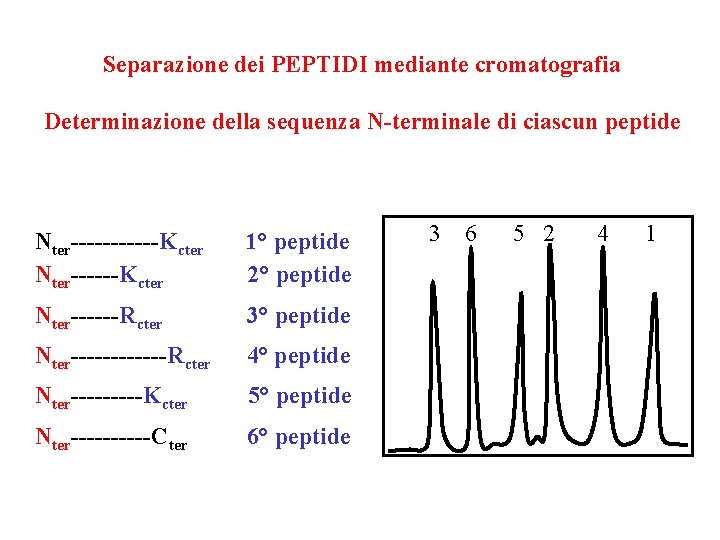
Proteina di 150 aa Nter------K------R------R-----K-----Cter Idrolisi con TRIPSINA, peptidasi dotata di elevata specificità: taglia i legami peptidici dal lato C (verso il terminale carbossilico) dei residui carichi positivamente Arg (R) e Lys (K), se il residuo successivo non è Pro Nter------Kcter 1° peptide 2° peptide Nter------Rcter 3° peptide Nter------Rcter 4° peptide Nter-----Kcter 5° peptide Nter-----Cter 6° peptide

Separazione dei PEPTIDI mediante cromatografia Determinazione della sequenza N-terminale di ciascun peptide Nter------Kcter 1° peptide 2° peptide Nter------Rcter 3° peptide Nter------Rcter 4° peptide Nter-----Kcter 5° peptide Nter-----Cter 6° peptide 3 6 5 2 4 1

• E’ necessario adoperare un metodo diverso per generare una serie di frammenti peptidici differenti • Anche in questo caso si procederà alla determinazione della sequenza N-terminale di ciascun peptide ottenuto • Le due serie di sequenze peptidiche sovrapposte consentono di ricostruire la sequenza di ciascun polipeptide

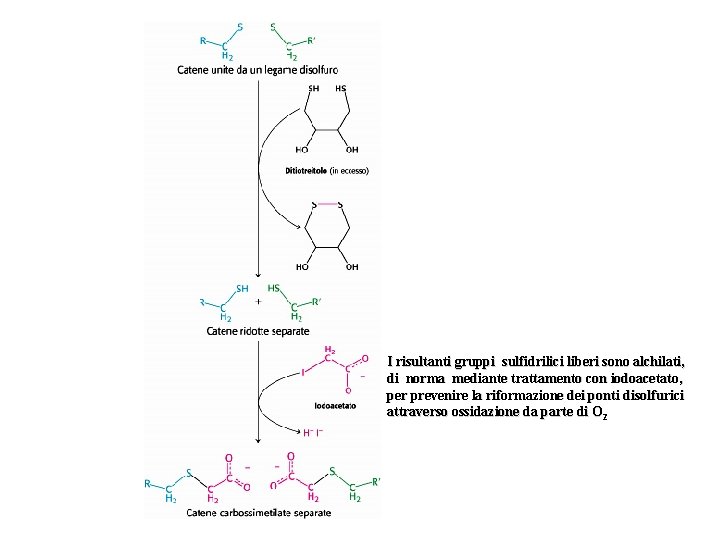
I risultanti gruppi sulfidrilici liberi sono alchilati, di norma mediante trattamento con iodoacetato, per prevenire la riformazione dei ponti disolfurici attraverso ossidazione da parte di O 2

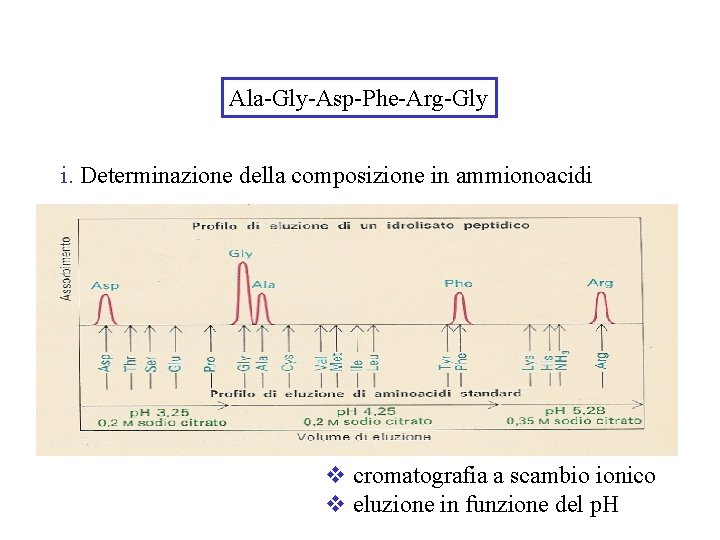
Ala-Gly-Asp-Phe-Arg-Gly i. Determinazione della composizione in ammionoacidi v cromatografia a scambio ionico v eluzione in funzione del p. H

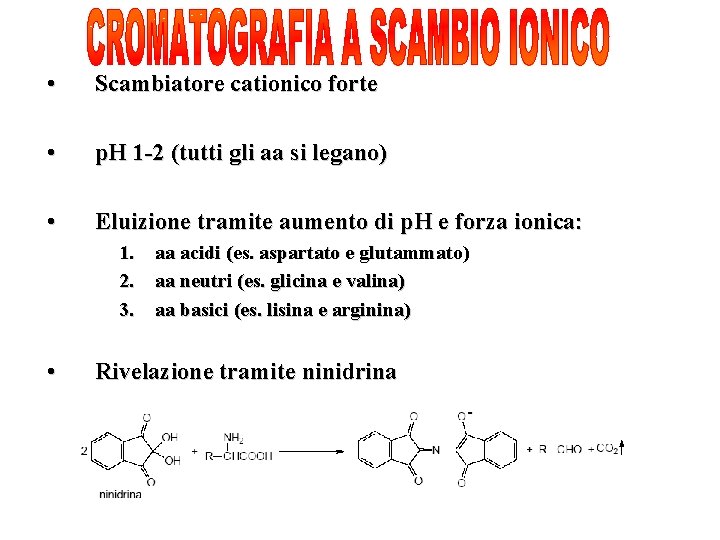
• Scambiatore cationico forte • p. H 1 -2 (tutti gli aa si legano) • Eluizione tramite aumento di p. H e forza ionica: 1. aa acidi (es. aspartato e glutammato) 2. aa neutri (es. glicina e valina) 3. aa basici (es. lisina e arginina) • Rivelazione tramite ninidrina

ii. Identificazione del residuo amino terminale (a) v marcatura con cloruro di dansile v idrolisi Il composto fluorescente dansil cloruro reagisce con le ammine primarie formando polipeptidi dansilati. Il trattamento di un polipeptide dansilato con un acido in soluzione acquosa ad alta temperatura idrolizza i suoi legami peptidici ed il residuo N-terminale risulta così libero. Questo derivato può poi essere separato dagli altri amminoacidi per via cromatografica ed identificato grazie alla sua intensa fluorescenza gialla. (b) degradazione di Edman: rimozione di un amminoacido alla volta dall’estremità NH 2 -terminale

a-c Ala c-e Gly

Degradazione di Edman Lunghezza massima 50 residui perdita di attendibilità Tagli specifici con metodi chimici o enzimatici Reagente Taglio chimico Bromuro di cianogeno O-iodobenzoato Idrossilammina 2 -Nitro-5 -tiocianobenzoato Taglio enzimatico Tripsina Clostripaina Proteasi dello Stafilococco Sito di taglio Lato carbossilico di residui Met Lato carbossilico di residui Trp Legami Asp-Gly Lato aminico di residui di Cys Lato carbossilico di residui Lys e Arg Lato carbossilico di residui Asn e Gln

Prima proteina sequenziata Sanger F. , Tuppy H. (1951) “The amino-acid sequence in the phenylalanyl chain of insulin 2. The investigation of peptides from enzymic hydrolysates. ” Biochem. J. 49: 481 -490 Si dimostró che la sequenza era costituita solo da L-aminoacidi uniti tra loro da legami peptidici fra i gruppi a-amminici e i gruppi a-carbossilici
 Assorbimento atomico a fiamma
Assorbimento atomico a fiamma Spettrofotometria
Spettrofotometria Poliribosoma
Poliribosoma Sintese de lipidios
Sintese de lipidios Capsida proteica
Capsida proteica Holoenzima
Holoenzima Desnaturação proteica reversivel e irreversivel
Desnaturação proteica reversivel e irreversivel Síntese proteíca
Síntese proteíca Determinazione del prezzo
Determinazione del prezzo Determinazione dei cloruri
Determinazione dei cloruri Tabella criteri di determinazione ore sostegno
Tabella criteri di determinazione ore sostegno Bufala
Bufala Determinazione attività enzimatica spettrofotometro
Determinazione attività enzimatica spettrofotometro Titolazione aceto
Titolazione aceto Determinazione del prezzo
Determinazione del prezzo Determinazione del ferro con ortofenantrolina
Determinazione del ferro con ortofenantrolina Determinazione del prezzo
Determinazione del prezzo Gradiente di concentrazione
Gradiente di concentrazione Formule inverse concentrazioni percentuali
Formule inverse concentrazioni percentuali Dissociazione acido acetico
Dissociazione acido acetico Solubilit
Solubilit Molarità unità di misura
Molarità unità di misura Pila a concentrazione
Pila a concentrazione Difficoltà di concentrazione adulti
Difficoltà di concentrazione adulti Marco rostellato
Marco rostellato Soluzioni
Soluzioni Legge di teorell
Legge di teorell