SICSI Scuola Interuniversitaria Campana di Specializzazione allInsegnamento Corso





























- Slides: 31

SICSI Scuola Interuniversitaria Campana di Specializzazione all’Insegnamento Corso di Chimica degli elementi nell’Ambiente Il Cloro Prof. Salvatore Andini Classe A 013 – VIII Ciclo ANNO ACCADEMICO 2008 -2009

Prerequisiti discreta conoscenza dei fondamenti della chimica generale Obiettivi 1. Conoscere le caratteristiche fisiche e chimiche dell’elemento presentato mettendole in relazione al gruppo di appartenenza nella tavola periodica; 2. Indicare le utilizzazioni pratiche del cloro e di alcuni dei suoi derivati; 3. Conoscere i processi industriali per la preparazione del cloro e del suo composto più significativo (HCl); 4. Conoscere i risvolti ambientali del cattivo utilizzo di alcuni dei composti del cloro, promozione della coscienza ambientale dello studente. 5. In riferimento all’attività di laboratorio: rafforzare la comprensione dei concetti scientifici; sviluppare la comprensione del metodo scientifico; sviluppare la capacità di condurre indagini; acquisire le abilità manuali di esecuzione, individuare ed assemblare la strumentazione necessaria per l’esecuzione dell’esercitazione; riflettere sulle connessioni tra la teoria e la realtà; imparare ad operare in laboratorio, consapevolmente ed attivamente, nel rispetto delle norme di sicurezza.


numero Atomico 17 Isolato per la prima volta nel 1774 Cl simbolo Chimico Carl Wilhelm Scheele Cloro 35, 453 dal chimico svedese massa atomica (u) configurazione elettronica: [Ne]3 s 23 p 5 Temperatura di fusione -101 °C Temperatura di ebollizione -34, 7 °C densità 0. 003214 (g cm-3) stati di ossidazione: -1, +3, +4, +5, +7 Raggio atomico 0. 97 Å Raggio ionico 1. 81 Å E’ un elemento spiccatamente elettronegativo E° = 3. 16 volt per Cl 2 (g) + 2 e = 2 Cl- (aq) è un buon ossidante!!!!

Fonti Il cloro non si ritrova in natura allo stato libero data la sua elevata reattività E’ presente in vari minerali comuni il principale è il cloruro di sodio (Na. Cl). La sorgente naturale di cloro più importante è rappresentata dall’acqua marina, in cui esso è presente come ione cloruro. La gran parte dei cloruri è solubile in acqua, perciò i cloruri allo stato solido si trovano soltanto nelle regioni più aride o in giacimenti sotterranei profondi. Minerali comuni di cloro sono la halite (Na. Cl), silvite (KCl) e la carnallite (KMg. Cl 3 - 6 H 2 O) Saline di San Leonardo - Trapani

COME SI PRESENTA? molecola biatomica (Cl 2) allo stato elementare gas di colore giallo-verde , ha odore irritante e può essere molto pericoloso se inalato. Il Cl 2 è stato usato come arma chimica nella prima guerra mondiale

RUOLO BIOLOGICO FONDAMENTALE: Sottoforma di cloruro è essenziale per i mammiferi e le piante. I succhi gastrici dello stomaco contengono acido cloridrico. La composizione ionica dei fluidi corporei di molti animali, inclusi gli esseri umani, richiama quella dell'acqua marina. Come riflesso dell'origine marina della vita, lo ione cloruro è l'anione più abbondante nel plasma sanguigno.

• all’Aria REATTIVITÀ del cloro ASSENTE • con l’Acqua Il cloro reagisce con acqua producendo l'ipoclorito, OCl-, secondo la reazione: Cl 2(g) + H 2 O(l) OCl-(aq) + 2 H+(aq) + Cl-(aq) La posizione dell’equilibrio dipende dal p. H della soluzione. • con Basi Il cloro reagisce con soluzioni acquose di alcali a caldo producendo clorato, Cl. O-3. Soltanto un sesto del cloro totale è convertito in questa reazione 3 Cl 2(g) + 6 OH-(aq) Cl. O-3 (aq) + 5 Cl-(aq) + 3 H 2 O • con Acidi ASSENTE Efficace agente ossidante: esso può ossidare non solo elementi spiccatamente elettropositivi ma anche metalli nobili e non metalli, con potenziali di riduzione positivi. E° = 3. 16 volt per Cl 2 (g) + 2 e = 2 Cl- (aq) Allo stato elementare il cloro presenta una reattività notevole: un aspetto particolare della loro reattività è la loro TOSSICITÀ di cui in seguito valuteremo alcuni esempi.

PREPARAZIONE Per la preparazione del cloro si può ricorrere all’elettrolisi di soluzioni acquose (generalmente di Na. Cl) 2 Na+ (aq) + 2 Cl- (aq) + 2 H + - 2 O 2 Na (aq) + 2 OH (aq) + Cl 2(g) + H 2(g) Dal punto di vista industriale 4 HCl(g) + O 2 (g) = 2 Cl 2(g) + 2 H 2 O(g) L’ossidazione viene effettuata mediante ossigeno atmosferico in presenza di cloruro rameico, Cu. Cl 2, a circa 450°C. Il cloruro rameico si trasforma in cloruro rameoso, che funge da effettivo catalizzatore

COMPOSTI BINARI interalogeni, ossidi, idruro L’IDRURO del cloro: acido cloridrico, HCl. acido forte molto solubile in acqua. La reazione di dissociazione seguente è praticamente completa: HCl(aq) + H 2 O H 3 O+ (aq) + Cl-(aq) Industrialmente la preparazione di HCl si effettua a partire dal cloruro di sodio con acido solforico: a temperatura ambiente Na. Cl(s) + H 2 SO 4 (l) = Na. HSO 4 (s) + HCl(g) a temperature superiori (500°C): Na. Cl(s) + Na. HSO 4 (l) = Na 2 SO 4 (s) + HCl(g)

OSSIDI Sono quattro gli ossidi di cloro ben caratterizzati: Cl 2 O (Cl(I)) instabili. Cl. O 2 (Cl(IV)) Cl 2 O 6 (Cl(VI)) più o meno tendenti a decomposizioni o reazioni esplosive. Cl 2 O 7 (Cl(VII)) L’ ossido di dicloro si prepara a partire dall’elemento: 2 Cl 2(g) + 2 Hg. O(s) = Hg. Cl 2 · Hg. O(s) + Cl 2 O (g) Per il suo uso industriale quale forte agente ossidante va rammentato il diossido di cloro, che è un gas ed è ottenibile in situ mediante la seguente reazione con soluzioni di acido clorico: 2 Cl. O-3(aq) + H 3 O+ (aq) + SO 3 (aq) = 2 Cl. O 2 (g) + HSO-4(aq) + H 2 O

COMPOSTI INTERALOGENO ottenibili mediante combinazione diretta a partire dagli elementi. elevata reattività (ad es. la facile idrolisi in presenza di acqua). Fluoruri Il fluoro, F 2, reagisce con cloro a 225°C per formare la specie Cl. F. Cl 2(g) + F 2(g) 2 Cl. F(g) E' anche possibile la formazione del trifluoruro di cloro anche se in questo caso la reazione non va a completamento. Cl 2(g) + 3 F 2(g) 2 Cl. F 3(g) In condizionio forzate, il fluoro eccedente reagisce con cloro a 350°C e ad una pressione di 225 atm per formare la specie Cl. F 5. Cl 2(g) + 5 F 2(g) 2 Cl. F 5(g)

Bromuri Il cloro reagisce con il bromo, Br 2, in fase gassosa, per formare la specie interalogena instabile bromuro di cloro, Cl. Br. Cl 2(g) + Br 2(g) 2 Cl. Br(g) Ioduri Similmente, il cloro reagisce con lo iodio, I 2, a temperatura ambiente per formare la specie interalogena, Cl. I, ioduro di cloro. Cl 2(g) + I 2(g) 2 ICl(s)

OSSIACIDI Di primaria importanza è la reazione del cloro con l’acqua, da tale processo, si forma l’acido ipocloroso, debole ed instabile: Cl 2 (aq) + 2 H 2 O Cl- (aq) + HCl. O (aq) + H 3 O+(aq) All’equilibrio la specie HCl. O, acido ipocloroso, è piccola, ma se si opera in ambiente alcalino l’equilibrio diviene nettamente favorevole alla formazione degli ioni ipoclorito. Per far decorrere spontaneamente una reazione verso destra basta che risulti positivo il potenziale normale DE ( potenziale di riduzione del catodo + potenziale di ossidazione dell’anodo) della pila corrispondente. I potenziali di riduzione della semireazioni, cui partecipano specie contenenti cloro in due stati di ossidazione diversi sono riportati nello schema seguente: +1. 19 volt Cl. O-4 Cl. O -3 +1. 21 volt HCl. O 2 +1. 65 volt HCl. O +1. 61 volt Cl 2 +1. 36 volt Cl -

L’acido cloroso, HCl. O 2, è un acido relativamente debole e non può essere isolato. E’ un acido leggermente più forte dell’acido ipocloroso. L’acido clorico, HCl. O 3, è un acido forte ed un forte agente ossidante, non può essere isolato puro: l’allontanamento del solvente da una soluzione acquosa di tale acido ne provoca la violenta decomposizione. L’acido perclorico, HCl. O 4, è un acido fortissimo in soluzione acquosa. A differenza dell’acido ipocloroso e dell’acido clorico, è stabile allo stato puro; è un liquido incolore che solidifica a – 112°C.

COMPOSTI ORGANOCLORURATI molecole organiche contenenti uno o più atomi di cloro organoclorurati saturi (alogenuri alchilici) insaturi (alogenuri alchenici) aromatici (alogenuri acrilici) legame carbonio–cloro ha elevata stabilità composti idrofobi una volta penetrati nell’ambiente tali composti vengono degradati con estrema difficoltà, conseguente accumulo. risvolti sullo stato di salute degli animali e che della terra.

Il diclorometano, CH 2 Cl 2, liquido molto volatile eccellenti proprietà solventi nei confronti di soluti organici non polari impiegato, come solvente, nella decaffeinazione del caffè, per rimuovere vernici, …. Il tetracloruro di carbonio, CCl 4, sostanza altamente tossica, è fortemente limitata negli impieghi; venduto comunemente come smacchiante e come solvente L’ 1, 2 -dibromoetano, C 2 H 2 Br 2 usato come insetticisa, sottrattore di piombo dalle benzine, come solvente e come intermedio nella sintesi di diversi farmaci e vernici.

I cloruri alchenici contengono almeno un atomo di cloro legato ad un carbonio occupato in un doppio legame. Il cloruro di vinile viene consumato in grandi quantità come materia prima nella produzione di tubazioni, tubi flessibili, carta da imballaggio etc. E’ un gas altamente infiammabile, volatile e dall’odore dolciastro; è un noto cancerogeno per l’uomo. Esistono tre isomeri del dicloroetilene tutti e trasparenti e liquidi. Trova impiego nei materiali da rivestimento e come solventi. Il tricloroetilene, TCE, è un liquido volatile trasparente e non infiammabile, è un eccellente sgrassante e solvente per lavaggi a secco. Il tetracloroetilene, liquido incolore e non infiammabile, ha impieghi simili a quelli del TCE. L’esaclorobutadiene, un liquido incolore dall’odore simile all’acqua ragia usato oltre che come solvente come liquido scambiatore di calore…

I cloruri arilici derivati dal benzene e dal toluene trovano numerosi impieghi nelle sintesi chimiche, come pesticidi e come materie prime per la loro produzione, come solventi, e in altre applicazioni. Il monoclorobenzene è un liquido infiammabile con punto di ebollizione di 132°C, è usato come solvente, come liquido scambiatore di calore e come reagente nella sintesi organica. L’ 1, 2 -diclorobenzene è usato come solvente, per sgrassare la lana ed il pellame e come reagente nella sintesi organica per la produzione di tinture.

Pesticidi organoclorurati peso molecolare medio, origine industriale sostanze in grado di uccidere un organismo indesiderato o, almeno, di esercitare nei suoi confronti un’azione di controllo/limitazione. insetticidi erbicidi VANTAGGI: • controllo delle malattie infettive e parassitarie (malaria, febbre gialla, peste bubbonica) • eliminare gli insetti che risultano molesti, (comuni zanzare e mosche)

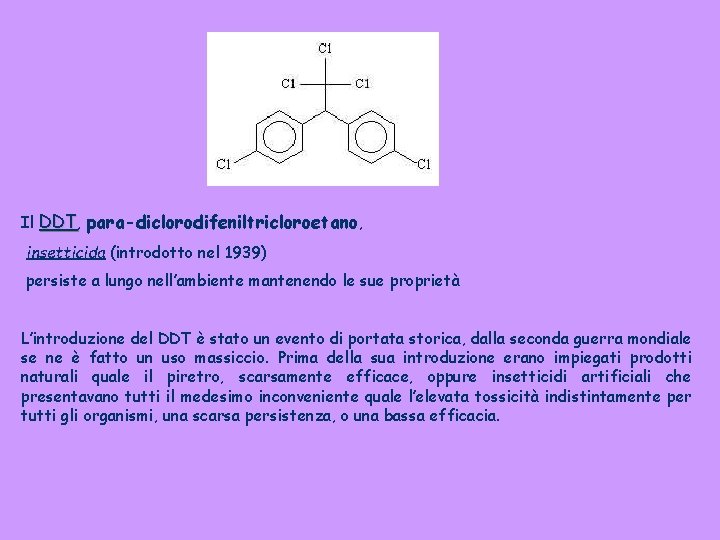
Il DDT, para-diclorodifeniltricloroetano, insetticida (introdotto nel 1939) persiste a lungo nell’ambiente mantenendo le sue proprietà L’introduzione del DDT è stato un evento di portata storica, dalla seconda guerra mondiale se ne è fatto un uso massiccio. Prima della sua introduzione erano impiegati prodotti naturali quale il piretro, scarsamente efficace, oppure insetticidi artificiali che presentavano tutti il medesimo inconveniente quale l’elevata tossicità indistintamente per tutti gli organismi, una scarsa persistenza, o una bassa efficacia.

VANTAGGI: • è estremamente tossico per gli insetti e per gli artropodi in genere, mentre lo è meno per gli altri animali; • agisce sia per ingestione che per contatto; • è una molecola semplice dal costo di produzione ridotto; • essendo persistente rende inutili i trattamenti ripetuti. SVANTAGGI: • scarsamente solubile in acqua, quindi venivano preparate soluzioni di tale sostanza venivano impiegati solventi organici maleodoranti e nocivi per la salute. • Dopo del tempo dal suo utilizzo si possono osservare la comparsa di specie DDTresistenti; • La sua elevata persistenza si è trasformata da vantaggio a grave pericolo data la difficoltà che si incontra per eliminarlo dall’ambiente. Dal 1973 l’Agenzia per la Protezione Ambientale proibì qualsiasi uso del DDT. Oggi il DDT viene ancora impiegato nei paesi in via di sviluppo.

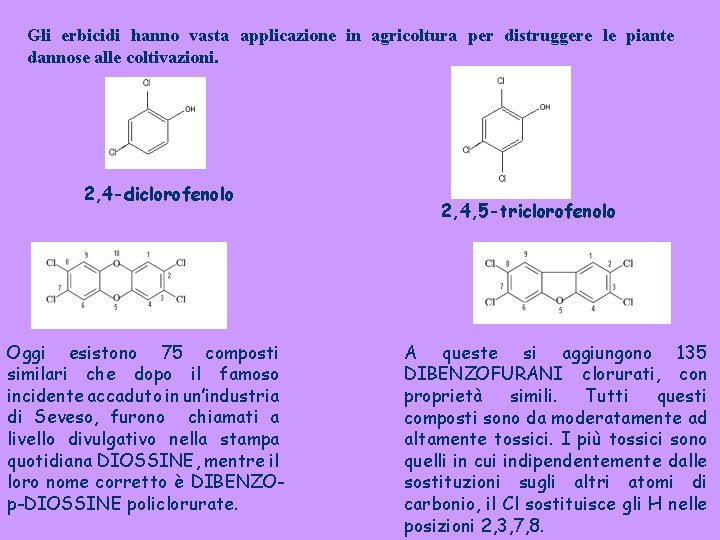
Gli erbicidi hanno vasta applicazione in agricoltura per distruggere le piante dannose alle coltivazioni. 2, 4 -diclorofenolo Oggi esistono 75 composti similari che dopo il famoso incidente accaduto in un’industria di Seveso, furono chiamati a livello divulgativo nella stampa quotidiana DIOSSINE, mentre il loro nome corretto è DIBENZOp-DIOSSINE policlorurate. 2, 4, 5 -triclorofenolo A queste si aggiungono 135 DIBENZOFURANI clorurati, con proprietà simili. Tutti questi composti sono da moderatamente ad altamente tossici. I più tossici sono quelli in cui indipendentemente dalle sostituzioni sugli altri atomi di carbonio, il Cl sostituisce gli H nelle posizioni 2, 3, 7, 8.

POLICLOROBIFENILI PCB (difenili policlorurati) derivati del difenile per sostituzione degli idrogeni con Cl miscele a vario grado di clorurazione viscose densità aumenta col numero di atomi di cloro sostituenti sono praticamente insolubili in acqua ed altamente liposolubili Schema di numerazione usato per i PCB: per convenzione l’anello che possiede il sosituente nella posizione con numero più basso sarà l’anello indicato con numeri senza pedice. Sono sostanze inerti, difficili da bruciare, liofile, sono liquidi a ridotta tensione di vapore e sono ottimi isolanti termici. Trovano impiego come fluidi refrigeranti nei trasformatori e nei condensatori. A partire dal 1971 i legislatori hanno fatto in modo di diminuire sempre più la loro produzione fino al 1977, anno in cui la stessa è stata completamente interrotta.

Data la loro persistenza e la loro solubilità nei tessuti adiposi si accumulano in vari organismi soprattutto quelli marini. I PCB nella catena alimentare subiscono il cosiddetto fenomeno della biomagnificazione. Fenomeno del bioaccumulo e della biomagnificazione dei PCB nella catena alimentare dei grandi Laghi del Nord America. Nel disegno si può osservare come la % dei PCB presenti nelle uova dei gabbiani reali, sia 50000 volte superiore a quella dei PCB presenti nel fitoplancton acquatico nei grandi Laghi del Nord America. In altre parole gli animali che occupano una posizione ai vertici della catena alimentare sono quelli che risultano più esposti al fenomeno dell’accumulo di organoclorurati. I PCB provocano danni a carico della sfera riproduttiva dell’uomo e degli altri animali ed una reazione epidermica nota come Cloracne. “In generale quasi tutte le molecole organiche con atomi di cloro sono mutagene, cioè producono alterazioni del patrimonio genetico delle cellule. Molti agenti mutageni sono cancerogeni, cioè producono tumori” (Galassi 1991).

CLOROFLUOROCARBURI composti volatili costituiti da 1 o 2 atomi di carbonio che legano cloro e fluoro composti inerti non infiammabili non tossici. Questi composti vengono indicati col rispettivo numero di codice da cui è possibile ricavare la formula chimica aggiungendo il numero 90. Le cifre risultanti corrispondono, rispettivamente, al numero di atomi di carbonio, idrogeno e fluoro presenti nella molecola. Gli atomi di cloro risultano nel completamento alla saturazione delle valenze del carbonio: C F Esempio CFC-12: Formula chimica: CF 2 Cl 2 90+12=102 H I CFC più comuni sono il CFC-12 ed il CFC-11. CF 2 Cl 2 gas a temperatura ambiente usato come liquido refrigerante nei frigoriferi e negli impianti di aria condizionata per automobili. CFCl 3 è un liquido che bolle ad una temperatura prossima a quella ambiente è stato usato nella fabbricazione di schiume morbide ed uretaniche per isolare frigoriferi e pareti di edifici. Entrambi sono stati usati come propellente nelle bombolette spray.

Oggi i CFC sono in disuso a causa della loro responsabilità nella DISTRUZIONE DELLA FASCIA D’OZONO ATMOSFERICO. Il problema dei CFC è grave perché questi composti hanno grande inerzia chimica e riescono a rimanere inalterati nell’atmosfera dai 500 anni. I CFC sono stati messi al bando. Inoltre ricordiamo che tali molecole rappresentano, tra i vari gas presenti in tracce, quelli con maggiore potenziale per quanto riguarda gli effetti sul riscaldamento planetario: EFFETTO SERRA ANTROPICO

USI ED APPLICAZIONI INDUSTRIALI DEL CLORO Viene messo in commercio in bombole, allo stato liquido, in recipienti di acciaio. • Il cloro allo stato elementare viene utilizzato nella preparazione di molti dei suoi derivati. • Impiegato per le sue proprietà ossidanti come disinfettante delle acque potabili, cui si fa ricorso quando, malauguratamente, la purezza batteriologica di un’acqua non sia soddisfacente. • Come sbiancante, il cloro (Cl 2) è una sostanza estremamente reattiva che tende a combinarsi in tempi rapidissimi con il materiale, organico e non, col quale viene a contatto, agendo come un potente ossidante. Questo conta moltissimo per gli usi che se ne fanno. Come sbiancante infatti il cloro reagisce, distruggendo le molecole naturali che causano macchie o colorazioni indesiderate. • Nella produzione del polimero PVC (polivinilcloruro) • Nella produzione della soluzione acquosa di ipoclorito di sodio, la nota “varechina”, impiegato come mezzo candeggiante e disinfettante • usato estesamente nella produzione di prodotti: di carta, di tinture, nel tessile, di prodotti petroliferi, di medicine, di antisettici, di insetticidi, di derrate alimentari, di solventi, di vernici, di plastica e molti altri prodotti di consumo….

IN LABORATORIO Esperienza A. Preparazione del Cloro Il cloro si ottiene per ossidazione dell’acido cloridrico ad opera del permanganato di potassio. La raezione è la seguente: 2 KMn. O 4 + 6 HCl + 10 HCl 2 Mn. Cl 2 + 2 KCl + 5 Cl 2 + 8 H 2 O In questo caso il permanganato viene ridotto a cloruro di manganese, ed il cloro che nell’acido cloridrico era in forma ridotta, con numero di ossidazione – 1, passa a cloro gassoso (in forma ossidata) con numero di ossidazione 0. Ovvero in forma ionica : 10 Cl 2 Mn. O 4 - + 16 H+ + 10 e 5 Cl 2 + 10 e 2 Mn 2+ + 8 H 2 O (ossidazione) (riduzione) _______________________ 10 Cl- + 2 Mn. O 4 - + 16 H+ 5 Cl 2 + 2 Mn 2+ + 8 H 2 O E’ dunque grazie ad una ossidazione in ambiente acido ad opera di un energetico ossidante, quale il permanganato di potassio, che si realizzerà la produzione di cloro gassoso.

Materiale occorrente • n. 1 provettone codato; • n. 1 tappo di gomma forato; • n. 1 siringa di plastica; • n. 1 tubicino di vetro; • n. 1 raccordo di gomma; • acido cloridrico (HCl) soluzione al 37%; ATTENZIONE : Il CLORO è molto TOSSICO se inalato anche a concentrazioni basse; dunque lavorare sotto cappa; HCl (aq, conc. ) è irritante a contatto con l’epidermide (nel caso lavare con abbondante acqua corrente) o per inalazione di vapori (Vedi Scheda di Sicurezza); Il PERMANGANATO DI POTASSIO è NOCIVO non inalare e non ingerire (Vedi Scheda di Sicurezza). • permanganato di potassio (KMn. O 4). Procedimento Si introduca nel provettone codato un cucchiaio di permanganato di potassio e poi si proceda a chiudere il provettone con il tappo forato su cui sia stata inserita la siringa contenente acido cloridrico. Lentamente si facciano cadera delle goccie di acido nel provettone. Si osservi quanto accade. Si produce immediatamente effervescenza con sviluppo di un gas: il cloro (Cl 2). Tale elemento ha un colore giallo- verde visibile ed un odore caratteristico. Evitare di far disperdere il gas sviluppato in questa esperienza perché deve essere utilizzato nell’esperienza che faremo subito di seguito.

Esperienza B. Proprietà del Cloro Si verificheranno alcune proprietà del cloro appena prodotto. Materiale occorrente n. 1 provettone codato; n. 1 tappo di gomma forato; quelli dell’esperienza precedente n. 1 siringa di plastica; Esperienza A n. 1 tubicino di vetro; n. 1 raccordo di gomma; acido cloridrico (HCl) soluzione al 37%; permanganato di potassio (KMn. O 4); n. 3 provette cartina indicatrice di p. H; fiore colorato. Procedimento Si raccolga il cloro prodotto nell’esperienza precedente in una provetta così come mostrato in a) nella figura di seguito riportata. Tenendo la provetta inclinata, si avvicini un fiammifero acceso alla bocca della provetta stessa. 1. Che cosa si può notare? Dopo aver raccolto il cloro che si sviluppa dalla reazione in un’altra provetta si introducano, alla bocca della stessa, la cartina indicatrice di p. H (che è colorata) ed i petali colorati di un fiore. 2. Cosa si nota?
 Vanvitelli scuola di specializzazione
Vanvitelli scuola di specializzazione Sicsi
Sicsi Sicsi scuola
Sicsi scuola Tlc bidimensionale
Tlc bidimensionale Genetica medica unife
Genetica medica unife Domotica etimologia
Domotica etimologia Spirometro a campana
Spirometro a campana Poesia arturo prat chacon para niños
Poesia arturo prat chacon para niños Caracteristicas de la campana de gauss
Caracteristicas de la campana de gauss Transformacion isoentropica
Transformacion isoentropica Monopolio comercial
Monopolio comercial Hera y juno
Hera y juno Campana piccina che attendi lassù
Campana piccina che attendi lassù Simone campana
Simone campana Valter campana
Valter campana Maria girone
Maria girone Pirámide en forma de campana
Pirámide en forma de campana La campaña definitiva 1820 a 1822
La campaña definitiva 1820 a 1822 Campaña cuidado de manos
Campaña cuidado de manos Flujo de campo eléctrico
Flujo de campo eléctrico Signo de la tienda de campaña endoscopia
Signo de la tienda de campaña endoscopia Relazione finale corso di formazione
Relazione finale corso di formazione Slide antincendio
Slide antincendio Glc cromatografia
Glc cromatografia Corso icq
Corso icq Carlo crivelli self portrait
Carlo crivelli self portrait Slide corso formazione segnaletica stradale
Slide corso formazione segnaletica stradale Modellistica energetica
Modellistica energetica Corso vhdl
Corso vhdl Corso allenatore di base basket
Corso allenatore di base basket Slide corso trattori agricoli
Slide corso trattori agricoli Slide corso macchine movimento terra
Slide corso macchine movimento terra




















































