Regulacin de la actividad enzimtica 1 Regulacin de











- Slides: 20

Regulación de la actividad enzimática, 1

Regulación de la actividad enzimática v= k+2 e 0 s Km + s = Vmax s Km + s I. Sobre e 0: Regulación de la concentración enzimática II. Sobre Km y k+2: Regulación de la actividad intrínseca de la enzima 1. Regulación alostérica 2. Regulación por modificación covalente

Regulación alostérica Procesos a nivel celular; regulación de ajuste fino de la actividad enzimática, a través de efectos de retroalimentación (negativa o positiva) Regulación por modificación covalente Procesos a nivel supracelular (orgánico); regulación a gran escala de actividades enzimáticas, a través de modificación covalente de enzimas, provocadas por señales (transducción de señales)

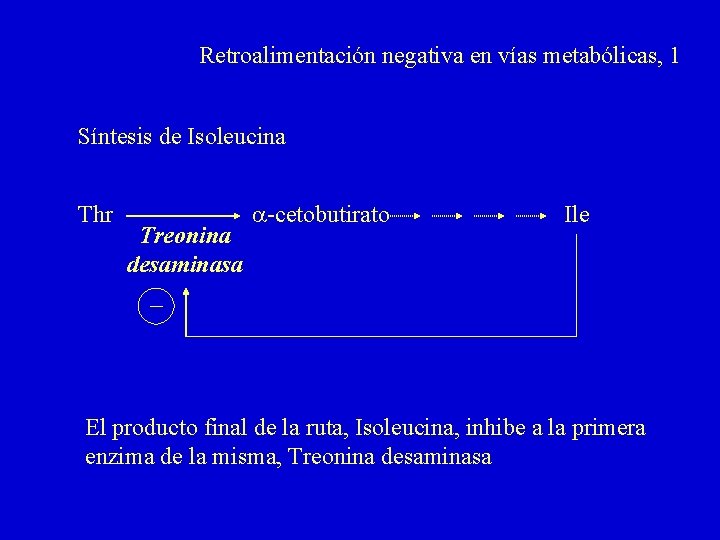
Retroalimentación negativa en vías metabólicas, 1 Síntesis de Isoleucina Thr Treonina desaminasa a-cetobutirato Ile El producto final de la ruta, Isoleucina, inhibe a la primera enzima de la misma, Treonina desaminasa

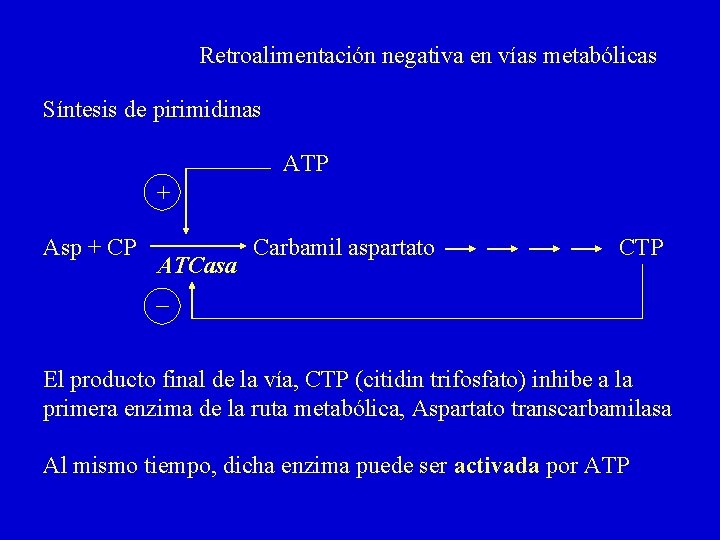
Retroalimentación negativa en vías metabólicas Síntesis de pirimidinas ATP + Asp + CP ATCasa Carbamil aspartato CTP El producto final de la vía, CTP (citidin trifosfato) inhibe a la primera enzima de la ruta metabólica, Aspartato transcarbamilasa Al mismo tiempo, dicha enzima puede ser activada por ATP

Rutas metabólicas controladas por retroalimentación Ruta Glicolisis Neoglucogénesis Bios. Ács. Grasos Bios. Colesterol Bios. Purinas Enzima Fosfofructokinasa FBP fosfatasa Acetil. Co. A carboxilasa HMGCo. A reductasa PRPP sintetasa Inhibidor ATP AMP Acil. Co. A Colesterol AMP, GMP, IMP

En el estudio de las enzimas controladas por realimentación negativa, se comprobaron una serie de regularidades en las mismas: 1. Primer paso de una ruta metabólica o punto de ramificación 2. Enzimas de naturaleza compleja: subunidades; la enzima puede desensibilizarse a sus inhibidores por diversos métodos. 3. Los inhibidores se comportan como competitivos (elevan el valor de la Km aparente, pero sin embargo no son análogos estructurales del substrato Estas últimas características lleva al concepto de alosterismo: Una acción sobre la actividad enzimática que se desarrolla fuera del Centro Activo (Jacob y Monod, 1960)

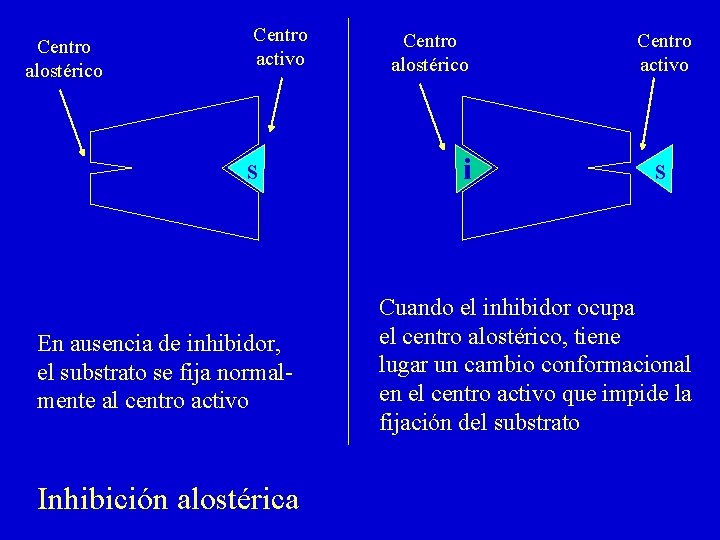
Centro alostérico Centro activo s En ausencia de inhibidor, el substrato se fija normalmente al centro activo Inhibición alostérica Centro alostérico i Centro activo s Cuando el inhibidor ocupa el centro alostérico, tiene lugar un cambio conformacional en el centro activo que impide la fijación del substrato

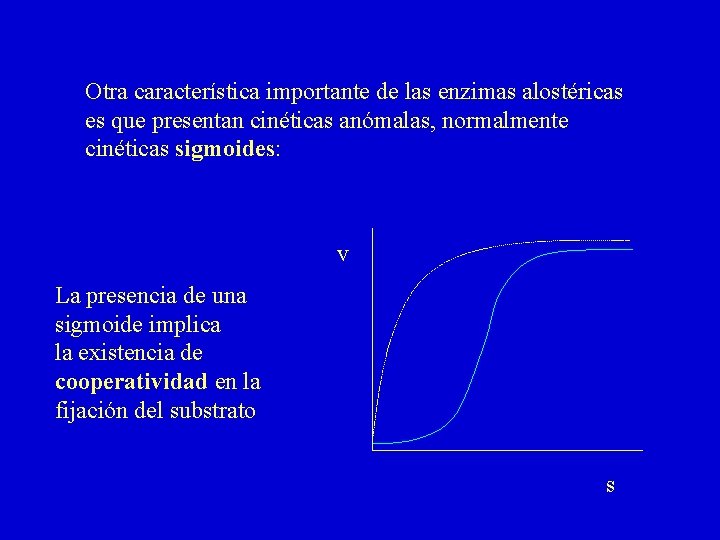
Otra característica importante de las enzimas alostéricas es que presentan cinéticas anómalas, normalmente cinéticas sigmoides: v La presencia de una sigmoide implica la existencia de cooperatividad en la fijación del substrato s

La cooperatividad (positiva) consiste en que la fijación de una molécula de substrato favorece la fijación del siguiente, y así hasta ocuparse toda la molécula s + 1 s s + 2 s s s + 3 s s En términos de Km veríamos que Km 1 > Km 2 > Km 3 Existe también cooperatividad negativa, cuando la fijación de una molécula de substrato dificulta la fijación del siguiente.

El comportamiento cooperativo implica: 1. Que hay más de un sitio de fijación de substrato por molécula de enzima (estr. cuaternaria) 2. Que hay interacciones entre los sitios de fijación

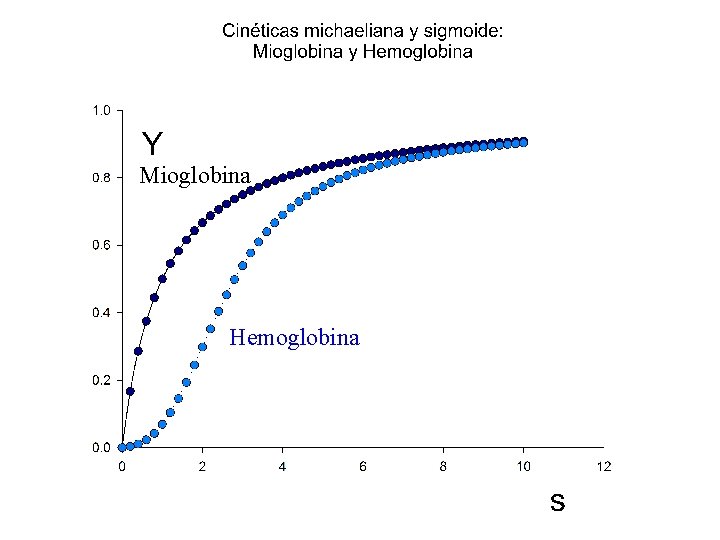
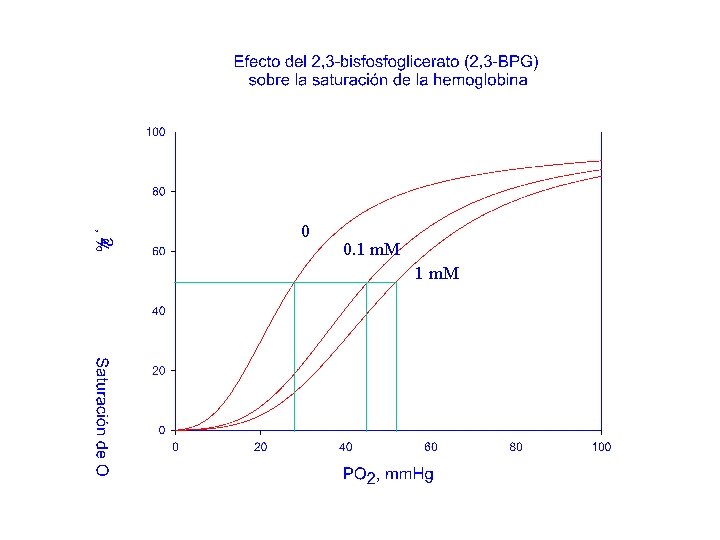
Un sistema alostérico clásico es la Hemoglobina: 1. La fijación de su “substrato”, O 2, es de tipo sigmoide 2. La fijación del “substrato” puede inhibirse por efectores (H+, CO 2, 2, 3 -BPG) que no actúan sobre el “Centro Activo” (grupo hemo) 3. Las subunidades, por separado, presentan cinética michaeliana en la fijación de O 2

Mioglobina Hemoglobina

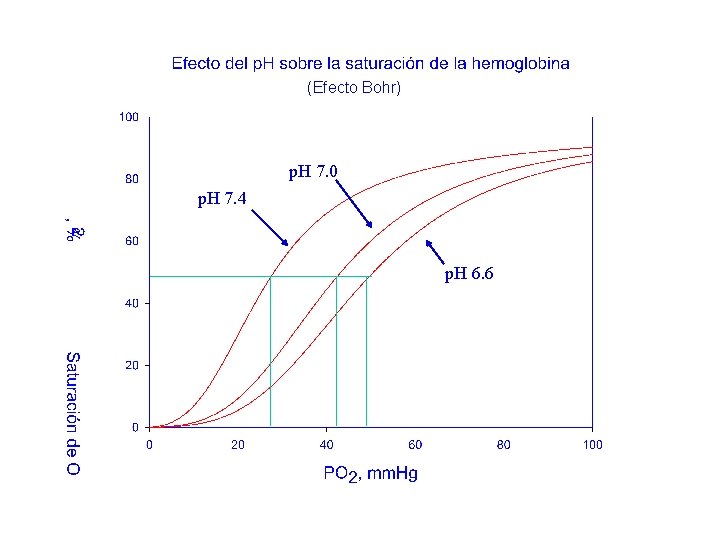
(Efecto Bohr) p. H 7. 0 p. H 7. 4 p. H 6. 6

0 0. 1 m. M

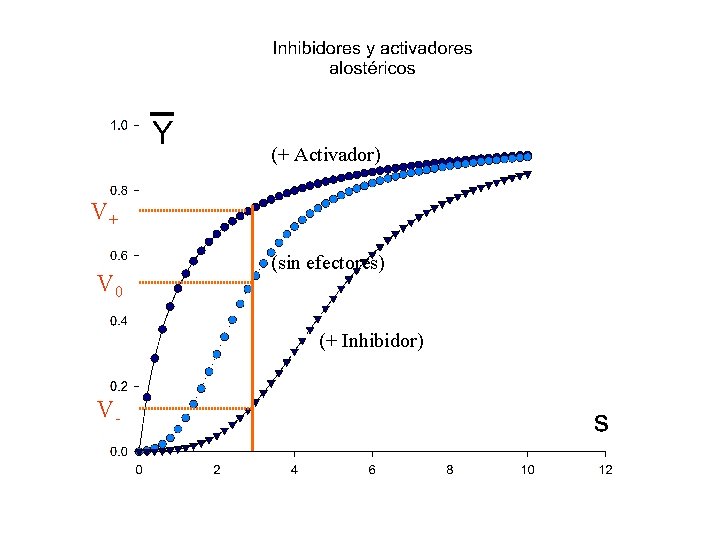
(+ Activador) V+ V 0 (sin efectores) (+ Inhibidor) V-

Los efectores alostéricos operan sobre el grado de cooperatividad del sistema: - Los inhibidores alostéricos aumentan el grado de cooperatividad - Los activadores alostéricos disminuyen el grado de cooperatividad; a concentraciones elevadas de activador, la cinética pasa a ser michaeliana, y deja de ser sigmoide.

Ecuación de Hill h > 1, cooperatividad positiva h = 1, no hay cooperatividad h < 1, cooperatividad negativa Obsérvese que para h=1, esta ecuación se reduce a una forma normalizada de la ecuación de Michaelis-Menten:

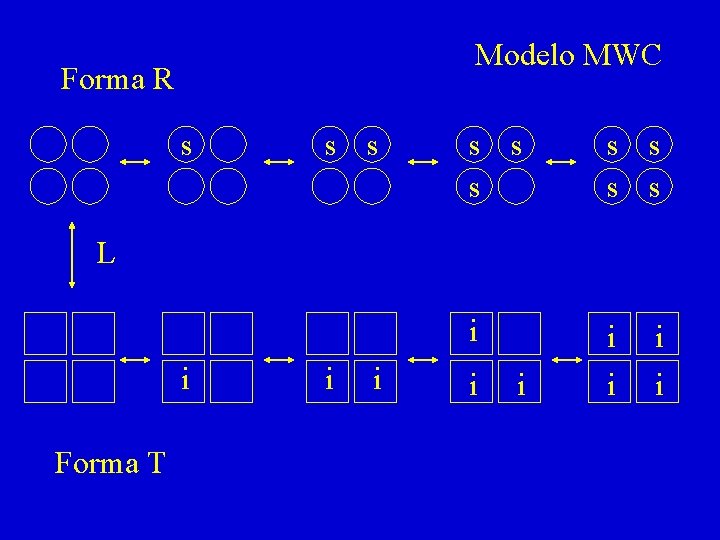
Modelo MWC Forma R s s s s s i i i L i Forma T i i i

a: Concentración normalizada de substrato, s/Km L: Constante alostérica: a mayor valor de L, mayor grado de cooperatividad (positiva) n: Número de sitios de fijación de substrato
 Ejemplo de actividad moderada
Ejemplo de actividad moderada Puntos cardinales chile
Puntos cardinales chile Ejemplo de gobierno escolar
Ejemplo de gobierno escolar Corpus christi para niñosactividades
Corpus christi para niñosactividades Actividad de poemas
Actividad de poemas Conclusión de actividad física
Conclusión de actividad física Trabajo de artes visuales para segundo básico
Trabajo de artes visuales para segundo básico Actividad
Actividad Actividad optica en quimica organica
Actividad optica en quimica organica Actividades de los pronombres
Actividades de los pronombres Remedios varo nació en _______.
Remedios varo nació en _______. Ecuacion debye huckel
Ecuacion debye huckel Modulo 23 semana 2
Modulo 23 semana 2 Leucoaraiosis
Leucoaraiosis Problemas con la ram
Problemas con la ram Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Responde en tu cuaderno las siguientes preguntas
Responde en tu cuaderno las siguientes preguntas Actividad
Actividad Tabla comparativa de software libre y comercial
Tabla comparativa de software libre y comercial Afinidad enzimatica
Afinidad enzimatica Actividad 5. diagrama de flujo
Actividad 5. diagrama de flujo