Enzimas Curvas temporales de actividad enzimtica de LDH

































- Slides: 45

Enzimas Curvas temporales de actividad enzimática de LDH

Función de las proteínas Centro de acción en procesos biológicos. • Catalizan el conjunto de reacciones químicas a las que de manera general nos referimos como vida. • Regulan: directamente como enzimas o indirectamente en forma de mensajeros químicos (hormonas, receptores, transportadores). • Dan soporte: fibras musculares, micro fibrillas en ciclo celular, etc. • En defensa: anticuerpos (inmunoglobulinas). • Papel pasivo: colágeno en huesos, tendones, ligamentos.

Proteínas En términos de estructura: relaciones tridimensionales entre los componentes atómicos de una proteína: • Estructura primaria, secundaria, terciaria y cuaternaria. • Grupos prostéticos • Modificaciones covalentes

Catalizador Molécula inorgánica u orgánica que incrementa notablemente la velocidad de una reacción química sin ser modificada o consumida en la reacción.

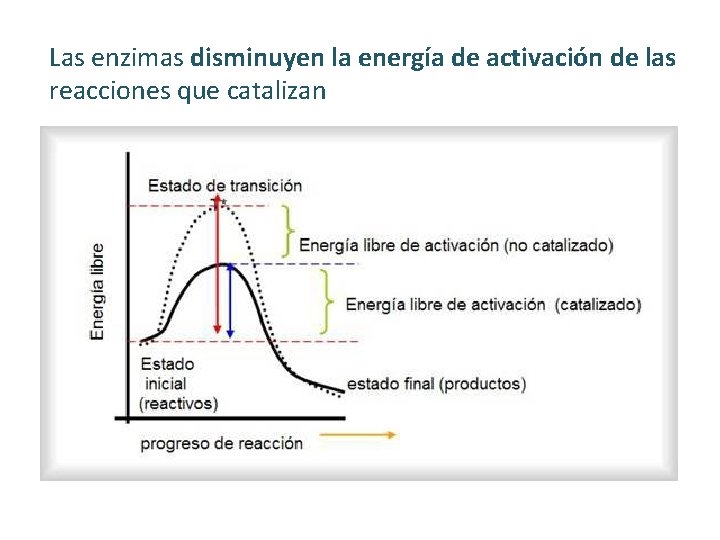
Enzimas Son catalizadores biológicos. Disminuyen la energía de activación de las reacciones que catalizan, pero NO modifican la constante de equilibrio. • Ej. Constante de equilibrio de una reacción: Keq = K 1 K-1 = 10 -3 10 -5 = 100 Reacción catalizada por una enzima acelera la reacción 10, 000 veces Keq = K 1 K-1 = 10 10 -2 = 100

Ejemplo La reacción en que una molecula de orotidina monofosfato pierde un CO 2 ocurre 1017 veces más rápida cuando es catalizada por la enzima orotidina monofosfato descarboxilasa que cuando no es catalizada. 1017 = 100, 000, 000 CIEN MIL BILLONES DE VECES MÁS RÁPIDA

Ventajas de enzimas sobre catalizadores inorgánicos • EFICIENCIA Velocidades de reacción elevadas • CONDICIONES SUAVES DE REACCIÓN Temperatura, p. H, presión • ESPECIFICIDAD DE LA REACCIÓN Unión a sustrato • CAPACIDAD DE REGULACIÓN Control alostérico, modificación covalente, Síntesisdegradación

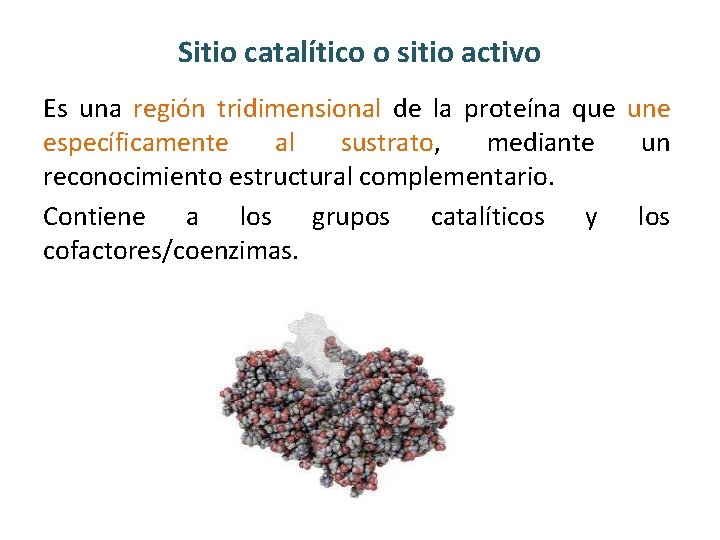
Sitio catalítico o sitio activo Es una región tridimensional de la proteína que une específicamente al sustrato, mediante un reconocimiento estructural complementario. Contiene a los grupos catalíticos y los cofactores/coenzimas.

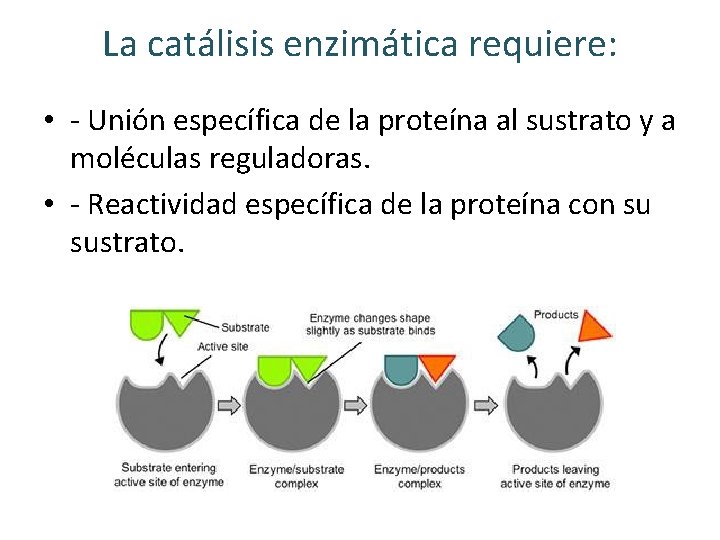
La catálisis enzimática requiere: • - Unión específica de la proteína al sustrato y a moléculas reguladoras. • - Reactividad específica de la proteína con su sustrato.

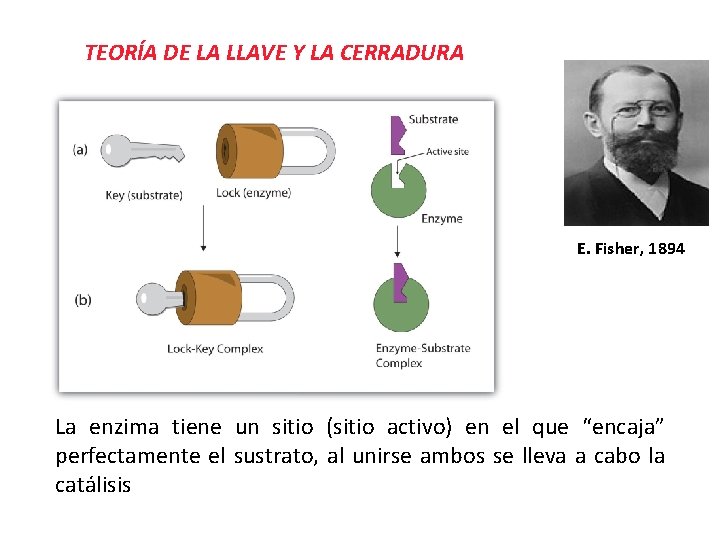
Dos teorias para explicar la unión específica enzima-sustrato: – TEORÍA DE LA LLAVE Y LA CERRADURA – TEORÍA DEL AJUSTE INDUCIDO

TEORÍA DE LA LLAVE Y LA CERRADURA E. Fisher, 1894 La enzima tiene un sitio (sitio activo) en el que “encaja” perfectamente el sustrato, al unirse ambos se lleva a cabo la catálisis

TEORÍA DEL AJUSTE INDUCIDO D. Koshland, 1958 La unión del sustrato al sitio activo de la enzima promueve un cambio conformacional de la enzima para que al unirse ambos se lleva a cabo la catálisis

CLASIFICACIÓN DE LAS ENZIMAS En general, los nombres de las enzimas se forman añadiendo el sufijo “asa” al nombre de la sustancia en la que actúan

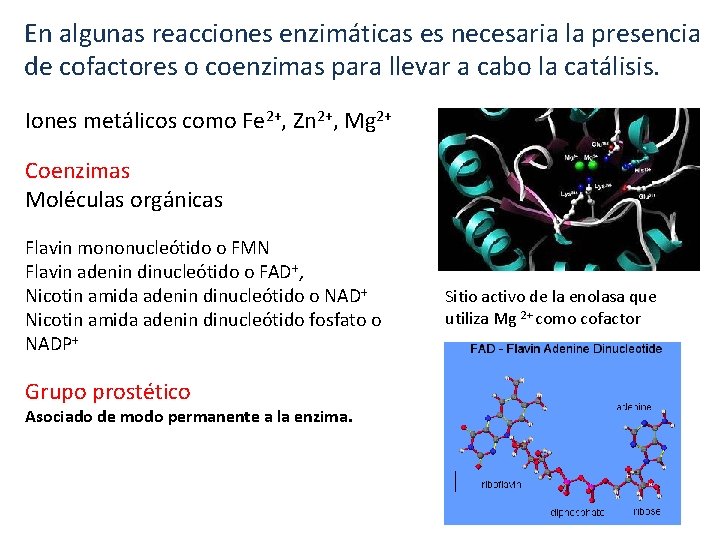
En algunas reacciones enzimáticas es necesaria la presencia de cofactores o coenzimas para llevar a cabo la catálisis. Iones metálicos como Fe 2+, Zn 2+, Mg 2+ Coenzimas Moléculas orgánicas Flavin mononucleótido o FMN Flavin adenin dinucleótido o FAD+, Nicotin amida adenin dinucleótido o NAD+ Nicotin amida adenin dinucleótido fosfato o NADP+ Grupo prostético Asociado de modo permanente a la enzima. Sitio activo de la enolasa que utiliza Mg 2+ como cofactor


Las enzimas disminuyen la energía de activación de las reacciones que catalizan

Cinética enzimática Es el estudio de la velocidad a la cual se lleva a cabo una reacción catalizada por una enzima y de los factores que la afectan.

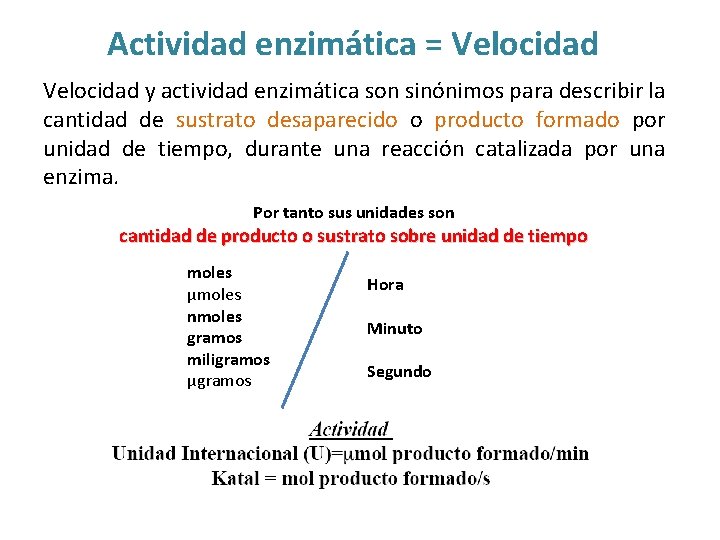
Actividad enzimática = Velocidad y actividad enzimática son sinónimos para describir la cantidad de sustrato desaparecido o producto formado por unidad de tiempo, durante una reacción catalizada por una enzima. Por tanto sus unidades son cantidad de producto o sustrato sobre unidad de tiempo moles µmoles nmoles gramos miligramos µgramos Hora Minuto Segundo


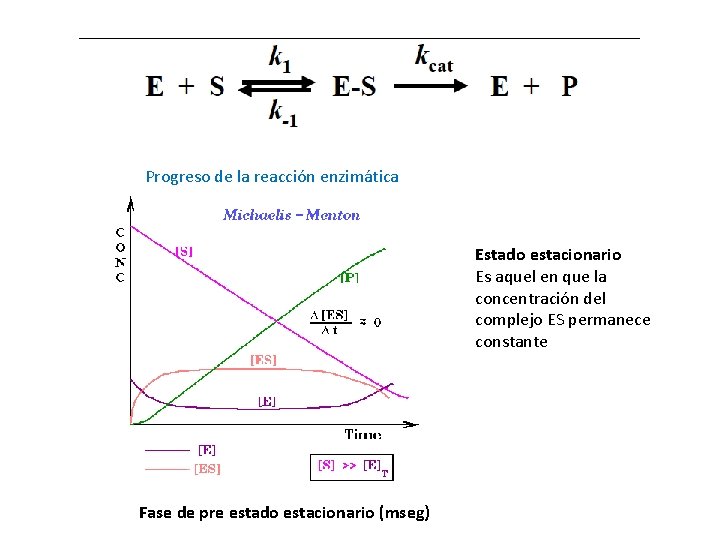
Progreso de la reacción enzimática Estado estacionario Es aquel en que la concentración del complejo ES permanece constante Fase de pre estado estacionario (mseg)

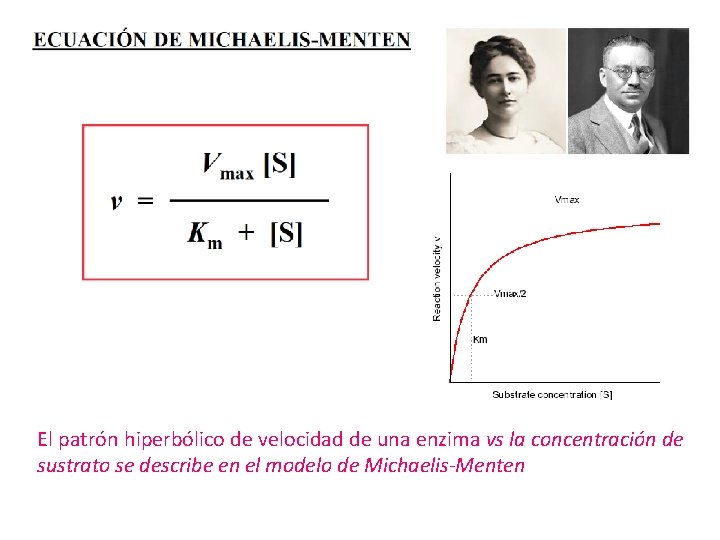
El patrón hiperbólico de velocidad de una enzima vs la concentración de sustrato se describe en el modelo de Michaelis-Menten

Condiciones en las que aplica la ecuación de Michaelis-Menten Velocidad inicial No añadir producto al medio de ensayo Concentraciones de sustrato muy superiores a la concentración de la enzima La concentración de sustrato debe permanecer “casi” constante durante el periodo de tiempo en que se mide la reacción

Velocidad inicial La velocidad de una reacción (no orden cero) disminuye a medida que ésta progresa ya que la concentración del reactante(s) disminuye, y porque si la reacción es reversible inicia la reacción inversa. • • Por ello es conveniente medir la velocidad inicial (v 0) de la reacción: la velocidad antes de que la concentración de los reactantes disminuya significativamente y que los productos alcancen una concentración que produzca una reacción inversa significativa. • En las reacciones catalizadas por enzimas, dos razones que hacen conveniente medir velocidades iniciales: 1) el producto puede ser un inhibidor de la reacción, aún cuando la reacción no sea reversible. 2) la enzima puede ser inestable en el medio de reacción.

Parámetros cinéticos Velocidad máxima

Constante de Michaelis-Menten (Km) La Km es la concentración de sustrato a la cual la velocidad es: Vmax/2 Es un parámetro de afinidad de la enzima por el sustrato Km ↑= baja unión al sustrato, baja afinidad por el sustrato Km ↓= alta unión al sustrato, alta afinidad por el sustrato

Factores que afectan la velocidad de una reacción catalizada por enzimas Concentración de sustrato / cofactores Concentración de enzima Inhibidores Activadores p. H Temperatura

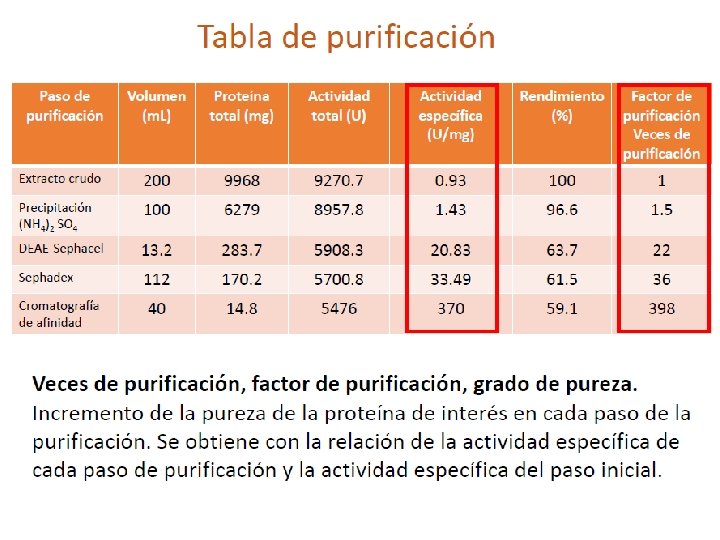
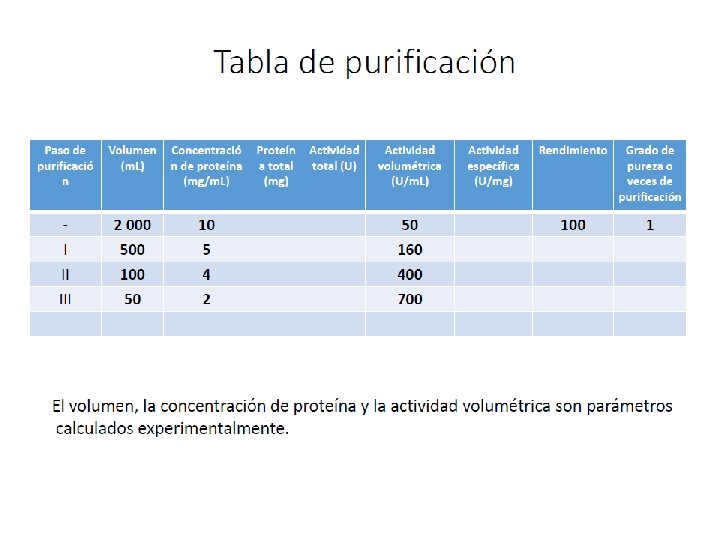
Actividad específica La actividad específica es la velocidad de una reacción enzimática expresada en términos de la cantidad de enzima.

Diseño de un ensayo enzimático Para el diseño de un ensayo enzimático se requiere conocer la reacción que se analiza: A) Cuáles son las especies que se requieren: sustrato, la o las coenzimas, el o los cofactores, entre otros. B) La estequiometría de la reacción C) Los efectos de p. H, temperatura y fuerza iónica sobre la actividad de la enzima.

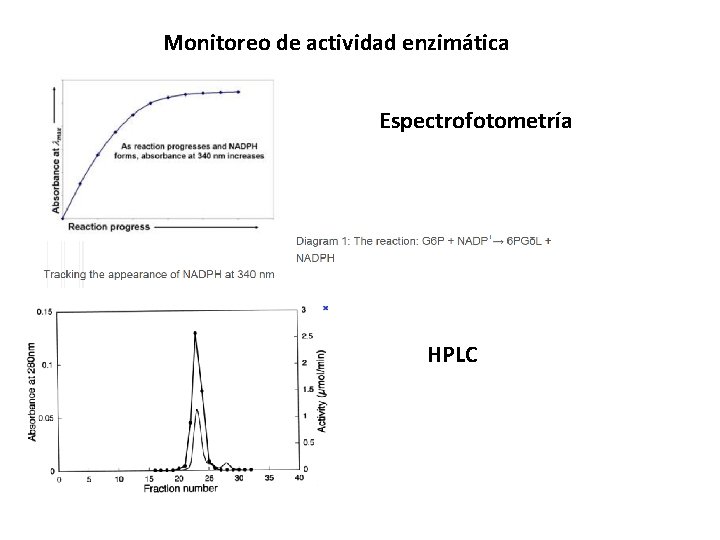
Monitoreo de actividad enzimática Espectrofotometría HPLC

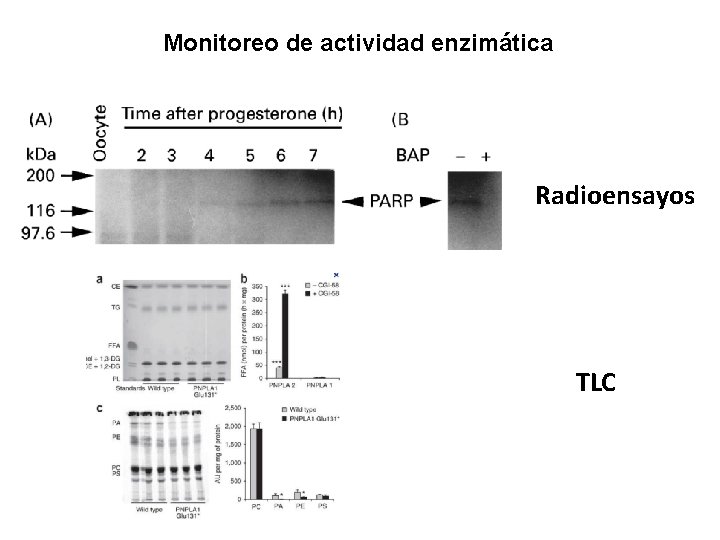
Monitoreo de actividad enzimática Radioensayos TLC

LDH (EC 1. 1. 1. 27). Enzima importante en el metabolismo anaerobio de la glucosa para la regeneración de ATP. El piruvato es reducido a lactato gracias a la oxidación de NADH a NAD+



¿Qué hacer en la práctica? 1. Cambiar el switch mental y enfocar los pensamientos en BIOQUÍMICA! 2. Recordar los pasos a seguir para realizar las curvas temporales (determinar actividad por espectrofotometría) 3. ¡Mantener los tubos en hielo! 4. Determinar la actividad de la LDH mediante curvas temporales











 1 met = 1 kcal/kg/hr
1 met = 1 kcal/kg/hr Ldh
Ldh Ldh
Ldh Transudate
Transudate Ldh
Ldh Ldh size
Ldh size Enzima
Enzima Ldh informational bulletins
Ldh informational bulletins Que es la centrifugacion diferencial
Que es la centrifugacion diferencial What causes hemolytic anemia
What causes hemolytic anemia Health standards louisiana
Health standards louisiana Lattato deidrogenasi
Lattato deidrogenasi Niveles normales ldh
Niveles normales ldh Pluralidad de voces narrativas
Pluralidad de voces narrativas Marcadores de preterito perfecto
Marcadores de preterito perfecto Tipos de albergues temporales
Tipos de albergues temporales Conectores de consecuencia
Conectores de consecuencia Imperfecto pasado
Imperfecto pasado Efectivos temporales
Efectivos temporales Conectores condicionales
Conectores condicionales Albergues temporales
Albergues temporales Nervus nasopalatinus
Nervus nasopalatinus Diseño de series temporales
Diseño de series temporales Elementos espaciales de una onda
Elementos espaciales de una onda Comunicacion pulpar
Comunicacion pulpar Relación endofórica
Relación endofórica Heterotermos temporales
Heterotermos temporales Inversiones temporales
Inversiones temporales Las técnicas narrativas analépticas
Las técnicas narrativas analépticas Surco sagital
Surco sagital Mimopyramidové dráhy
Mimopyramidové dráhy Proyecto 1 elaborar un ensayo sobre un tema de interés
Proyecto 1 elaborar un ensayo sobre un tema de interés Que son conectores temporales
Que son conectores temporales Serie de tiempo estacional
Serie de tiempo estacional Clases de adverbios
Clases de adverbios Ajuste de curvas calculo numerico
Ajuste de curvas calculo numerico Elipse en la vida real
Elipse en la vida real Curvas de indiferencia atipicas
Curvas de indiferencia atipicas Metodos numericos
Metodos numericos Estágios de produção microeconomia
Estágios de produção microeconomia Trigger respirador
Trigger respirador Qumica
Qumica Area entre dos curvas
Area entre dos curvas Curvas de templabilidad
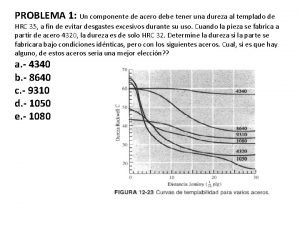
Curvas de templabilidad Curvas y mapas de indiferencia
Curvas y mapas de indiferencia Curvas tangentes
Curvas tangentes