3 ACTIVIDAD ENZIMTICA PARTE II FACTORES QUE MODIFICAN







![Transformación de la ecuación de Michaelis-Menten v Lineal 1/v vs 1/[S] (Dobles recíprocos o Transformación de la ecuación de Michaelis-Menten v Lineal 1/v vs 1/[S] (Dobles recíprocos o](https://slidetodoc.com/presentation_image_h/15a64cb3bc7cd6032f87a5ae981f6874/image-14.jpg)
















- Slides: 44

3. ACTIVIDAD ENZIMÁTICA PARTE II. FACTORES QUE MODIFICAN LA ACTIVIDAD DE LAS ENZIMAS: EFECTO DE LA CONCETRACIÓN DE SUSTRATO Y DE UN INHIBIDOR

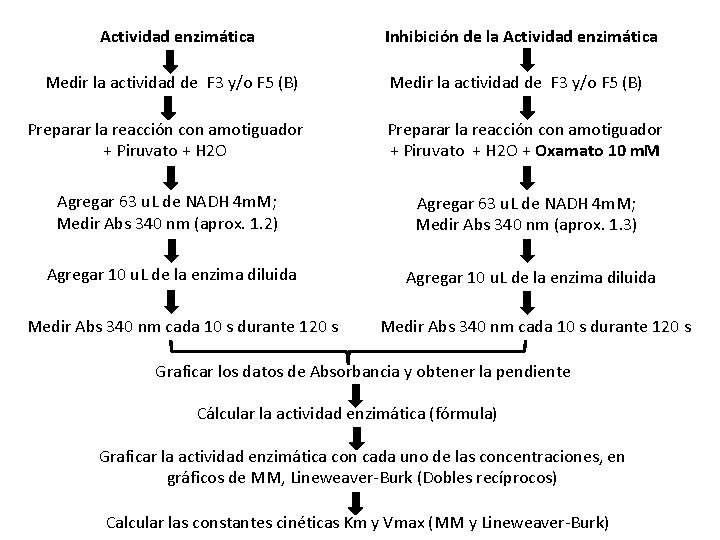
Práctica Objetivos: ü Determinar la cantidad de sustrato en la cual la enzima alcanza su Vmax. ü Calcular los parámetros cinéticos de la reacción catalizada de la enzima LDH utilizando diferentes gráficos de la ecuación linearizada de Michaelis-Menten. ü Determinar el efecto de un inhibidor (Oxamato) en la actividad de LDH. ü Analizar el efecto del inhibidor sobre los parámetros cinéticos.


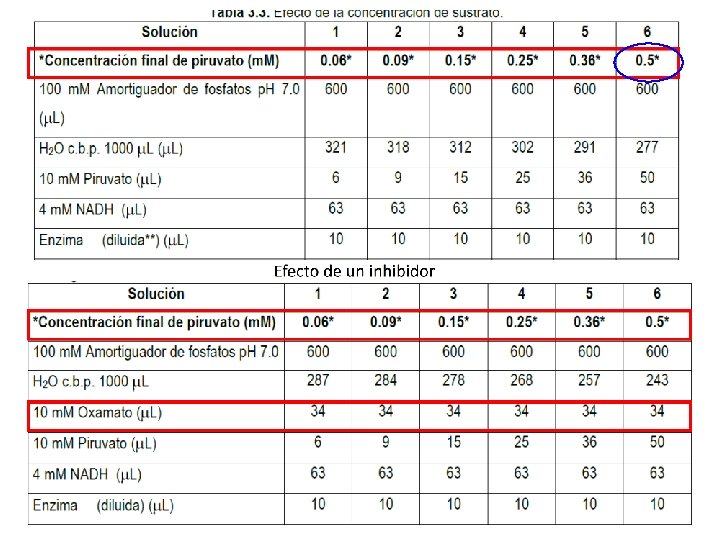
Práctica ü Se determinará la Km y Vmax ü Se mantendrán constantes la concentración de enzima, p. H y temperatura de la reacción. ü Se determinará el tipo de inhibición del oxamato en la enzima LDH. Ø Se determinará la actividad enzimática a concentraciones de piruvato (sustrato) ascendentes: Piruvato (10 m. M) 0. 06, 0. 09, 0. 15, 0. 25, 0. 36, 0. 5 m. M Ø Con las mismas concentraciones de piruvato, medir el efecto del oxamato (inhibidor) en la enzima a una concentración constante de 10 m. M

Actividad enzimática Medir la actividad de F 3 y/o F 5 (B) Inhibición de la Actividad enzimática Medir la actividad de F 3 y/o F 5 (B) Preparar la reacción con amotiguador + Piruvato + H 2 O + Oxamato 10 m. M Agregar 63 u. L de NADH 4 m. M; Medir Abs 340 nm (aprox. 1. 2) Agregar 63 u. L de NADH 4 m. M; Medir Abs 340 nm (aprox. 1. 3) Agregar 10 u. L de la enzima diluida Medir Abs 340 nm cada 10 s durante 120 s Graficar los datos de Absorbancia y obtener la pendiente Cálcular la actividad enzimática (fórmula) Graficar la actividad enzimática con cada uno de las concentraciones, en gráficos de MM, Lineweaver-Burk (Dobles recíprocos) Calcular las constantes cinéticas Km y Vmax (MM y Lineweaver-Burk)


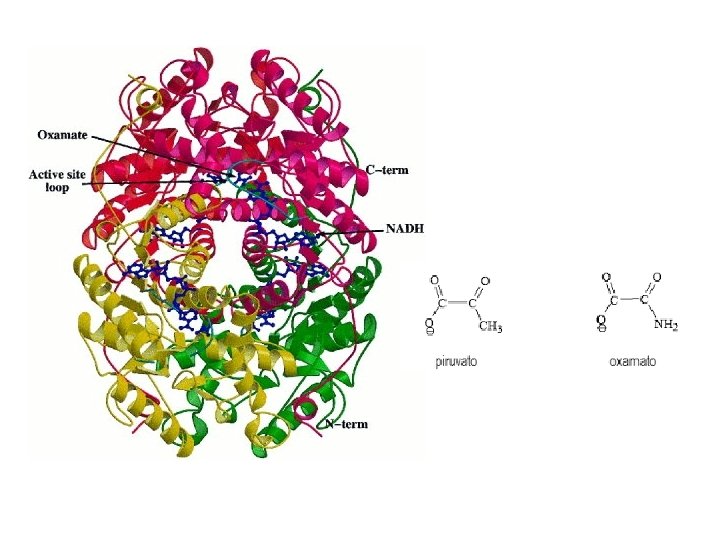
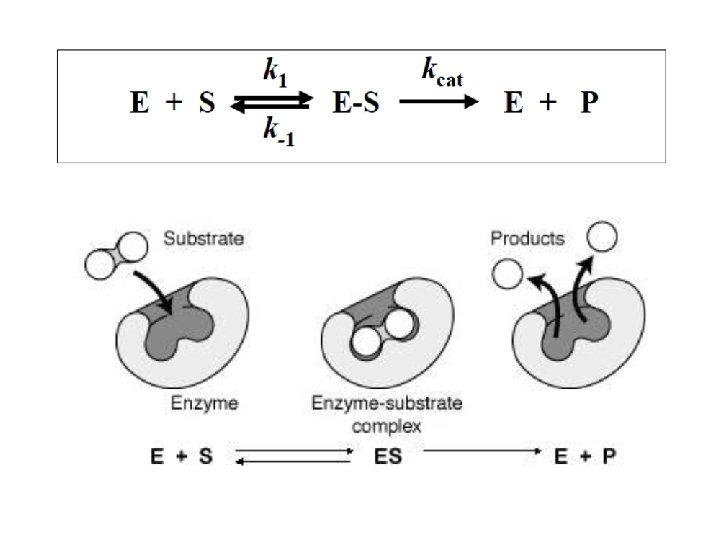
¿Qué son las enzimas? • Son proteínas que catalizan reacciones bioquímicas que se llevan a cabo en la célula (catalizadores biológicos). • Tienen un sitio activo donde se encuentran los grupos químicos responsables de la reacción. • Son altamente específicas a la reacción que catalizan (catalizadores específicos), que catalizan un solo tipo de reacción y casi siempre actúan sobre un solo sustrato o un grupo reducido de ellos. • Muchas de las enzimas necesitan de cofactores para realizar su función (en su mayoría de grupos metálicos unidos al grupo activo o como cofactores). • Su función depende de la integridad de la proteína. • Los reactivos de las reacciones catalizadas por las enzimas se denominan sustratos.

La velocidad de una reacción catalizada por una enzima depende de factores como: ü Actividad enzimática ü La concentración del sustrato [S] ü Concentración de la enzima ü La temperatura ü El p. H del medio ü Inhibidores ü Activadores

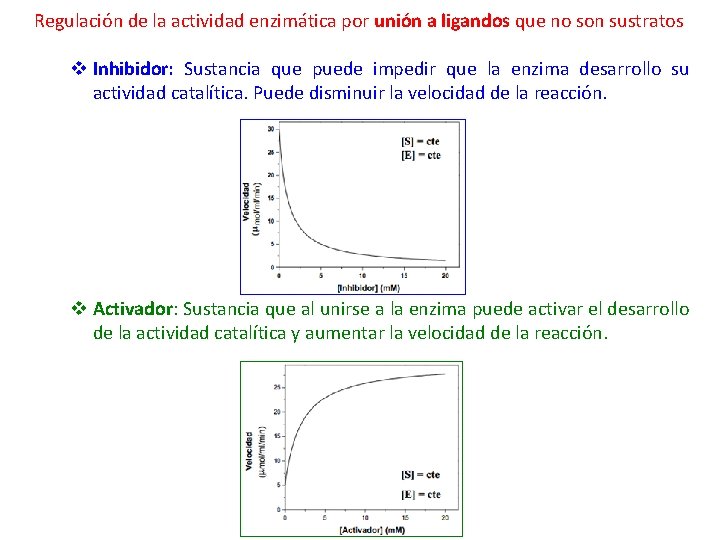
Regulación de la actividad enzimática Modificaciones en la enzima v Unión de ligandos (sustratos y no sustratos) • Inhibidores • Activadores v Regulación covalente • Fosforilación • Proteólisis v Isoenzimas Cantidad de enzima v Síntesis • Expresión del gen • Síntesis en el ribosoma v Degradación

Regulación de la actividad enzimática por unión a ligandos que no son sustratos v Inhibidor: Sustancia que puede impedir que la enzima desarrollo su actividad catalítica. Puede disminuir la velocidad de la reacción. v Activador: Sustancia que al unirse a la enzima puede activar el desarrollo de la actividad catalítica y aumentar la velocidad de la reacción.


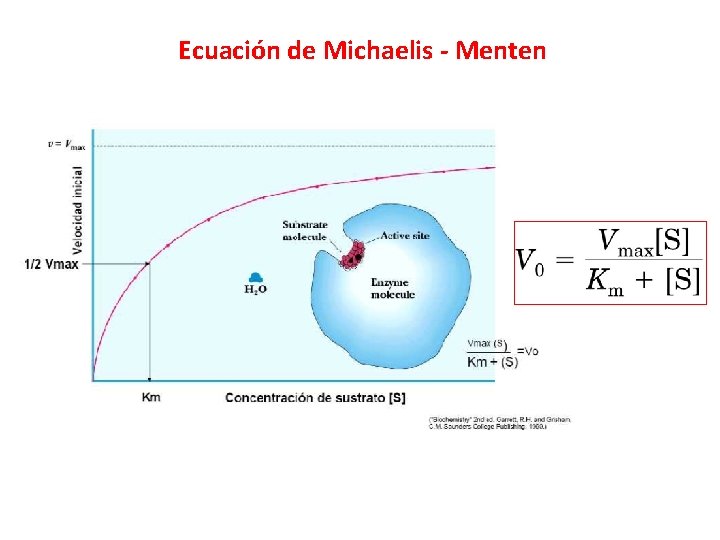
Ecuación de Michaelis - Menten

Parámetros enzimáticos Vmax: Se alcanza cuando todos los sitios activos están ocupados por el sustrato (100% de los sitios activos). Cuando toda la enzima esta como [ES]. KM: Concentración de sustrato a la que V 0 es la ½ de Vmax (50% de los sitios activos ocupados). Cuanto menor es la Km, mayor es la afinidad de la enzima por el sustrato. Es constante en cada enzima. (Constate de Michaelis-Menten) KCAT: Número de recambio. Número de moléculas de sustrato convertidos en producto por unidad de enzima y por unidad de tiempo en condiciones saturantes del sustrato. Constante de especificidad (Kcat/Km): Indica cual es el mejor sustrato (aquel que tenga la mayor constante). Indica a eficiencia catalítica de la enzima. Representa el paso de unión de la enzima y el sustrato (cualquier factor que afecte esta afectando la constante de paso de unión).
![Transformación de la ecuación de MichaelisMenten v Lineal 1v vs 1S Dobles recíprocos o Transformación de la ecuación de Michaelis-Menten v Lineal 1/v vs 1/[S] (Dobles recíprocos o](https://slidetodoc.com/presentation_image_h/15a64cb3bc7cd6032f87a5ae981f6874/image-14.jpg)
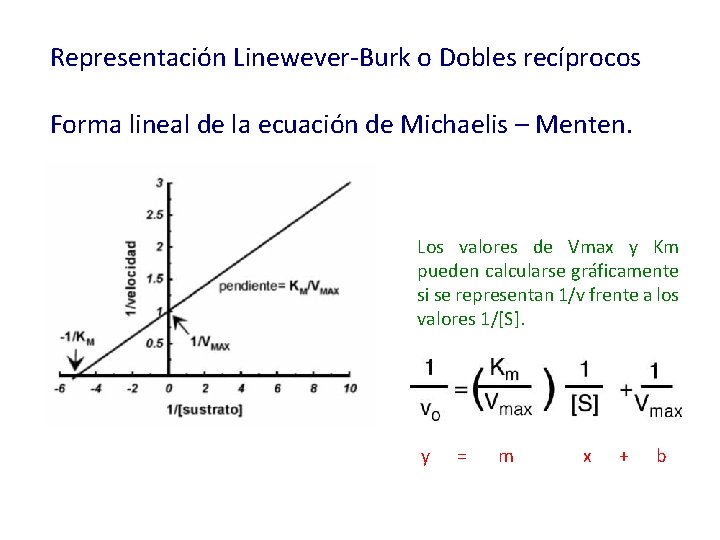
Transformación de la ecuación de Michaelis-Menten v Lineal 1/v vs 1/[S] (Dobles recíprocos o Linewever-Burk) v Sigmoidal v vs log S (Semi-logarítmica)

Representación Linewever-Burk o Dobles recíprocos Forma lineal de la ecuación de Michaelis – Menten. Los valores de Vmax y Km pueden calcularse gráficamente si se representan 1/v frente a los valores 1/[S]. y = m x + b


Inhibición de la actividad enzimática ² Inhibidores presentes en la célula: regulación metabólica. ² Agentes tóxicos o drogas: acción tóxica. ² Agentes farmacológicos: acción terapéutica. Tipos de inhibición: Ø Irreversible Ø Reversible • Competitivo • No competitivo • Incompetitivo

Tipos de inhibidores Reversibles Competitiva: El inhibidor se une a la enzima libre interfiriendo con la unión del sustrato. Incompetitivo: El inhibidor se une al complejo enzima-sustrato interfiriendo con la formación de producto. No competitivo: Es un tipo especial de inhibidor mixto que se une con igual afinidad a la enzima libre y al complejo enzima-sustrato. Mixto: El inhibidor se une tanto a la enzima libre como al complejo enzima sustrato, interfiriendo la unión del sustrato y la formación del producto.

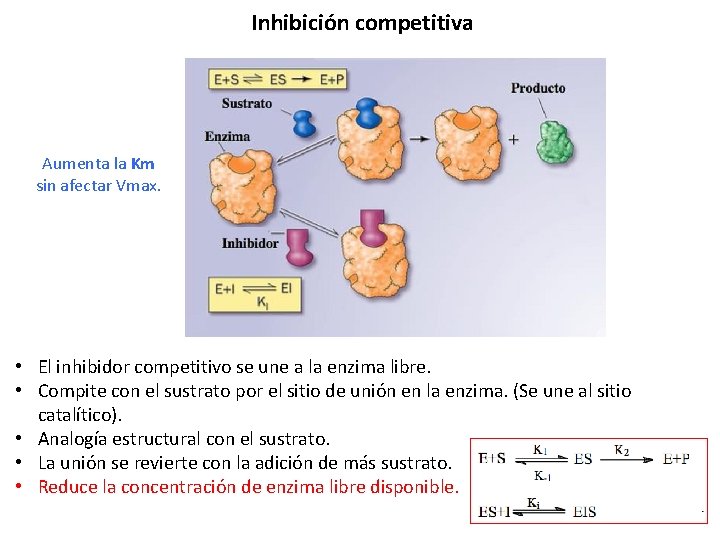
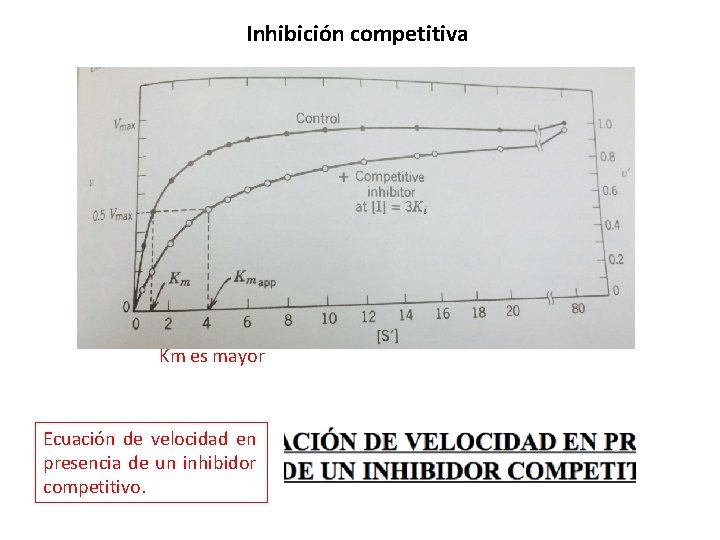
Inhibición competitiva Aumenta la Km sin afectar Vmax. • El inhibidor competitivo se une a la enzima libre. • Compite con el sustrato por el sitio de unión en la enzima. (Se une al sitio catalítico). • Analogía estructural con el sustrato. • La unión se revierte con la adición de más sustrato. • Reduce la concentración de enzima libre disponible.

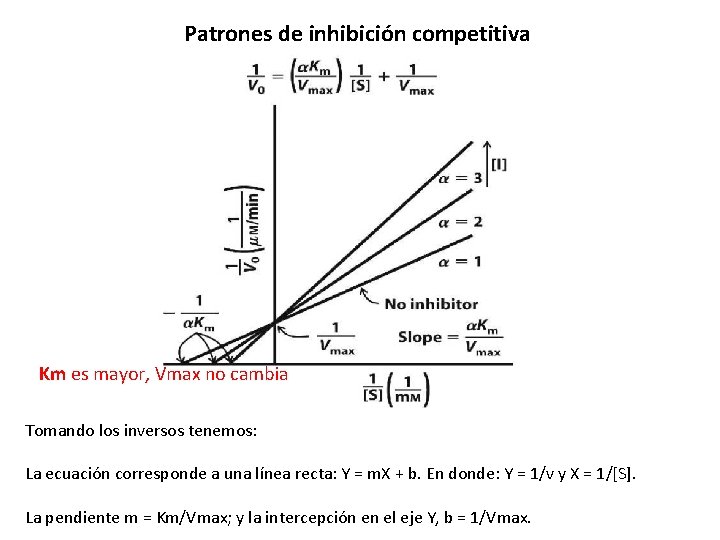
Patrones de inhibición competitiva Km es mayor, Vmax no cambia Tomando los inversos tenemos: La ecuación corresponde a una línea recta: Y = m. X + b. En donde: Y = 1/v y X = 1/[S]. La pendiente m = Km/Vmax; y la intercepción en el eje Y, b = 1/Vmax.

Inhibición competitiva Km es mayor Ecuación de velocidad en presencia de un inhibidor competitivo.

Tipos de inhibidores Reversibles Competitiva: El inhibidor se une a la enzima libre interfiriendo con la unión del sustrato. Incompetitivo: El inhibidor se une al complejo enzima-sustrato interfiriendo con la formación de producto. No competitivo: Es un tipo especial de inhibidor mixto que se une con igual afinidad a la enzima libre y al complejo enzima-sustrato. Mixto: El inhibidor se une tanto a la enzima libre como al complejo enzima sustrato, interfiriendo la unión del sustrato y la formación del producto.

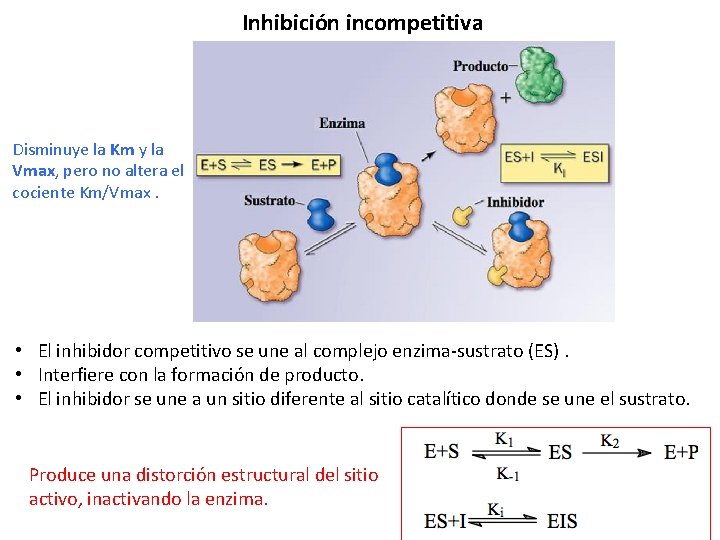
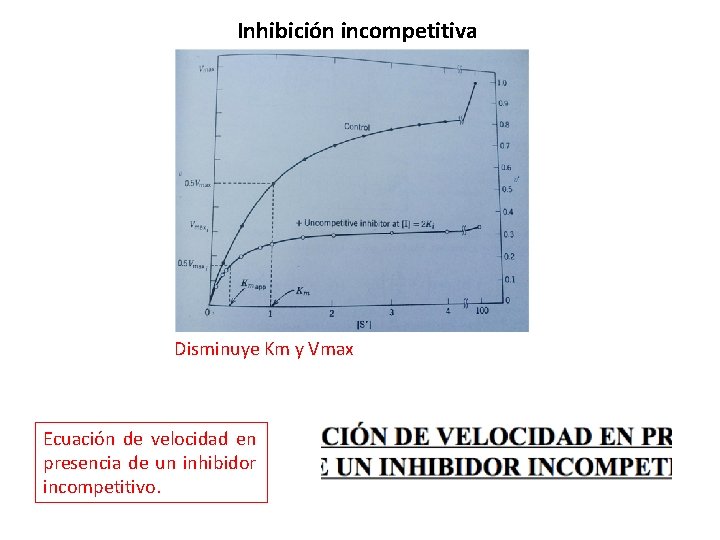
Inhibición incompetitiva Disminuye la Km y la Vmax, pero no altera el cociente Km/Vmax. • El inhibidor competitivo se une al complejo enzima-sustrato (ES). • Interfiere con la formación de producto. • El inhibidor se une a un sitio diferente al sitio catalítico donde se une el sustrato. Produce una distorción estructural del sitio activo, inactivando la enzima.

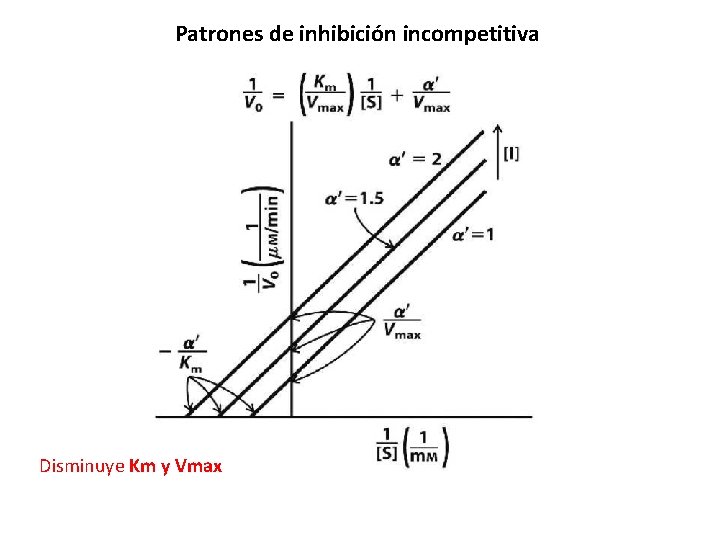
Patrones de inhibición incompetitiva Disminuye Km y Vmax

Inhibición incompetitiva Disminuye Km y Vmax Ecuación de velocidad en presencia de un inhibidor incompetitivo.

Tipos de inhibidores Reversibles Competitiva: El inhibidor se une a la enzima libre interfiriendo con la unión del sustrato. Incompetitivo: El inhibidor se une al complejo enzima-sustrato interfiriendo con la formación de producto. No competitivo: Es un tipo especial de inhibidor mixto que se une con igual afinidad a la enzima libre y al complejo enzima-sustrato. Mixto: El inhibidor se une tanto a la enzima libre como al complejo enzima sustrato, interfiriendo la unión del sustrato y la formación del producto.

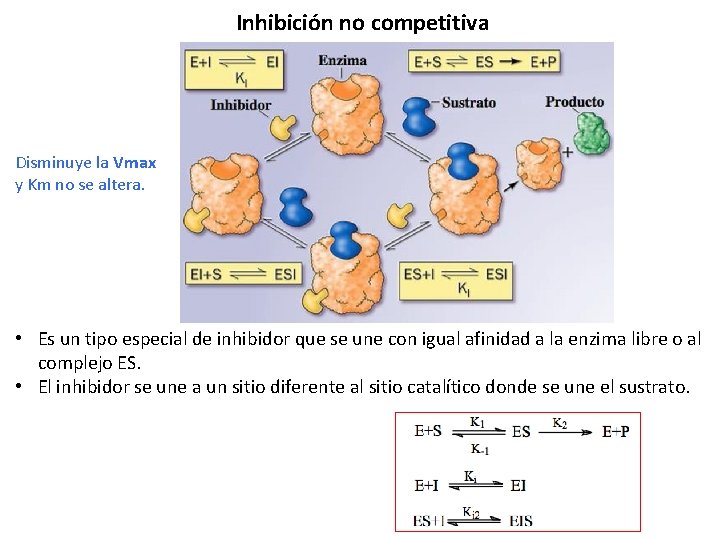
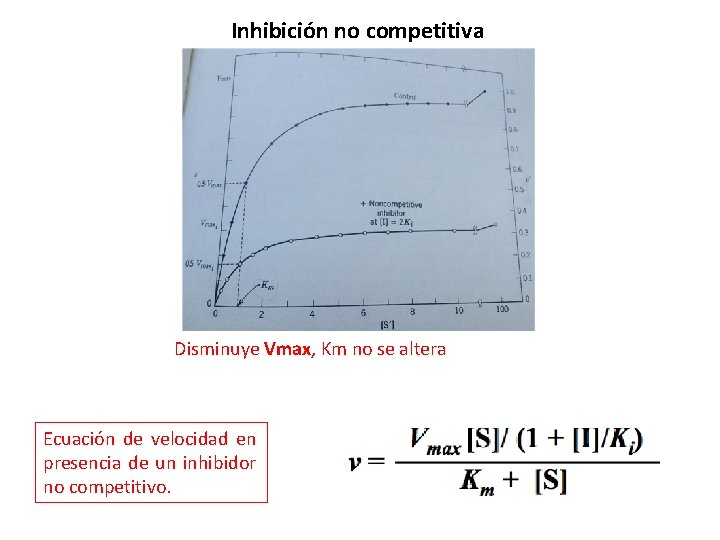
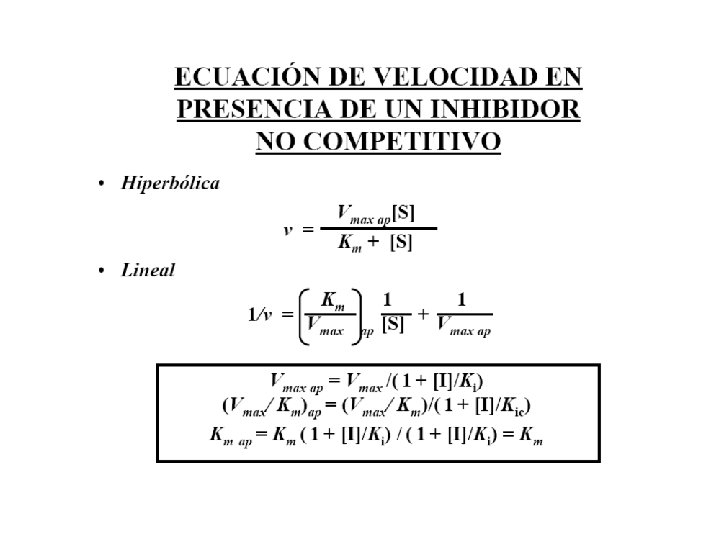
Inhibición no competitiva Disminuye la Vmax y Km no se altera. • Es un tipo especial de inhibidor que se une con igual afinidad a la enzima libre o al complejo ES. • El inhibidor se une a un sitio diferente al sitio catalítico donde se une el sustrato.

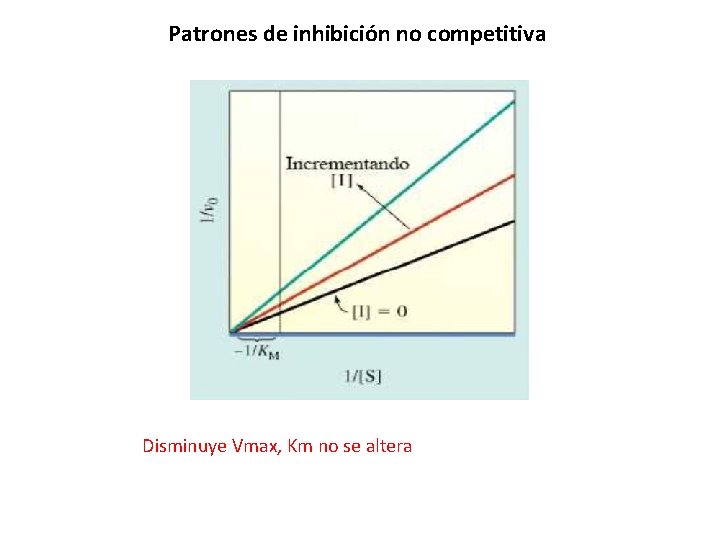
Patrones de inhibición no competitiva Disminuye Vmax, Km no se altera

Inhibición no competitiva Disminuye Vmax, Km no se altera Ecuación de velocidad en presencia de un inhibidor no competitivo.

Tipos de inhibidores Reversibles Competitiva: El inhibidor se une a la enzima libre interfiriendo con la unión del sustrato. Incompetitivo: El inhibidor se une al complejo enzima-sustrato interfiriendo con la formación de producto. No competitivo: Es un tipo especial de inhibidor mixto que se une con igual afinidad a la enzima libre y al complejo enzima-sustrato. Mixto: El inhibidor se une tanto a la enzima libre como al complejo enzima sustrato, interfiriendo la unión del sustrato y la formación del producto.

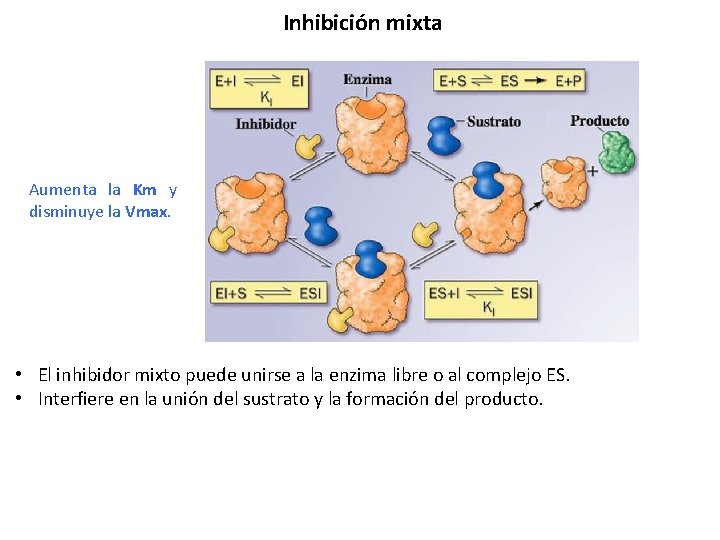
Inhibición mixta Aumenta la Km y disminuye la Vmax. • El inhibidor mixto puede unirse a la enzima libre o al complejo ES. • Interfiere en la unión del sustrato y la formación del producto.

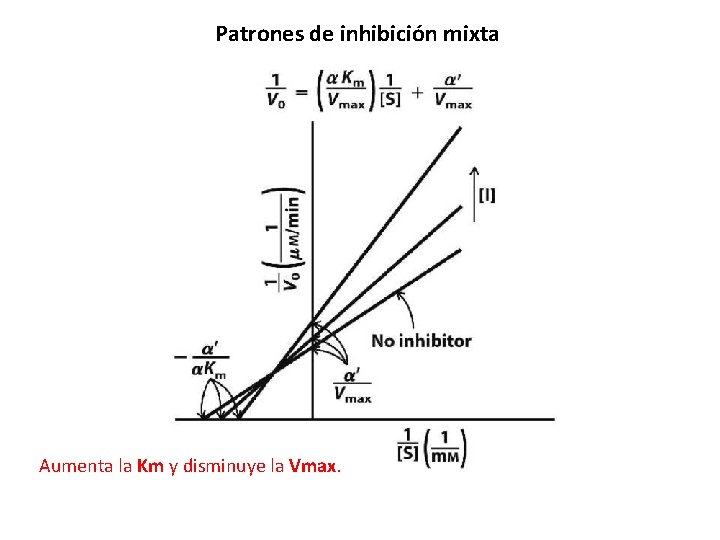
Patrones de inhibición mixta Aumenta la Km y disminuye la Vmax.

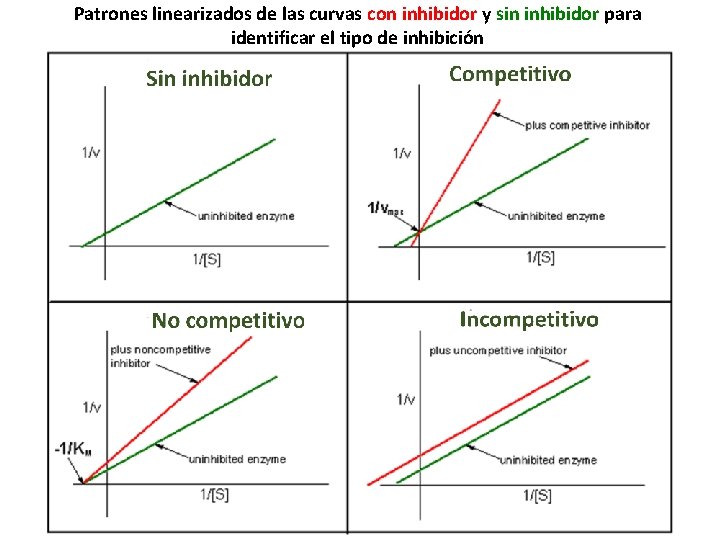
Patrones linearizados de las curvas con inhibidor y sin inhibidor para identificar el tipo de inhibición


Material Adicional

La enzima más eficiente es aquella que posee el mayor valor de KCAT/Km (Constante de especificidad).

Unidades de los parámetros enzimáticos






Gráfica de representación de Eadie-Hofsteen Ecuación de Eadie-Hofsteen de la velocidad de la reacción La representación de Vo frente a Vo/[S] se conoce como la representación de Eadie-Hofsteen. Donde: Vo = representa la velocidad de la reacción Km = constante de Michaelis- Menten [S] = concentración de sustrato Vmax = máximo de la velocidad de la reacción • Se le asigna el mismo peso a todos lo puntos para cualquier rango de concentración del sustrato, tiene menos margen de error. • Las variables son dependientes de la velocidad de la reacción. • Se obtiene multiplicando ambos miembros de la ecuación Lineweaver-Burk por Vmax.
