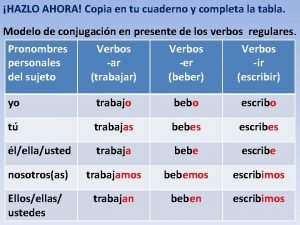
Responde en tu cuaderno 1 Dibuja un tomo

Responde en tu cuaderno: 1. Dibuja un átomo y rotula todas sus partes (lápiz) 2. El número atómico Z representa: a) nº electrones b) nº protones c) nº neutrones 3. Un isótopo tiene: a) mismo nº protones y nº electrones y distinto nº neutrones b) mimo nº neutrones y nº electrones y distinto nº protones c) mismo nº protones y nº neutrones y distinto nº eletrones 4. El número másico A es igual a: a) nº protones + nº electrones b) nº protones + nº neutrones c) nº electrones + nº neutrones 5. Las series de elementos en vertical se llaman periodos y en horizontal grupos a) Verdadero b) Falso

Actividad 1: - Responde a las preguntas 1 – 4 (al final de los apuntes) - Extensión: comienza a memorizar los números de oxidación de los elementos

Masa molecular Las moléculas están formadas por átomos. La masa de una molécula es igual a la suma de las masas de los átomos que la forman. Por ejemplo, la masa molecular del oxígeno gas (O 2) se calcula a partir de la masa atómica del oxígeno, 16 u: 2 átomos de oxígeno (O) = 2 × 16 = 32 u La masa molecular de las sustancias se expresa en unidades de masa atómica (uma o u). Sin embargo, estas unidades son extremadamente pequeñas: u = 1. 66 × 10 -24 g, en otras palabras 0. 000000000000166 g.

Actividad 6. - Calcula la masa molecular de los siguientes compuestos: a) KMn. O 4 b) KCl c) Al 2(SO 4)3 d) H 2 CO 3 e) Ba(Cl. O 3)2 Masas atómicas: K: 39; Mn: 55; O: 16; Cl: 35. 5; Al: 27; S: 32; H: 1; C: 12; Ba : 137

Masa molecular La masa molecular de las sustancias se expresa en unidades de masa atómica (uma o u)… …pero estas unidades son extremadamente pequeñas… u = 1. 66 × 10 -24 g = 0. 000000000000166 g … tan pequeñas que no podemos medirlas en el laboratorio. Necesitamos usar unidades mayores que podamos medir. ¿Cómo resolver éste problema? Con la unidad mol

Mol Una masa de cualquier sustancia igual a la masa molecular en u pero expresada en gramos contiene un número constante de partículas. Este número es tan grande como 6. 023 × 1023 y… … se denomina Número de Avogadro (NA). La cantidad de materia que contiene 6. 023 × 1023 partículas (átomos, moléculas, iones, electrones) se llama Mol La unidad de esa cantidad de materia es el Mol (M) https: //www. youtube. com/watch? v=iy. J 7 f 6 pp. Ga. Q

Mol ¿Cuántas moléculas contienen 1 mol de hidróxido de magnesio, Mg(OH)2? Datos: Masas atómicas H: 1 u, O: 16 u, Mg: 24 u. 1) Calculamos la masa molecular: 2 x 24 + 2 x(16 + 1) = 48 + 34 = 82 uma 2) Multiplicamos la masa molecular por 6, 023 x 1023 82 x 6, 023 x 1023 = 494 x 1023 = 4, 94 x 1025 Usamos notación científica para estos números tran grandes Calcula cuántas moléculas contiene un mol de las sustancias indicadas en el ejercicio 5 y (extensión) 6

Mol Factores de conversión: Masa molecular (uma) en g = 6, 023 x 1023 partículas = 1 Mol (M) Fórmula Moles = g/masa molecular 23 Nº partículas = moles x 6, 023 x 10

Mol Factores de conversión: Masa molecular (uma) en g = 6, 023 x 1023 partículas = 1 Mol (M) ¿Cuántas moléculas contienen 36 gramos de agua? ¿Cuál es la masa de cada molécula? Datos: Masas atómicas H: 1 u, O: 16 u. Masa molecular: 2 x 1 + 16 = 18 uma 6, 023 x 1023 moléculas x 36 g = 3903 x 1023 = 3, 9 x 1026 18 g
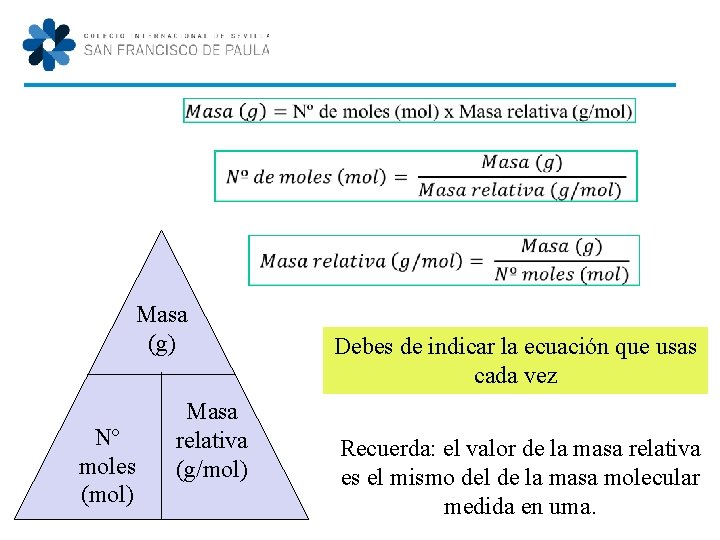
Masa (g) Nº moles (mol) Masa relativa (g/mol) Debes de indicar la ecuación que usas cada vez Recuerda: el valor de la masa relativa es el mismo del de la masa molecular medida en uma.
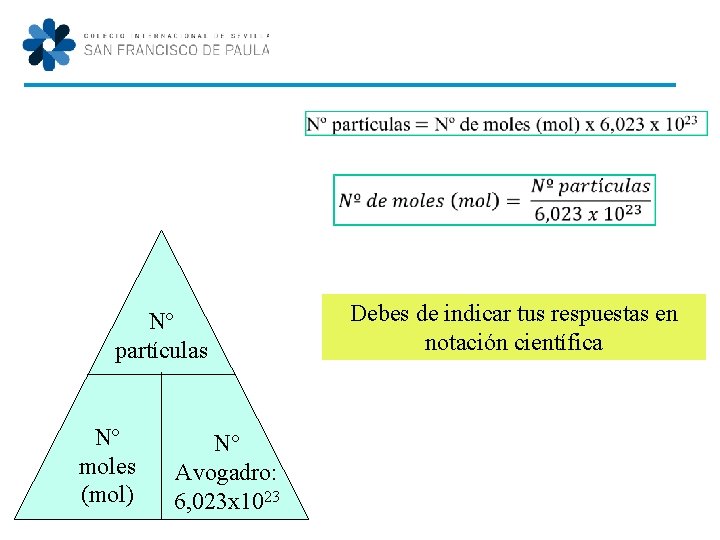
Nº partículas Nº moles (mol) Nº Avogadro: 6, 023 x 1023 Debes de indicar tus respuestas en notación científica
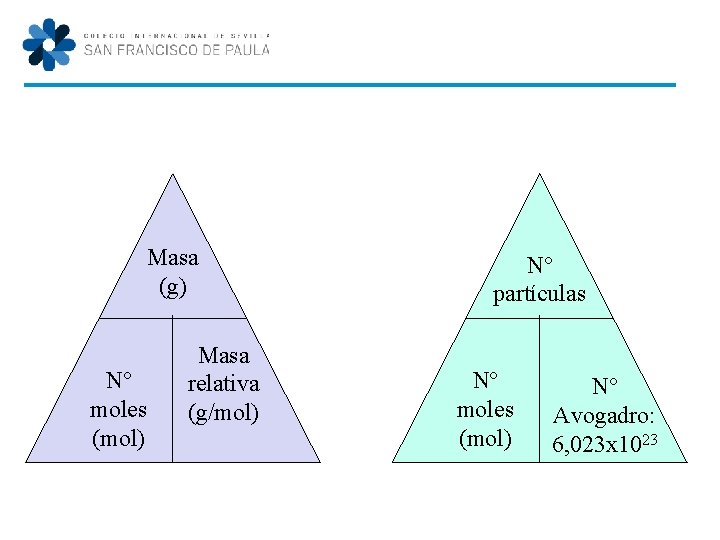
Masa (g) Nº moles (mol) Masa relativa (g/mol) Nº partículas Nº moles (mol) Nº Avogadro: 6, 023 x 1023
- Slides: 12