NORMATIVIDAD NACIONAL GRUPO PROGRAMAS ESPECIALES DIRECCIN DE MEDICAMENTOS






















- Slides: 24

NORMATIVIDAD NACIONAL GRUPO PROGRAMAS ESPECIALES DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLOGICOS 2014

Contenido • • Normas nacionales Resolución 8430 de 1993 Resolución 2378 de 2008 y su anexo técnico Decreto 677 de 1995 • Resolución 2011020764 de 2011 • Sitio web Invima Grupo Programas Especiales

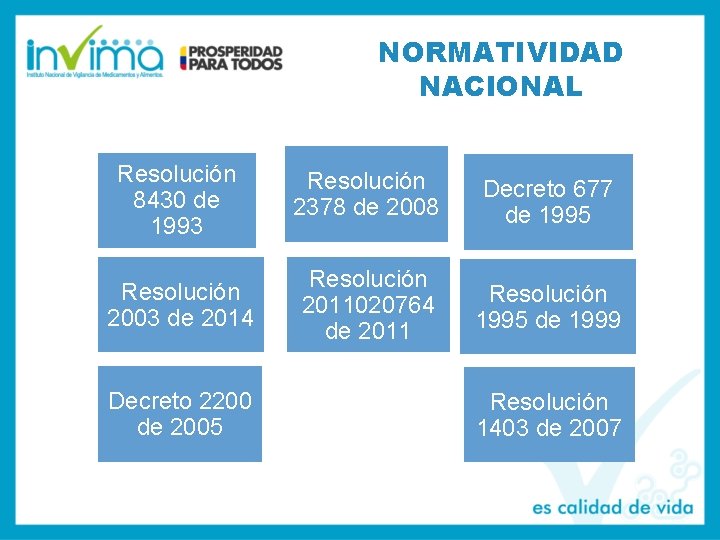
NORMATIVIDAD NACIONAL Resolución 8430 de 1993 Resolución 2378 de 2008 Decreto 677 de 1995 Resolución 2003 de 2014 Resolución 2011020764 de 2011 Resolución 1995 de 1999 Decreto 2200 de 2005 Resolución 1403 de 2007

NORMATIVIDAD NACIONAL Resolución 8430 de 1993 “Por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud”. • Disposiciones generales Artículo 2. Comité de Ética en Investigación. • De la investigación en seres humanos. Capítulo 1 De los aspectos éticos de la investigación en seres humanos. • De la investigación farmacológica: definición, fases de la investigación. Artículos 53 a 59.

RESOLUCIÓN 8430 DE 1993 En toda investigación en la que el ser humano sea sujeto de estudio, deberá prevalecer el criterio del respeto a su dignidad y la protección de sus derechos y su bienestar. (Artículo 5) Deberá prevalecer la seguridad de los beneficiarios y expresar claramente los riesgos (mínimos) (Artículo 6 Literal d) Artículo 6 Literal e) Contará con el Consentimiento Informado y por escrito del sujeto de investigación o su representante legal

RESOLUCIÓN 8430 DE 1993 Artículo 11 Clasificación investigaciones a)Investigación sin riesgo b)Investigación con riesgo mínimo c)Investigaciones con riesgo mayor que el mínimo: Estudios con medicamentos.

RESOLUCIÓN 8430 DE 1993 Artículos 14 a 16 Consentimiento informado • Definición: Capacidad de libre elección y sin coacción. • Contenido del documento de consentimiento informado. • Requisitos del documento

RESOLUCIÓN 8430 DE 1993 Artículo 6 Literal f) Deberá ser realizada por profesionales conocimiento y experiencia para cuidar la integridad del ser humano bajo la responsabilidad de una entidad de salud, supervisada por las autoridades de salud, siempre y cuando, cuenten con los recursos humanos y materiales necesarios que garanticen el bienestar del sujeto de investigación.

RESOLUCIÓN 8430 DE 1993 • Artículo 8. Se protegerá la privacidad del individuo, sujeto de investigación, identificándolo solo cuando los resultados lo requieran y éste lo autorice. • Artículo 12. El investigador principal suspenderá la investigación de inmediato, al advertir algún riesgo o daño para la salud del sujeto en quien se realice la investigación. Así mismo, será suspendida de inmediato para aquellos sujetos de investigación que así lo manifiesten.

RESOLUCIÓN 8430 DE 1993 Ø Investigación en comunidades (Capítulo II). Ø Investigación discapacitados (Capítulo III). en Ø Grupos subordinados (Artículos 45 y 46) menores de edad o

NORMATIVIDAD NACIONAL Resolución 2378 de 2008 “Por la cual se adoptan las Buenas Prácticas Clínicas para las instituciones que conducen investigación con medicamentos en seres humanos” El Invima deberá verificar que las instituciones que desarrollen investigaciones en seres humanos con medicamentos, cumplan con las Buenas Prácticas Clínicas (Artículo 3). No se podrán iniciar proyectos de investigación clínica con medicamentos en seres humanos que no estén aprobados por el Invima (Artículo 5).

Resolución 2378 de 2008 • Interrupción de investigaciones (Artículo 6): Alteración de las condiciones de autorización, Incumplimiento de las Buenas Prácticas Clínicas. Protección a los seres humanos sujetos de ensayo. Defensa de la salud pública. • Comité de Ética institucional (Artículo 7). Evaluación documentos relacionados con el protocolo. • Sanciones (Artículo 9). Amonestación, multa.

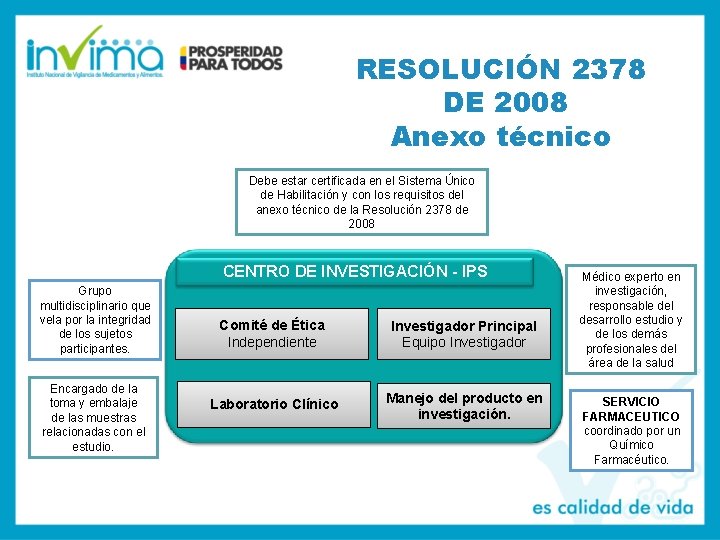
RESOLUCIÓN 2378 DE 2008 Anexo técnico Debe estar certificada en el Sistema Único de Habilitación y con los requisitos del anexo técnico de la Resolución 2378 de 2008 CENTRO DE INVESTIGACIÓN - IPS Grupo multidisciplinario que vela por la integridad de los sujetos participantes. Encargado de la toma y embalaje de las muestras relacionadas con el estudio. Comité de Ética Independiente Investigador Principal Equipo Investigador Laboratorio Clínico Manejo del producto en investigación. Médico experto en investigación, responsable del desarrollo estudio y de los demás profesionales del área de la salud SERVICIO FARMACEUTICO coordinado por un Químico Farmacéutico.

Resolución 2378 de 2008 • Aspectos de alta importancia o críticos: relacionados con la seguridad de los sujetos participantes o con la validez de los datos. • Aspectos de mediana importancia o no críticos: aquellos que pueden llegar a tener un impacto en la integridad de los resultados.

Resolución 2378 de 2008 - Anexo técnico • Comité de Ética: Responsabilidades, composición y procedimientos, documentación y archivo. • Investigador: competencia, funciones responsabilidades (Manejo del medicamento investigación), documentación y archivo. y en • Patrocinador: Responsabilidades y funciones. • Laboratorio clínico: Recurso Humano, Procedimientos Operativos Estandarizados, manejo de las muestras, auditorías internas.

MANEJO DEL PRODUCTO EN INVESTIGACIÓN Decreto 2200 de 2005 “Por el cual se reglamenta el servicio farmacéutico” Resolución 1403 de 2007 “Por la cual se determina el Modelo de Gestión del Servicio Farmacéutico…”

MANEJO DEL PRODUCTO EN INVESTIGACIÓN Resolución 1403 de 2007 Artículo 5 Funciones Investigación. Realizar o participar en estudios relacionados con medicamentos y dispositivos médicos, que conlleven el desarrollo de sus objetivos, especialmente aquellos relacionados con la farmacia clínica. Artículo 7 Grados de complejidad. El servicio farmacéutico será de baja, mediana y alta complejidad Mediana y Alta complejidad. Además de las actividades y/o procesos del servicio farmacéutico de baja complejidad, realizará: f) Investigación clínica.

Decreto 677 de 1995 “ Por el cual se reglamenta parcialmente el Régimen de Registros y licencias, el control de calidad así como el Régimen de Vigilancia Sanitaria de Medicamentos, Cosméticos, Preparaciones Farmacéuticas a base de recursos naturales, productos de aseo, higiene y limpieza y otros productos de uso doméstico y se dictan otras disposiciones sobre la materia” Título VIII Del régimen de control y vigilancia sanitaria, las medidas sanitarias de seguridad, procedimientos y sanciones. Artículo 104. De las medidas sanitarias de seguridad: Suspensión parcial o total de actividades o servicios. Artículo 105. Del objeto de las medidas sanitarias de seguridad: prevenir o impedir que la ocurrencia de un hecho o la existencia de una situación atenten o puedan significar peligro contra la salud individual o colectiva de la comunidad.

Resolución 2011020764 del 2011 “Por la cual se establece el reglamento relativo al contenido y periodicidad de los reportes de eventos adversos en la fase de investigación clínica”. Aplica para el reporte de Eventos Adversos asociados con la seguridad de los medicamentos en investigación.

RESOLUCIÓN 2011020764 DE 2011 EVENTO ADVERSO SERIO Cualquier ocurrencia desfavorable que a cualquier dosis: Ø Resulta en fallecimiento. Ø Amenaza la vida, requiere hospitalización o prolongación de la ya existente. Ø Da como resultado incapacidad o invalidez ¿ ESPERADO ? Centro de investigación (IP) 24 horas • Comité de Ética en investigación • Laboratorio Patrocinador NACIONAL ¿ CAUSALIDAD ? Laboratorio Patrocinador 7 Días - INVIMA INTERNACIONAL

COMUNICACIÓN

COMUNICACIÓN

GRACIAS Gracias invimabpc@invima. gov. co www. invima. gov. co Carrera 68 D No. 17 -11 - Bogotá, D. C. Colombia. Teléfono: (1)2948700 ext. 3940

 Medicamentos en situaciones especiales
Medicamentos en situaciones especiales Direccin
Direccin Direccin
Direccin Direccin
Direccin Direccin
Direccin United postal stationery society
United postal stationery society Atravesamiento institucional ejemplos
Atravesamiento institucional ejemplos Predicado
Predicado Grupo nominal e grupo verbal
Grupo nominal e grupo verbal Constituintes da frase
Constituintes da frase Conocimientos especiales
Conocimientos especiales Capacidades coordinativas especiales
Capacidades coordinativas especiales Lenguas de especialidad
Lenguas de especialidad Compuestos especiales
Compuestos especiales Ocasiones especiales ejemplos
Ocasiones especiales ejemplos Lectura intensiva concepto
Lectura intensiva concepto Residuos especiales hospitalarios ejemplos
Residuos especiales hospitalarios ejemplos Multiplicaciones especiales
Multiplicaciones especiales Circunscripciones especiales
Circunscripciones especiales Sopas claras
Sopas claras Verbos especiales
Verbos especiales El dominio de una funcion exponencial esta dado por
El dominio de una funcion exponencial esta dado por Cilindros sin vastago
Cilindros sin vastago Comerciante individual el salvador
Comerciante individual el salvador Clientes con necesidades especiales
Clientes con necesidades especiales