Mtodos de esterilizacin y desinfeccin Medios de cultivo

























- Slides: 28

Métodos de esterilización y desinfección. Medios de cultivo. Curso: Diagnóstico de enfermedades vegetales 27 de mayo de 2011 Ing. Agr. MSc. Vivienne Gepp

Objetivo • Que el estudiante se familiarice con los procesos de desinfección y esterilización comúnmente utilizados en un Laboratorio de Fitopatología. • Conocer los medios de cultivo más usados.

Definiciones Esterilización = proceso mediante el cual se matan o eliminan todas las formas de vida microbiana. estéril o no estéril. Desinfección = eliminar microorganismos patógenos total o parcialmente niveles de desinfección. Asepsia = exclusión continuada de microorganismos contaminantes.

Métodos de esterilización • FISICOS: – Calor • seco (llama, horno) • húmedo (autoclave) – Radiaciones • MECÁNICOS – Filtración • QUIMICOS – Gaseosos – No gaseosos

Calor seco • Esterilización directa en la llama

Calor seco alcohol 96% + mechero

Calor seco alcohol 96% + mechero

Calor seco Horno

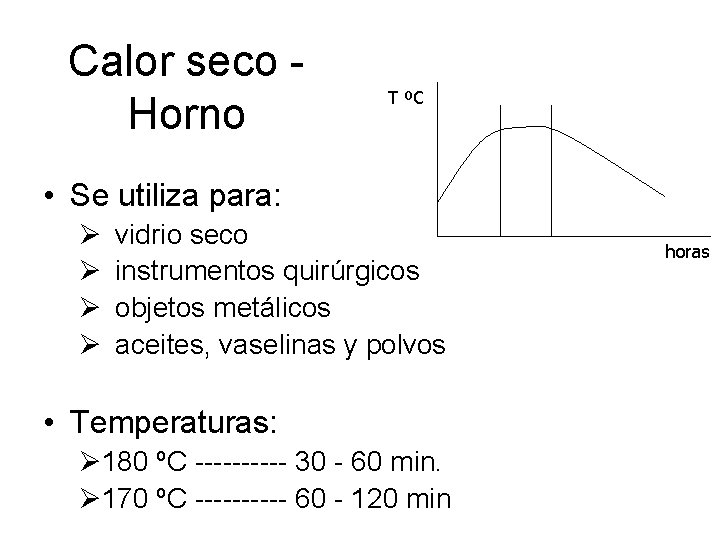
Calor seco Horno T ºC • Se utiliza para: Ø Ø vidrio seco instrumentos quirúrgicos objetos metálicos aceites, vaselinas y polvos • Temperaturas: Ø 180 ºC ----- 30 - 60 min. Ø 170 ºC ----- 60 - 120 min horas

Calor seco • Recipientes de metal o envolver en papel (usar temp. menor en este caso) • Dejar que vuelva a temp. ambiente antes de abrir

Calor húmedo • Con presión: autoclave, olla presión • Para sustancias estables al calor – ¿combinaciones reactivos a temp altas? • Temperatura – presión – tiempo Temp. 100 115 Tiempo 20 h 2, 5 h 51 min. 121 125 130 15 min. 6, 4 min. 2, 4 min.

Autoclave

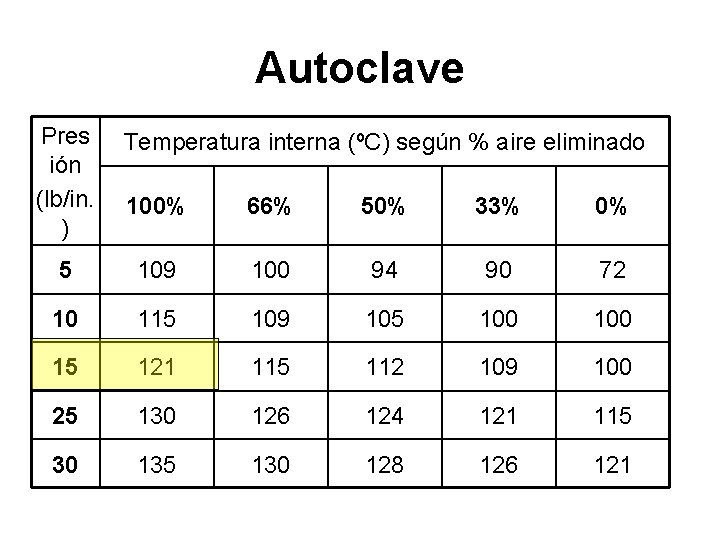
Autoclave Pres ión (lb/in. ) Temperatura interna (ºC) según % aire eliminado 100% 66% 50% 33% 0% 5 109 100 94 90 72 10 115 109 105 100 15 121 115 112 109 100 25 130 126 124 121 115 30 135 130 128 126 121

Calor húmedo - Autoclave • ¿cómo optimizar eficacia? – eliminar aire, – contenidos similares, – no apretados, dejar espacios verticales, • Precauciones: – tapas sueltas, – recipientes con hasta 1/3 de volumen, – vuelta a presión normal lenta.

Controles de esterilización a. Físicos b. Químicos c. Biológicos

Controles de esterilización a. Físicos b. Químicos c. Biológicos

Esterilización química • Ventajas: no requiere altas temperaturas ni aparatos costosos • Desventajas: mayor tiempo, sustancias inflamables y muy tóxicos y alto costo • Ejemplos: óxido de etileno, formaldehído

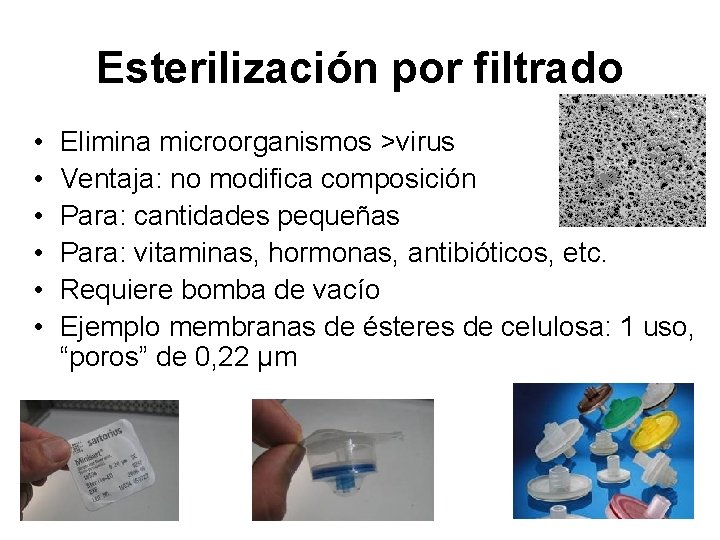
Esterilización por filtrado • • • Elimina microorganismos >virus Ventaja: no modifica composición Para: cantidades pequeñas Para: vitaminas, hormonas, antibióticos, etc. Requiere bomba de vacío Ejemplo membranas de ésteres de celulosa: 1 uso, “poros” de 0, 22 µm

CAMPANAS DE FLUJO LAMINAR

Radiaciones UV

Desinfección superficial

Desinfección superficial Técnicas comunes en Fitopatología: • Lavado previo en agua corriente – detergente? cepillo? • Agua corriente 2 o más horas • Alcohol 70% • Hipoclorito de sodio: – 1% Cloro activo, 2 %, 0, 35% etc. – minutos – enjuague posterior

Desinfección superficial Selección de técnica(s) según: • tejido: grosor, consistencia • hongo a aislar: ej. Oomycetes, Rhizoctonia • dónde pensamos que está el patógeno

Medios de cultivo • Componentes básicos • ¿Sólido o líquido? • Ajuste de p. H • Inhibidores de “contaminantes”: – bacterias – hongos no deseados

Clasificación de medios de cultivo • Sintéticos – más complicados para elaborar, muchos componentes • Naturales – raíces y frutos aportan lo necesario para hongos, ¿bacterias necesitan más? • Semi-sintéticos

¿Qué aportan los medios? • Soporte - Agentes solidificantes: – gelatina: fusión a 37ºC, solidifica 25 -30ºC, se descompone a 121ºC – agar: fusión a 80 -100ºC, solidifica a 35 -50ºC • Carbono orgánico – Azúcares inducen crecimiento micelio, pueden inhibir esporulación temporal- o permanentemente. • • Vitaminas y otros factores de crecimiento Inhibidores Sustancias que permiten diferenciar spp. o biotipos Indicadores

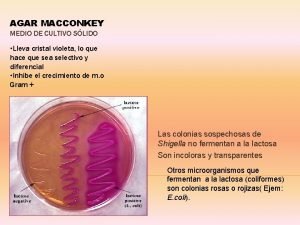
Medios comunes: • Agar papa dextrosa • Agar agua • Nutriente agar dextrosa • Agar harina de maíz • Extracto de levadura dextrosa con carbonato de calcio (Yeast Dextrose Ca. C 03) • Agar V 8 • B de King • Agar malta

Dispensado de medios • Temperatura: 45 -50ºC – mayor: condensa H 2 O – menor: solidificación prematura • Placas de Petri: aprox. 20 ml c/u • Tubos de ensayo: vertical o pico de flauta
 Horno pasteur o estufa poupinel
Horno pasteur o estufa poupinel Clasificación de medios de cultivo
Clasificación de medios de cultivo Medio semisolido
Medio semisolido Medio de cultivo
Medio de cultivo Medios de cultivo semisinteticos
Medios de cultivo semisinteticos Tetanoespasmina
Tetanoespasmina Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Condon vaginal
Condon vaginal Mtodos
Mtodos Mtodos
Mtodos Campylobacter jejuni cultivo
Campylobacter jejuni cultivo Descarboxilasas
Descarboxilasas Cultivo de arro
Cultivo de arro Cultivo secundario
Cultivo secundario Papa china beneficios
Papa china beneficios Cultivo puro
Cultivo puro Cultivo de los olmecas
Cultivo de los olmecas Teoria do cultivo
Teoria do cultivo Cultivos histotípicos y organotípicos
Cultivos histotípicos y organotípicos Cultivo faringeo
Cultivo faringeo Principal cultivo maya
Principal cultivo maya Cultivo liquido seminal
Cultivo liquido seminal Acinetobacter baumannii cultivo
Acinetobacter baumannii cultivo