MORT CELLULAIRE NECROSE APOPTOSE AUTOPHAGY NECROSE n n





































- Slides: 56

MORT CELLULAIRE NECROSE APOPTOSE AUTOPHAGY

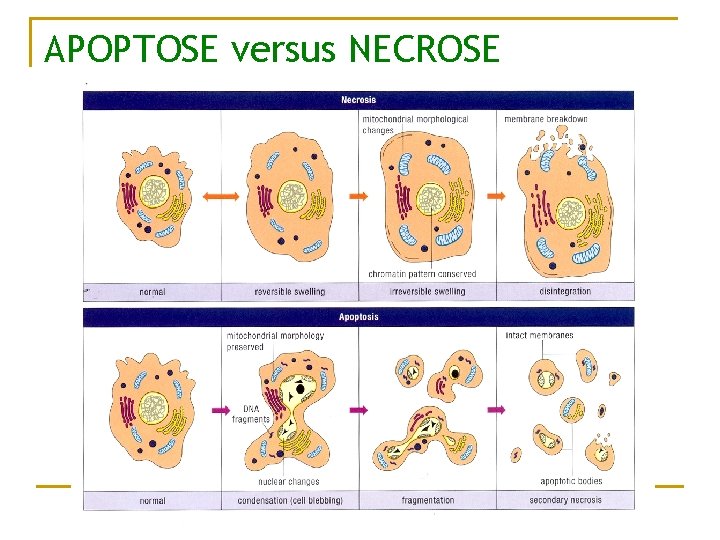
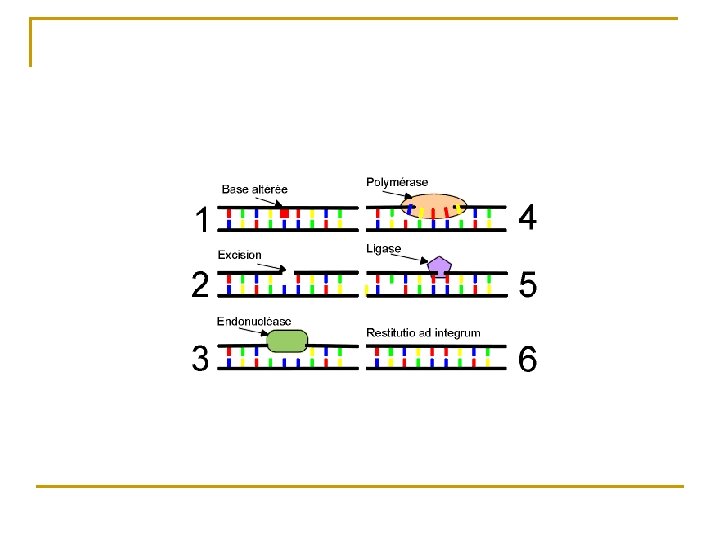
NECROSE n n La nécrose est une mort anormale de la cellule (cf. apoptose) Causes possibles : q q n Perte de l’homéostasie cellulaire Réduction de l’afflux sanguin Trop peu d’oxygène dans le sang Toxines, trauma, radiation, T°, etc. . Conséquences : q q Les cellules gonflent, éclatent et relarguent leurs contenus dans les espaces interstitiels Importante réaction inflammatoire

Fonctions cellulaires altérées q q q Dérégulation de la perméabilité membranaire et donc influence les mécanismes de transport Réduction du métabolisme cellulaire Plus de synthèse protéique Dommage au lysosomes : fuite d’enzyme dans le cytoplasme Destruction des organelles cellulaires

MECANISMES MOLECULAIRES n L’absence d’oxygène entraine : q q q n Déplétion d’ATP Synthèse et dégradation des phospholipides Fuite de calcium de la mitochondrie Reperfusion q Création d’oxygène radicalaire O 2 - , OH-, H 2 O 2 n n Molécules très réactive qui attaquent tous les constituants cellulaires Les capacités de détoxication de ces molécules sont très limités au niveau cellulaire

Atteinte cellulaire liée aux ROS n n n Anion Superoxyde formés par les P 450 et détoxication par les superoxyde dismutase Hydrogène peroxyde détoxication par : catalase et glutathion peroxydase Radical hydroxyl. OH initie une peroxydation lipidique et les atteintes à l’ADN

Comment les radiations tuent les cellules n n Radiolyse de l’eau H 20 donne. H et. OH Dommage aux membranes Dommage à l’ADN Les cellules non proliférative sont aussi tuées mais les doses doivent être plus importante

1ère Mise en évidence de l’apoptose n Date du milieu du XIXème siècle puis remis au jour dans les années 30 pour vraiment être caractérisé en 1972

Apoptose histoire n n 1842 : Carl Vogt remarque la disparition de noyaux dans certains tissus 1951 décrit la mort de certaines cellules dans les tissus embryonnaire 1964 Première utilisation du terme mort programmée 1972 Kerr Wyllie et Currie utilise le terme d’apoptose

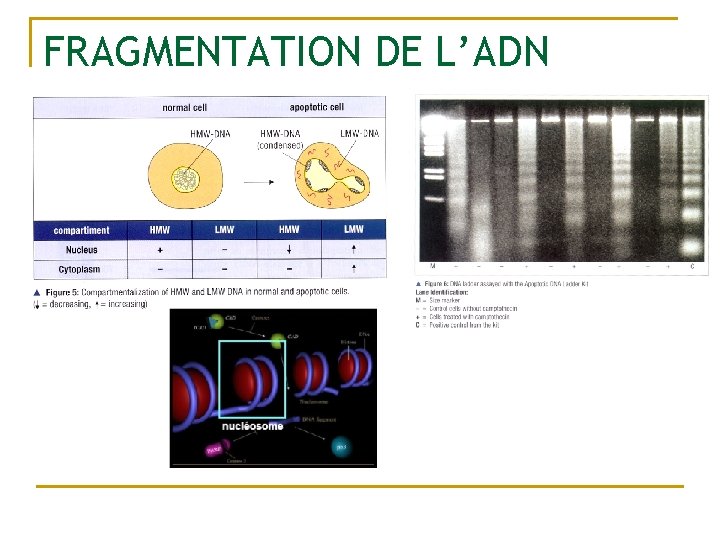
APOPTOSE n Caractéristiques d’une cellule en apoptose q q q n Condensation cellulaire Condensation de la chromatine Fragmentation de l’ADN « blebbing » de la membrane Exposition sur la membrane externe des phosphatidylserine Sécrétion de cytokines qui inhibe l’inflammation Ces caractéristiques sont régulés par des signaux

AUTOPHAGIE n n Sorte de « self » cannibalisme Manque de nutriment Digestion d’organelle intracellulaire Réarrangement de la membrane séquestration des composants dans des autophagosomes puis fusion avec lysozomes (dégradation enzymatique)

APOPTOSE versus NECROSE

FRAGMENTATION DE L’ADN

BLEBBING DES CELLULES

Pourquoi l’apoptose n n n Nombre de cellules dans l’organisme : 1014 Sans apoptose 12 miles de longueur Durée de vie d ’une cellule (70 109 meurent) q q très variable selon l ’origine vie post-embryonnaire 200 types de cellules possédant toutes une durée de vie différente n n n Cell. Intestinales 1 semaines Erythrocyte 120 jours Cell. Hépatiques 1 ½ an Cell. Osseuses 25 -30 ans Neurones, Cell. Cardiaques, rétine, ne sont jamais remplacées Peau renouvelée tout les 23 jours

n Différenciation cellulaire q implique toute cellule soit au bon endroit au bon moment n Toutes cellules en trop doit disparaître n Période et vie cellulaire q q cellule en G 0 importance du réveil

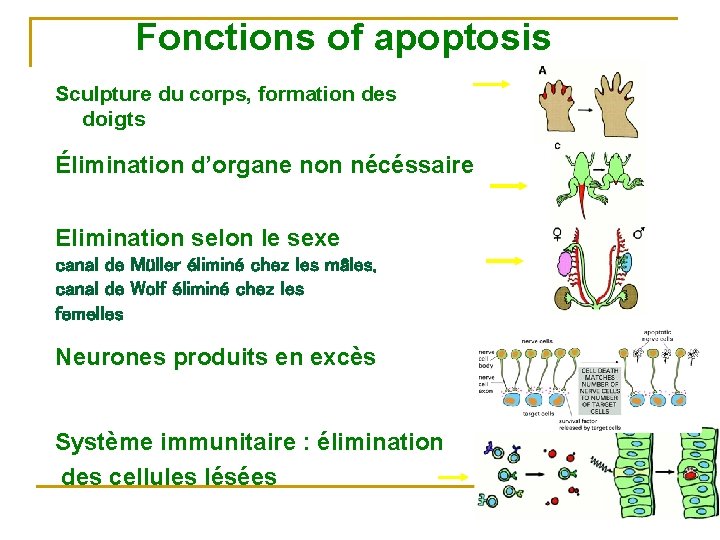
Importance de l’apoptose n n n Homéostasie cellulaire, développement embryonnaire, synapse système immunitaire … Trop d’apoptose : maladie dégénératives Trop peu d’apoptose Cancer, maladies autoimmunes

Fonctions of apoptosis Sculpture du corps, formation des doigts Élimination d’organe non nécéssaire Elimination selon le sexe canal de Müller éliminé chez les mâles, canal de Wolf éliminé chez les femelles Neurones produits en excès Système immunitaire : élimination des cellules lésées

Caenorhabditis elegans n n 1090 cellules somatiques 131 meurent par apoptose 116 de ces 131 appartiennent au système nerveux et à l’ectoderme 959 se développent en tissus

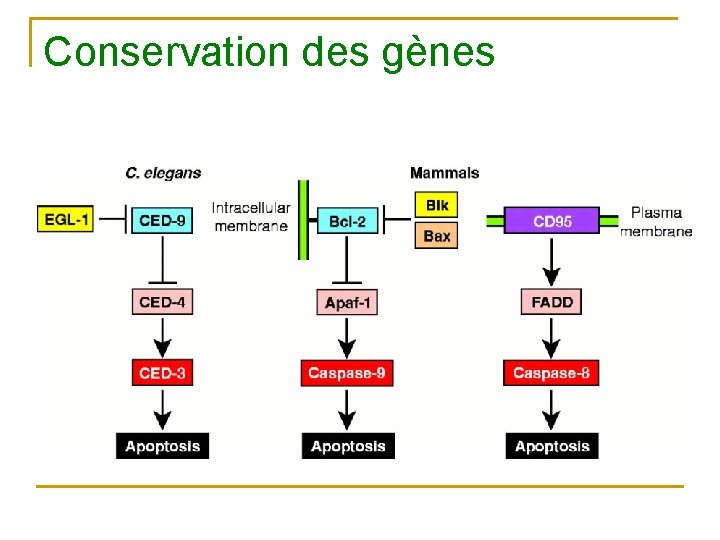
MECANISMES GENERAUX n n Très conservés des espèces les plus élémentaires aux mammifères Premières études chez Caenorhabditis elegans q q 2 gènes ced-3 ced-4 «killer gene» 1 gènes ced-9 «survival gene»

Conservation des gènes


Voie Apoptotique

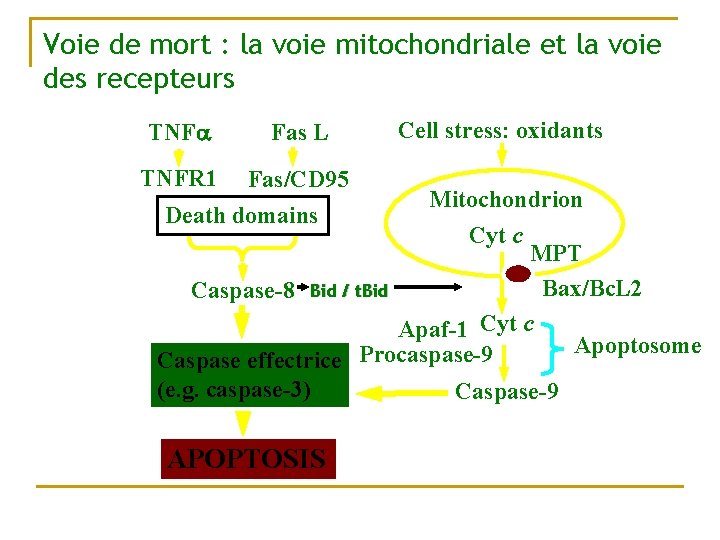
Différence entre les voies récepteur et mitochondriale n Mitochondriale q q q n Médié par le stress Synthèse de protéines 12 -24 heures Récepteur q q Pas de synthèse de prot Très rapide qqs heures

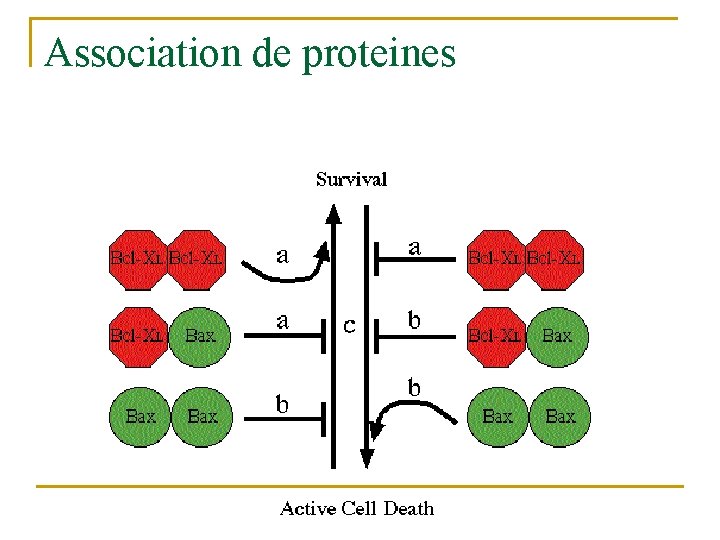
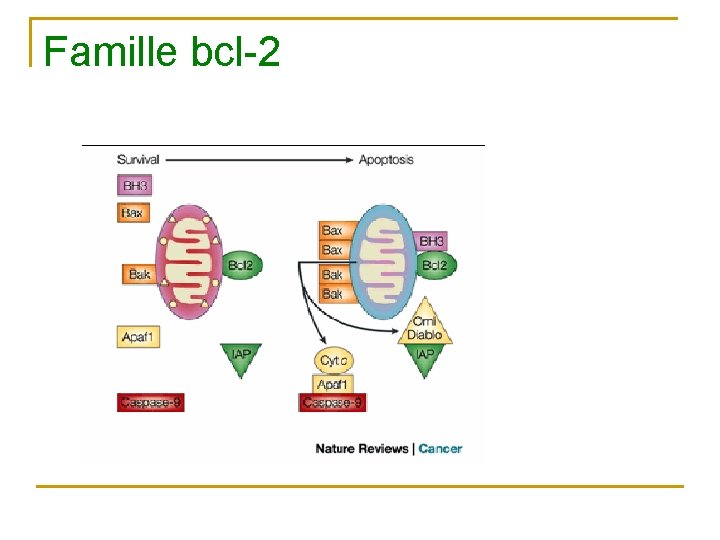
Les grandes familles de proteines impliquées dans l’apoptose : bcl-2 n n Homologue de ced-9 famille conservée, séquence homologue q n n BH domains (dimèrization pour activation) Famille contenant des gènes pro et antiapoptotiques Homo et hétérodimère (balance entre mort et survie cellulaire)

Découverte de Bcl-2 n n En 1986 3 groupes indépendants clone ce que l’on appellera Bcl-2 oncogène En 1988 bcl-2 conduit a certain cancer en empêchant la mort cellulaire

Les grandes familles de protéines impliquées dans l’apoptose : Bcl-2 (CED-9) Bcl-2 homology domains BH 1, BH 2, BH 3, Dimérisation BH 3, BH 1, BH 2 Liaison Apaf-1 BH 4

Association de proteines


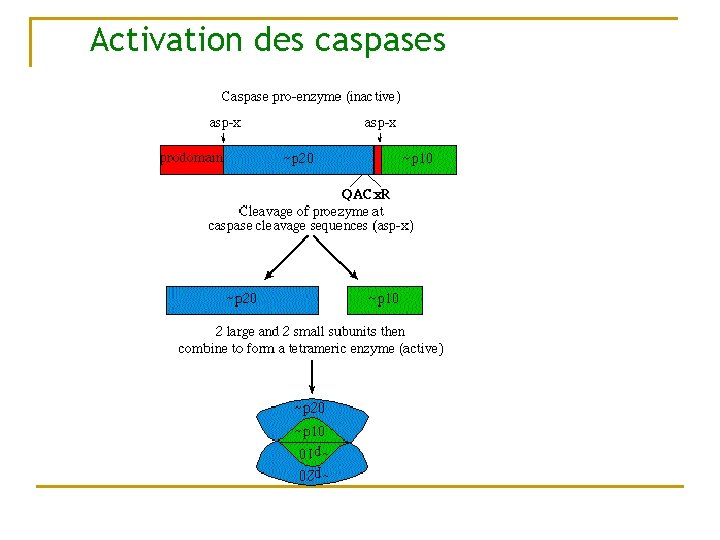
Activation des caspases

Les Caspase (CED-3) n n Cystéine protéase (17 membres) sont synthétisée à l’état de précurseur (QACXG) Comment les caspases tuent la cellule q n Destruction de protéines indispensable a la vie de la cellule Régulation des caspases : activation en cascade, IAP inhibiteur de caspase

Voie de mort : la voie mitochondriale et la voie des recepteurs TNFa Fas L TNFR 1 Fas/CD 95 Death domains Cell stress: oxidants Mitochondrion Cyt c MPT Bax/Bc. L 2 Caspase-8 Bid / t. Bid Apaf-1 Cyt c Apoptosome Procaspase-9 Caspase effectrice (e. g. caspase-3) Caspase-9 APOPTOSIS

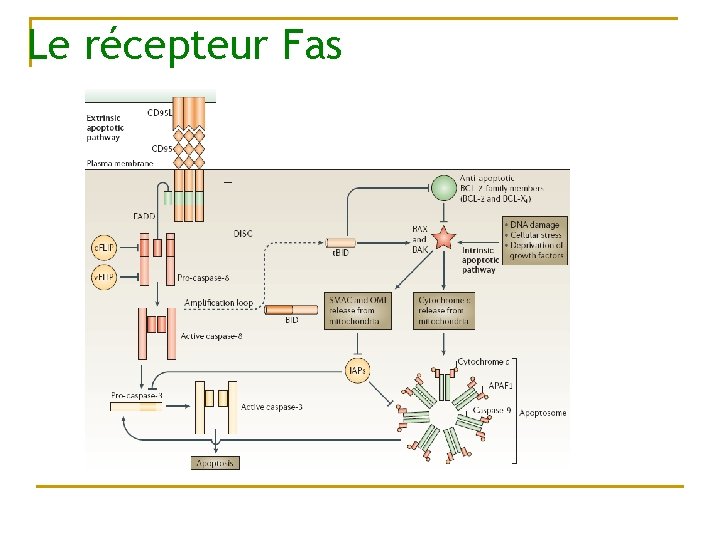
La voie de mort récepteur dépendant n n n Les récepteurs de mort : ils sont placés dans les membranes et détecte les signaux extracellulaire et initie rapidement la machinerie apoptotique Ils appartiennent à la famille des récepteurs au TNF car il contiennent un domaine extracellulaire riche en cystéine et dans le cytoplasme des séquences conservés appelés « Death Domain » Leurs ligands sont eux aussi très conservés

Le récepteur Fas

Récepteur TNRF 1 : active des facteurs de transcription (gènes inflammation, immunologie) induit l’apoptose si synthèse protéique bloqué Ligand -TNF Receptor TNFR 1 TNFR associated death domain, TRADD Death domain, DD Fas-associated death domain, FADD Receptor interacting protein, RIP JNKK TNFR-associated IKK factor 2, TRAF 2 JNK NFk. B c-Jun Caspase 8 Effector caspases Apoptosis

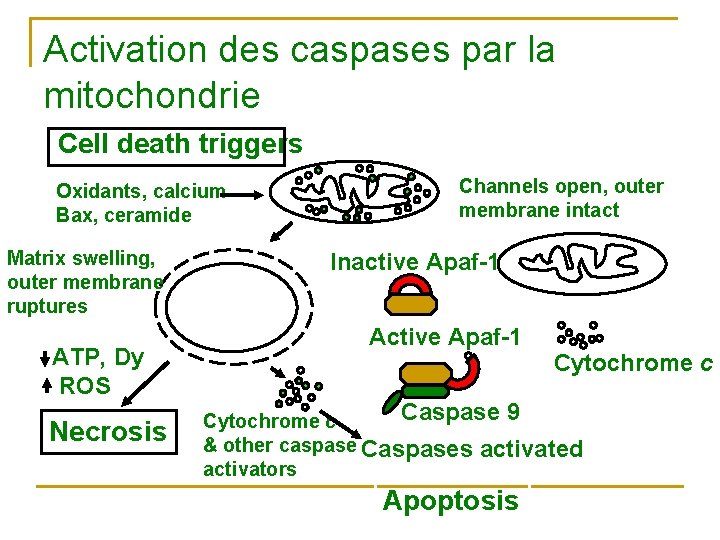
Mitochondrie et apoptose n n La mitochondrie est impliqué dans l’exécution et joue un rôle pivot 3 mécanismes q q q Dérégulation de la synthèse d’ATP Altération du statut REDOX Fuite de facteurs apoptogène qui vont activer des caspases

Famille bcl-2

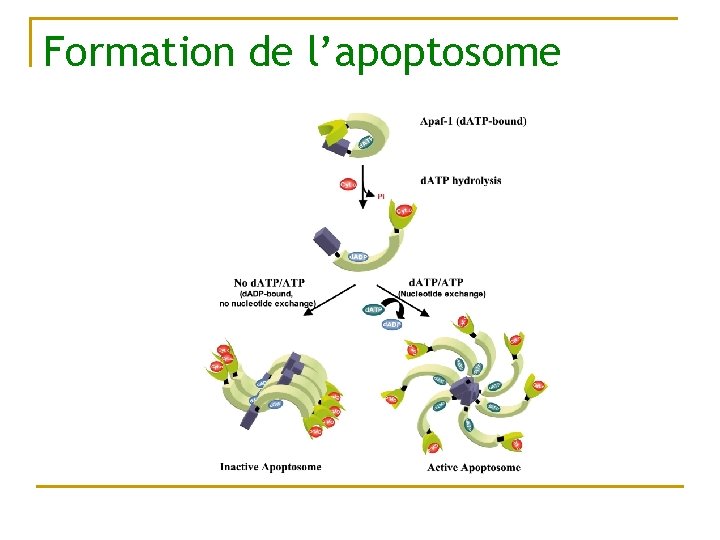
Protéines activatrices des caspases n n n Cyt c va former l’apoptosome Procaspase 3 «dans certains tissus comme Apoptosis inducing factor AIF

Activation des caspases par la mitochondrie Cell death triggers Oxidants, calcium Bax, ceramide Matrix swelling, outer membrane ruptures ATP, Dy ROS Necrosis Channels open, outer membrane intact Inactive Apaf-1 Active Apaf-1 Cytochrome c Caspase 9 Cytochrome c & other caspase Caspases activated activators Apoptosis

Formation de l’apoptosome

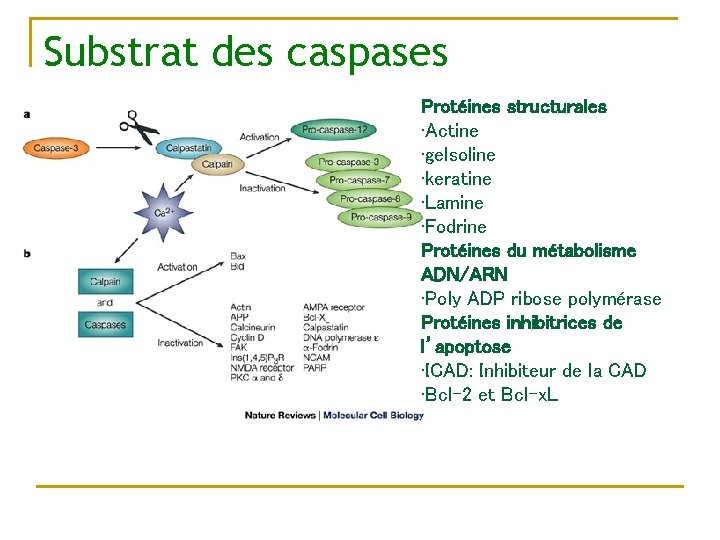
Substrat des caspases Protéines structurales • Actine • gelsoline • keratine • Lamine • Fodrine Protéines du métabolisme ADN/ARN • Poly ADP ribose polymérase Protéines inhibitrices de l’apoptose • ICAD: Inhibiteur de la CAD • Bcl-2 et Bcl-x. L

Inhibitors of Apoptosis Proteins (IAPs) Identifié à partir de baculovirus n Consiste en diverses protéines : NAIP, MIAP XIAP, c. IAP 1, c. IAP 2, and survivine n Suppression de l’apoptose en empêchant l’activation des caspases et leur activités (caspase-3, -7, and 9) liaison spécifique n Expression of c. IAP 1/2 is stimulated by NF-κBmediated survival signals. n Negative regulators of IAPs: Smac/DIABLO, XAF 1, and OMI/HTRA 2 n

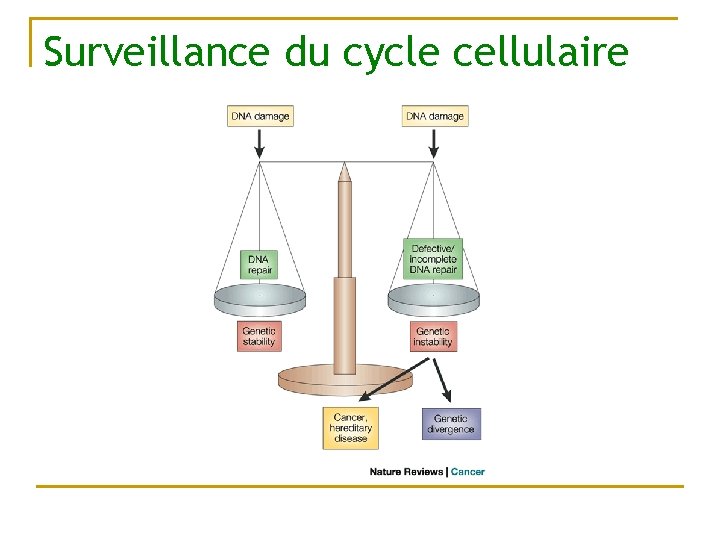
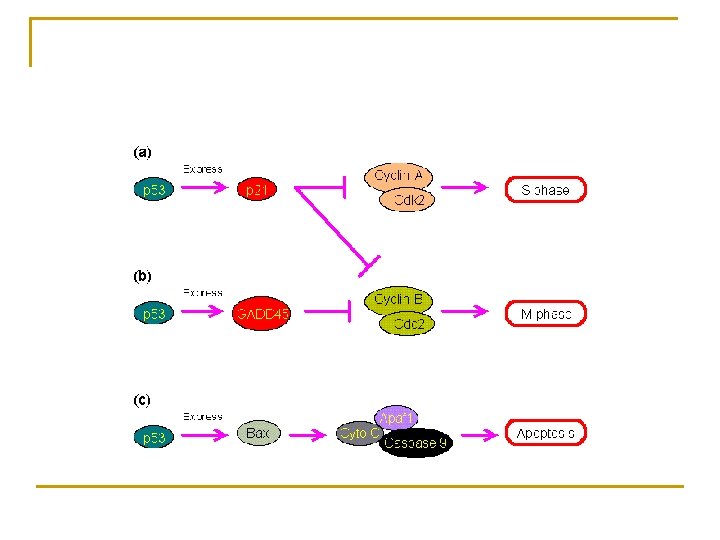
Surveillance du cycle cellulaire

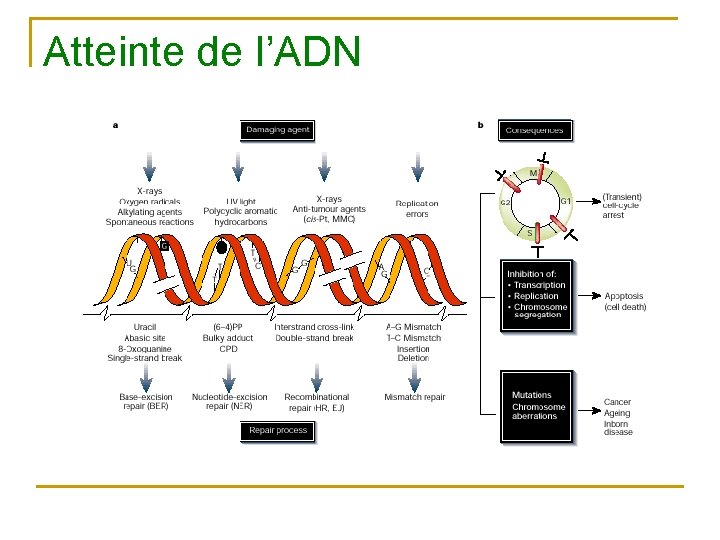
Atteinte de l’ADN


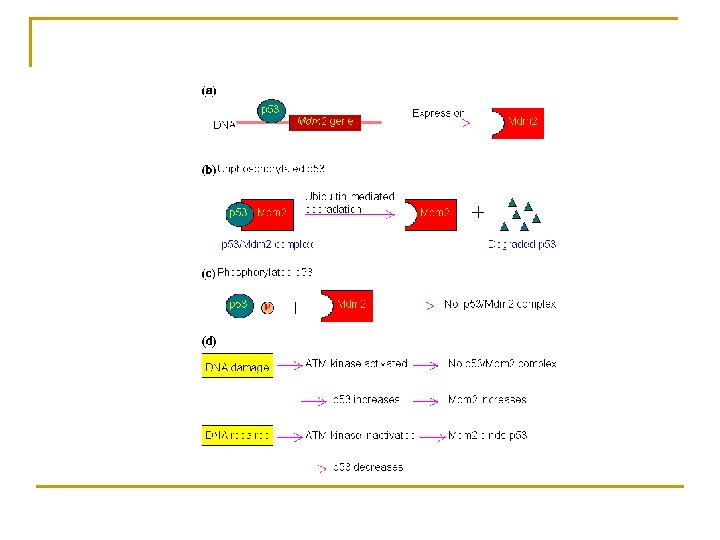
La proteine P 53 n n Dans les cellules normales (non stressé) la p 53 est rapidement dégradé après association avec son régulateur MDM 2. p 53 forme un complexe avec une proteine E 3 (ubiquitin ligase) et ainsi p 53 est guidé vers le proteasome. Dans les cellules normales p 53 est un régulateur positif de la prolifération cellulaire Dans les cellules « stressées » p 53 arrête la division par un phénomène apoptotique mitochondrial dépendant (Bax oligomérisation). Dans les cellules cancéreuses p 53 est un facteur de transcription (Puma, Noxa, p 53 AIP 1, Bax, Apa-1)

MDM 2 : Mouse Double Minute 2 n Le gène mdm 2 encode pour une protéine (zinc finger) qui inhibe p 53 pendant la phase de croissance dans une cellule normale q q n n Au niveau du noyau « bind » p 53 N-Terminal et masque son domaine de transactivation Au niveau du cytoplasme MDM 2 est responsable de l’ubiquitylisation et donc de la dégradation de p 53, MDM 2 est une cible de p 53 MDM 2 est une ubiquitin ligase (p 53 dégradation)

Comment p 53 est elle activé et stabilisé lors d’une atteinte à l’ADN n n Phosphorylation Inhibition du transport hors du noyau

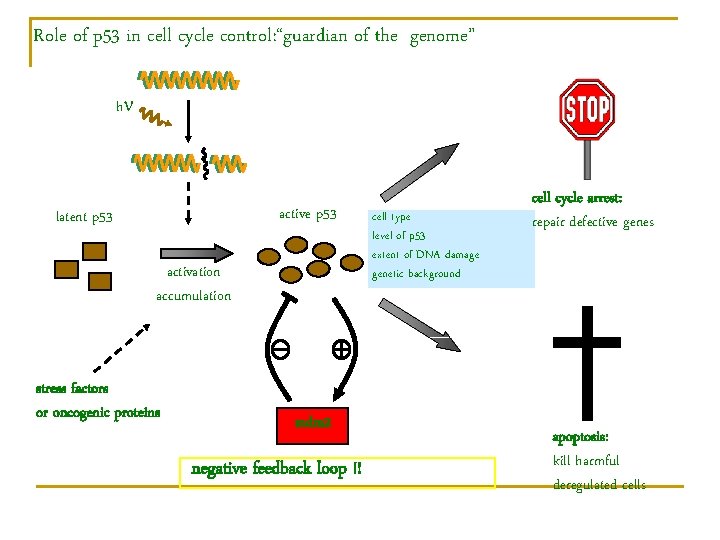
Role of p 53 in cell cycle control: “guardian of the genome” h active p 53 latent p 53 activation accumulation stress factors or oncogenic proteins mdm 2 negative feedback loop !! cell type level of p 53 extent of DNA damage genetic background cell cycle arrest: repair defective genes apoptosis: kill harmful deregulated cells




Si p 53 est nécessaire pour supprimer des cellules altérées, que peut on attendre alors si p 53 est muté ? n Pas de blocage de la division cellulaire n Cancer

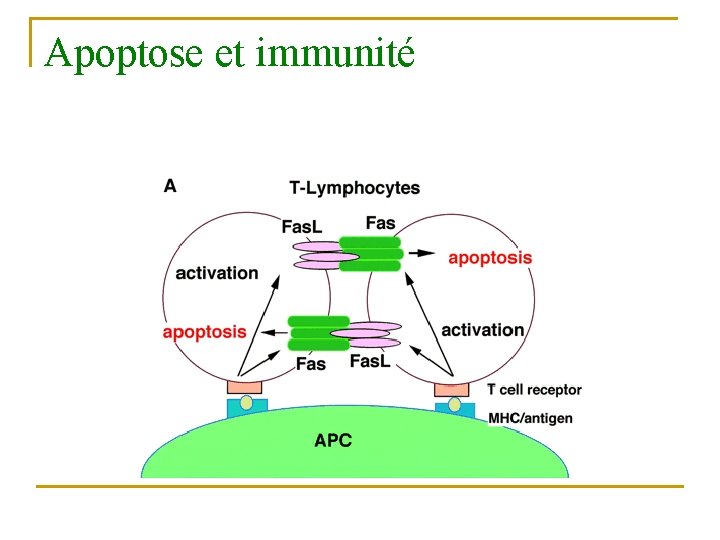
Apoptose et immunité



n n n n • DED: death effector domain • CARD: caspase recruitment domain • CAD: caspase-activated deoxyribonuclease (CAD) • ICAD: CAD inhibitor • FADD: Fas-associated death domain • FLICE: Fas-like interleukin-1β converting enzyme • DISC: death inducing signaling complex • AIF: apoptosis inducing factor • Apaf-1: Apoptotic protease-activating factor-1 • Apoptosome: Cyt. C Apaf-1, d. ATP/ATP and pro-caspase 9 • Smac: second mitochondria-derived activator of caspase. • DIABLO: direct IAP binding protein with low p. I Bcl-2 proteins : B cell leukemia/lymphoma 2 Caspases : cysteine-dependent asparate-specific proteases; IAPs: Inhibitor of apoptosis
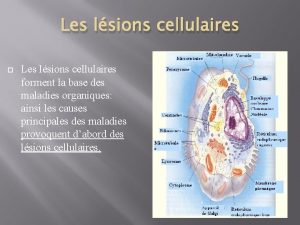
 Necrose e apoptose
Necrose e apoptose Apoptose exemplos
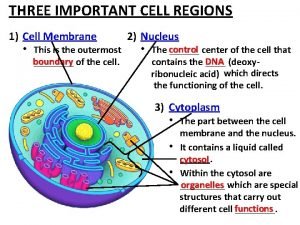
Apoptose exemplos Cell regions
Cell regions Autophagy
Autophagy Psm culture cellulaire
Psm culture cellulaire Signalisation cellulaire
Signalisation cellulaire Cellulaire
Cellulaire Respiration cellulaire
Respiration cellulaire Schéma de la cellule
Schéma de la cellule Necrose liquefeita
Necrose liquefeita Necrose tubulaire aigue
Necrose tubulaire aigue Idrosadenoide
Idrosadenoide Tipos necrose
Tipos necrose Pulpite chronique hyperplasique
Pulpite chronique hyperplasique Mnm cardiologia
Mnm cardiologia La nécrose pulpaire
La nécrose pulpaire Words with the root mort
Words with the root mort Solomon linda le lion est mort ce soir
Solomon linda le lion est mort ce soir La mort nest rien
La mort nest rien Maxalexis
Maxalexis La peine de mort argument contre
La peine de mort argument contre François coppée la mort des oiseaux
François coppée la mort des oiseaux Autoportrait avec passeport juif
Autoportrait avec passeport juif Pierre bachelet décès
Pierre bachelet décès Heros de la mort aux trousses
Heros de la mort aux trousses Nestrien
Nestrien Comment est mort pouchkine
Comment est mort pouchkine Three lessons of joe flom
Three lessons of joe flom Saule pleureur mort
Saule pleureur mort Seuil de rentabilité formule
Seuil de rentabilité formule Texte de doris lussier sur la mort
Texte de doris lussier sur la mort Situation de passage le dernier jour d'un condamné
Situation de passage le dernier jour d'un condamné Jacky kennedy hustler
Jacky kennedy hustler Orphée et eurydice corot
Orphée et eurydice corot Biographie d'euclide
Biographie d'euclide Viitor cu cap de mort
Viitor cu cap de mort Maurice tillet mort
Maurice tillet mort Vincenzo camuccini la mort de césar
Vincenzo camuccini la mort de césar Pam mort
Pam mort Homophone de mort
Homophone de mort Au aripi subtiri strabatute de nervuri
Au aripi subtiri strabatute de nervuri Triomphe de la mort
Triomphe de la mort Nous sommes soeurs aussi fragiles que les ailes du papillon
Nous sommes soeurs aussi fragiles que les ailes du papillon Slidetodoc
Slidetodoc