Metode Titrimetri Volumetri n n Prosedur analisis kimia















![[HA] = [A-] = 4, 00 60 - [H 3 O+] 4, 00 60 [HA] = [A-] = 4, 00 60 - [H 3 O+] 4, 00 60](https://slidetodoc.com/presentation_image/305a79ce59ef40cddc7600f92be73bde/image-20.jpg)





- Slides: 27

Metode Titrimetri / Volumetri n n Prosedur analisis kimia yang didasarkan pada pengukuran jumlah larutan titran yang bereaksi dengan analit. Larutan titran : larutan yang digunakan untuk mentitrasi, biasanya digunakan suatu larutan standar Larutan standar: larutan yang telah diketahui konsentrasinya titrasi dilakukan dengan menambahkan sedikit demi sedikit titran ke dalam analit

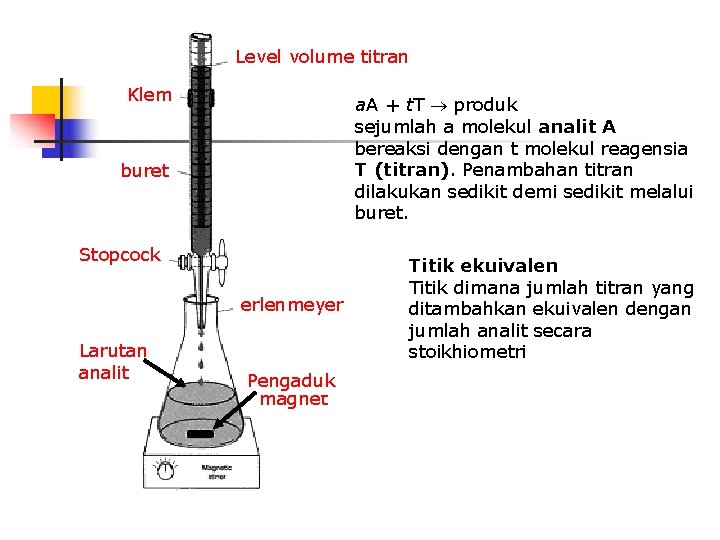
Level volume titran Klem a. A + t. T produk sejumlah a molekul analit A bereaksi dengan t molekul reagensia T (titran). Penambahan titran dilakukan sedikit demi sedikit melalui buret Stopcock erlenmeyer Larutan analit Pengaduk magnet Titik ekuivalen Titik dimana jumlah titran yang ditambahkan ekuivalen dengan jumlah analit secara stoikhiometri

Konsentrasi Larutan Molaritas (M) mol A = M= Liter larutan M= mol V Untuk mencari gram zat terlarut: g = M x V x BM mmol A m. L larutan

Soal: • Hitung molaritas suatu larutan H 2 SO 4 yang mempunyai densitas 1, 30 g/ml dan mengandung 32, 6% bobot SO 3. BM SO 3=80, 06 • Jawab: 1 liter larutan mengandung 1, 30 g/ml x 1000 ml/L x 0, 326 = 424 g SO 3 (424 g) / (80, 06 g/mol) M= = 5, 3 mol/L 1 liter Karena 1 mol SO 3 menghasilkan dalam air maka ada 5, 3 mol/L H 2 SO 4 dalam larutan itu

Soal n Berapa gram Na 2 SO 4 (142, 1 g/mol) diperlukan untuk membuat larutan sebanyak 250 m. L dengan konsentrasi 0, 683 M p. 138

Normalitas (N) ek A mek A N= = m. L larutan Liter larutan gram ek ek = N= Berat Ekuivalen V Untuk mencari gram zat terlarut: g = N x V x BE

Soal: • Hitung berapa gram Na 2 CO 3 murni diperlukan untuk membuat 250 ml larutan 0, 150 N. Natrium karbonat itu dititrasi dengan HCl menurut persamaan CO 32 - + 2 H+ H 2 CO 3 • Jawab: tiap Na 2 CO 3 bereaksi dengan 2 H+ , oleh itu berat ekuivalennya setengah BMnya, 106/2 = 53 g/ek jadi, banyaknya Na 2 CO 3 yang diperlukan: ek = g/BE g = (0, 15 ek/L) x (0, 25 L) x (53 g/ek) = 1, 99 g

Persen Berat gram zat terlarut dalam 100 g larutan g zat terlarut %= x 100% g zat terlarut + g pelarut HCl pekat (BM 36, 5) mempunyai densitas 1, 19 g/ml dan mengandung 37% berat HCl. Berapa ml asam pekat ini harus diambil dan diencerkan menjadi 1 liter untuk membuat larutan 0, 100 M g = M x V x BM = (0, 100 mol/L) x (1 L) x (36, 5 g/mol) = 3, 65 gram dalam 1 ml HCl pekat terdapat 1, 19 g/ml HCl x 0, 37 = 0, 44 g/ml Berapa M HCl pekat? M = mol/L = g/(BM x V) gram HCl = (1, 19 g/ml) x (1000 ml/L) x 0, 37 = 440 g/L M = 440 g / {(36, 5 g/mol) x 1 L }= 12, 055 M 3, 65 g = 8, 3 ml 0, 44 g/ml M 2 x V 2 0, 1 x 1 = V 1 = 12, 055 M 1 ml = = 0, 0083 L = 8, 3 ml

Jenis - jenis titrasi n n Titrasi asam - basa titrasi redoks titrasi pembentukkan kompleks titrasi pengendapan

Titrasi Asam - Basa n Titran merupakan asam atau basa kuat n n n titrasi asam kuat - basa kuat - asam kuat asam lemah - basa kuat basa lemah - asam kuat Indikator: zat yang ditambahkan ke dalam larutan analit untuk mengetahui titik akhir titrasi

Penentuan titik akhir titrasi Perhatikan perubahan warna

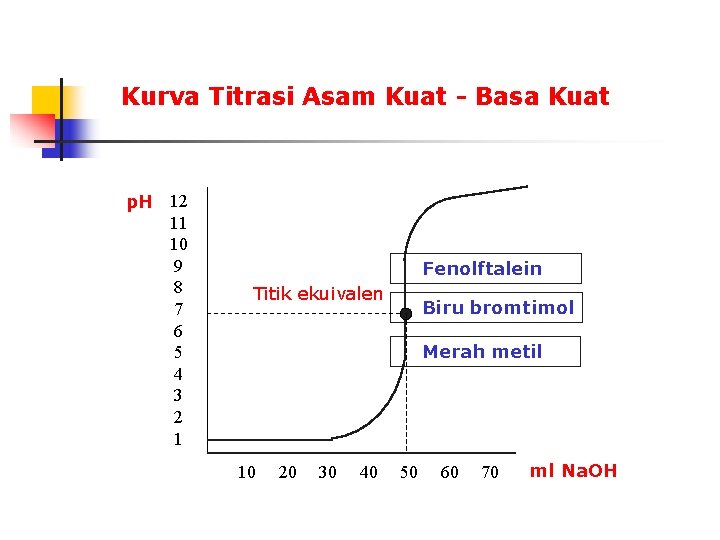
Kurva Titrasi Asam Kuat - Basa Kuat p. H 12 11 10 9 8 7 6 5 4 3 2 1 Fenolftalein Titik ekuivalen Biru bromtimol Merah metil 10 20 30 40 50 60 70 ml Na. OH

Titrasi asam kuat - basa kuat misalkan 50 ml HCl 0, 1 M dititrasi dengan Na. OH 0, 1 M HCl(aq) + Na. OH(aq) Na. Cl(aq) + H 2 O(l) atau H+(aq) + OH-(aq) H 2 O(l) sebelum penambahan Na. OH HCl adalah asam kuat dan terdisosiasi lengkap, jadi [H+] = 0, 1 p. H = - log [H+] = 1 Setelah penambahan 10 ml Na. OH reaksi yang terjadi selama titrasi adalah H+(aq) + OH-(aq) H 2 O(l) (50 ml) x (0, 1 mmol/ml) H= bereaksi dengan (10 ml) x (0, 1 mmol/ml) OHH+(aq) 5, 00 mmol 1, 00 mmol 4, 00 mmol + OH-(aq) 1, 00 mmol H 2 O(l) 0 dalam kesetimbangan terdapat 4, 00 mmol H= dalam 60 ml larutan. Jadi, [H+] = 4, 00 mmol / 60 ml = 6, 67 x 10 -2 mmol/ml p. H = - log [H+] = 2 - log 6, 67 = 1, 18 hitung p. H larutan setelah penambahan 20, 30, 45 dan 49, 9 ml Na. OH

Setelah penambahan 50 ml Na. OH reaksi berlangsung sempurna, garam yang dihasilkan yaitu Na. Cl tidak asam dan tidak pula basa dalam larutan air (tidak dihidrolisis), maka larutan itu netral; [H+] = [OH-] = 1, 0 x 10 -7 p. H = 7 Setelah penambahan 60 ml Na. OH Perhatikan: setelah titik ekuivalen tercapai (besar p. H = 7, 00), penambahan 0, 05 ml titran akan merubah p. H menjadi 9, 7 nilai tersebut diperoleh dari H+(aq) + OH-(aq) H 2 O(l) 5, 00 mmol 5, 05 mmol 5, 00 mmol 0 0, 05 mmol dalam kesetimbangan terdapat 0, 05 mmol OH- dalam 100, 05 ml larutan. Jadi, [OH-] = 0, 05 mmol / 100, 05 ml = 0, 0005 mmol/ml p. OH = - log [OH-] = 3, 30125 p. H = 14 - p. OH = 9, 7 H+(aq) + OH-(aq) H 2 O(l) 5, 00 mmol 6, 00 mmol 5, 00 mmol 0 1, 00 mmol dalam kesetimbangan terdapat 1, 00 mmol OH- dalam 110 ml larutan. Jadi, [OH-] = 1, 00 mmol / 110 ml = 9, 1 x 10 -3 mmol/ml p. OH = - log [OH-] = 3 - log 9, 1 = 2, 04 hitung p. H larutan setelah p. H = 14 - p. OH = 11, 96 penambahan 51, 70, 80, 100 ml Na. OH

Perubahan warna pada fenolftalien n Perubahan warna terjadi pada p. H 8, 3 - 10

Perubahan warna pada biru bromtimol n Perubahan warna terjadi pada p. H 6 - 7, 6

Perubahan warna pada merah metil n Perubahan warna terjadi pada p. H 4, 2 - 6, 3

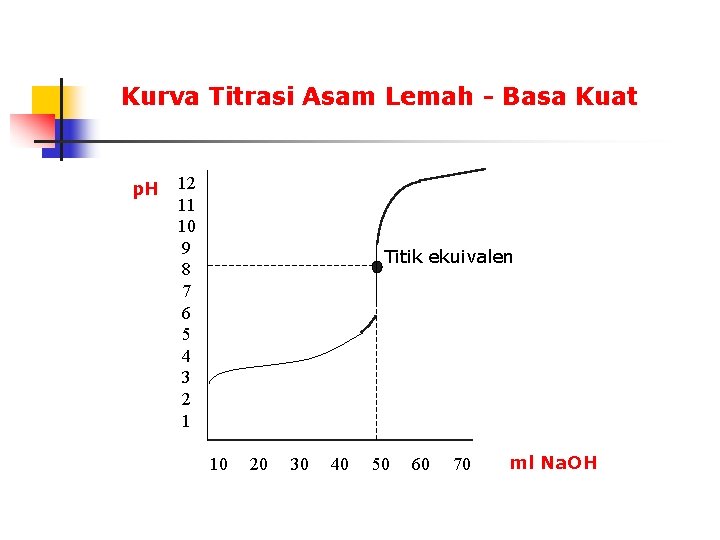
Kurva Titrasi Asam Lemah - Basa Kuat p. H 12 11 10 9 8 7 6 5 4 3 2 1 Titik ekuivalen 10 20 30 40 50 60 70 ml Na. OH

Titrasi asam lemah - basa kuat misalkan 50 ml suatu asam lemah HA Ka =1, 0 x 10 -5 0, 1 M dititrasi dengan Na. OH 0, 1 M sebelum penambahan Na. OH HA adalah asam lemah dan terdisosiasi dengan lemah HB (aq) + H 2 O (l) H 3 O+ (aq) + AMaka dianggap [H 3 O+] [A-] dan [HA] = 0, 1 - [H 3 O+] 0, 1 [H 3 O+][A-] = Ka [HA] [H 3 O]2 0, 1 = 1, 0 x 10 -5 [H 3 O+] = 1, 0 x 10 -3 p. H = 3, 00 (aq) Setelah penambahan 10 ml Na. OH reaksi yang terjadi selama titrasi adalah HA + OH- H 2 O + A(50 ml) x (0, 1 mmol/ml) HA bereaksi dengan (10 ml) x (0, 1 mmol/ml) OHHA 5, 00 mmol 1, 00 mmol 4, 00 mmol + OH- 1, 00 mmol 0 H 2 O + A- 1, 0 mmol dalam kesetimbangan terdapat 4, 00 mmol HA dan 1, 0 mmol A- dalam 60 ml larutan.
![HA A 4 00 60 H 3 O 4 00 60 [HA] = [A-] = 4, 00 60 - [H 3 O+] 4, 00 60](https://slidetodoc.com/presentation_image/305a79ce59ef40cddc7600f92be73bde/image-20.jpg)
[HA] = [A-] = 4, 00 60 - [H 3 O+] 4, 00 60 1, 00 + [H 3 O+] 60 60 [H 3 O+][A-] = Ka [HA] Setelah penambahan 50 ml Na. OH (p. H pada titik ekuivalen) terbentuk 5, 00 mmol A-; [A-] = 5, 00/100 = 0, 05 M A- adalah basa dan reaksinya dengan air adalah A- + H 2 O HA + OHdianggap [HA] [OH-] maka [HA][OH-] = Kb = 1, 0 x 10 -9 [A- ] [H 3 O+] (1, 0/60) (4, 0/60) = 1, 0 x 10 -5 [H 3 O+] = 4 x 10 -5 p. H = 5 - log 4 = 4, 40 [OH-] 0, 05 2 = 1, 0 x 10 -9 [OH-] = 7, 1 x 10 -6 p. OH = 5, 15 p. H = 8, 85

Setelah penambahan 60 ml Na. OH setelah tercapai titik ekuivalen, masih terdapat 10 ml OH- 0, 1 M atau 1, 0 mmol sementara OH- yang dihasilkan dari reaksi A - + H 2 O HA + OHdapat diabaikan, sehingga 1, 0 mmol [OH ] = = 9, 1 x 10 -3 110 ml p. OH = 2, 04 p. H = 11, 96 Perhatikan: setelah titik ekuivalen tercapai (besar p. H = 8, 85), penambahan 0, 10 ml titran akan merubah p. H menjadi 9, 7 nilai tersebut diperoleh dari 0, 01 mmol [OH-] = 100, 1 ml p. OH = 4, 0 p. H = 10, 0 = 9, 99 x 10 -5

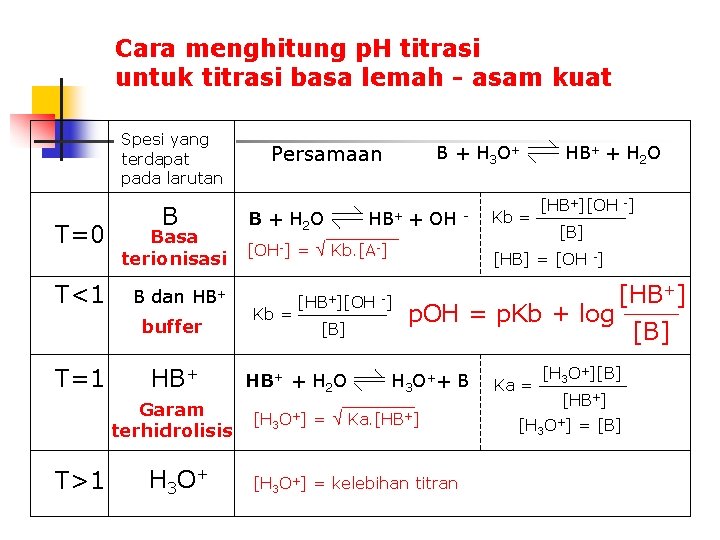
Cara menghitung p. H titrasi untuk titrasi asam lemah - basa kuat Spesi yang terdapat pada larutan HA T=0 asam terionisasi T<1 HA dan Abuffer T=1 A- HA + OH Persamaan + H 3 O++ A- Ka = [H 3 O ][A ] HA + H 2 O [H 3 O+] Ka = = Ka. [HA] [H 3 O+][A-] [HA] A- + H 2 O [H 3 OH- [HA] = [A-] O+] p. H = p. Ka + log HA + OH Garam [OH-] = Kb. [A-] terhidrolisis T>1 A- + H 2 O - [OH-] = kelebihan titran - Kb = [A-] [HA][OH -] [A-] [HA] = [OH -]

Cara menghitung p. H titrasi untuk titrasi basa lemah - asam kuat Spesi yang terdapat pada larutan T=0 T<1 B Basa terionisasi B dan HB+ buffer T=1 HB+ Garam terhidrolisis T>1 H 3 O+ Persamaan B + H 2 O [OH-] Kb = = B + H 3 O+ HB+ + OH - Kb. [A-] HB+ + H 2 O [HB+][OH -] [B] [HB] = [OH -] [HB+][OH -] [B] Kb = HB+ + H 2 O p. OH = p. Kb + log H 3 O++ B [H 3 O+] = Ka. [HB+] [H 3 O+] = kelebihan titran Ka = [HB+] [H 3 O+][B] [HB+] [H 3 O+] = [B]

Soal n Senyawa cisplatin Pt(NH 3)2 Cl 2 sebagai agen chemotherapy yang dapat dibuat sesuai reaksi berikut: (NH 4)2 Pt. Cl 4 (s)+ 2 NH 3 (aq) 2 NH 4 Cl(aq)+ Pt(NH 3)2 Cl 2 (s) untuk membuat cisplatin, anda mereaksikan sebanyak 15, 5 gram padatan (NH 4)2 Pt. Cl 4 dengan 225 m. L larutan NH 3 0, 75 M n n n a. tentukan reaksi yang terjadi bila NH 3 dilarutkan dalam air b. tentukan p. H larutan NH 3 0, 75 M (Kb NH 3=1, 8 x 10 -5) c. tuliskan reaksi ionisasi (NH 4)2 Pt. Cl 4 dan Pt(NH 3)2 Cl 2 bila larut dalam air

n n n d. antara larutan (NH 4)2 Pt. Cl 4 (373 g/mol) dan Pt(NH 3)2 Cl 2 (300 g/mol) bila larut dalam air dengan molaritas yang sama, manakah yang mempunyai daya hantar listrik paling besar e. Berdasarkan data di atas tentukan pereaksi yang jumlahnya berlebih, dan tentukan mana pereaksi pembatas f. berapa banyak cisplatin yang dapat terbentuk sebanyaknya g. sesudah pereaksi pembatas digunakan dihasilkan cisplatin yang maksimum, apa dan berapa gram jumlah pereaksi yang tersisa h. tentukan molaritas larutan NH 4 Cl yang terbentuk dari reaksi tersebut

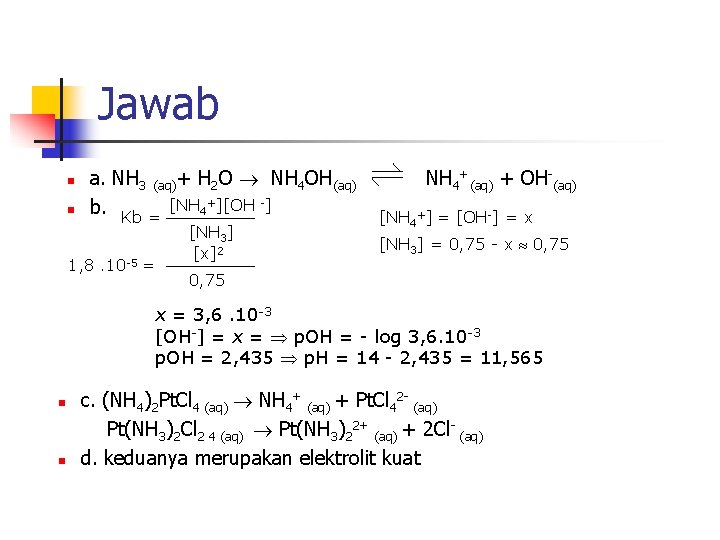
Jawab n n a. NH 3 (aq)+ H 2 O NH 4 OH(aq) b. Kb = [NH 4+][OH -] 1, 8. 10 -5 = [NH 3] [x]2 NH 4+(aq) + OH-(aq) [NH 4+] = [OH-] = x [NH 3] = 0, 75 - x 0, 75 x = 3, 6. 10 -3 [OH-] = x = p. OH = - log 3, 6. 10 -3 p. OH = 2, 435 p. H = 14 - 2, 435 = 11, 565 n n c. (NH 4)2 Pt. Cl 4 (aq) NH 4+ (aq) + Pt. Cl 42 - (aq) Pt(NH 3)2 Cl 2 4 (aq) Pt(NH 3)22+ (aq) + 2 Cl- (aq) d. keduanya merupakan elektrolit kuat

(NH 4)2 Pt. Cl 4 (s) + 2 NH 3 (aq) 2 NH 4 Cl(aq)+ Pt(NH 3)2 Cl 2 (s) n e. mol (NH 4)2 Pt. Cl 4 = 15, 5 g/ 373 = 0, 0416 mol NH 3 = 0, 225 L x 0, 75 mol/L = 0, 16875 mol 1 mol (NH 4)2 Pt. Cl 4 2 mol NH 3 0, 0416 mol(NH 4)2 Pt. Cl 4 0, 0832 mol NH 3 pereaksi pembatas adalah (NH 4)2 Pt. Cl 4 n f. cisplatin yang terbentuk 0, 0416 mol x 300 g/mol = 12, 48 g n g. sisa NH 3 0, 16875 mol - 0, 0832 mol = 0, 08555 mol x 17 g/mol = 1, 454 g NH 3 n h. jumlah mol NH 4 Cl = 2 x 0, 0416 mol = 0, 0832 molaritas = 0, 0832 mol / 0, 225 L = 0, 36978 M
 Titrimetric methods of analysis
Titrimetric methods of analysis Gasometri adalah
Gasometri adalah Pengertian analisis volumetri
Pengertian analisis volumetri Contoh analisis volumetri
Contoh analisis volumetri Dasar-dasar analisis fonem
Dasar-dasar analisis fonem Kaidah teks prosedur kiat menata rambut pendek
Kaidah teks prosedur kiat menata rambut pendek Teori kesalahan
Teori kesalahan Analytical chemistry statistics
Analytical chemistry statistics Pengertian laporan keuangan konsolidasi metode equity
Pengertian laporan keuangan konsolidasi metode equity Langkah-langkah metode ilmiah
Langkah-langkah metode ilmiah Contoh metode ilmiah kimia
Contoh metode ilmiah kimia Titrimetri
Titrimetri Pipet tetes
Pipet tetes Soal titrasi redoks
Soal titrasi redoks Analisis yang mempertajam analisis rasio dengan memisahkan
Analisis yang mempertajam analisis rasio dengan memisahkan Peratus untung bersih atas jualan
Peratus untung bersih atas jualan Contoh format analisis jabatan dan analisis beban kerja
Contoh format analisis jabatan dan analisis beban kerja Bab 10 analisis risiko: analisis rasio
Bab 10 analisis risiko: analisis rasio Analisis yang mempertajam analisis rasio dengan memisahkan
Analisis yang mempertajam analisis rasio dengan memisahkan Perhitungan kadar air gravimetri
Perhitungan kadar air gravimetri Contoh soal metode analisis titik impas lokasi
Contoh soal metode analisis titik impas lokasi Contoh fishbone
Contoh fishbone Metode analisa gravimetri
Metode analisa gravimetri Metode semi average ganjil
Metode semi average ganjil Contoh bagan pohon masalah
Contoh bagan pohon masalah Prinsip analisis lemak metode soxhlet
Prinsip analisis lemak metode soxhlet Analisis usg isu kontemporer
Analisis usg isu kontemporer Metode root cause analysis
Metode root cause analysis