Analisis Volumetri Definisi Analisis Volumetri Dasar Reaksi Analisis














- Slides: 15


Analisis Volumetri ü Definisi Analisis Volumetri ü Dasar Reaksi Analisis Volumetri ü Pembagian Reaksi dalam Analisis Volumetri ü Larutan Standar ü Titik Ekuivalensi dan Titik Akhir Titrasi ü Satuan Konsentrasi

Definisi Analisis Volumetri 1. Ialah analisis yang didasarkan pada pengukuran volume suatu larutan yang konsentrasinya diketahui dengan pasti, yang dibutuhkan untuk bereaksi sempurna dengan suatu zat yang akan ditentukan konsentrasinya. 2. Prosesnya disebut titrasi, larutan yang diketahui konsentrasinya disebut larutan standar atau larutan baku

Dasar Reaksi Analisis Volumetri ü Didasarkan m. C pada suatu reaksi kimia : C m. R n + n. R dimana : C = zat penitrasi R = zat yang dititrasi m = jumlah mol C n = jumlah mol R

Syarat-syarat reaksi : Reaksi harus sederhana yang dapat ditunjukkan dengan persamaan kimia; zat yang ditentukkan harus bereaksi sempurna dengan pereaksi secara stokiometri ü Reaksi harus berlangsung cepat ü Harus ada perubahan sifat fisika atau kimia yang dapat ditandai pada ttk ekuivalen ü Indikator yang digunakan harus jelas menunjukkan titik akhir titrasi ü

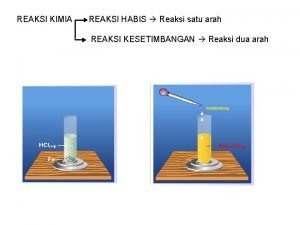
Pembagian Reaksi dalam Analisis Volumetri Reaksi asam basa atau netralisasi H 3 O+ + OH 2 H 2 O H 3 O + + A HA + H 2 O B+ + OHBOH 2. Reaksi pengendapan Ag+ + Cl. Ag. Cl Pb 2+ + Cr. O 42 Pb. Cr. O 4 1.

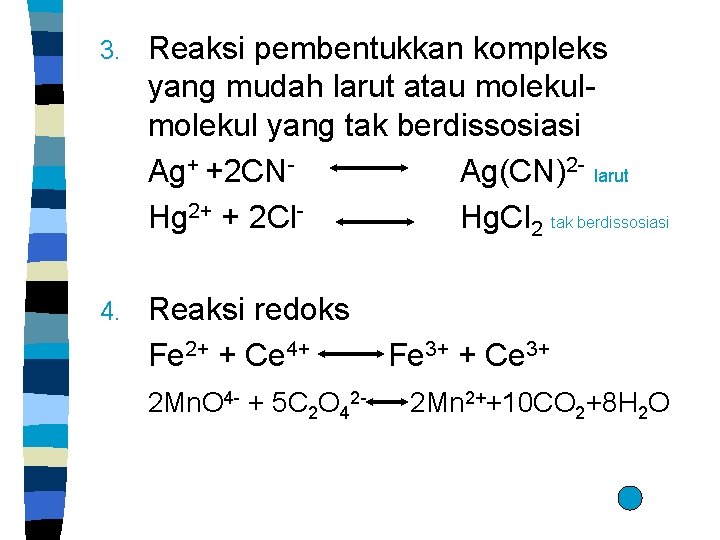
3. Reaksi pembentukkan kompleks yang mudah larut atau molekul yang tak berdissosiasi Ag+ +2 CNAg(CN)2 - larut Hg 2+ + 2 Cl. Hg. Cl 2 tak berdissosiasi 4. Reaksi redoks Fe 2+ + Ce 4+ 2 Mn. O 4 - + 5 C 2 O 42 - Fe 3+ + Ce 3+ 2 Mn 2++10 CO 2+8 H 2 O

Larutan standar 1. ü ü Zat Standar Primer Pada reaksi asam-basa : Na 2 CO 3, Na 2 B 4 O 7, KHP, KIO 3, HCl dgn td. konstan, C 6 H 5 COOH, H 2 C 2 O 4. 2 H 2 O Pada reaksi pengendapan : Ag. NO 3, Na. Cl, KBr Pada reaksi pembentukkan kompleks : Ag. NO 3, Na. Cl, KCl, EDTA Pada reaksi redoks : K 2 Cr 2 O 7, KBr. O 3, KIO 3, I 2, As 2 O 3, Na 2 C 2 O 4, KH(IO 3)2

2. Zat standar sekunder ü Terdiri dari asam-asam, Na. OH, KOH, Ba(OH)2, KMn. O 4, KCNS, NH 4 CNS, dan Na 2 S 2 O 3 ü Syarat zat standar primer : Harus murni, pengotor harus < 0, 02% Harus stabil Mudah dikeringkan, tidak higroskopis Mempunyai berat ekuivalen yang besar 1. 2. 3. 4.

Titik Ekivalen dan Titik Akhir Titrasi ü Titik ekivalen (ttk akhir teoritis titrasi) adalah titik (saat) dimana jumlah ekivalen zat penitrasi sama dengan jumlah ekivalen zat yang dititrasi ü Titik akhir titrasi adalah saat timbul perubahan warna indikator ü Jika ttk akhir titrasi tdk berimpit dengan ttk ekivalensi kesalahan titrasi

Titik akhir titrasi dapat di deteksi berdasarkan ü Perubahan warna indikator ü Terjadinya kekeruhan yang disebabkan oleh terbentuk atau melarutnya endapan ü Perubahan DHL larutan ü Perubahan arus listrik dalam larutan

Satuan Konsentrasi a. Satuan Fisika Persen berat (% w/w) b. Persen volume (%v/v) c. Persen berat/volume (%w/v) d. Parts Per Million dan Parts Per Billion 1 ppm (bag. per sejuta) = 1 mg zat/L larutan 1 ppb (bag. per milliard) = 1 g/L larutan ü

üSatuan kimia a. Kemolaran (M) Jumlah mol zat terlarut dalam 1 liter larutan b. ü ü ü Kenormalan (N) ekivalen zat terlarut dalam liter larutan Berat satu ekivalen disebut berat ekivalen (BE) Reaksi asam-basa 1 ekivalen 1 mol H+ atau 1 mol OHReaksi pengendapan dan pembentukan kompleks BE = BM/ muatan ion Reaksi redoks 1 ek 1 mol elektron

c. Titer (T) Satuan titer adalah berat / volume, tetapi berat yang digunakan pereaksi yang bereaksi dengan larutan, bukan dengan zat terlarut. T = N X BE

 Contoh analisis volumetri
Contoh analisis volumetri Materi analisis volumetri
Materi analisis volumetri Pengertian analisis volumetri
Pengertian analisis volumetri Algoritma yang merupakan gabungan dari beberapa rbm adalah
Algoritma yang merupakan gabungan dari beberapa rbm adalah Reaksi ch3 ch2 cl
Reaksi ch3 ch2 cl Reaksi reaksi pada gas mulia
Reaksi reaksi pada gas mulia Tentukan produk reaksi dari reaksi amina berikut
Tentukan produk reaksi dari reaksi amina berikut Dasar dasar analisis fonem
Dasar dasar analisis fonem Dasar pendidikan kebangsaan
Dasar pendidikan kebangsaan Definisi persamaan dasar akuntansi
Definisi persamaan dasar akuntansi Dasar dasar bk
Dasar dasar bk Basic engineering process
Basic engineering process Pertanyaan tentang korespondensi surat
Pertanyaan tentang korespondensi surat Kode etik desain grafis
Kode etik desain grafis Peta konsep tentang jaringan komputer
Peta konsep tentang jaringan komputer Dasar dasar pengambilan keputusan menurut george r terry
Dasar dasar pengambilan keputusan menurut george r terry