VOLUMETRI PENDAHULUAN ASIDIALKALIMETRI ANALISIS VOLUMETRI analisis titrimetri analisis















![Komposisi TAT : [Na 2 HPO 4] = Y kelebihan Na. OH [Na. H Komposisi TAT : [Na 2 HPO 4] = Y kelebihan Na. OH [Na. H](https://slidetodoc.com/presentation_image_h2/419756ef92b9d0cde38589feaea45f14/image-18.jpg)
![Komposisi TAT-I : [Na. H 2 PO 4] = Y : kekurangan Na. OH Komposisi TAT-I : [Na. H 2 PO 4] = Y : kekurangan Na. OH](https://slidetodoc.com/presentation_image_h2/419756ef92b9d0cde38589feaea45f14/image-20.jpg)



















- Slides: 40

VOLUMETRI PENDAHULUAN ASIDI-ALKALIMETRI

ANALISIS VOLUMETRI : analisis titrimetri, analisis penentuan kadar sampel berdasarkan ekivalensi larutan standar yang ditambahkan dari buret dengan bantuan indikator untuk menetapkan banyaknya volume yang harus ditambahkan • SAMPEL : dapat berupa padatan ataupun cairan • LARUTAN STANDAR : bisa larutan standar/larutan baku primer ataupun larutan baku sekunder • INDIKATOR : - larutan indikator asam-basa, - perubahan warnanya menentukan akhir titrasi, - pada titik akhir titrasi disimpulkan larutan baku ekivalen dengan sampel. PERHITUNGAN : V sampel x N sampel = V baku x N baku mgrek sampel = V baku x N baku

PEMILIHAN INDIKATOR 1 grl = 1 grek, kesetaraan dengan 1 H+ atau 1 OH- (dalam asam basa) atau ditentukan oleh reaksi yang terjadi berdasarkan indikator yang Contoh : dipakai 1). H 2 C 2 O 4 : pada pembakuan Na. OH reaksi : H 2 C 2 O 4 + 2 Na. OH Na 2 C 2 O 4 + 2 H 2 O 1 grl H 2 C 2 O 4 perlu 2 grl Na. OH 1 M H 2 C 2 O 4 = 2 N 2). Na 2 CO 3 : ditetapkan dengan larutan baku HCl reaksi : a. Na 2 CO 3 + HCl Na. HCO 3 + Na. Cl b. Na 2 CO 3 + 2 HCl H 2 CO 3 + 2 Na. Cl Reaksi a) : bila digunakan ind. pp (8. 0 – 10. 0) 1 grl = 1 grek b) : bila digunakan ind. jm (3. 1 – 4. 4) 1 grl = 2 grek Analisis TAT (titik akhir titrasi) dan TE (titik ekivalen) : a. Na. HCO 3 : p. H = ½ (p. Ka 1 + p. Ka 2) = ½ (6. 37 + 10. 25) = 8. 31 (protolit antara-1) p. H ekivalen terletak pada color change ind. 1 grl Na 2 CO 3 = 1 grek atau 1 M = 1 N

b. H 2 CO 3 p. H = ½ (p. Ka 1 + p. C) = ½ (6. 37 + 1. 50) = 3. 935 (asam lemah) TE (3. 935) terletak pada color change interval indikator grl Na 2 CO 3 = 2 grek atau 1 Mtergantung = 2 N. • 1 KESIMPULAN : ekivalensi pada hasil reaksi dimana • • p. H ekivalennya terletak pada color change interval dari indikator yang digunakan, selain adanya kesalahan titrasi yang terjadi pada TAT sehingga tidak memungkinkan penggunaan TE tersebut sebagai acuan pemilihan ind. • Contoh : H 2 C 2 O 4 dalam ekivalensinya selalu 1 M = 2 N sebab • Na. HC 2 O 4 tak dapat dipakai sebagai acuan pemilihan • indikator kesalahan titrasi cukup besar • p. H dari Na. HC 2 O 4 (protolit antara-1) = ½ (p. Ka 1 + p. Ka 2) • = ½ (1. 23 + 4. 19) = 2. 71 • tak ada ind. yang sesuai, karena besarnya kesalahan titrasi yang terjadi pada p. H tersebut




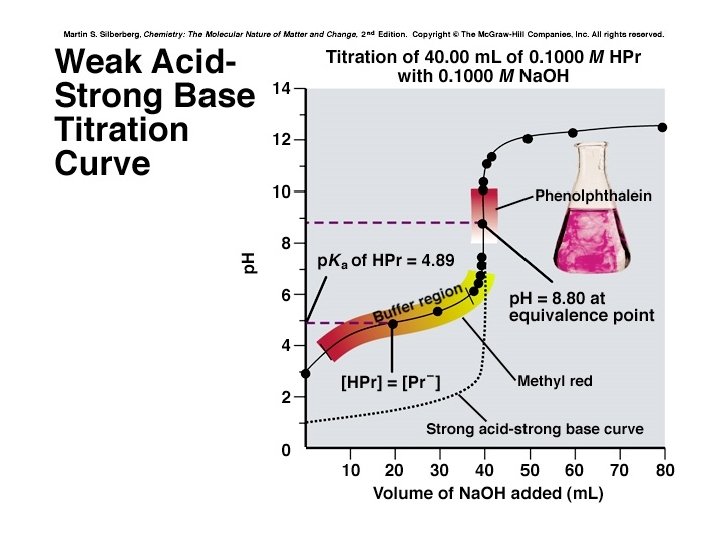
KESALAHAN TITRASI : TINJAUAN ANTARA TITIK AKHIR TITRASI (INDIKATOR) vs TITIK EKIVALEN Contoh : I 10. 0 ml HCl 0. 1025 M + 50 ml air + 2 -3 tetes ind pp (8 – 10), dititrasi dengan larutan baku Na. OH 0. 0982 N sampai TAT (tak berwarna merah muda) 1). Reaksi : HCl + Na. OH Na. Cl + H 2 O 2). Menetukan p. H hasil reaksi : Na. Cl + H 2 O p. H = p. H H 2 O = 7 3). Menentukan apakah TAT jatuh sebelum atau sesudah TE 4). Menetukan komposisi senyawa yang ada pada TAT 5). Menetukan perumusan p. H pada TAT yang akan dipakai untuk perhitungan kekurangan / kelebihan pentiter 6). Perhitungan kesalahan titrasi : (kelebihan / kekurangan pentiter) x 100% (pentiter yg seharusnya)

MENETAPKAN TAT : p. H________7______8_______10_____ • Penetapan TAT : diambil p. H TE TATterdekat dari color change interval indikator pp (8 – 10) terhadap TE à TAT : sesudah TE atau pentiter : BERLEBIH Na. OH Komposisi pada TAT : Na. Cl + H 2 O + Na. OH : kelebihan ( mis. X ml 0. 0982 N) à p. H larutan = p. H dari Na. OH = p. H TAT = 8 p. OH = 14 – 8 = 6 à p. OH = - log [Na. OH] = (X). / (V total lar ) x 0. 0982 V total lar = V HCl + V aquades + V Na. OH = (10 x 0. 1025) / (0. 0982) + X ml = (10. 44 + X) ml V total lar = 10 + 50 + 10. 44 + X = (70. 44 + X) ml [Na. OH] = (X) / (70. 44 + X) x 0. 0982. Persamaan : p. OH = - log [Na. OH] atau 10 – 6 = - log [Na. OH]

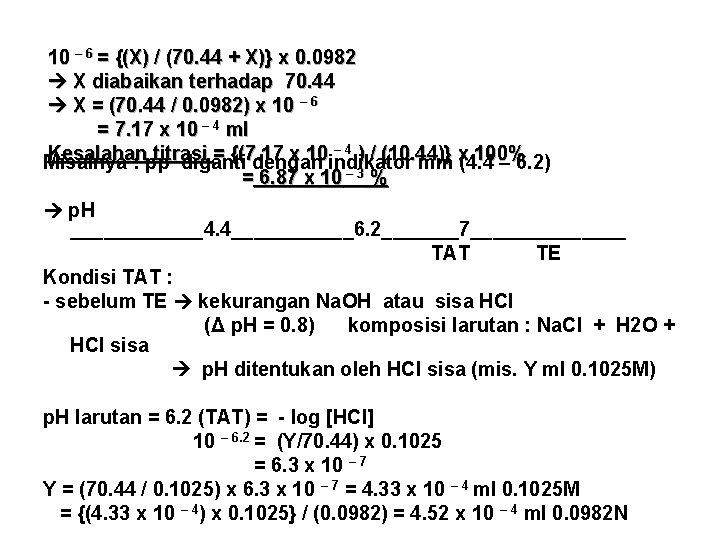
10 – 6 = {(X) / (70. 44 + X)} x 0. 0982 X diabaikan terhadap 70. 44 X = (70. 44 / 0. 0982) x 10 – 6 = 7. 17 x 10 – 4 ml – 4 ) / (10. 44)} x 100% Kesalahan titrasi = {(7. 17 x 10 Misalnya : pp diganti dengan indikator mm (4. 4 – 6. 2) = 6. 87 x 10 – 3 % p. H ______4. 4______6. 2_______7_______ TAT TE Kondisi TAT : - sebelum TE kekurangan Na. OH atau sisa HCl (Δ p. H = 0. 8) komposisi larutan : Na. Cl + H 2 O + HCl sisa p. H ditentukan oleh HCl sisa (mis. Y ml 0. 1025 M) p. H larutan = 6. 2 (TAT) = - log [HCl] 10 – 6. 2 = (Y/70. 44) x 0. 1025 = 6. 3 x 10 – 7 Y = (70. 44 / 0. 1025) x 6. 3 x 10 – 7 = 4. 33 x 10 – 4 ml 0. 1025 M = {(4. 33 x 10 – 4) x 0. 1025} / (0. 0982) = 4. 52 x 10 – 4 ml 0. 0982 N


Contoh : II larutan HAc+0. 0975 4. 74) 50 ml air + 2 tetes ind • 10. 0 1). ml Reaksi : HAc Na. OHM (p. Ka Na. Ac + H+2 O pp (8 – 10. 0) dititrasi dengan larutan baku Na. OH 0. 1036 N • 2). p. H larutan = p. H Na. Ac p. OH = ½ (p. Kb Ac- + p. C) • V Na. OH ekiv = (10 x 0. 0975) / 0. 1036 • = 9. 41 ml • [Na. Ac] = (10 x 0. 0975) / (10 + 50 + 9. 41) = 0. 0140 • - log [Na. Ac] = p. C • = - log 0. 0140 = 1. 98 • p. OH = ½ (14 - 4. 74 + 1. 98) = 5. 62 • p. H = 14 – 5. 62 = 8. 38 • 3). Menentukan TAT : • p. H ---------- 8. 38 ---------- 10. 0 ------ • TAT TE • TAT : sebelum TE atau kekurangan Na. OH atau ada sisa HAc

4). Komposisi pada TAT : Na. Ac + H 2 O + HAc sisa p. H larutan = p. Ka HAc + log { [Na. Ac] / [HAc]} = larutan dapar 5). Misalkan sisa HAc = X ml à Na. Ac = (10 – X) ml 0. 0975 à 8 = 4. 74 + log (10 - X) / (X) à à log (10 – X) / (X) = 3. 26 à (10 – X) / (X) = 10 3. 26 à = 1819. 7 X = 5. 45 x 10 – 3 6). Kesalahan titrasi : {(sisa) / (yang semula)} x 100% (Δ p. H = 0. 38) = {(5. 45 x 10 – 3) / (10)} x 100% = 5. 45 x 10 – 2 %

Contoh : III 10. 0 ml larutan HAc 0. 0975 M (p. Ka 4. 74) + 50 ml air + 2 tetes ind Menentukan TAT–: 10. 6) dititrasi dgn larutan baku Na. OH 0. 1036 N timolftalein (9. 4 p. H -----------8. 38 ------ 9. 4 ------ 10. 6 --------TE TAT : sesudah TE atau kelebihan Na. OH Komposisi pada TAT : Na. Ac + H 2 O + Na. OH (kelebihan, mis. Y ml) p. H ditentukan oleh kelebihan Na. OH (protolit kuat) p. H = 9. 4 p. OH = 14 – 9. 4 = 4. 6 [OH-] = 2. 51 x 10 – 5 [Na. OH] = {(Y) / ( 10 + 50 + 9. 41)} x 0. 1036 = 2. 51 x 10 – 5 à Y = 1. 68 x 10 – 2 à Kesalahan titrasi = {(1. 68 x 10 – 2) / (9. 41)} x 100 % à = 0. 18 % (Δ p. H = 1. 02)

Contoh : IV 10. 0 ml H 3 PO 4 0. 1016 M + 50 ml air + 2 tetes ind mo (3. 1 – 4. 4) dititrasi dengan larutan baku Na. OH 0. 1085 N • 3 PO 1). Reaksi : H 3 PO Na. OH Na. H 2 p. Ka PO 4 3+=H 2 O H , p. Ka = 7. 21 dan 12. 31 (I) 4 + 2 4 : p. Ka 1 = 2. 12 • • • H 3 PO 4 + 2 Na. OH Na 2 HPO 4 + 2 H 2 O (II) H 3 PO 4 + 3 Na. OH Na 3 PO 4 + 3 H 2 O (III) 2). p. H ekivalen : - tahap I = ½ (p. Ka 1 + p. Ka 2) = ½ (2. 12 + 7. 21) = 4. 665 = 4. 67 - tahap II = ½ (p. Ka 2 + p. Ka 3) = ½ (7. 21 + 12. 31) = 9. 76 - tahap III = 14 - ½ (p. Kb PO 43 - + p. C) = 12. 19 Reaksi tahap III V Na. OH = 3 x {(10 x 0. 1016) / (0. 1085)} = 28. 09 [Na 3 PO 4] = (10 x 0. 1016) / (10 + 50 + 28. 09) = 0. 0115 p. C = - log 0. 0115 = 1. 94 p. H ekiv tahap III = 14 – ½ (14 – 12. 31 + 1. 94) = 12. 185 = 12. 19

3). Menetapkan TAT : p. H ------- 3. 1 ----- 4. 4 --- 4. 67 ------9. 76 ----12. 19 -----TAT TE-III 4). Kondisi TAT : sebelum TE-I atau kekurangan Na. OH atau sisa H 3 PO 4 (mis. X ml) Komposisi larutan : Na. H 2 PO 4 + H 2 O + H 3 PO 4 sisa dapar p. H larutan = p. Ka H 3 PO 4 + log [Na. H 2 PO 4] / [H 3 PO 4] = p. Ka 1 + log (10 – X) / (X) 4. 4 = 2. 12 + log (10 – X) / (X) = 2. 28 (10 – X) / (X) = 10 2. 28 = 190. 55 X = (10)/(190. 55 +1) = 0. 05 ml 5). Menghitung kesalahan titrasi : (sisa H 3 PO 4) x 100% (H 3 PO 4 awal = {(0. 05) / (10)} x 100 % = 0. 5 % Catatan : pada perhitungan p. H larutan dapar konsentrasi boleh dalam M, mgrl, ml.

Contoh : IV 10. 0 ml H 3 PO 4 0. 1016 M + 50 ml air + 2 tetes ind mbp (5. 2 – 6. 8) dititrasi dengan larutan baku Na. OH 0. 1085 N 1) Reaksi : seperti diatas p. Ka 1 = 2. 12 p. Ka 2– =I 7. 21 dan p. Ka 3 = 12. 31 4 : ekivalen 2)H 3 PO p. H : p. H, ekiv = 4. 67 p. H ekiv – II = 9. 76 p. H ekiv – III = 12. 19 3). Menetapkan TAT : p. H -------4. 67 ---- 5. 2 ------ 6. 8 --------9. 76 ------12. 19 --TE-I TAT TE-II TEIII 4). Kondisi TAT : - kelebihan Na. OH Na. H 2 PO 4 + H 2 O + Na. OH (kelebihan) Na 2 HPO 4 + Na. H 2 PO 4 (sisa) + H 2 O dapar p. H = p. Ka Na. H 2 PO 4 + log [Na 2 HPO 4] / [Na. H 2 PO 4]
![Komposisi TAT Na 2 HPO 4 Y kelebihan Na OH Na H Komposisi TAT : [Na 2 HPO 4] = Y kelebihan Na. OH [Na. H](https://slidetodoc.com/presentation_image_h2/419756ef92b9d0cde38589feaea45f14/image-18.jpg)
Komposisi TAT : [Na 2 HPO 4] = Y kelebihan Na. OH [Na. H 2 PO 4] = : (10 – Y) 5). Perhitungan kelebihan Na. OH 5. 2 = 7. 21 + log (Y) / (10 – Y) = 5. 2 – 7. 21 = - 2. 01 (Y) / (10 – Y) = 10 – 2. 01 = 0. 0098 Y = 0. 097 = 0. 10 ml 6). Kesalahan titrasi: (Na 2 HPO 4 yang terjadi) / (Na. H 2 PO 4 seharusnya) x 100% (0. 10) / (10) x 100 % = 1. 00 %

Contoh : V 10. 0 ml H 3 PO 4 0. 1016 M + 50 ml air + 2 tetes ind tp (8. 3 – 10. 5) dititrasi dengan larutan baku Na. OH 0. 1085 N H 3 PO 4 : p. Ka 1 = 2. 12 , p. Ka 2 = 7. 21 dan p. Ka 3 = 12. 31 • Reaksi : seperti diatas (lihat contoh sebelumnya) • p. H ekivalen : p. H ekiv – I = 4. 67 p. H ekiv – II = 9. 76 p. H ekiv – III = 12. 19 3). Menetapkan TAT-I : p. H -------4. 67 ------ 8. 3 -------9. 76 ------ 10. 5 ------12. 19 --TE-I TAT-I TE-II TAT-II TE-III 4). Kondisi TAT-I : - kekurangan Na. OH Na 2 HPO 4 + H 2 O + Na. H 2 PO 4 (kelebihan) Na 2 HPO 4 + Na. H 2 PO 4 (sisa) + H 2 O dapar p. H = p. Ka 2 Na. H 2 PO 4 + log [Na 2 HPO 4] / [Na. H 2 PO 4]
![Komposisi TATI Na H 2 PO 4 Y kekurangan Na OH Komposisi TAT-I : [Na. H 2 PO 4] = Y : kekurangan Na. OH](https://slidetodoc.com/presentation_image_h2/419756ef92b9d0cde38589feaea45f14/image-20.jpg)
Komposisi TAT-I : [Na. H 2 PO 4] = Y : kekurangan Na. OH [Na 2 HPO 4] = (10 – Y) 8. 3 = 7. 21 + log (10 – Y ) / (Y) 5). Perhitungan kekurangan Na. OH : log (10 –Y) / (Y) = 8. 3 – 7. 21 = 1. 09 (10 –Y) / (Y) = 10 1. 09 = 12. 30 Y = (10) / (12. 30 + 1) = 0. 75 ml 6). Kesalahan titrasi ( TAT-I : p. H = 8. 3 ) Δ p. H = 1. 46 (Na. H 2 PO 4 sisa) / (Na 2 HPO 4 seharusnya) x 100% (0. 75) / (10) x 100 % = 7. 50 % 7). Kondisi TAT-II : - kelebihan Na. OH Na 2 HPO 4 + H 2 O + Na 3 PO 4 (kelebihan) Na 2 HPO 4 + Na 3 PO 4 (kelebihan) + H 2 O dapar p. H = p. Ka 3 Na. H 2 PO 4 + log [Na 3 PO 4] / [Na 2 HPO 4] Komposisi TAT-II : [Na 3 PO 4] = X : kelebihan Na. OH [Na 2 HPO 4] = (10 – X) 10. 5 = 12. 31 + log (X ) / (10 – X)

8). Perhitungan kelebihan Na. OH : log (X) / (10 – X) = 10. 5 – 12. 31 = - 1. 81 (X) / (10 - X) = 10 - 1. 81 = 0. 0155 X = (0. 155) / (1. 0155) = 0. 15 ml 9). Kesalahan titrasi ( TAT-II : p. H = 10. 5 ) : Δ p. H = 0. 74 (Na 3 PO 4 yang terjadi) / (Na 2 HPO 4 seharusnya) (0. 15) / (10) x 100 % = 1. 50 %

Contoh : VI Apakah 10. 0 ml HAc 0. 1 M (p. Ka 4. 74) terkontaminasi dengan HCl 0. 01 M + 50 ml air + 2 tetes ind pp (8 – 10) dapat dititrasi dgn larutan baku Na. OH 0. 1 N ? • 1). Reaksi : HCl Na. Cl (Na. Cl) tetap • + Na. OH • HAc (HAc) tetap Na. Ac • 2). p. H ekiv-I : Na. Cl + HAc = ½ (p. Ka HAc + p. C HAc) • = ½ (4. 74 + mis. 1) = 2. 87 • p. H ekiv-II : Na. Cl + Na. Ac = 14 – ½ (p. Kb Ac- + p. C Ac-) • = 14 – ½(14 – 4. 74 + mis. 1) = 8. 87 • 3). Penetapan TAT : • p. H ----2. 87 -------- 8 -------8. 87 -------- 10 ------ • TE-I TAT TE-II

4). Tinjauan TAT kesalahan titrasi : 5). (p. H = 8): - HCl akan tertitrasi habis (p. H ekiv-II > 7) - kekurangan Na. OH atau HAc (sisa) dan Na. Ac (terbentuk) - TAT pada p. H 8, sebagian HAc belum tertitrasi (p. H ekiv-II = 8. 87) p. H dapar = p. Ka + log [Na. Ac] / [HAc] mis. HAc sisa = X 8 = 4. 74 + log (10 – X) / (X) = 10 3. 26 = 1819. 70 X = (10) / (1819. 70 + 1) = 0. 0055 ml 6) Menghitung kesalahan titrasi : - Na. OH untuk HCl = (10 x 0, 01) / (0. 1) = 1 ml - Na. OH untuk HAc = kurang 0. 0055 ml - total kelebihan Na. OH = (1 – 0. 0055) ml = 0. 9945 ml - Kesalahan titrasi = {(0. 9945) / (10)} x 100 % = 9. 945 %

PENETAPAN KADAR - TIDAK MEMPERMASALAHKAN KESALAHAN TITRASI - EKIVALENSI BERDASARKAN TAT (IND) YANG DIGUNAKAN • Contoh : I – Penetapan kadar Ca. CO 3 (MR 100. 08) dimana H 2 CO 3 dengan p. Ka 1 = 6. 37 dan p. Ka 2 = 10. 25 – Prosedur : 500. 4 mg sampel batu kapur dipanaskan, setelah dingin + 50. 0 ml HCl 0. 2000 N , kemudian dititrasi dengan larutan baku Na. OH 0. 1016 N dan ind hijaubrom kresol (3. 8 - 5. 4) yang ternyata perlu : 4. 50 ml untuk mencapai TAT KAJIAN : 1). Reaksi : Ca. CO 3 + 2 HCl (berlebih) Ca. Cl 2 + H 2 CO 3 HCl (sisa) + Na. OH Na. Cl + H 2 O 2) p. H ekiv : H 2 CO 3 + Ca. Cl 2 + Na. Cl + H 2 O ditentukan oleh : H 2 CO 3 = ½ (p. Ka 1 + p. C) = ½ (6. 37 + mis. 2) = 4. 185 (masih dalam color change interval ind hbk)

3). Perhitungan : sisa HCl = (4. 50 x 0. 1060) grek = 0. 4770 mgrek HCl = Ca. CO 3 = (50 x 0. 2000) – 0. 4770 = 9. 523 mgrek 4). Penetapan ekivalensi : Ca. CO 3 + 2 HCl 1 mgrl Ca. CO 3 = 2 mgrek 5). Menghitung kadar : Ca. CO 3 = 9. 523 mgrek = ½ x 9. 523 mgrl = 4. 7615 x 100. 08 (MR) = 476. 53092 mg = 476. 53 mg Kadar = (476. 53 / 500. 4) x 100 % = 95. 23 %

Contoh : II 100. 0 ml air yang mengandung HCO 3 - (MR 61) dan CO 3= (MR 60) + ind jm (3. 1 – 4. 4) – dititrasi dgn HCl 0. 0200 N memerlukan 41. 00 ml untuk mencapai TAT nya dan bila ind yang digunakan pp (8 – 10. 0) maka memerlukan 2. 00 ml 1). Reaksi : HCO 3 - (HCO 3 -) tetap H 2 CO 3 + HCl = CO 3 H 2 CO 3 2). p. H ekiv-I : p. H HCO 3 - = ½ (p. Ka 1 + p. Ka 2) = ½ (6. 37+10. 25) = 8. 31 ekiv-II : p. H H 2 CO 3 = ½ (p. Ka 1 + p. C) = ½ (6. 37 + mis. 2) = 4. 185 3). Ind pp (8 – 10) : sesuai reaksi tahap-I HCl bereakksi dengan CO 3= HCO 3 - dan 1 mgrl = 1 mgrek kadar CO 3= = 2. 00 x 0. 0200 = 0. 04 mgrek = 0. 04 mgrl = 0. 04 x 60 (MR) = 2. 4 mg / 100 ml = 24 mg / liter Ind jm (3. 1 – 4. 4) : sesuai reaksi tahap-II HCl bereaksi dengan CO 3= H 2 CO 3 (1 mgrl = 2 mgrek) dan HCO 3 - H 2 CO 3 ( 1 mgrl = 1 mgrek) HCl untuk HCO 3 - = (41. 00 x 0. 0200) – (2 x 0. 04) = 0. 74 mgrek kadar HCO 3 - = 0. 74 mgrl = 0. 74 x 61 (MR) = 45. 14 mg /100 ml

Contoh : III 250. 0 ml larutam mengandung Na. OH (MR 40) dan Na 2 CO 3 (MR 106). 25. 0 ml larutan tsb + ind pp (8 – 10), perlu 23. 20 ml HCl 0. 1023 N untuk TAT, bila ind jm (3. 1 – 4. 4) perlu 24. 60 ml HCl 0. 1023 N untuk TAT-nya. 1). Reaksi : Na. OH Na. Cl (Na. Cl) + HCl Na 2 CO 3 (Na 2 CO 3) Na. HCO 3 H 2 CO 3 2). p. H ekiv-I : Na. Cl + Na 2 CO 3 = 14 – ½(p. Kb CO 3= + p. C) = 14 – ½ {(14 – 10. 25) + mis. 2)} = 11. 125 p. H ekiv-II : Na. Cl + Na. HCO 3 = ½ (p. Ka 1 +p. Ka 2) = ½ (6. 37 + 10. 25) = 8. 31 p. H ekiv-III : Na. Cl + H 2 CO 3 = ½ (p. Ka 1 + p. C) = ½ (6. 37 + mis. 2) = 4. 185

3) Tinjauan TAT / TE : - ind pp (8 – 10), sesuai reaksi tahap II, TE : 8. 31 - ind jm (3. 1 – 4. 4), sesuai reaksi tahap III, TE = 4. 185 4). Perhitungan : - Tahap II : HCl untuk : Na. OH Na. Cl = X ml Na 2 CO 3 Na. HCO 3 = (23. 20 – X) ml - Tahap III : HCl untuk : Na. OH Na. Cl = X ml Na 2 CO 3 H 2 CO 3 = (24. 60 – X) ml - Persamaan : Na. HCO 3 H 2 CO 3 = (24. 60 – 23. 20) = 1. 40 ml - Kadar Na 2 CO 3 = Na. HCO 3, 1 mgrl = 1 mgrek = 1. 40 x 0. 1023 mgre = 1. 40 x 0. 1023 x 106 x 250 ml/25 ml = 151. 81 mg Kadar Na. OH = (23. 20 – 1. 40) x 0. 1023 x 40 x 250 ml/25 ml = 892. 06 mg atau (24. 60 – 2 x 1. 40) x 0. 1023 x 40 x 250 ml/25 ml = 892. 06 mg

Contoh : IV : suatu sampel mengandung KOH (MR 56. 1) dan K 2 CO 3 (MR 138. 2), + 50 ml air + ind pp (8 – 10) perlu HCl 0. 0950 N : 22. 40 ml untuk 1). Reaksi : jm (3. 1 – 4. 4) perlu HCl 0. 0950 N : 25. 80 ml untuk TAT bila ind nya. KOH KCl (KCl) + HCl K 2 CO 3 (K 2 CO 3) KHCO 3 H 2 CO 3 2). p. H ekiv-I : KCl + K 2 CO 3 = 14 – ½(p. Kb CO 3= + p. C) = 14 – ½ {(14 – 10. 25) + mis. 2)} = 11. 125 p. H ekiv-II : KCl + KHCO 3 = ½ (p. Ka 1 +p. Ka 2) = ½ (6. 37 + 10. 25) = 8. 31 p. H ekiv-III : KCl + H 2 CO 3 = ½ (p. Ka 1 + p. C) = ½ (6. 37 + mis. 2) = 4. 185

3) Tinjauan TAT / TE : - ind pp (8 – 10), sesuai reaksi tahap II, TE : 8. 31 - ind jm (3. 1 – 4. 4), sesuai reaksi tahap III, TE = 4. 185 4). Perhitungan : - Tahap II : HCl untuk : KOH KCl = Y ml K 2 CO 3 KHCO 3 = (22. 40 – Y) ml - Tahap III : HCl untuk : KOH KCl = Y ml K 2 CO 3 H 2 CO 3 = (25. 80 – Y) ml - Persamaan : KHCO 3 H 2 CO 3 = (25. 80 – 22. 40) = 3. 40 ml Kadar K 2 CO 3 (= KHCO 3, 1 mgrl = 1 mgrek) = 3. 40 x 0. 0950 mgrek - = 3. 40 x 0. 0950 x 138. 2 = 44. 64 mg - Kadar KOH = (22. 40 – 3. 40) x 0. 0950 x 56. 1 = 101. 26 mg Atau : (25. 80 – 2 x 3. 40) x 0. 0950 x 56. 1 = 101. 26 mg

Contoh : V : sampel Na. OH tehnis mengandung CO 2 dalam bentuk Na 2 CO 3. MR dari Na. OH = 40 dan Na 2 CO 3 = 106 sedang Untuk penetapan prosedur H 2 CO 3 dengan kadar p. Ka 1 masing-masingnya = 6. 37 dan p. Ka 2 =digunakan 10. 25 • a. 254. 6 mg sampel + 50 ml air + ind campur (biru timol & merah kresol) dengan perubahan warna pada p. H 8. 3, kemudian dititrasi dengan larutan baku HCl 0. 1028 N yang ternyata memerlukan 33. 83 ml untuk mencapai TAT- nya. b. 260. 2 mg sampel + 50 ml air + ind hijau brom kresol (p. H 3. 6 – 5. 2) dititrasi dengan larutan baku HCl 0. 1208 N yang ternyata memerlukan 35. 64 ml untuk mencapai TAT- nya. ANALISIS PERMASALAHAN : 1. Reaksi : suatu campuran basa (Na. OH : basa kuat dan Na 2 CO 3 : basa lemah polivalen reaksi dengan asam akan berlangsung secara bertahap, mulai dari basa kuatnya lebih dahulu

Na. OH Na 2 CO 3 Na. Cl + HCl (Na 2 CO 3) (Na. Cl) + HCl Na. HCO 3 (Na. Cl) + HCl H 2 CO 3 2. Perhitungan p. H titik ekivalen tahapan : - p. H ekiv-I : Na. Cl & Na 2 CO 3 p. H = p. H dari Na 2 CO 3 p. H = 14 – ½ (14 – p. Ka 2 + p. C) , misalkan p. C = 1. 5 = 14 – ½ (14 – 10. 25 + 1. 5) = 11. 625 - p. H ekiv-II : Na. Cl & Na. HCO 3 p. H dari Na. HCO 3 (protolit antara) : p. H = ½ (p. Ka 1 + p. Ka 2) = ½ (6. 37 + 10. 25) = 8. 31 - p. H ekiv-III : Na. Cl & H 2 CO 3 p. H dari H 2 CO 3 (as lemah polivalen p. H = ½ (p. Ka 1 + p. C) = ½ (6. 37 + 1. 5) = 3. 935 (misalkan p. C H 2 CO 3 = 1. 5)

3. Penet. TAT / TE sesuai tahapan reaksi yang mana : - prosedur apan a : p. H TAT = 8. 3 reaksi tahap : II - prosedur b : p. H TAT = 3. 6 reaksi tahap III 4. Penggunaan pentiter / berekasi dengan sampel seperti reaksi mana : - Prosedur a : HCl : bereaksi dengan Na. OH Na. Cl Na 2 CO 3 Na. HCO 3 - Prosedur b : HCl : bereaksi dengan Na. OH Na. Cl Na 2 CO 3 Na. HCO 3 H 2 CO 3 5. Penyetaraan berat timbangan sampel : untuk memudahkan perhitungan berat sampel pada prosedur a) & prosedur b) harus dibuat sama, dengan konsekuensi perubahan ml pentiter. Misal : berat sampel = 254. 6 mg (prosedur a) berat sampel b = 254. 6 mg HCl (untuk prosedur b) = (254. 6 / 260. 2) x 35. 64 ml = 34. 87 ml

6. Perhitungan : • prosedur a : HCl untuk Na. OH Na. Cl = X ml Na 2 CO 3 Na. HCO 3 = (33. 83 – X) ml • prosedur b : HCl untuk Na. OH Na. Cl = X ml Na 2 CO 3 Na. HCO 3 H 2 CO 3 = (34. 87 – X) • Persamaan : HCl untuk Na 2 CO 3 Na. HCO 3 = ½ (Na 2 CO 3 H 2 CO 3) Atau : (33. 83 – X) =1/2 ( 34. 87 – X) 67. 66 – 2 X = 34. 87 – X X = 67. 66 – 34. 87 = 32. 79 ml Kadar Na. OH = (32. 79 x 0. 1028 x 40) /(254. 6) x 100% = 52. 96 % Kadar Na 2 CO 3 = {(33. 83 – 32. 79) x 106} / (254. 6) x 100% = 4. 45 %

5 a. Penyetaraan berat sampel sesuai prosedur b) : 260. 2 mg HCl pada prosedur a) = (260. 2 / 254. 6) x 33. 83 ml = 34. 57 ml 6 a. Perhitungan : - Prosedur a : HCl untuk Na. OH Na. Cl = X ml Na 2 CO 3 Na. HCO 3 = (34. 57 – X) ml - Prosedur b : HCl untuk Na. OH Na. Cl = X ml Na 2 CO 3 Na. HCO 3 H 2 CO 3 = (35. 64 – X) ml - Persamaan : HCl untuk Na 2 CO 3 Na. HCO 3 = ½ ( Na 2 CO 3 Na. HCO 3 H 2 CO 3 ) (34. 57 – X) = ½ (35. 64 – X) X = 33. 50 ml - Kadar Na. OH = (33. 50 x 0. 1028 x 40) / (260. 2) x 100% = 52. 94 % - Kadar Na 2 CO 3 ={(34. 57 – 33. 50)x 0. 1028 x 106}/(260. 2)x 100% = 4. 48 %

Contoh : VI : Suatu sampel campuran Na. H 2 PO 4 (MR 126. 0) dan Na 2 HPO 4 (MR 142. 0) ditentukan kadar masing-masingnya dengan berikut ini + 50 ml air + 2 -3 tetes ind mm (4. 4 – 6. 2) + a. prosedur 370. 8 mg sampel dititrasi dengan larutan baku HCl 0. 1025 N , ternyata untuk mencapai TAT nya memerlukan : 12. 34 ml b. 385. 6 mg sampel + 50 ml air + 2 -3 tetes ind tp (9. 3 – 10. 5) + dititrasi dengan larutan baku Na. OH 0. 0975 N , ternyata untuk mencapai TAT nya memerlukan : 13. 86 ml H 3 PO 4 dengan p. Ka 1 = 2. 12 , p. Ka 2 = 7. 21 dan p. Ka 3 = 12. 67 PEMECAHAN PERMASALAHAN : 1. Reaksi : a. Na. H 2 PO 4 (Na. H 2 PO 4) H 3 PO 4 + HCl Na 2 HPO 4 Na. H 2 PO 4 H 3 PO 4

b. Na. H 2 PO 4 Na 2 HPO 4 + Na. OH Na 2 HPO 4 Na 3 PO 4 + Na. OH (Na 2 HPO 4) Na 3 PO 4 2. Perhitungan p. H ekivalen masing-masing tahap : p. H ekiv-I : p. H Na. H 2 PO 4 = ½ (p. Ka 1 + p. Ka 2) = ½ (2. 12 + 7. 21) = 4. 665 p. H ekiv-II : p. H H 3 PO 4 = ½ (p. Ka 1 + p. C) = ½ (2. 12 + 2. 0) = 2. 06 misalkan konsentrasi H 3 PO 4 = 0. 01 M atau p. C = 2 p. H ekiv-I : p. H Na 2 HPO 4 = ½ (p. Ka 2 + p. Ka 3) = ½ (7. 21 + 12. 67) = 9. 94 p. H ekiv-II : p. H Na 3 PO 4 = 14 – ½ (p. Kb PO 43 - + p. C) , mis. p. C = 2 = 14 – ½(14 – 12. 67 + 2) = 12. 335

. Penetapan tahapan reaksi vs p. H ekivalen : a. Ind 4. 4 – 6. 2 : sesuai reaksi tahap I (p. H ekiv = 4. 665) b. Ind (9. 3 – 10. 5) sesuai reaksi tahap I (p. H ekiv = 9. 94) 4. Perhitungan kadar : a. Reaksi tahap I : HCl bereaksi dengan Na 2 HPO 4 Na. H 2 PO 4 1 mgrl Na 2 HPO 4 = 1 mgrek Kadar Na 2 HPO 4 = (12. 34 x 0. 1025 x 142. 0) / (370. 8) x 100 % = 48. 44 % b. Reaksi tahap I : Na. OH bereaksi dengan Na. H 2 PO 4 Na 2 HPO 4 1 mgrl Na. H 2 PO 4 = 1 mgrek Kadar Na. H 2 PO 4 = (13. 86 x 0. 0975 x 120. 0) / (385. 6) x 100 % = 42. 05 %

Contoh : VII: suatu sampel campuran HAc (p. Ka 4. 74 & MR 60. 0) dan HCl (MR 36. 5) ditetapkan kadar masing-masingnya dengan prosedur berikut iniml : larutan sampel + 25 ml air + ind (2. 9 – 4. 0) + dititrasi a. 10. 0 dengan larutan baku Na. OH 0. 1012 N, ternyata untuk mencapai TAT nya memerlukan 3. 45 ml b. 10. 0 ml larutan sampel + 25 ml air + ind 8. 0 – 10. 0) + dititrasi dengan larutan baku Na. OH 0. 1012 N, ternyata untuk mencapai TAT nya memerlukan 12. 36 ml PEMECAHAN PERMASALAHAN : 1. Reaksi : HCl Na. Cl + Na. OH HAc (Na. Cl) + Na. OH (HAc) Na. Ac

2. Penetapan Perhitungan p. H ekivalen 3. tahapan reaksi: : ekiv-I = p. H ½(p. Ka p. C) = ½ (4. 74 I + 2) ekiv = 3. 37 -p. HProsedur a) HAc : ind =2. 9 – 4. 0 +: reaksi tahap (p. H = 3. 37) p. H ekiv-II = p. H Na. Ac = 14 – ½ (14 – 4. 74 + 2) = 8. 37; misal p. C = 2 Na. OH bereaksi dengan HCl Na. Cl - Kadar HCl = (3. 45 x 0. 1012) / (10. 0) = 0. 0352 N = 0. 0352 mgrek / liter = 0. 0352 x 36. 5 mg / liter = 1. 2848 mg / liter - Prosedur b) : ind (8. 0 – 10. 0) : reaksi thp II (p. H ekiv = 8. 37 Na. OH (total) bereaksi dengan HCl Na. Cl (3. 45 ml) HAc Na. Ac - Kadar HAc = {(12. 36 – 3. 45) x 0. 1012} / (10. 0) = 0. 0910 N = 0. 0910 x 60. 0 mg / liter = 5. 4600 mg / liter.
 Gasometri adalah
Gasometri adalah Pengertian analisis volumetri
Pengertian analisis volumetri Alat volumetri
Alat volumetri Contoh analisis titrimetri
Contoh analisis titrimetri Larutan signette
Larutan signette Soal titrasi redoks
Soal titrasi redoks Titrimetri
Titrimetri Pendahuluan organisasi
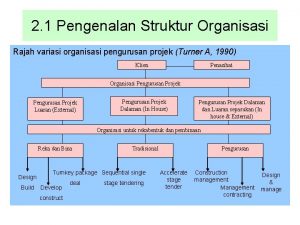
Pendahuluan organisasi Kerangka pendahuluan
Kerangka pendahuluan Contoh kasus aspek sdm dalam studi kelayakan bisnis
Contoh kasus aspek sdm dalam studi kelayakan bisnis Pendahuluan statistik
Pendahuluan statistik Punca salah faham terhadap islam
Punca salah faham terhadap islam Kerangka pendahuluan karya tulis
Kerangka pendahuluan karya tulis Pendahuluan luas
Pendahuluan luas Pendahuluan presentasi
Pendahuluan presentasi Manfaat melancong bersama keluarga
Manfaat melancong bersama keluarga Grafik flow adalah
Grafik flow adalah Tujuan audit pendahuluan
Tujuan audit pendahuluan Logo pendahuluan
Logo pendahuluan Artikel populer
Artikel populer Penanda wacana organisasi
Penanda wacana organisasi Pendahuluan dalam presentasi
Pendahuluan dalam presentasi Untuk mebuat garis arsir digunakan garis....
Untuk mebuat garis arsir digunakan garis.... Pendahuluan modul
Pendahuluan modul Struktur tulisan ilmiah
Struktur tulisan ilmiah Bagian pelengkap penutup adalah
Bagian pelengkap penutup adalah Bentuk mukjizat alquran
Bentuk mukjizat alquran Struktur pendahuluan
Struktur pendahuluan Askep konstipasi pada anak
Askep konstipasi pada anak Contoh huraian karangan
Contoh huraian karangan Perkenalan pendahuluan
Perkenalan pendahuluan Karangan jenis wawancara
Karangan jenis wawancara Studi kelayakan pendahuluan
Studi kelayakan pendahuluan Contoh pendahuluan huraian
Contoh pendahuluan huraian Proses akuntansi secara garis besar
Proses akuntansi secara garis besar Logo pendahuluan
Logo pendahuluan Pendahuluan definisi
Pendahuluan definisi Pendahuluan komunikasi
Pendahuluan komunikasi Studi pendahuluan adalah
Studi pendahuluan adalah Pendahuluan organisasi
Pendahuluan organisasi Format pendapat
Format pendapat