LES AMINES 1 Dfinition Nomenclature 1 1 Dfinition







- Slides: 23

LES AMINES

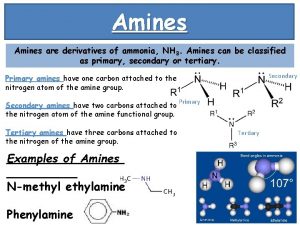
1 - Définition- Nomenclature 1 -1 Définition: Caractérisées par la liaison , elles sont primaires, secondaires ou tertiaires suivant que N est relié à un, deux ou trois atomes de carbone. R-NH 2 (A. I) R-NH-R’ (A. II) RR’R’’N (A. III) 1 -2 Nomenclature Les amines primaires (R-NH 2) sont nommées en ajoutant la terminaison AMINE au nom du groupe R-. L’atome de C directement lié à N porte le n° 1. Ex: Nommez: (A): (B): ( C): Rép:

Remarques a) Les amines primaires (R-NH 2) peuvent également être nommées en ajoutant le suffixe AMINE au nom de la chaîne hydrocarbonée (avec élision de la voyelle « e » ) Hexan-3 -amine (ou 3 -Méthylbutylamine) (ou 1 -Ethylbutylamine) * La nomenclature utilisant l’alkyle R- est préférable. b) Si N est sur un cycle benzénique il s’agit de benzénamines (ou anilines ou amines aromatiques) c) Pour les amines II et III, on se refère au substituant le plus important de N et on nomme les autres comme substituant(s) à la suite de N (N- ou N, N-). On peut les considérer comme des alkylamines (substituants par ordre alphabétique)

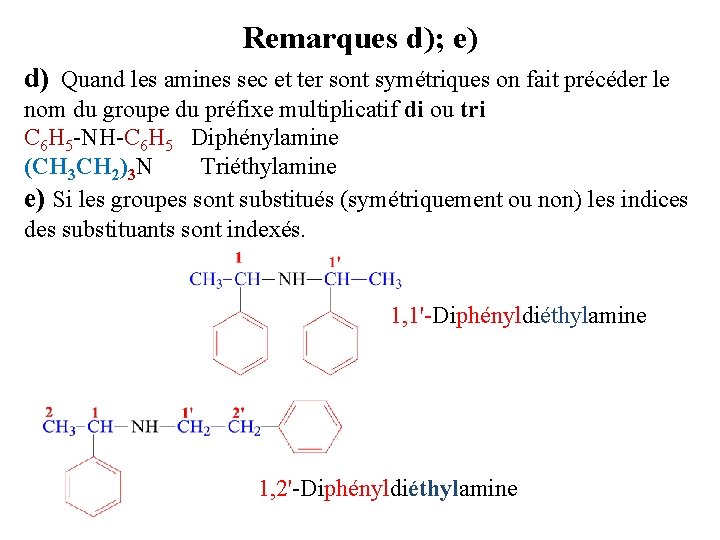
Remarques d); e) d) Quand les amines sec et ter sont symétriques on fait précéder le nom du groupe du préfixe multiplicatif di ou tri C 6 H 5 -NH-C 6 H 5 Diphénylamine (CH 3 CH 2)3 N Triéthylamine e) Si les groupes sont substitués (symétriquement ou non) les indices des substituants sont indexés. 1, 1'-Diphényldiéthylamine 1, 2'-Diphényldiéthylamine

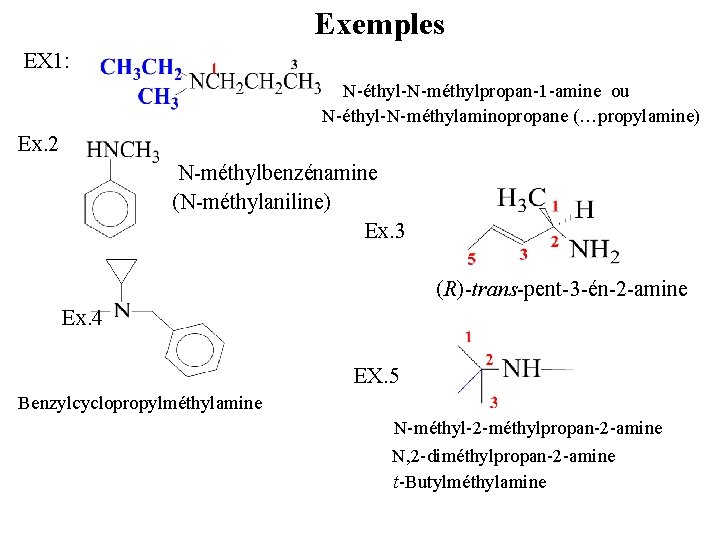
Exemples EX 1: N-éthyl-N-méthylpropan-1 -amine ou N-éthyl-N-méthylaminopropane (…propylamine) Ex. 2 N-méthylbenzénamine (N-méthylaniline) Ex. 3 (R)-trans-pent-3 -én-2 -amine Ex. 4 EX. 5 Benzylcyclopropylméthylamine N-méthyl-2 -méthylpropan-2 -amine N, 2 -diméthylpropan-2 -amine t-Butylméthylamine

Remarques: f); g) f) Le préfixe amino est utilisé en présence d’une fonction prioritaire (alcool, cétone, aldéhyde, acide et dérivés). Il en découle les noms en aminoalcanes. g) Si deux ou trois groupes R- identiques comportant des fonctions prioritaires sur la fonction amine, sont liés à un atome d’azote les groupes –NH- et correspondants sont désignés respectivement par les préfixes IMINO et NITRILO

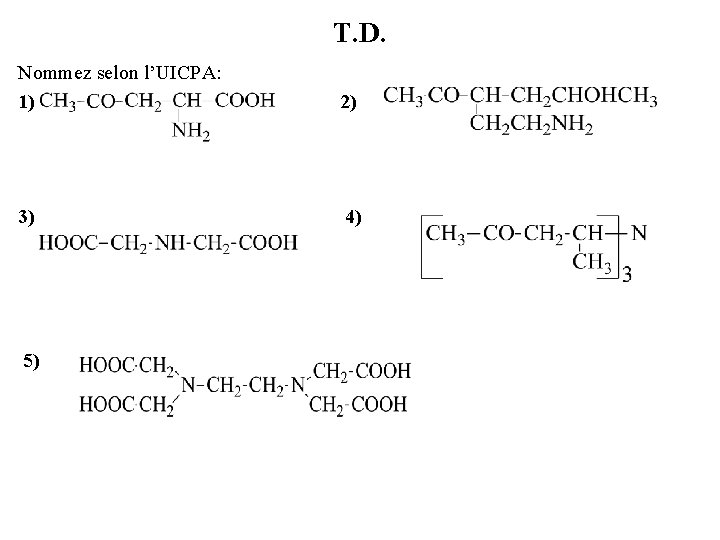
T. D. Nommez selon l’UICPA: 1) 2) 3) 4) 5)

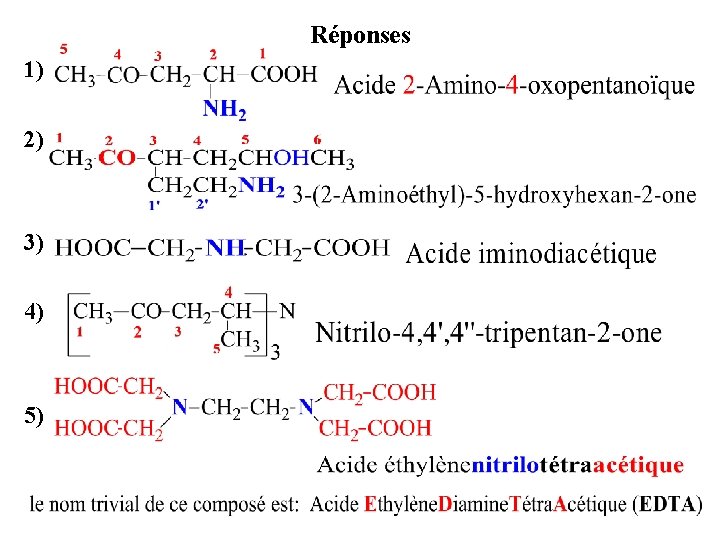
Réponses 1) 2) 3) 4) 5)

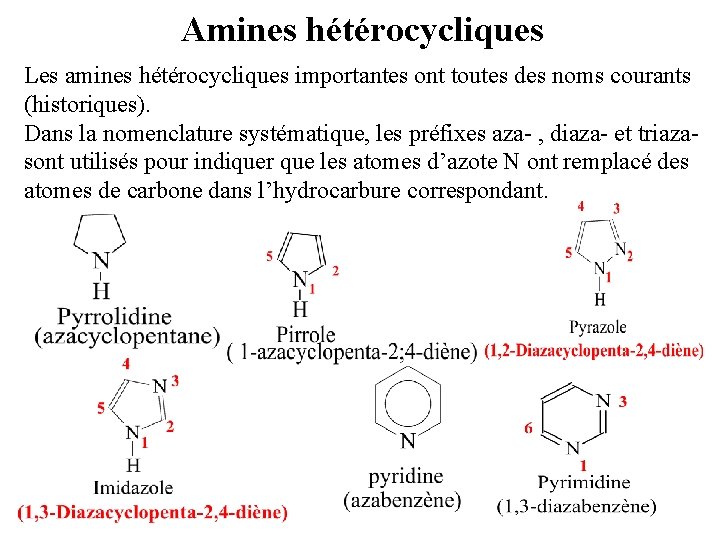
Amines hétérocycliques Les amines hétérocycliques importantes ont toutes des noms courants (historiques). Dans la nomenclature systématique, les préfixes aza- , diaza- et triazasont utilisés pour indiquer que les atomes d’azote N ont remplacé des atomes de carbone dans l’hydrocarbure correspondant.

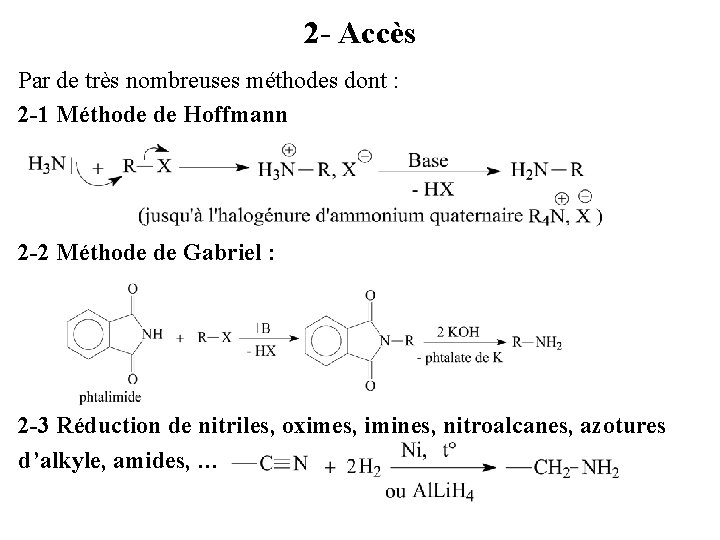
2 - Accès Par de très nombreuses méthodes dont : 2 -1 Méthode de Hoffmann 2 -2 Méthode de Gabriel : 2 -3 Réduction de nitriles, oximes, imines, nitroalcanes, azotures d’alkyle, amides, …

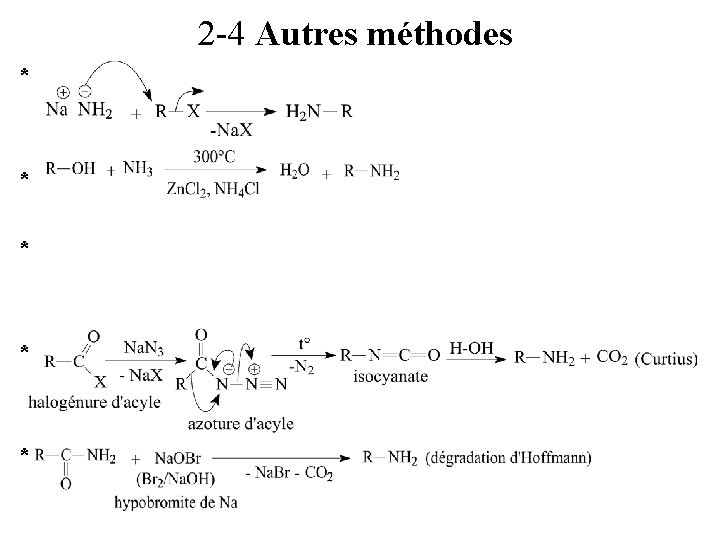
2 -4 Autres méthodes * * *

3 - Caractéristiques physiques De moins en moins solubles dans l’eau quand R de R-NH 2 augmente. Elles ont des Téb inférieures à celles des alcools homologues (liaisons H moins fortes).

Réactivités Elles sont basiques et nucléophiles (doublet libre sur l’azote) d’une part et acides (NH des amines I et II moins acides que OH des alcools). Les alkylamines sont plus basiques (III > I) que les benzénamines dont le doublet participe à la résonnance d’autant plus que le noyau porte des substituants électrons-attracteurs (différents d’électronsdonneurs). La basicité des amines peut être évaluée par l’acidité de leurs acides conjugués (p. Ka 10) ; p. Ka. H-OH = 15, 7 et p. Ka. RO-H = 16 -18. Plus l’amine est basique plus son acide conjugué est faible (plus son p. Ka est grand).

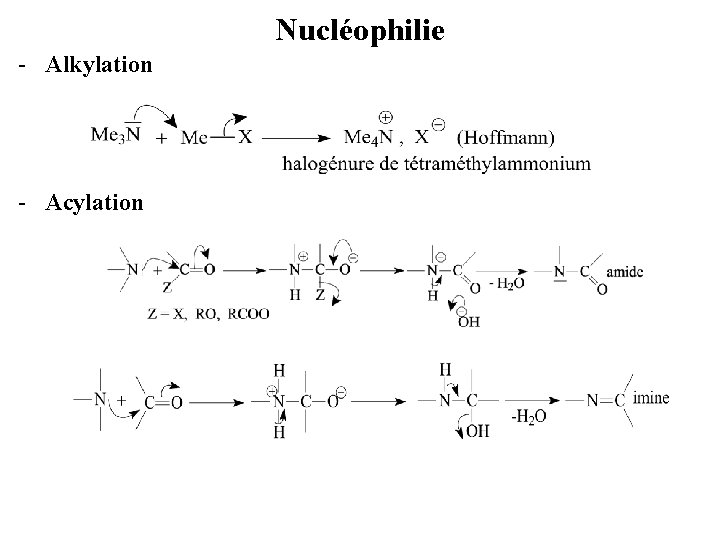
Nucléophilie - Alkylation - Acylation

Nitrosation par le cation nitrosyle Action de HNO 2 : - Amines primaires - Amines secondaires - Amines tertiaires sur les:

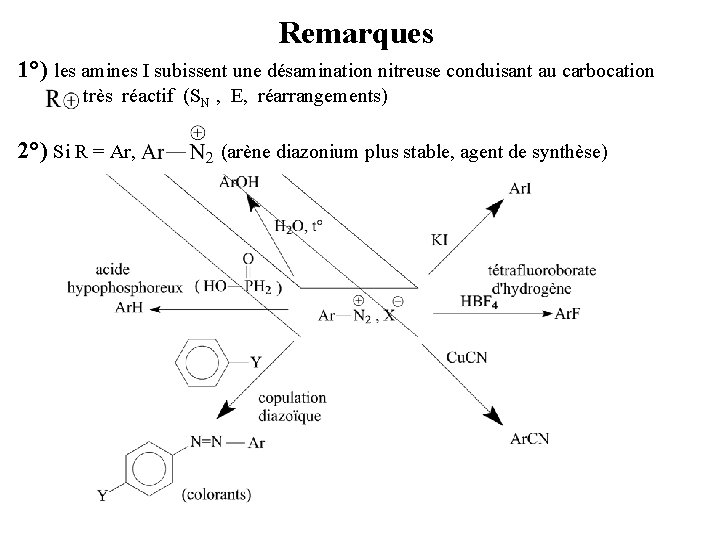
Remarques 1°) les amines I subissent une désamination nitreuse conduisant au carbocation très réactif (SN , E, réarrangements) 2°) Si R = Ar, (arène diazonium plus stable, agent de synthèse)

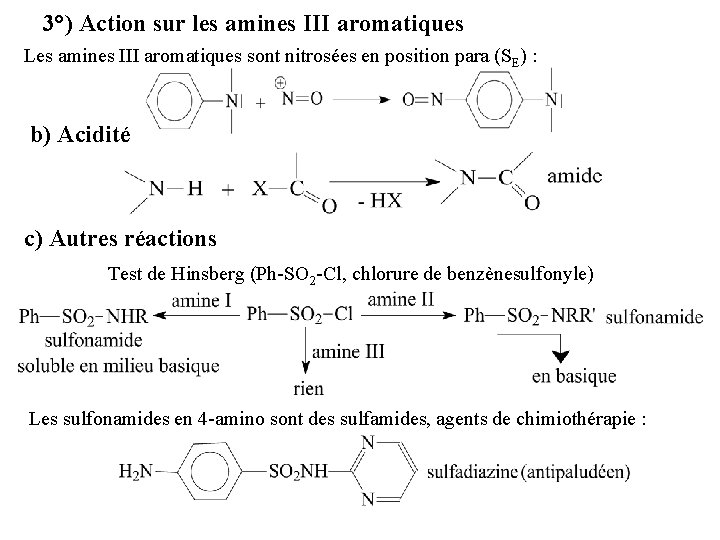
3°) Action sur les amines III aromatiques Les amines III aromatiques sont nitrosées en position para (SE) : b) Acidité c) Autres réactions Test de Hinsberg (Ph-SO 2 -Cl, chlorure de benzènesulfonyle) Les sulfonamides en 4 -amino sont des sulfamides, agents de chimiothérapie :

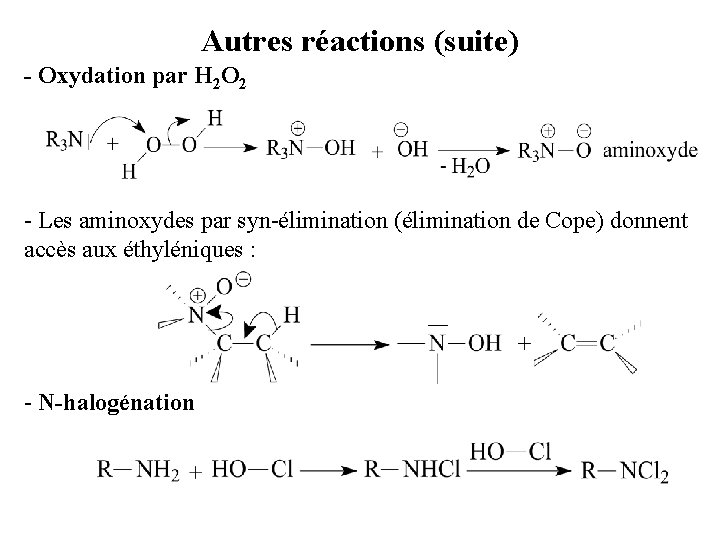
Autres réactions (suite) - Oxydation par H 2 O 2 - Les aminoxydes par syn-élimination (élimination de Cope) donnent accès aux éthyléniques : - N-halogénation

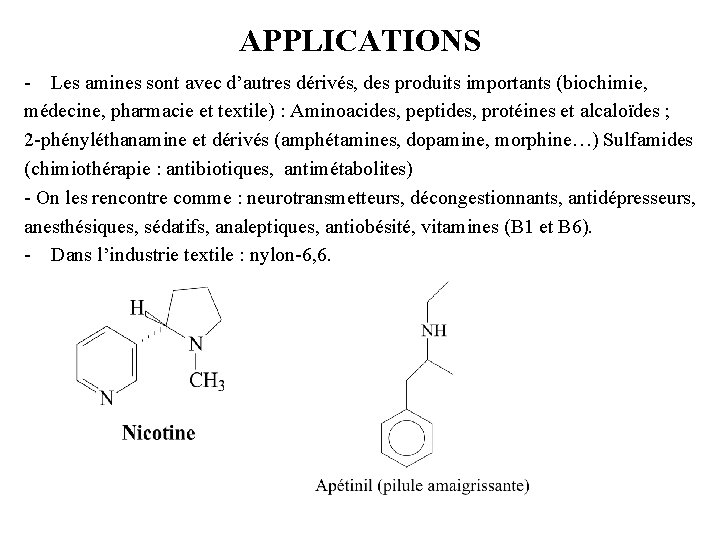
APPLICATIONS - Les amines sont avec d’autres dérivés, des produits importants (biochimie, médecine, pharmacie et textile) : Aminoacides, peptides, protéines et alcaloïdes ; 2 -phényléthanamine et dérivés (amphétamines, dopamine, morphine…) Sulfamides (chimiothérapie : antibiotiques, antimétabolites) - On les rencontre comme : neurotransmetteurs, décongestionnants, antidépresseurs, anesthésiques, sédatifs, analeptiques, antiobésité, vitamines (B 1 et B 6). - Dans l’industrie textile : nylon-6, 6.

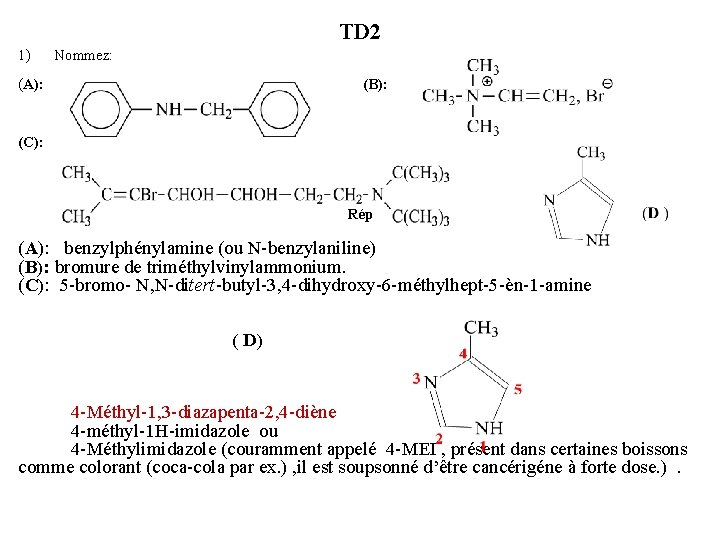
TD 2 1) Nommez: (A): (B): (C): Rép (A): benzylphénylamine (ou N-benzylaniline) (B): bromure de triméthylvinylammonium. (C): 5 -bromo- N, N-ditert-butyl-3, 4 -dihydroxy-6 -méthylhept-5 -èn-1 -amine ( D) 4 -Méthyl-1, 3 -diazapenta-2, 4 -diène 4 -méthyl-1 H-imidazole ou 4 -Méthylimidazole (couramment appelé 4 -MEI , présent dans certaines boissons comme colorant (coca-cola par ex. ) , il est soupsonné d’être cancérigéne à forte dose. ).

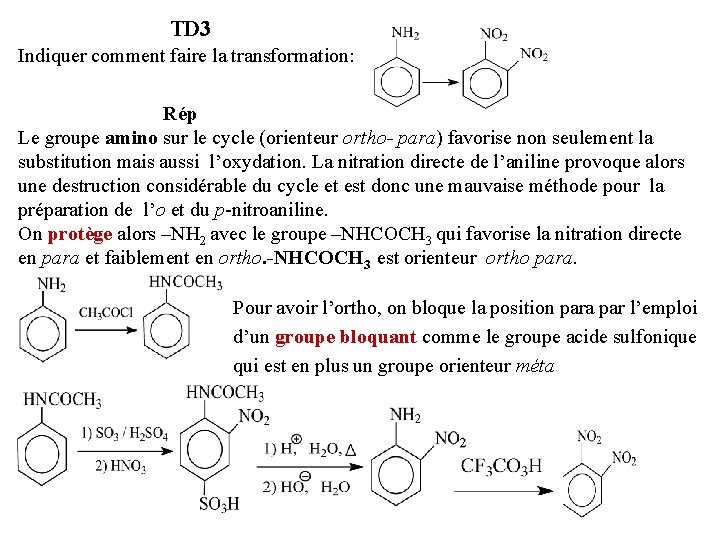
TD 3 Indiquer comment faire la transformation: Rép Le groupe amino sur le cycle (orienteur ortho- para) favorise non seulement la substitution mais aussi l’oxydation. La nitration directe de l’aniline provoque alors une destruction considérable du cycle et est donc une mauvaise méthode pour la préparation de l’o et du p-nitroaniline. On protège alors –NH 2 avec le groupe –NHCOCH 3 qui favorise la nitration directe en para et faiblement en ortho. -NHCOCH 3 est orienteur ortho para. Pour avoir l’ortho, on bloque la position para par l’emploi d’un groupe bloquant comme le groupe acide sulfonique qui est en plus un groupe orienteur méta

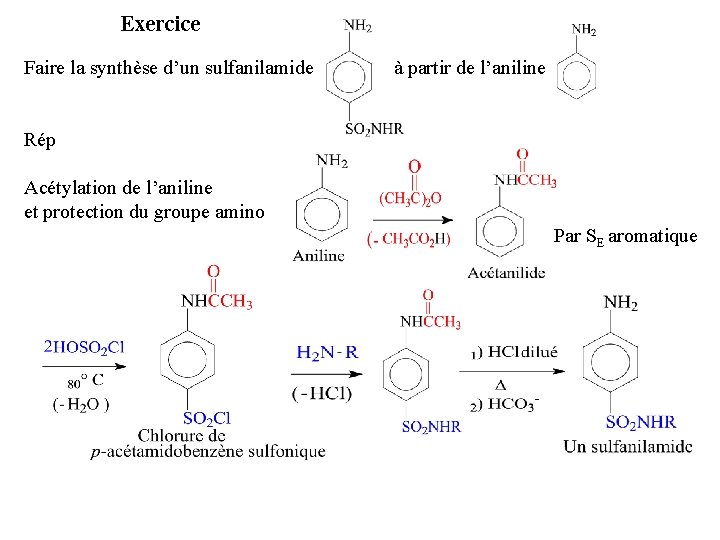
Exercice Faire la synthèse d’un sulfanilamide à partir de l’aniline Rép Acétylation de l’aniline et protection du groupe amino Par SE aromatique

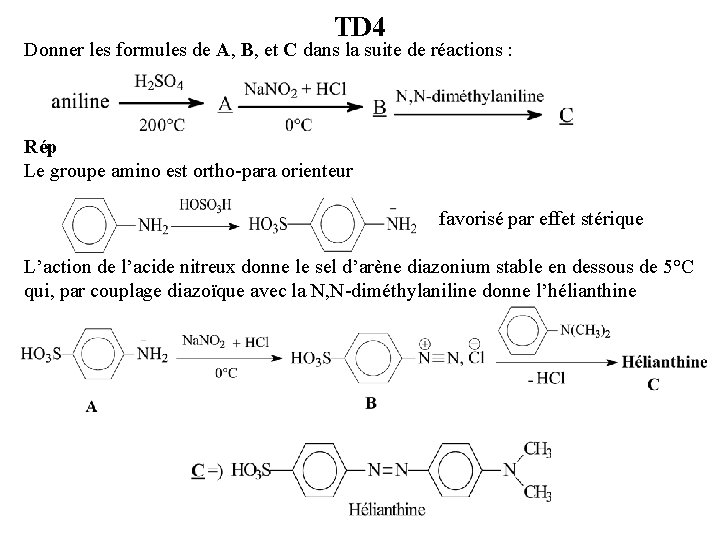
TD 4 Donner les formules de A, B, et C dans la suite de réactions : Rép Le groupe amino est ortho-para orienteur favorisé par effet stérique L’action de l’acide nitreux donne le sel d’arène diazonium stable en dessous de 5°C qui, par couplage diazoïque avec la N, N-diméthylaniline donne l’hélianthine
 Amines chemsheets
Amines chemsheets Basicity of amines
Basicity of amines Classification of amines
Classification of amines Nomenclature amines
Nomenclature amines Dfinition
Dfinition Définition de la lecture méthodique
Définition de la lecture méthodique Dfinition
Dfinition Dfinition
Dfinition Dfinition
Dfinition Dfinition
Dfinition Basicity amines
Basicity amines Amines hydrogen bonding
Amines hydrogen bonding Physical properties of amines
Physical properties of amines Adrenergic drugs
Adrenergic drugs Amine polarity
Amine polarity Do aromatic amines give hinsberg test
Do aromatic amines give hinsberg test Reaction between carboxylic acid and amine
Reaction between carboxylic acid and amine Dissociation des acides aminés
Dissociation des acides aminés Amines hydrogen bonding
Amines hydrogen bonding Aniline reacts with bromine water at room temperature
Aniline reacts with bromine water at room temperature Dissociation des acides aminés
Dissociation des acides aminés Drogue vasoactive exemple
Drogue vasoactive exemple Solubility of amines
Solubility of amines Geometry of amines
Geometry of amines