La nuova legislazione dei mangimi medicati Stato dellarte





























- Slides: 31

La nuova legislazione dei mangimi medicati: Stato dell’arte Dr. ssa Laura Contu Ufficio 7 Seminario Assalzoo RICETTA ELETTRONICA: FOCUS SUI MANGIMI MEDICATI Bologna, 11 maggio 2018

Revisione della Direttiva 90/167/CEE • Normativa del 1990; • Necessità di rispecchiare il progresso tecnico nel settore; • Aree grigie, non adeguatamente affrontate dalla Direttiva; • Garantire un elevato livello di sicurezza nella fabbricazione, produzione ed utilizzo dei MM/PI; • Diverse interpretazioni da parte degli SS. MM. ; • Disomogeneità nell’applicazione; • Ostacolo al libero mercato;

Revisione della Direttiva 90/167/CEE I mangimi medicati rappresentano una valida via di somministrazione del farmaco per via orale agli animali: • Praticità d’uso; • Sicurezza per gli operatori e riduzione del personale a contatto con farmaci; • Assenza di stress e traumi per gli animali; • Dosaggio più preciso di altre metodiche (top dressing); • Migliore omogeneità e stabilità del PA.

PROCESSO DI REVISIONE A partire dal 2009, la DGSANCO ha attivato un’ampia consultazione degli stakeholders e delle AC: • questionario agli SSMM in merito allo status quo; • indagine via web tra gli stakeholder; • colloqui specifici con gli esperti del settore e con le AC (SCo. PAFF e CVO meeting); • la DGSANCO ha incaricato il Food Chain Evaluation Consortium (FCEC) di valutare la situazione relativa alla produzione e uso dei mangimi medicati nell’EU: Evaluation of the EU Legislative Framework in the Field of Medicated Feed Final report

OBIETTIVI STRATEGICI GENERALI • garanzia di un elevato livello di protezione della salute pubblica e degli animali. • buon funzionamento di un mercato interno competitivo e innovativo per i mangimi medicati, OBIETTIVI SPECIFICI • Bando dell’uso preventivo dei MM con AM per animali da reddito; • superamento dell'approccio di "tolleranza zero" nei confronti del carry-over inevitabile; • messa a disposizione degli allevatori e dei proprietari di pet di mangimi medicati ad un prezzo competitivo; • diminuzione del rischio di AMR derivante dalla somministrazione di residui e di livelli subterapeutici di antimicrobici agli animali; • miglioramento della salute degli animali mediante il dosaggio preciso dei farmaci per uso orale; • eliminazione degli ostacoli ai mangimi medicati innovativi.

STATO DEI LAVORI • 10/09/2014: la CE presenta la bozza al Consiglio EU sotto Presidenza Italiana • 10 WP al Consiglio dell’EU fino al 26 gennaio 2016 • Stop fino a Settembre 2017, 2 WP sotto Presidenza Estone • Da Novembre 2017 Attachès meeting Emendamenti del Parlamento EU (93 AM) 1 COREPER 20 Dicembre 2017 Riunioni trilogo (EC-EP-Cons dell’EU) e riunioni di debriefing attachès (ultima 3 maggio 2018).

STRUTTURA DEL REGOLAMENTO ALLEGATO I Requisiti specifici applicabili agli operatori del settore dei mangimi di cui all'articolo 3 (8 sezioni) Capo I Campo di applicazione, scopo e definizioni (artt. 0 -2) ALLEGATO II A Capo II Fabbricazione, stoccaggio, trasporto e immissione sul mercato (artt. 3 -11) ALLEGATO III Capo III Riconoscimento di stabilimenti (artt. 12 -14) Capo IV Prescrizione e utilizzo (artt. 15 -17) Capo V Disposizioni procedurali e finali (artt. 18 -23) Lista di sostanze attive antimicrobiche di cui all’art. 7 (2 a 0) Indicazioni specifiche di etichettatura di cui all'articolo 9 (1 ) ALLEGATO IV Tolleranze ammesse per l'etichettatura riguardante la composizione dei mangimi medicati o dei prodotti intermedi di cui all'articolo 9 (3) ALLEGATO V Informazioni da includere nella prescrizione veterinaria per mangimi medicati di cui all'articolo 15 (2) ALLEGATO VI Tavola di concordanza di cui all'articolo 22

Campo di applicazione: MM e PI A COSA? a) Produzione, stoccaggio e trasporto di MM/PI b) Immissione sul mercato, incluso import, ed uso di MM e PI c) Export, tranne gli artt. 9, 15, 16 and 17 IN AGGIUNTA ALLA NORMATIVA MANGIMISTICA • Non si applica ai farmaci veterinari finchè non sono inseriti in un MM o PI. • La regolamentazione della distribuzione e della fornitura dei PI viene delegata all’adozione di norme nazionali (art. 105 a(2) reg. VMP e (art. 110 (6) reg. VMP).

Campo di applicazione Non si applica a forme di somministrazione orale di farmaci veterinari, diverse dai MM e PI…. Cons. 5: Other alternative routes for oral administration, such as mixing of water for drinking with a veterinary medicinal product or as manual mixing of a veterinary medicinal product into feed are not part of the scope of this Regulation (VMP) applies to veterinary medicinal products for the time up until these products are included in medicated feed or intermediate products, [including for the purpose of what in Directive 90/167/EEC was referred to as 'pre-mixes'], after which this Regulation applies to the exclusion of Regulation (VMP).

Top dressing, sprayzzazione ed acqua di abbeverata

Posizione Italiana L’IT appoggia il PE (AM 19) in linea con altri SS. MM. AM 19: art. 1 a): “This Regulation shall not apply to finished veterinary medicinal products to be orally administered that have been approved for use via feed as oral powders (via 'top dressing') or in drinking water. The Commission shall, by. . . [12 months after the date of entry into force of this Regulation], propose a specific legislative proposal on the administration of veterinary medicinal products for use via feed or in drinking water. ” IT: It would be advisable for the Commission to undertake the commitment to standardize the conditions of orally administered veterinary medicinal products used via feed as oral powders (via 'top dressing') or in drinking water used for mass treatment, to avoid that the farmers could use them through a preferential route instead of medicated feed, not having to submit to no rules or additional authorization.

Import e EU trade art. 11 L’OSM che introduce da un altro SM o importa un MM/PI, si deve assicurare che nello SM di destinazione sia permesso l’uso, ai sensi del regolamento VMP, del farmaco utilizzato per la produzione del mangime (allineamento con il reg VMP). Il PE vorrebbe bloccare anche l’import di animali o alimenti OA dai Paesi in cui vengono somministrati MM contenenti antimicrobici a scopo profilattico. (trilogo aperto)

Prescrizione art. 15 e Annex V • La cessione di MM ai detentori di animali e la produzione per autoconsumo sono soggette alla prescrizione medico veterinaria per mangime medicato. • Il medico veterinario è l’unica figura professionale abilitata a prescrivere MM nel territorio UE. (In primis…. Deroga come reg. VMP). • La prescrizione emessa conformemente all’art. 15 e contenente le informazioni dell’allegato V è riconosciuta valida da tutti gli SSMM. La CE con atti di esecuzione stabilirà il modello della prescrizione, disponibile anche in formato elettronico (LEGGE 20 novembre 2017, n. 167)

La figura professionale abilitata a prescrivere Il PE ha presentato una serie di emendamenti a vari articoli che mirano a permettere a tutte le figure professionali abilitate nei vari SS. MM. , di prescrivere mangimi medicati sul territorio dell’UE. NEGOZIAZIONE Al momento l’unica apertura riguarda solo quelle figure professionali già abilitate sul territorio UE, le cui prescrizioni saranno valide solo sul territorio nazionale ed esclusivamente per prescrivere MM contenenti alcuni antiparassitari o immunologici (no diagnosi preventiva da parte del veterinario) e mai per gli antimicrobici.

Prescrizione art. 15 Validità: • 6 mesi per animali NON produttori di alimenti • 3 settimane per animali produttori di alimenti e da pelliccia • 5 gg se il MM contiene antimicrobici Non ripetibile per animali produttori di alimenti e da pelliccia Durata del trattamento: deve essere in linea con l’SPC del farmaco miscelato nel mangime. Se non è indicata nell’SPC: • Non oltre 1 mese • 2 settimane per i MM contenenti antibiotici

Prescrizione in deroga Indicato chiaramente che i MM e PI che contengono VMP utilizzati “in deroga” artt. 115, 116 or 116 a Reg. VMP, devono essere prodotti con VMP autorizzati per la produzione di MM. (ex-premiscele).

Associazione di più VMP Osteggiata da molti SSMM. Il testo non prevedeva particolari indicazioni, era una responsabilità del veterinario prescrittore. Nelle ultima versione del testo appare (art. 15): “In particular, he shall not prescribe medicated feed with more that one veterinary medicinal product containing antimicrobial veterinary medicinal products” Es. Il veterinario sotto sua responsabilità può associare un antimicrobico ed un antinfiammatorio. 'medicated feed': a feed, which is ready to be directly fed to animals without further processing, consisting of a homogenous mixture of one or more veterinary medicinal products or intermediate products with feed materials or compound feed;

Produzione anticipata art. 8 E’ ammessa la produzione anticipata (in assenza di prescrizione) e l’immissione in commercio (ma non la consegna al detentore di animali) di MM e PI, Non ammessa nel caso di: • Produzione MM per autoconsumo • Miscelatori mobili • Produzione di MM/PI con VMP utilizzati in deroga (artt. 115 e 116 reg. VMP) • Il PE spinge per una notifica all’AC dei MM (tipo e quantità) prodotti, prima della prescrizione (trilogo aperto). E’ ammessa la produzione anticipata di MM/PI per pesci con VMP utilizzati in deroga (art. 116 a reg. VMP)

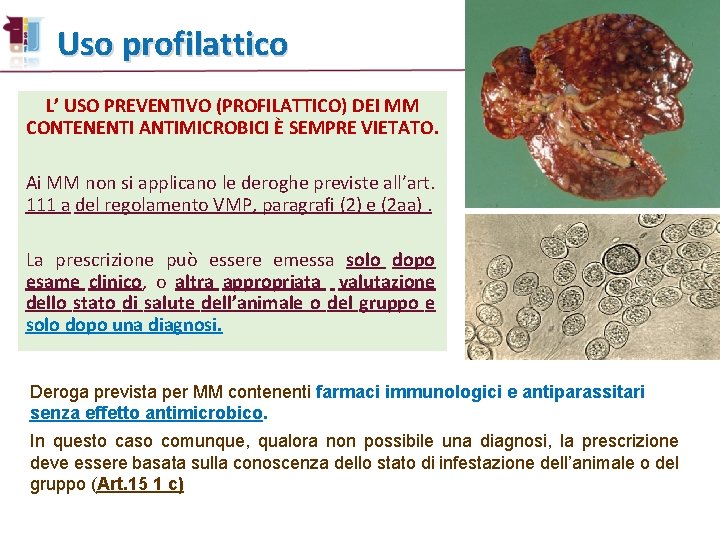
Uso profilattico L’ USO PREVENTIVO (PROFILATTICO) DEI MM CONTENENTI ANTIMICROBICI È SEMPRE VIETATO. Ai MM non si applicano le deroghe previste all’art. 111 a del regolamento VMP, paragrafi (2) e (2 aa). La prescrizione può essere emessa solo dopo esame clinico, o altra appropriata valutazione dello stato di salute dell’animale o del gruppo e solo dopo una diagnosi. Deroga prevista per MM contenenti farmaci immunologici e antiparassitari senza effetto antimicrobico. In questo caso comunque, qualora non possibile una diagnosi, la prescrizione deve essere basata sulla conoscenza dello stato di infestazione dell’animale o del gruppo (Art. 15 1 c)

L’uso profilattico Il PE ha un’approccio più aperto all’uso profilattico. Propone che il reg MM sia più in linea col Reg. VMP, e che sia possibilein alcuni casi utilizzare i MM contenenti antibiotici a scopo profilattico, senza sintomi clinici o diagnosi, ma solo sulla base della conoscenza ed esperienza del veterinario. Anche la metafilassi deve essere permessa per evitare la diffusione di malattie in un gruppo di animali dove è stata confermata la presenza dell’agente infettivo. Il Consiglio non cede sulla profilassi, che resta vietata per i MM contenenti antimicrobici (ammessa solo per immunologici e antiparassitari senza effetto antimicrobico). Concede un’apertura sulla metafilassi: Cons 19: The use of antimicrobials for metaphylaxis should only be allowed when the risk of spread of an infection is high.

Etichettatura art. 9 e Annex III • Etichettatura comune a tutti gli SSMM • Informazioni aggiuntive alle info previste dal reg. (CE) 767/09 per materie prime o mangimi composti Definiti come: MANGIME MEDICATO O PRODOTTO INTERMEDIO PER LA PRODUZIONE DI MANGIMI MEDICATI Medicazione: Sostanze attive + quantità aggiunta (mg/kg), Nome del VMP + numero AIC + titolare AIC;

Tolleranze analitiche Annex IV Tolleranze tra la quantità di sostanza attiva indicata in etichetta e rilevata all’analisi (controllo del titolo) Includono solo le tolleranze tecniche • Antimicrobici: 10% • Altre sostanze attive: Quantità dichiarata Tolleranza > 500 mg ± 10% ≤ 500 mg ± 20%

Pubblicità dei MM e PI (art. 10 a) • Proibita tranne quella destinata esclusivamente ai veterinari. • Non deve essere fuorviante o portare ad un uso scorretto del mangime. • I campioni di MM a scopo promozionale sono ammessi in piccole quantità, ma non nel caso di mangimi contenenti antimicrobici. • Chiaramente etichettati come campioni. Consegnati direttamente ai veterinari durante eventi sponsorizzati o da rappresentanti durante le loro visite Il PE spinge per allinearsi a quanto previsto per I VMP (trilogo aperto)

Riconoscimento (art. 12) Gli OSM che producono, stoccano, trasportano o immettono sul mercato MM o PI devono essere riconosciuti dalla AC. Iscritti in liste nazionali con un numero individuale nel formato dell’allegato V del reg. 183/05: α IT ABCDEFG 8 Deroga per: • Gli allevatori che comprano, stoccano e usano MM per autoconsumo • I traders senza possesso fisico della merce • I trasportatori o i magazzini di MM/PI in confezioni o contenitori SIGILLATI Previsti tempi transitori di adeguamento di 6 mesi dalla data di applicazione per gli OSM già autorizzati (se non notificano, sospensione del riconoscimento).

Modifiche del reg. (CE) 183/05 Distributori al dettaglio di pet food medicati e agli allevatori di animali da pelliccia che usano MM. (esclusi dal campo di applicazione del reg. 183/05) L’AC deve avere procedure per accedere alle informazioni dell’attività, (no registrazione 183/05, no ulteriori adempimenti) Art. 21 a Modifiche al Regolamento 183/2005 L’articolo 5 paragrafi 1 e 2 del reg. 183/05, viene modificato per indicare chiaramente che: Chi produce per autoconsumo mangimi miscelando VMP o PI è un OSM diverso da primario e deve rispettare l’allegato II del regolamento, nonchè l’art 6 e l’obbligo di un HACCP.

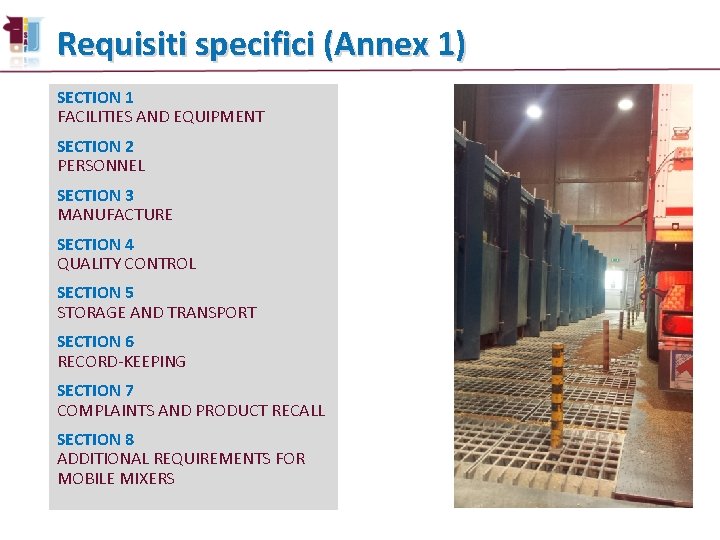
Requisiti specifici (Annex 1) SECTION 1 FACILITIES AND EQUIPMENT SECTION 2 PERSONNEL SECTION 3 MANUFACTURE SECTION 4 QUALITY CONTROL SECTION 5 STORAGE AND TRANSPORT SECTION 6 RECORD-KEEPING SECTION 7 COMPLAINTS AND PRODUCT RECALL SECTION 8 ADDITIONAL REQUIREMENTS FOR MOBILE MIXERS

Contaminazione crociata art. 7 e Annex 2 a Definizione Articolo 2: (EA) ‘CROSS-CONTAMINATION’: contamination of a non target feed with an active substance originating from the previous use of the facilities or equipment; Concetto esteso: I limiti di cc si applicano a tutti i mangimi non target (medicati o no), anche già presenti sul mercato. . . MA QUALI LIMITI? • Limiti provvisori? • Limiti in percentuali? • Approccio ALARA? • Limiti in mg/kg?

ACTIVE SUBSTANCE AMOXICILLIN AMPROLIUM ANNEX II A APRAMYCIN CHLORTETRACYCLINE COLISTIN DOXYCYCLINE FLORFENICOL FLUMEQUINE LINCOMYCIN NEOMYCIN SPECTINOMYCIN SULFONAMIDES Gli SSMM adotteranno limiti provvisori nazionali finchè la CE non stabilirà, tramite atti delegati basati su una valutazione del rischio EFSA, i limiti massimi ammessi di CC. Per le sostanze in Annex II A, la CE è obbligata ad adottarli entro 1 anno dalla data di applicazione del regolamento (3 anni +1), definendo anche i metodi analitici. TETRACYCLINE OXYTETRACYCLINE OXOLINIX ACID Può farlo a partire dalla data di entrata in vigore. PAROMOMYCIN PENICILLIN V TIAMULIN ……. . gentamicina, spiramicina , eritromicina? TIAMFENICOL TILMICOSIN TRIMETHOPRIM TYLOSIN VALNEMULIN TYLVALOSIN PE: Minimize CC= 3 % of the AS in the last batch of medicated feed or of intermediate product produced before the production of the next batch of non target feed…. trilogo

Contaminazione crociata In Italia continueranno ad applicarsi i limiti di 0, 5 ppm (penicilline) e 1 ppm (altre sostanze) Nota MINSAL DGSAF prot. 19392 dell’ 11/05/2015

Farmacovigilanza e raccolta dati uso Art. 3 “Article 54 and Section 6, of Chapter IV of Regulation (VMP) shall apply, mutatis mutandis, to medicated feed and intermediate products” Articolo 54 Reg. VMP: Collection of data on antimicrobial medicinal products used in animals Capitolo IV, Sezione 6 Reg. VMP PHARMACOVIGILANCE

Grazie per l’ attenzione
 Commedia dellarte
Commedia dellarte Normativa turistica
Normativa turistica Appunti legislazione scolastica
Appunti legislazione scolastica Legislazione turistica slide
Legislazione turistica slide Legge dei gas perfetti
Legge dei gas perfetti Nuova piscina trento
Nuova piscina trento Soluzioni chimica capitolo 14
Soluzioni chimica capitolo 14 Istituto comprensivo capoterra 1
Istituto comprensivo capoterra 1 Nuova economia del benessere
Nuova economia del benessere Soluzioni chimica più capitolo 11
Soluzioni chimica più capitolo 11 Scuola stirling vasto
Scuola stirling vasto Maria stella della nuova evangelizzazione
Maria stella della nuova evangelizzazione E vidi un nuovo cielo e una nuova terra
E vidi un nuovo cielo e una nuova terra Ittero medico e chirurgico
Ittero medico e chirurgico La nuova chimica di rippa soluzioni
La nuova chimica di rippa soluzioni Commedia nuova
Commedia nuova Leggere ad alta voce
Leggere ad alta voce Biagio carrubba
Biagio carrubba I 3 stadi dell'amore nella vita nuova
I 3 stadi dell'amore nella vita nuova Nuova infrastruttura cartografica
Nuova infrastruttura cartografica Nuova normativa etichette abbigliamento
Nuova normativa etichette abbigliamento Nuova direzione didattica vasto
Nuova direzione didattica vasto Dermatologo nuova ricerca rimini
Dermatologo nuova ricerca rimini Agnus dei qui tollis peccata mundi
Agnus dei qui tollis peccata mundi Testo della canzone la marcia dei diritti
Testo della canzone la marcia dei diritti Tutti i poligoni regolari
Tutti i poligoni regolari Polizia di stato piacenza
Polizia di stato piacenza Canad
Canad Il terzo stato
Il terzo stato Stato sociale in inglese
Stato sociale in inglese Esame di stato mentale
Esame di stato mentale Stato liberale
Stato liberale