LA CHIMIE PHYSIQUE Chapitre 3 Les lois des














- Slides: 41

LA CHIMIE PHYSIQUE Chapitre 3 Les lois des gaz idéaux et des gaz réels Guy COLLIN, 2014 -12 -28

Préambule n n La définition du gaz idéal présuppose qu’il n’existe aucune interactions entre les molécules sauf les collisions. Qu’arrive-t’il dans les gaz des gaz réels, là où des interactions (interactions de nature électriques, par exemple) sont présentes ? Quels sont les comportements d’un gaz idéal et celui d’un gaz réel ? Quelles sont les lois qui gouvernent ces gaz ? 2014 -12 -29

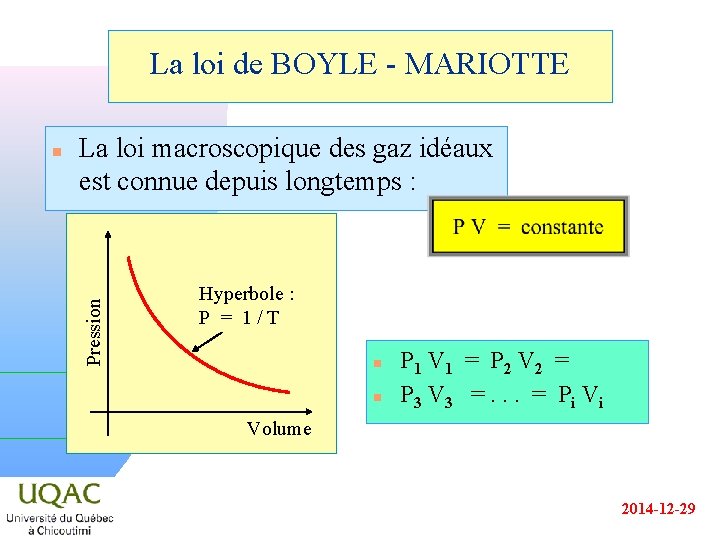
La loi de BOYLE - MARIOTTE La loi macroscopique des gaz idéaux est connue depuis longtemps : Pression n Hyperbole : P = 1/T n n P 1 V 1 = P 2 V 2 = P 3 V 3 =. . . = P i Vi Volume 2014 -12 -29

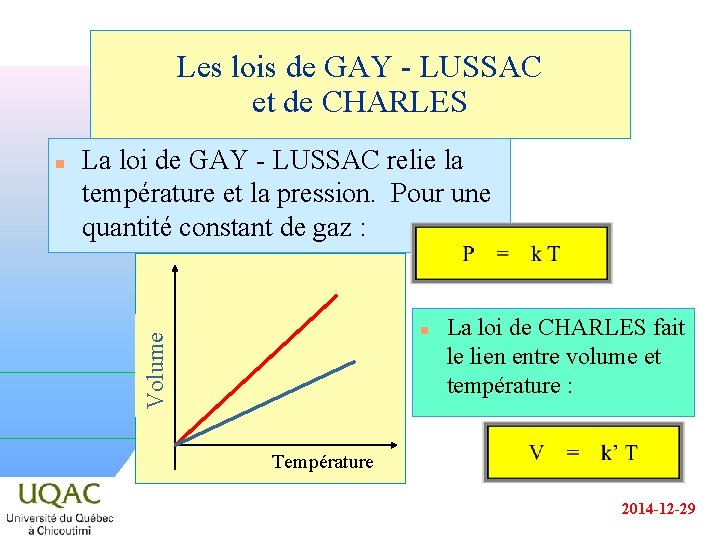
Les lois de GAY - LUSSAC et de CHARLES La loi de GAY - LUSSAC relie la température et la pression. Pour une quantité constant de gaz : n Volume Pression n La loi de CHARLES fait le lien entre volume et température : Température 2014 -12 -29

Loi de GAY - LUSSAC des volumes se combinant n Deux volume égaux de gaz, s’ils sont à la même température et à la même pression, contiennent le même nombre de molécules. n n H 2 + Cl 2 2 HCl 3 H 2 + N 2 2 NH 3 2014 -12 -29

Loi de DALTON et loi d’AMAGAT n Dans un mélange de gaz, la pression totale et la somme des pressions partielles des gaz constitutifs : n n Ptotale = P 1 + P 2 + P 3 + P 4. . . Dans un mélange de gaz, le volume total est la somme des volumes partiels des gaz constitutifs exerçant sous la même pression partielle : n Vtotale = V 1 + V 2 + V 3 + V 4. . . 2014 -12 -29

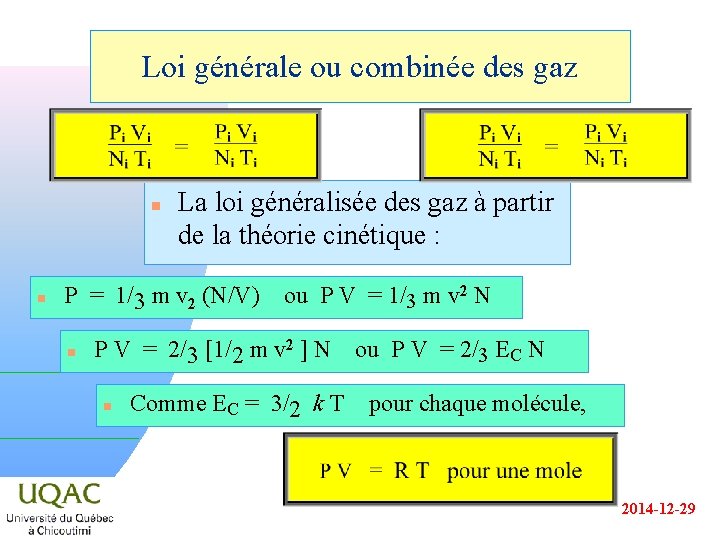
Loi générale ou combinée des gaz n n La loi généralisée des gaz à partir de la théorie cinétique : P = 1/3 m v 2 (N/V) ou P V = 1/3 m v 2 N n P V = 2/3 [1/2 m v 2 ] N n Comme EC = 3/2 k T ou P V = 2/3 EC N pour chaque molécule, 2014 -12 -29

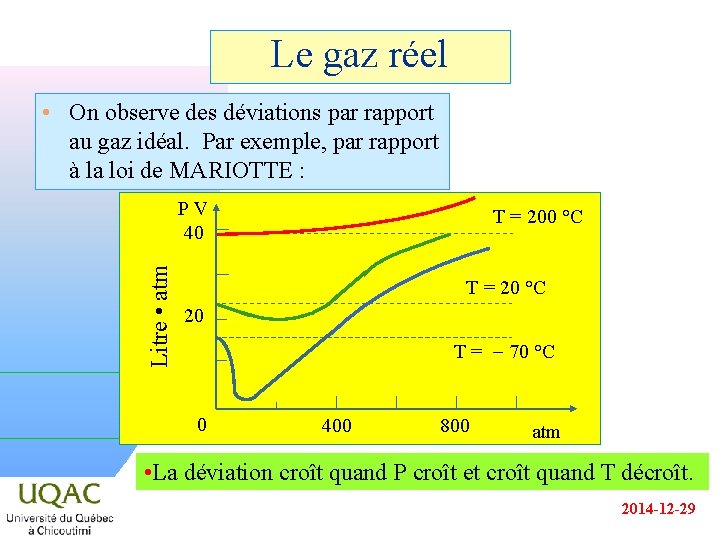
Le gaz réel • On observe des déviations par rapport au gaz idéal. Par exemple, par rapport à la loi de MARIOTTE : Litre • atm PV 40 T = 200 °C T = 20 °C 20 T = - 70 °C 0 400 800 atm • La déviation croît quand P croît et croît quand T décroît. 2014 -12 -29

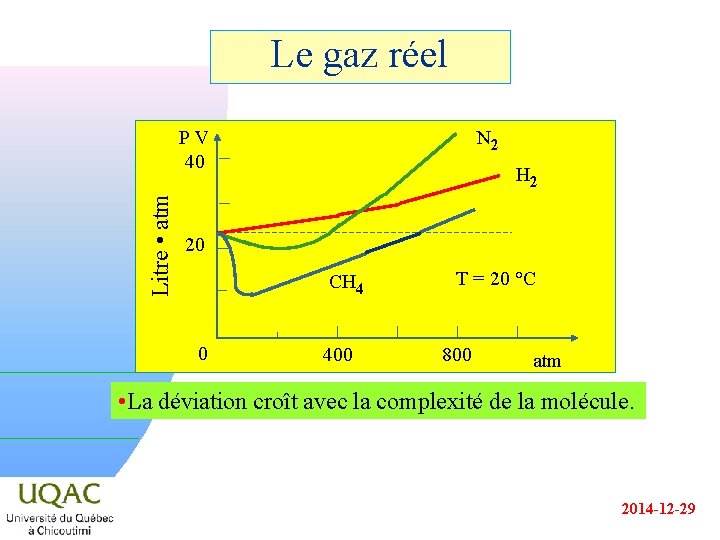
Le gaz réel Litre • atm PV 40 N 2 H 2 20 CH 4 0 400 T = 20 °C 800 atm • La déviation croît avec la complexité de la molécule. 2014 -12 -29

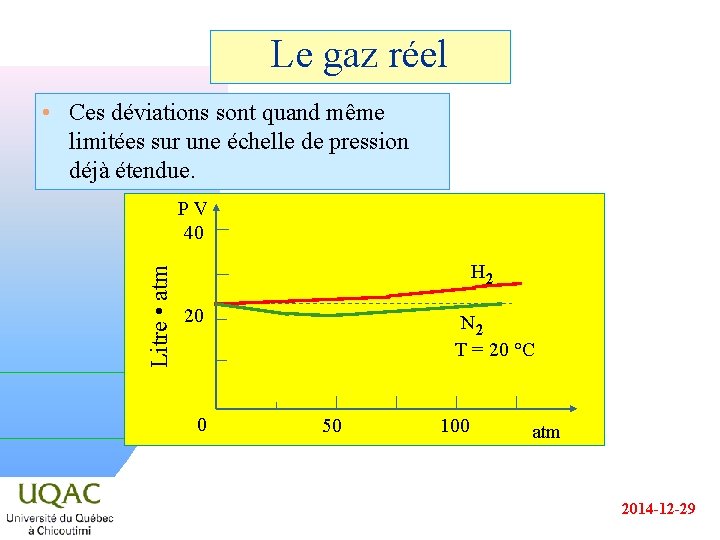
Le gaz réel • Ces déviations sont quand même limitées sur une échelle de pression déjà étendue. Litre • atm PV 40 H 2 20 0 N 2 T = 20 °C 50 100 atm 2014 -12 -29

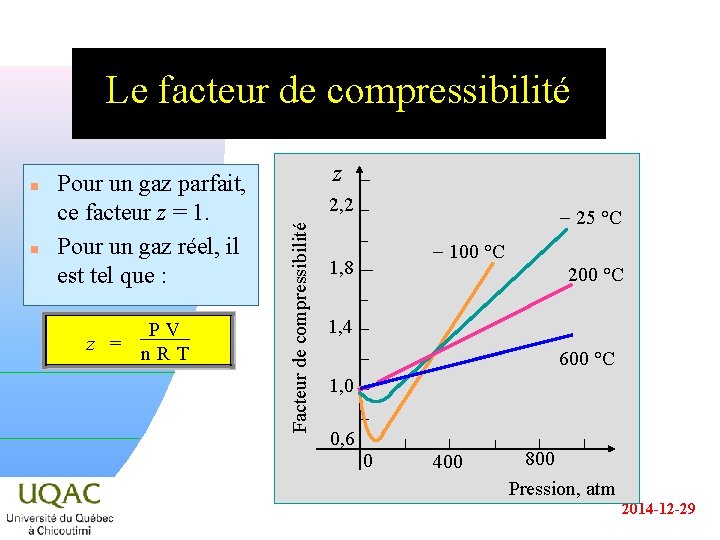
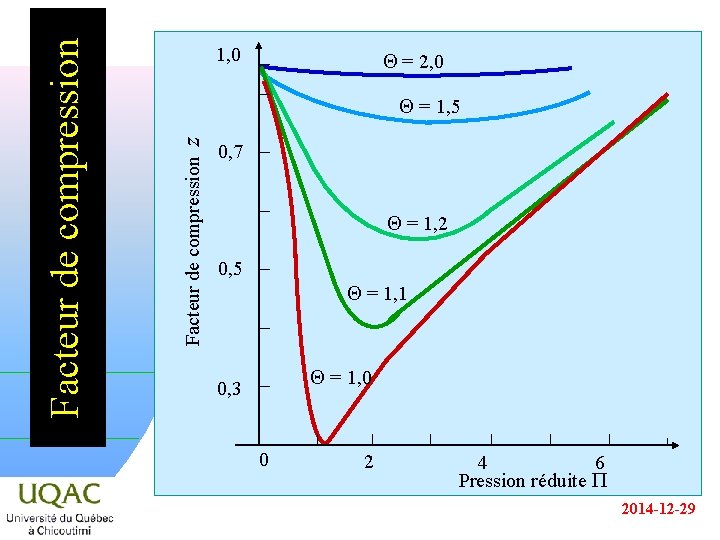
Le facteur de compressibilité n Pour un gaz parfait, ce facteur z = 1. Pour un gaz réel, il est tel que : PV z = n. RT z 2, 2 Facteur de compressibilité n - 25 °C - 100 °C 1, 8 200 °C 1, 4 600 °C 1, 0 0, 6 0 400 800 Pression, atm 2014 -12 -29

Effet de covolume Le volume réel disponible pour un gaz est le volume du réacteur diminué de son propre volume. Le volume V devient V - b (b est le covolume). Le grandeurs molaires deviennent : n n Ou encore, pour n moles : Rappel : 2014 -12 -29

Rayon moléculaire et covolume 2014 -12 -29

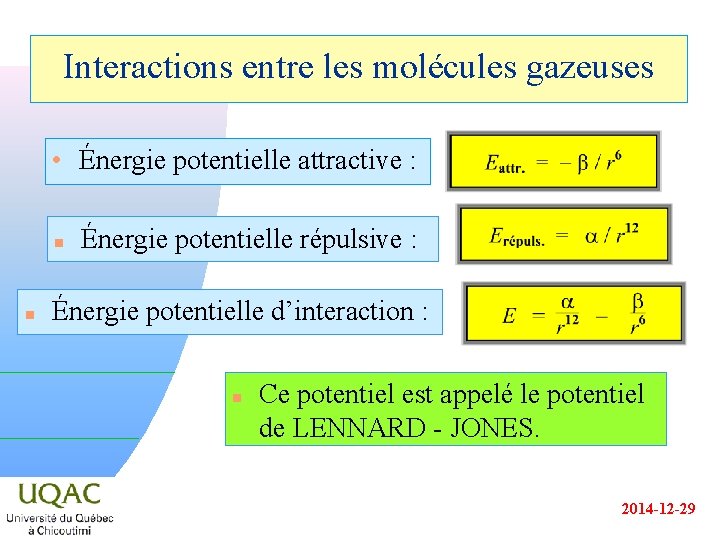
Interactions entre les molécules gazeuses • Énergie potentielle attractive : n n Énergie potentielle répulsive : Énergie potentielle d’interaction : n Ce potentiel est appelé le potentiel de LENNARD - JONES. 2014 -12 -29

Potentiel de LENNARD - JONES EP a/ Exemples : r 12 He*. . . He r = r 0 He. . He - b / r 6 • Pas d’attraction entre He et He : b 0 • Mais He*- He : b 0 2014 -12 -29

Loi de VAN DER WAALS n n Effet des forces de VAN DER WAALS sur la tenue d’un gaz réel. Lorsque la pression croît : Dans ces conditions la loi des gaz parfaits devient : n n Si V devient très grand, on retrouve la loi de MARIOTTE. La loi de MARIOTTE est le cas limite de la loi de VAN DER WAALS. 2014 -12 -29

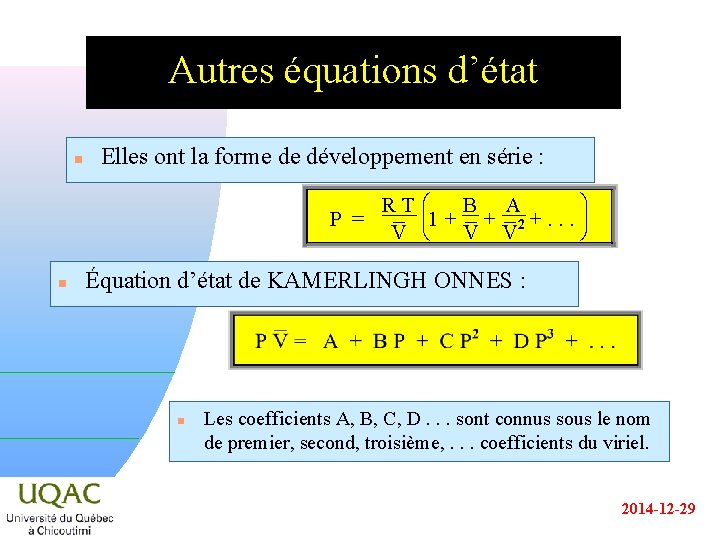
Autres équations d’état n Elles ont la forme de développement en série : RT P = V n æ ç 1 è ö B A + + 2+. . . ÷ V V ø Équation d’état de KAMERLINGH ONNES : n Les coefficients A, B, C, D. . . sont connus sous le nom de premier, second, troisième, . . . coefficients du viriel. 2014 -12 -29

Exemples de coefficients du viriel Tiré de « Principles of Phys. Chem. » , Maron & Prutton, 4 e éd. , 1965. 2014 -12 -29

Autre équation d’état n Équation d’état de BEATTIE - BRIDGEMAN : b g RT P = + 2+ 3+ 4 V V n Ou encore : n g. P P 2 b RT V = + R + + P T (R T)2 (R T)3 avec des constantes différentes pour chaque gaz : b = R T Bo - Ao + Rc / T 2 g = - R T Bo b + Ao a - Rc Bo / T 2 = R Bo b c / T 2 2014 -12 -29

Équation de BEATTIE - BRIDGEMAN Système : litre atm Tiré de « Principles of Phys. Chem. » , Maron & Prutton, 4 e éd. , 1965. 2014 -12 -29

Équations d’état de BERTHELOT n n Cette équation est utilisée pour la détermination exacte des poids moléculaires. Puisque : M é æ R Tö æ wö ê = çè P ÷ø çè V÷ø ê 1 ë æ öù 9 P Tc ç 6 Tc 2÷ú + 128 P T ç 1 - 2 ÷ú c è T øû Pourvu que Pc et Tc soient connus, cette formule est particulièrement précise. 2014 -12 -29

Autres équations d’état n Équation d’état de DIETERICI : 2014 -12 -29

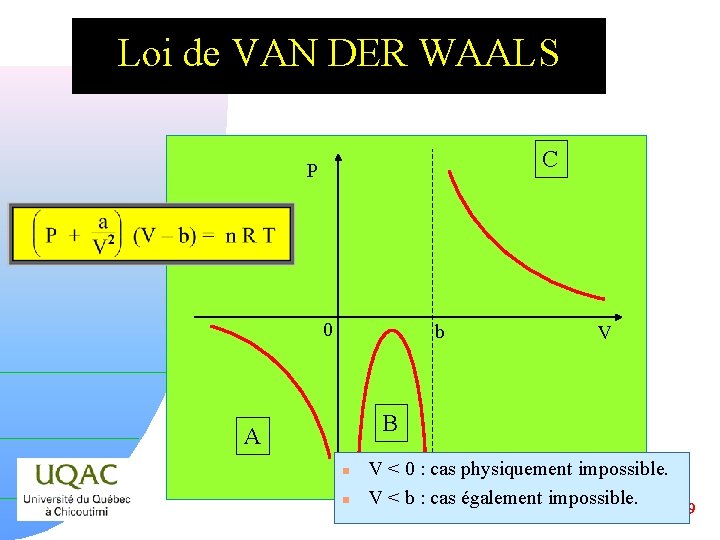
Loi de VAN DER WAALS C P 0 b V B A n n V < 0 : cas physiquement impossible. V < b : cas également impossible. 2014 -12 -29

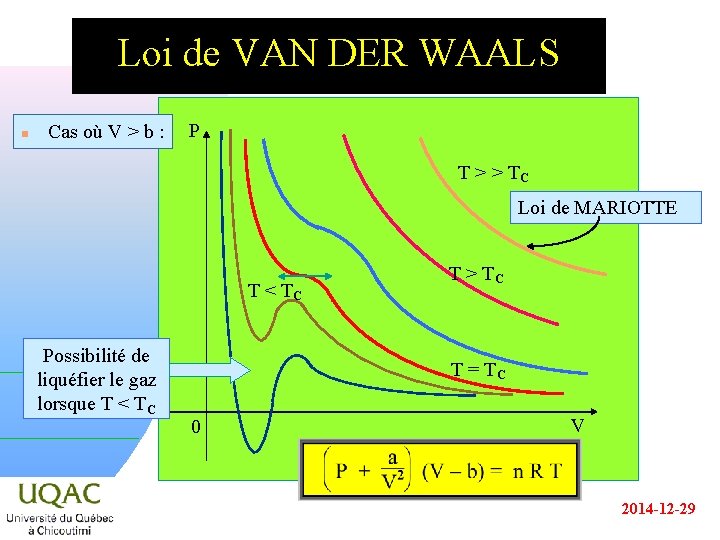
Loi de VAN DER WAALS n Cas où V > b : P T > > TC Loi de MARIOTTE T < TC Possibilité de liquéfier le gaz lorsque T < TC T > TC T = TC 0 V 2014 -12 -29

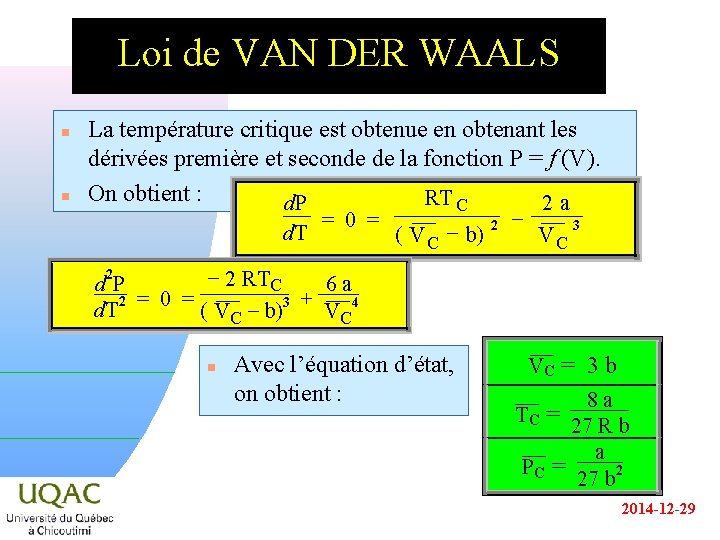
Loi de VAN DER WAALS n n La température critique est obtenue en obtenant les dérivées première et seconde de la fonction P = f (V). On obtient : RT C d. P 2 a d. T = 0 = ¯¯C - b) 2 (V - ¯¯C V 3 2 - 2 RTC d. P 6 a + 2 = 0 = d. T (V ¯¯C - b)3 V ¯¯C 4 n Avec l’équation d’état, on obtient : V ¯¯C = 3 b 8 a T ¯¯C = 27 R b a ¯¯ PC = 2 27 b 2014 -12 -29

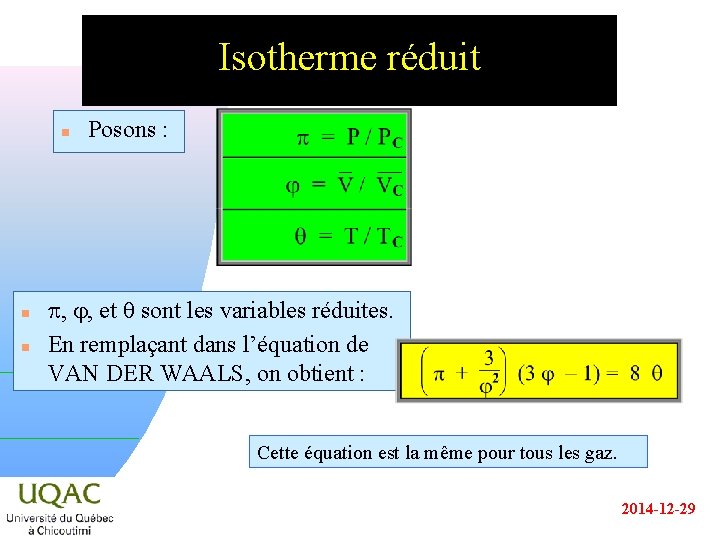
Isotherme réduit n n n Posons : p, , et sont les variables réduites. En remplaçant dans l’équation de VAN DER WAALS, on obtient : Cette équation est la même pour tous les gaz. 2014 -12 -29

Q = 2, 0 z Q = 1, 5 Facteur de compression 1, 0 0, 7 Q = 1, 2 0, 5 Q = 1, 1 Q = 1, 0 0, 3 0 2 4 6 Pression réduite P 2014 -12 -29

Constantes de VAN DER WAALS et valeurs critiques * a : atm litre 2 /mol 2 2014 -12 -29

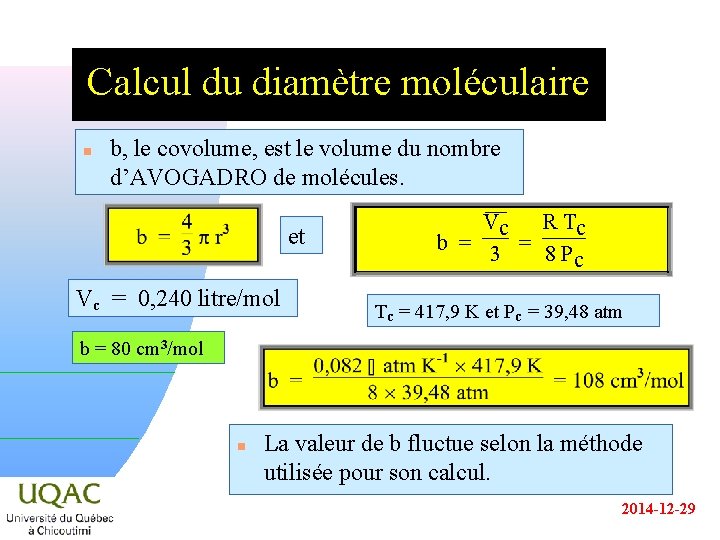
Calcul du diamètre moléculaire n b, le covolume, est le volume du nombre d’AVOGADRO de molécules. et Vc = 0, 240 litre/mol R Tc V ¯¯c b = 3 = 8 P c Tc = 417, 9 K et Pc = 39, 48 atm b = 80 cm 3/mol n La valeur de b fluctue selon la méthode utilisée pour son calcul. 2014 -12 -29

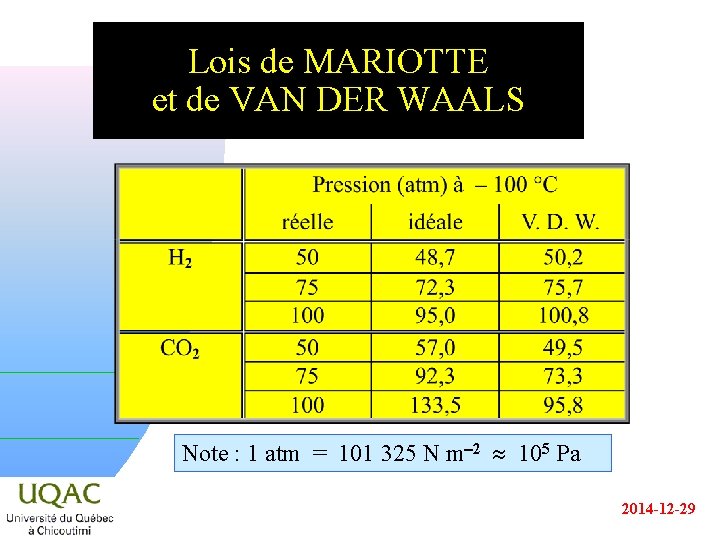
Lois de MARIOTTE et de VAN DER WAALS Note : 1 atm = 101 325 N m-2 105 Pa 2014 -12 -29

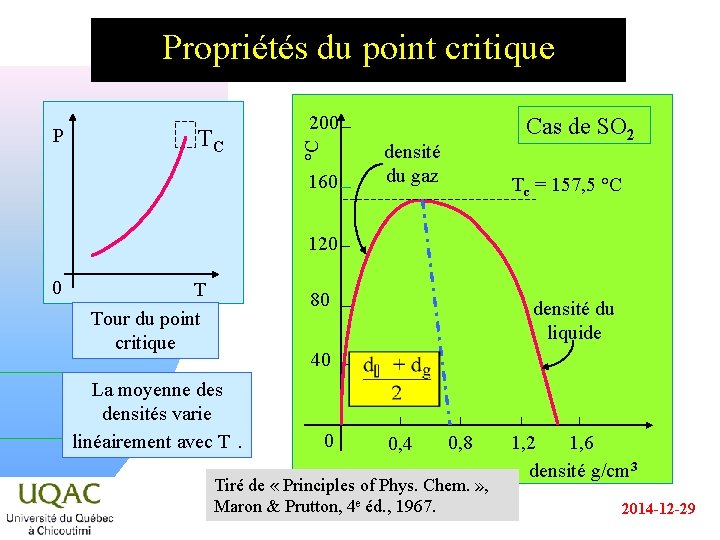
Propriétés du point critique 200 TC °C P 160 Cas de SO 2 densité du gaz Tc = 157, 5 °C 120 0 T Tour du point critique 80 densité du liquide 40 La moyenne des densités varie linéairement avec T . 0 0, 4 0, 8 Tiré de « Principles of Phys. Chem. » , Maron & Prutton, 4 e éd. , 1967. 1, 2 1, 6 densité g/cm 3 2014 -12 -29

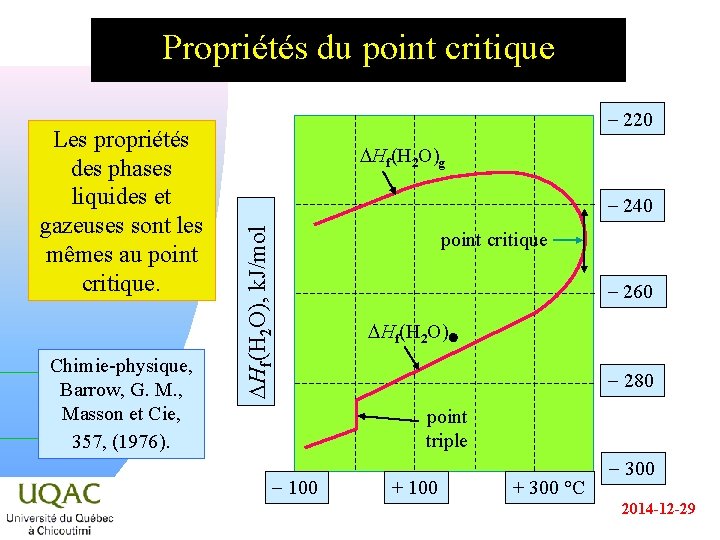
Propriétés du point critique Chimie-physique, Barrow, G. M. , Masson et Cie, 357, (1976). DHf(H 2 O)g - 240 DHf(H 2 O), k. J/mol Les propriétés des phases liquides et gazeuses sont les mêmes au point critique. - 220 point critique - 260 DHf(H 2 O) - 280 point triple - 100 + 300 °C - 300 2014 -12 -29

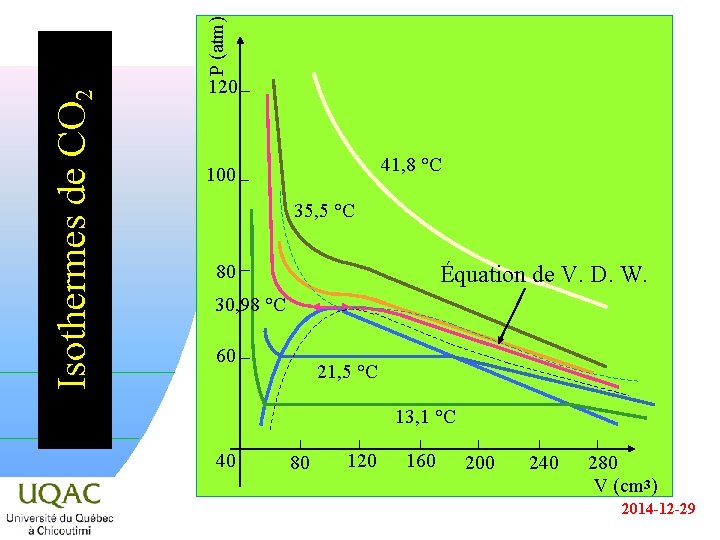
P (atm) Isothermes de CO 2 120 41, 8 °C 100 35, 5 °C Équation de V. D. W. 80 30, 98 °C 60 21, 5 °C 13, 1 °C 40 80 120 160 200 240 280 V (cm 3) 2014 -12 -29

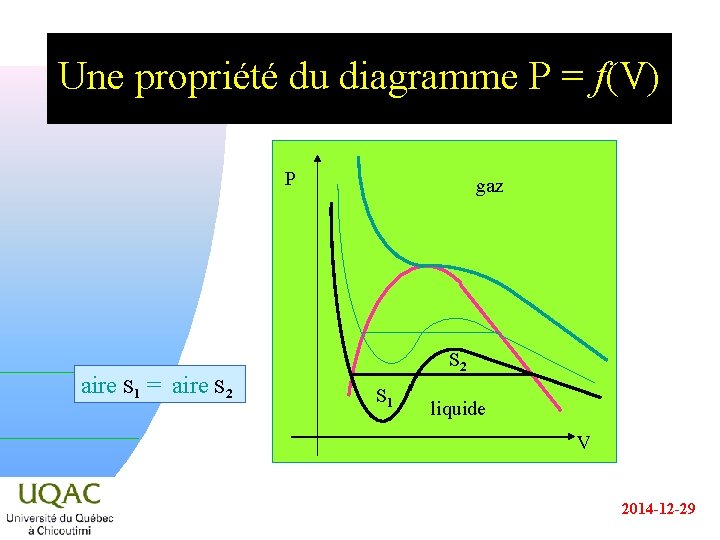
Une propriété du diagramme P = f(V) P aire S 1 = aire S 2 gaz S 2 S 1 liquide V 2014 -12 -29

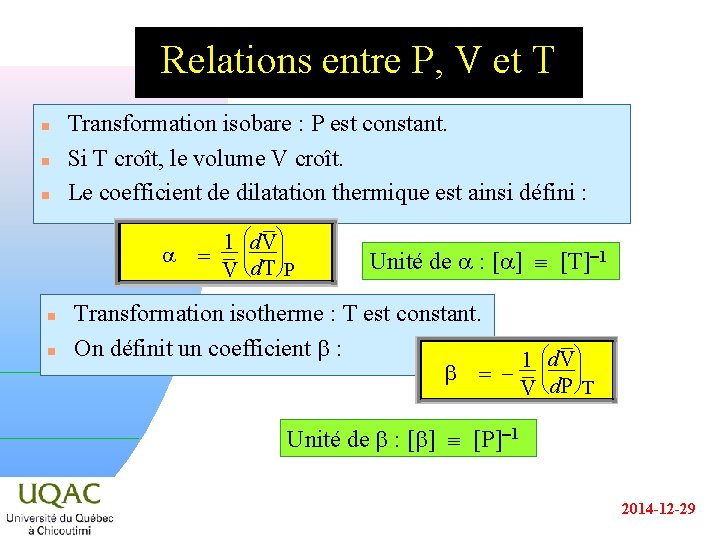
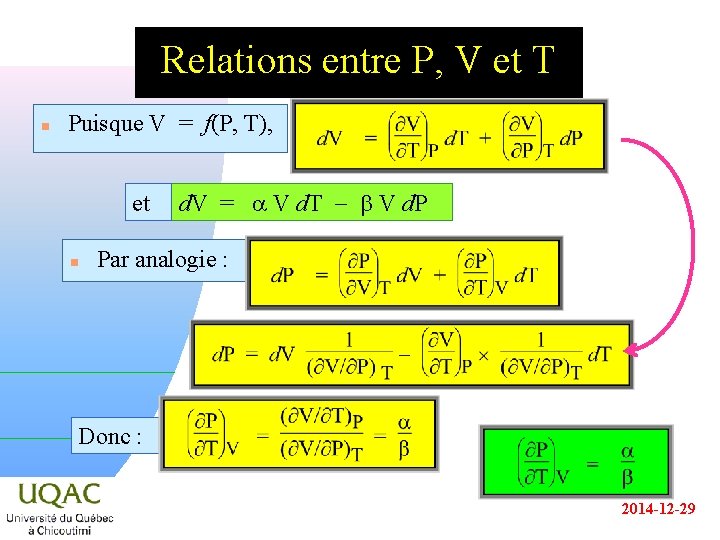
Relations entre P, V et T n n n Transformation isobare : P est constant. Si T croît, le volume V croît. Le coefficient de dilatation thermique est ainsi défini : 1 æçd. V ö÷ a = V è d. T øP n n Unité de a : [a] [T]-1 Transformation isotherme : T est constant. On définit un coefficient b : b 1 æçd. V ö÷ = V è d. P øT Unité de b : [b] [P]-1 2014 -12 -29

Relations entre P, V et T n Puisque V = f(P, T), et n d. V = a V d. T - b V d. P Par analogie : Donc : 2014 -12 -29

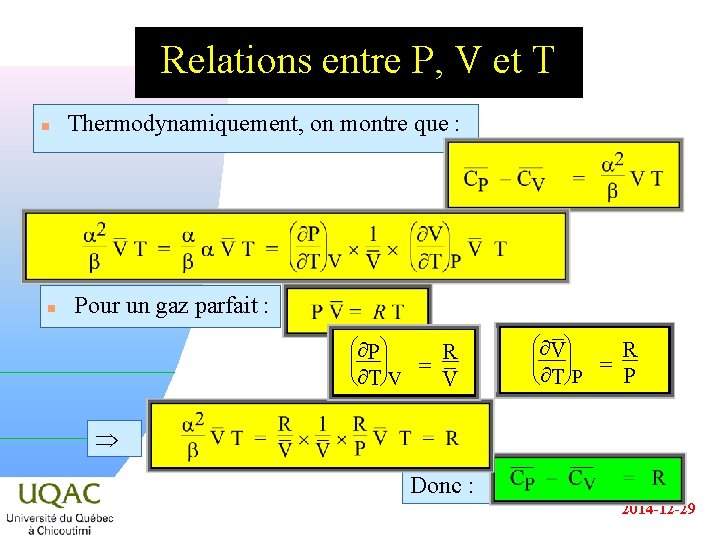
Relations entre P, V et T n n Thermodynamiquement, on montre que : Pour un gaz parfait : æ ¶P ö ç ÷ è¶TøV R = V æ¶V ö ç ÷ è ¶T øP R = P Donc : 2014 -12 -29

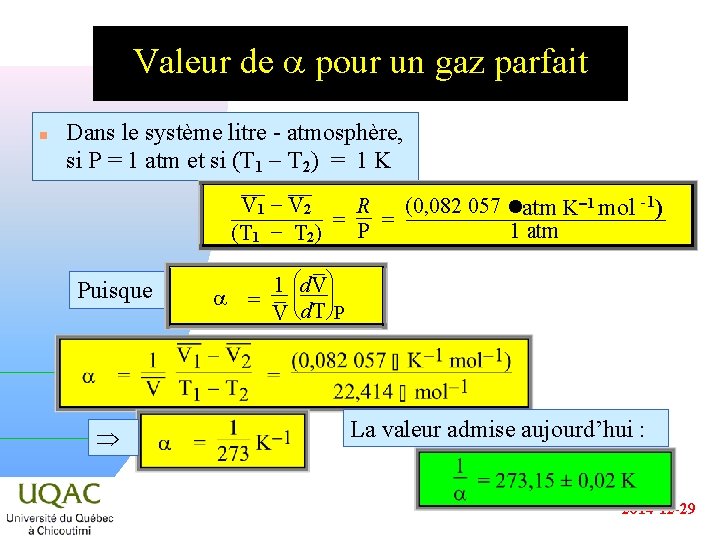
Valeur de a pour un gaz parfait 1 æçd. V ö÷ a = V è d. T øP n V = a T V est l’augmentation de volume pour une augmentation T. n V = (n R / P ) T V 1 - V 2 = a (T 1 - T 2 ) V V 2 = ¯¯ 1 - ¯¯ R (T - T 2) P 1 REGNAULT (1847) définissait a 0 de la manière suivante : V = V 0 (1 + a 0 ) 2014 -12 -29

Valeur de a pour un gaz parfait n Dans le système litre - atmosphère, si P = 1 atm et si (T 1 - T 2) = 1 K V 1 - ¯¯ V 2 ¯¯ R (0, 082 057 latm K-1 mol -1) = P = 1 atm (T 1 T 2 ) Puisque 1 æçd. V ö÷ a = V è d. T øP La valeur admise aujourd’hui : 2014 -12 -29

Loi de GRAHAM n n Cette loi est relative à la diffusion de gaz à travers une paroi poreuse. À température et pression constantes, les vitesses de diffusion de différents gaz varient inversement comme la racine carrée de leur poids moléculaire ou leur densité : 2014 -12 -29

Conclusion n n Les coefficients de la loi de VAN DER WAALS permettent de calculer les valeurs critiques d’un gaz. Les coefficient de dilatation, a et b, obtenus respectivement à P constant et à T constant, sont liés aux capacités calorifiques molaires à P et à V constants : La loi de GRAHAM permet de calculer les vitesses relatives de diffusion de deux gaz à travers une cloison poreuse : 2014 -12 -29