Kvalitativno odreivanje aniona na temelju preliminarnih ispitivanja Nastavni


















- Slides: 20

Kvalitativno određivanje aniona na temelju preliminarnih ispitivanja Nastavni predmet: Analitička kemija Razred: 2. Nastavni plan i program/Kurikulum: Kemijski tehničar Trajanje: 4 sata Pripremila: Sonja Rupčić Petelinc

• Zbog svoje strukture većina je aniona nestabilnija i reaktivnija od kationa. • Nestabilnost aniona posebno je izražena u kiselom mediju, dok su u neutralnom i lužnatom mediju znatno stabilniji i stoga manje reaktivni. UVOD • Ima čitav niz iznimaka i nastojat ćemo ih u ovom dijelu spomenuti. • Redoslijed ispitivanja aniona ovisi upravo o spomenutim svojstvima većine aniona. Zato prije sistematskog odjeljivanja i određivanja aniona treba ispitati njihovu reaktivnost prema sumpornoj kiselini, a zatim ponašanje u prisutnosti oksidacijskih i redukcijskih reagenasa.

Neki anioni mogu reagirati tako da ih ljudska osjetila registriraju: Neki anioni mogu reagirati tako da se produkti reakcije mogu dokazati određenim reagensom: boja nastalih plinova, boja otopine, miris i dr. CO 32 (aq), CH 3 COO (aq), SO 32 (aq), S 2 (aq), CN (aq), NO 2 (aq) (Ba(OH)2(aq), (CH 3 COO)2 Pb(aq), KI(aq)). Ta fotografija korisnika Nepoznat autor: licenca CC BY-NC-ND REAKCIJE NEKIH ANIONA S RAZRIJEĐENOM I KONCENTRIRANOM SUMPORNOM KISELINOM Koncentrirana sumporna kiselina djeluje mnogo agresivnije i pri radu o tome treba voditi računa.

POJEDINAČNE REAKCIJE ANIONA SA SUMPORNOM KISELINOM

Karbonatni ion s razrijeđenom sumpornom kiselinom oslobađa ugljikov(IV) oksid koji se može dokazati otopinom barijeva hidroksida: Sulfitni ion sa sumpornom kiselinom reagira tako da se oslobađa sumporov(IV) oksid, koji se osjeti po mirisu ili se dokazuje s Ba(OH)2(aq):

Tiosulfatni ion sa sumpornom kiselinom daje elementarni sumporov(IV) oksid: Kloridni ion reagira s koncentriranom sumpornom kiselinom, pri čemu se oslobađa plinoviti klorovodik: Acetatni ion, CH 3 COO (aq), reagira sa sumpornom kiselinom, pri čemu se oslobađa octena kiselina, koja se osjeća po mirisu:

Sulfidni ion sa sumpornom kiselinom razvija sumporovodik, plin koji ima miris na pokvarena jaja: Cijanidni ion reagira sa sumpornom kiselinom, pri čemu nastaje plinoviti cijanovodik koji ima miris na bademe i vrlo je otrovan. Potreban je oprez pri radu! Nitritni ion sa sumpornom kiselinom reagira i nastaju dušikov(II) i dušikov(IV) oksid:

VJEŽBA: Reakcije aniona s razrijeđenom i koncentriranom sumpornom kiselinom Pribor i kemikalije: • epruvete, kapalice, menzura 5 m. L, stakleni štapić • čvrsti uzorci aniona CO 32 , C 2 O 42 , SO 32 , SO 42 , S 2 O 32 , Cl , NO 3 , CH 3 COO , S 2 , NO 2 , H 2 SO 4(aq), H 2 SO 4(l), (CH 3 COO)2 Pb(aq), KI(aq), škrob Postupak: U epruvetu stavite malo čvrstog uzorka aniona i nekoliko kapi razrijeđene sumporne kiseline. Ako nema vidljive reakcije, epruveta se oprezno zagrije. Isto ponovite i s koncentriranom sumpornom kiselinom. Ta fotografija korisnika Nepoznat autor: licenca CC BY-ND

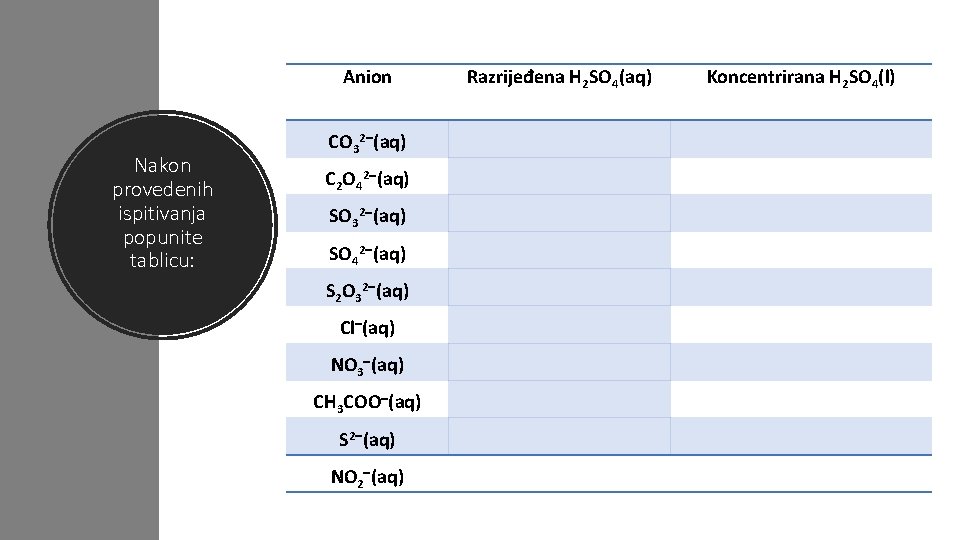
Anion Nakon provedenih ispitivanja popunite tablicu: CO 32 (aq) C 2 O 42 (aq) SO 32 (aq) SO 42 (aq) S 2 O 32 (aq) Cl (aq) NO 3 (aq) CH 3 COO (aq) S 2 (aq) NO 2 (aq) Razrijeđena H 2 SO 4(aq) Koncentrirana H 2 SO 4(l)

ISPITIVANJE OKSIDACIJSKIH I REDUKCIJSKIH SVOJSTAVA NEKIH ANIONA

Oksidacijska i redukcijska svojstva nekih aniona određuju se otopinom kalijeva permanganata i joda kao oksidansima i otopinom jodidnih iona kao reducensom. Oksalatni ion s otopinom kalijeva permanganata reagira uz zagrijavanje: Sulfitni ion s oksidansima se oksidira u sulfatni ion:

Tiosulfatni ion reagira i s otopinom kalijeva permanganata i s otopinom joda: Halogenidni ioni (Cl (aq), Br (aq), I (aq)) se u prisutnosti kalijeva permanganata oksidiraju u elementarni klor, brom i jod: Arsenitni ion se u prisutnosti oksidansa oksidira u arsenatni ion:

Oksidansi oksidiraju sulfidni ion u elementarni sumpor: Nitritni ion se u prisutnosti permanganatnog iona oksidira u nitratni ion: Kalijev permanganat oksidira cijanidni ion u dicijanidni ion, koji se u vodenim otopinama disproporcionira u cijanidni i cijanatni ion:

Kalijev permanganat oksidira heksacijanoferat(II) u heksacijanoferat(III): Kromatni ion oksidira jodidni ion u jod: Heksacijanoferatni(III) ion se u prisutnosti reducensa, jodidnog iona, reducira u heksacijanoferatni(II) ion:

Kloratni se ion u prisutnosti reducensa reducira u kloridni ion: Arsenatni se ion u prisutnosti jodidnih iona reducira u arsenitni ion:

VJEŽBA: Ispitivanje oksidacijskih i redukcijskih svojstava aniona • Pribor i kemikalije: • epruvete, kapalice, menzura 5 m. L, stakleni štapić, plamenik, drvena hvataljka • uzorci aniona CO 32 , C 2 O 42 , SO 32 , SO 42 , S 2 O 32 , Cl , NO 3 , CH 3 COO , S 2 , NO 2 , Br (aq), I (aq), [Fe(CN)6]4 (aq), Cr. O 42 (aq), [Fe(CN)6]3 (aq), Cl. O 3 (aq), H 2 SO 4(aq), c = 2 mol dm 3, KMn. O 4(aq), KI(aq), škrob • Postupak: Uzorak otopite u epruveti, zakiselite s nekoliko kapi sumporne kiseline, c = 2 mol dm 3, i podijelite u tri epruvete. • • U prvu epruvetu dodajte nekoliko kapi otopine kalijeva permanganata i otopinu u epruveti zagrijte do vrenja. Ako se boja permanganata izgubi, prisutan je reducens. • U drugu epruvetu dodajte nekoliko kapi otopine škroba i nekoliko kapi otopine joda. Ako plava boja nestane, prisutan je reducens. • U treću epruvetu dodajte nekoliko kapi otopine škroba i nekoliko kapi otopine kalijeva jodida. Ako se otopina oboji plavo, prisutan je oksidans. Ta fotografija korisnika Nepoznat autor: licenca CC BY-ND

a) – c) Promjena boje otopine kalijeva permanganata kao indikatora u prisutnosti sulfitnog aniona, SO 32–(aq). d)– f) Promjena boje otopine škroba i kalijeva jodida kao indikatora u prisutnosti sulfitnog aniona, SO 32–(aq).

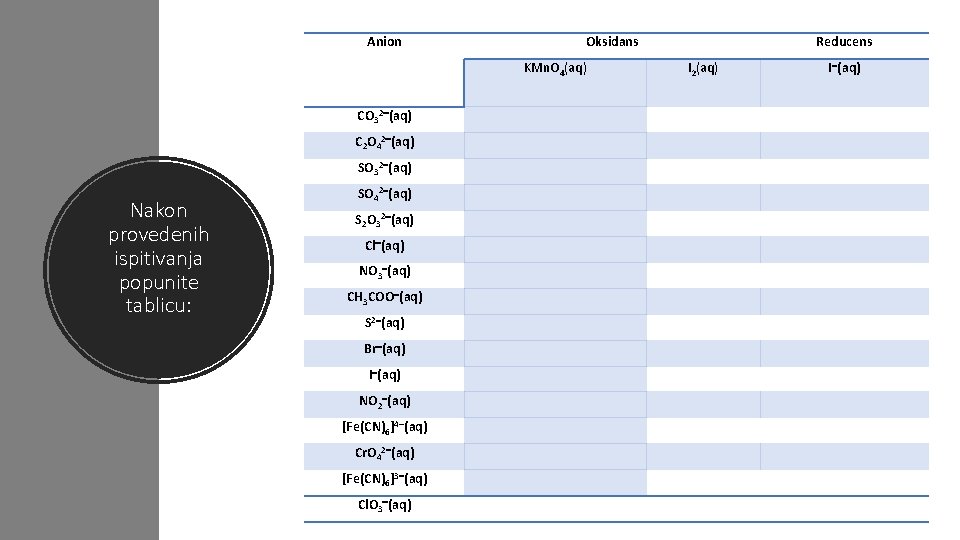
Anion Oksidans KMn. O 4(aq) CO 32 (aq) C 2 O 42 (aq) SO 32 (aq) Nakon provedenih ispitivanja popunite tablicu: SO 42 (aq) S 2 O 32 (aq) Cl (aq) NO 3 (aq) CH 3 COO (aq) S 2 (aq) Br (aq) I (aq) NO 2 (aq) [Fe(CN)6]4 (aq) Cr. O 42 (aq) [Fe(CN)6]3 (aq) Cl. O 3 (aq) Reducens I 2(aq) I (aq)

Literatura: Zoran Weihnacht, Sonja Rupčić Petelinc, Sanja Žužek: PRAKTIKUM ANALITIČKE KEMIJE, udžbenik analitičke kemije za srednje strukovne škole, Školska knjiga, Zagreb, 2008.

Hvala na pažnji!
 Epizodicko pamcenje
Epizodicko pamcenje Kvantitativno značenje
Kvantitativno značenje Miševi i mačke naglavačke pdf
Miševi i mačke naglavačke pdf Redoslijed događaja duh u močvari
Redoslijed događaja duh u močvari Godišnji ioop
Godišnji ioop Plavi lončić priča
Plavi lončić priča Kako se deli proslost ljudskog drustva
Kako se deli proslost ljudskog drustva Najveci negativni celi broj
Najveci negativni celi broj Crtani film srce u snijegu
Crtani film srce u snijegu Sadrzaoci brojeva
Sadrzaoci brojeva Umišljena mačka i zamišljeni miš
Umišljena mačka i zamišljeni miš Obrazac za pripremu nastavnog sata
Obrazac za pripremu nastavnog sata Nastavni plan i program za domacinstvo
Nastavni plan i program za domacinstvo Cilj nastavnog sata
Cilj nastavnog sata Jesen uređenje panoa
Jesen uređenje panoa Nastavni oblici rada
Nastavni oblici rada Didakticki principi
Didakticki principi Nastavni plan i program za domacinstvo
Nastavni plan i program za domacinstvo Metoda rada
Metoda rada Profesor baltazar nastavni listić
Profesor baltazar nastavni listić Junaci pavlove ulice kviz
Junaci pavlove ulice kviz