KIMIA ANALISIS I ANALISIS KUALITATIF SENYAWA APA 2














![CARA MENGUKUR KECEPATAN REAKSI C [B] [A] t u Diukur dengan : Pertambahan [ CARA MENGUKUR KECEPATAN REAKSI C [B] [A] t u Diukur dengan : Pertambahan [](https://slidetodoc.com/presentation_image_h2/5d651f710137db84101292c5e05357f9/image-27.jpg)





- Slides: 32

KIMIA ANALISIS I. ANALISIS KUALITATIF SENYAWA APA ? 2. ANALISIS KUANTITATIF BERAPA BANYAKNYA ?

YANG HARUS DIPELAJARI 1. LAMBANG UNSUR : kualitatif & kuantitatif 2. RUMUS EMPIRIS : menyatakan komposisi bahan yang tdr dr atom 3. VALENSI: bil yg menyatakan brp banyaknya atom H atau atom lain yg ekivalensi dng H (HCl , H 2 S, NH 3, CH 4). Ada yg dgn O, Cl (Mg. O, Al. Cl 3) 4. BILOKS : bil yg identik gdn valensi tetapi dg tanda yg menyatakan sifat muatan ketika terbentuk dr atomnya yg netral (HCl. O, HCl. O 2, HCl. O 3, HCl. O 4) 5. RUMUS BANGUN/STRUKTUR : konsep dari valensi (komposisi senyawa) : C 6 H 6 , C 6 H 6 O Rumus empiris sama belum tentu rumus struktur sama. 6. PERSAMAAN REAKSI KIMIA : harus benar dan lengkap

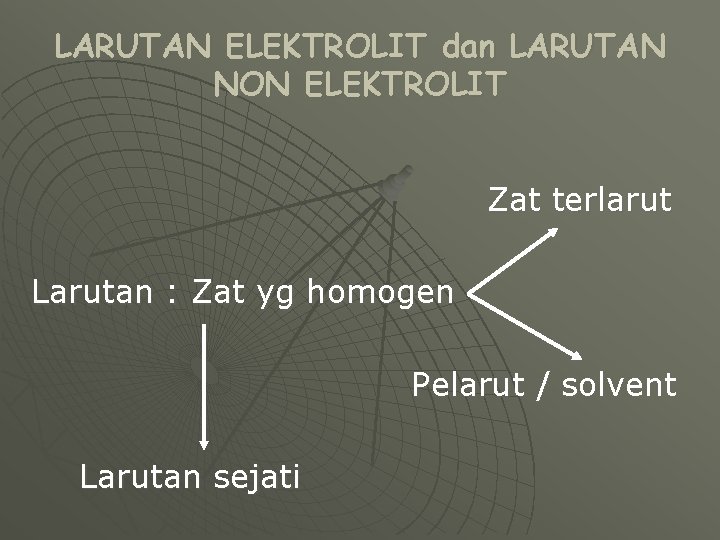
LARUTAN ELEKTROLIT dan LARUTAN NON ELEKTROLIT Zat terlarut Larutan : Zat yg homogen Pelarut / solvent Larutan sejati

Dibedakan 2 golongan bila dialiri arus listrik 1. Elektrolit v. Zat - zat yg dapat menghantarkan arus listrik pelarut air v. Terurai menjadi ionisasi misal: Asam basa, garam anorganik 2. Non Elektrolit v. Zat - zat yg tdk dpt menghantarkan arus listrik pelarut air v. Tidak terionkan misal: zat-zat organik seperti gula, gliserin, etanol , urea

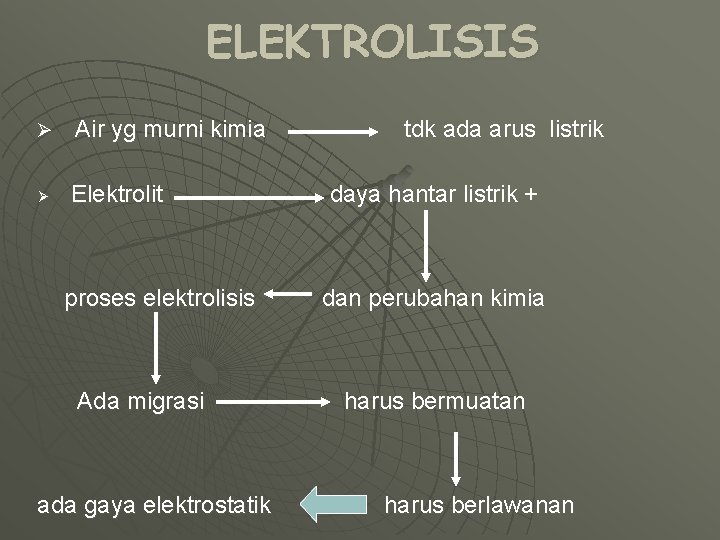
ELEKTROLISIS Ø Ø Air yg murni kimia Elektrolit proses elektrolisis Ada migrasi ada gaya elektrostatik tdk ada arus listrik daya hantar listrik + dan perubahan kimia harus bermuatan harus berlawanan

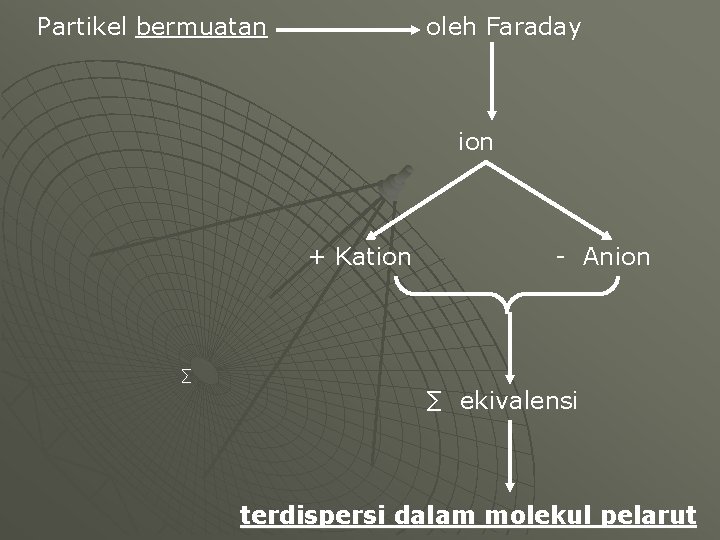
Partikel bermuatan oleh Faraday ion + Kation - Anion ∑ ∑ ekivalensi terdispersi dalam molekul pelarut

SIFAT LARUTAN 1. Non elektrolit Mis: 1 molekul non elektrolit + 1000 g air 1 molekul non elektrolit sbg partikel elektrolit tetap sama jumlah partikel sama Tekanan osmosis Tekanan uap Titik didih Identik Besaran – besaran dapat ditentukan

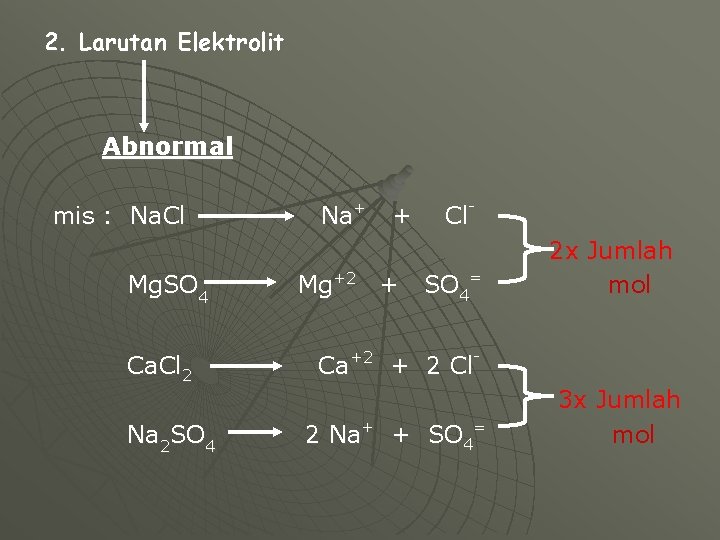
2. Larutan Elektrolit Abnormal mis : Na. Cl Mg. SO 4 Ca. Cl 2 Na 2 SO 4 Na+ + Mg+2 + Cl. SO 4= 2 x Jumlah mol Ca+2 + 2 Cl 2 Na+ + SO 4= 3 x Jumlah mol

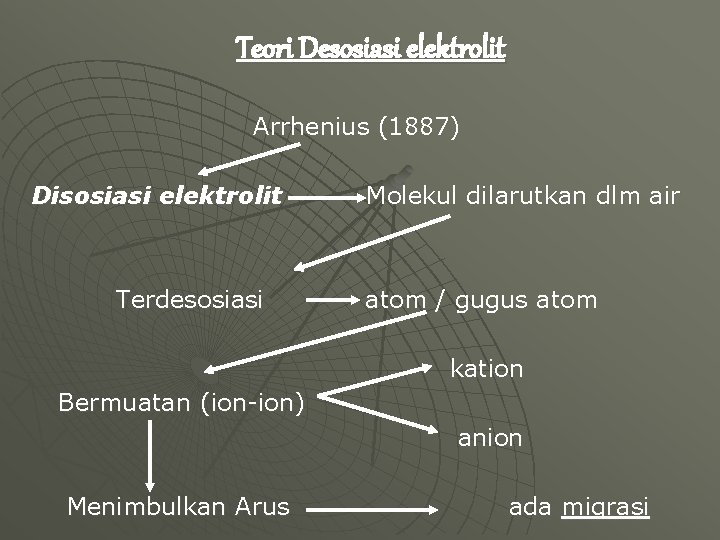
Teori Desosiasi elektrolit Arrhenius (1887) Disosiasi elektrolit Terdesosiasi Molekul dilarutkan dlm air atom / gugus atom kation Bermuatan (ion-ion) anion Menimbulkan Arus ada migrasi

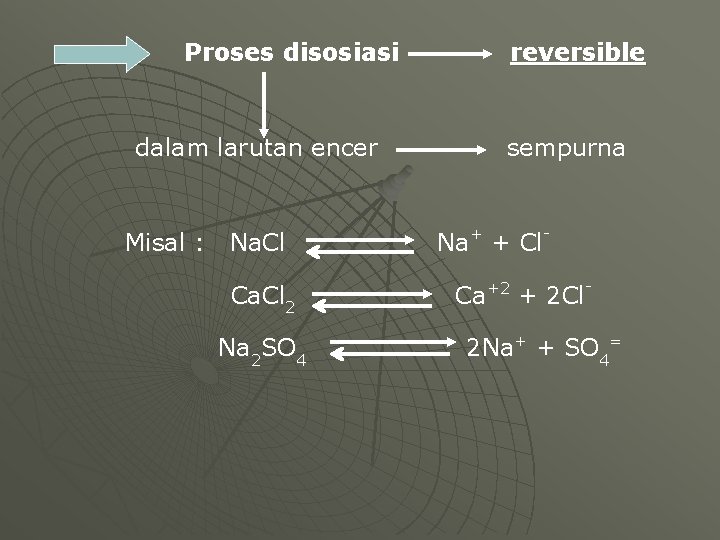
Proses disosiasi dalam larutan encer Misal : Na. Cl Ca. Cl 2 Na 2 SO 4 reversible sempurna Na+ + Cl. Ca+2 + 2 Cl 2 Na+ + SO 4=

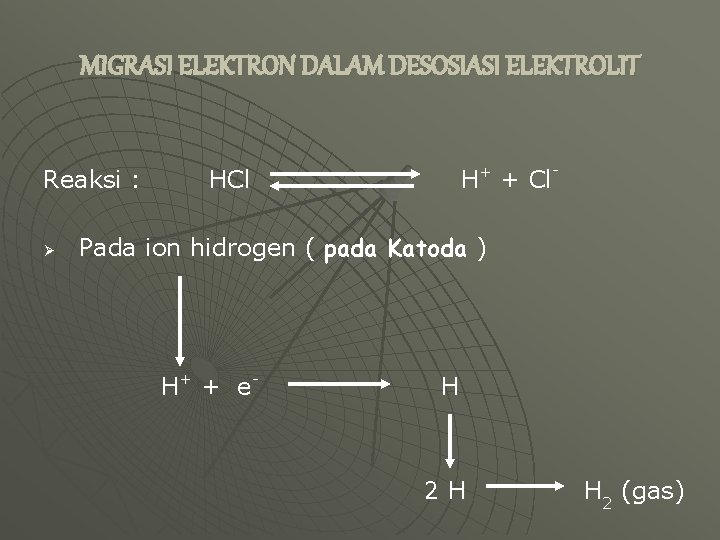
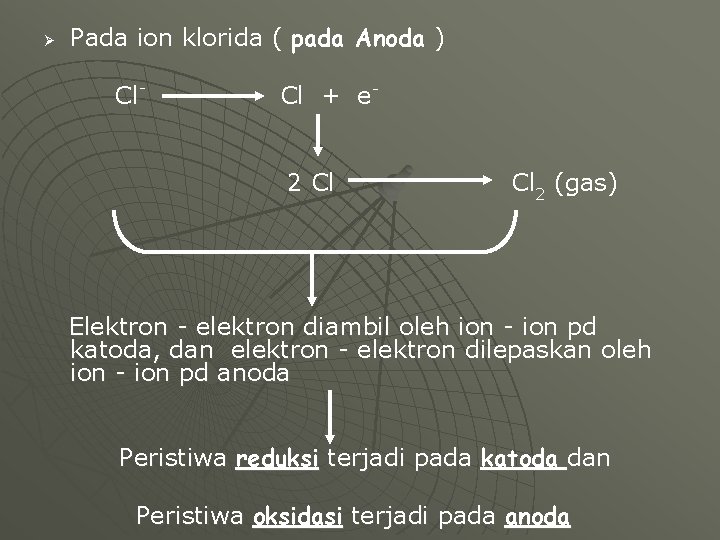
MIGRASI ELEKTRON DALAM DESOSIASI ELEKTROLIT Reaksi : Ø H+ + Cl- HCl Pada ion hidrogen ( pada Katoda ) H + + e- H 2 H H 2 (gas)

Ø Pada ion klorida ( pada Anoda ) Cl- Cl + e 2 Cl Cl 2 (gas) Elektron - elektron diambil oleh ion - ion pd katoda, dan elektron - elektron dilepaskan oleh ion - ion pd anoda Peristiwa reduksi terjadi pada katoda dan Peristiwa oksidasi terjadi pada anoda

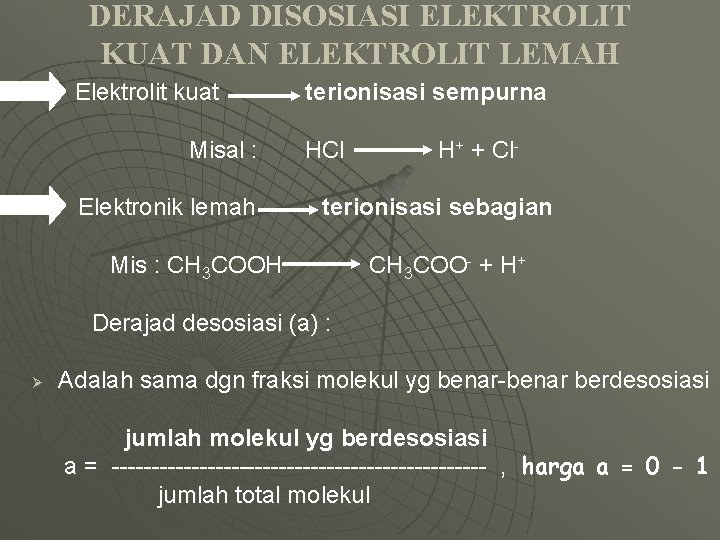
DERAJAD DISOSIASI ELEKTROLIT KUAT DAN ELEKTROLIT LEMAH Elektrolit kuat Misal : Elektronik lemah terionisasi sempurna HCl H+ + Cl- terionisasi sebagian Mis : CH 3 COOH CH 3 COO- + H+ Derajad desosiasi (a) : Ø Adalah sama dgn fraksi molekul yg benar-benar berdesosiasi jumlah molekul yg berdesosiasi a = ------------------------ , harga a = 0 - 1 jumlah total molekul

BEBERAPA METODA UNTUK MENGHITUNG a 1. Koef. Van’t Hoff nilai I I = jmlh rata-rata partikel yg terbentuk molekul 1 molekul terionisasi n ion permolekul na tak terdesosiasi I = n a + (1 – I ) I– 1 a= n– 1 1 -a dr 1


KESETIMBANGAN KIMIA q Reaksi Kimia : 1. Reversible kesetimbangan dinamis • Jml molekul (ion) dr tiap zat yg terurai = jml yg terbentuk dlm satuan waktu Mis. N 2 + 3 H 2 2 NH 3 2. Irreversible • Hanya produk reaksi Mis. HCl + Na. OH Na. Cl + Ag. NO 3 2 NH 3 N 2 + 3 H 2 Kimia kuantitatif Na. Cl + H 2 O Na. NO 3 + Ag. Cl

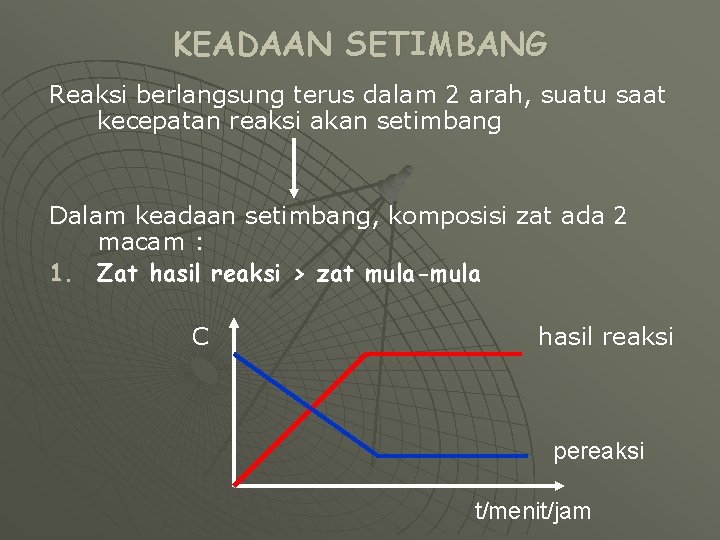
KEADAAN SETIMBANG Reaksi berlangsung terus dalam 2 arah, suatu saat kecepatan reaksi akan setimbang Dalam keadaan setimbang, komposisi zat ada 2 macam : 1. Zat hasil reaksi > zat mula-mula C hasil reaksi pereaksi t/menit/jam

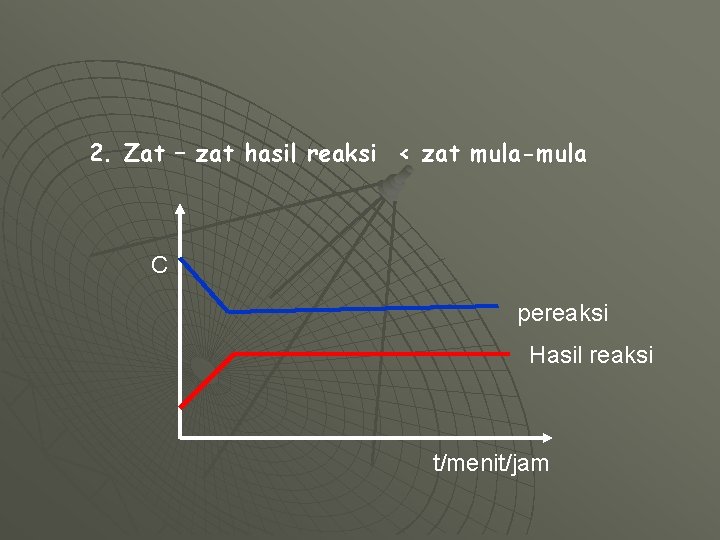
2. Zat – zat hasil reaksi < zat mula-mula C pereaksi Hasil reaksi t/menit/jam

KESETIMBANGAN KIMIA Hukum Kegiatan Massa Gueldberg dan Waage (1867) *Bahwa kecepatan suatu reaksi kimia pada suhu konstan adalah sebanding dng hasil kali konsentrasi zat-zat yang bereaksi m. A + n. B p. C + q. D [ C ] p [ D ]q K = --------[ A ] m [ B ]n

HUKUM AKSI MASSA Suatu reaksi kesetimbangan dapat digeser ke arah yang diinginkan Cara : 1. Mengubah Konsentrasi A+B C C K= -----[A] [B] Misal : * ingin menaikkan [C] yakni reaksi ke kanan, maka : dengan menambah [ A ] atau [ B ] * ingin menurunkan [C] yakni reaksi ke kiri, maka : dengan mengurangi [ A ] atau [ B ]

u Maka pengubahan konsentarasi zat akan terjadi pergeseran kesetimbangan. mempertahankan harga K

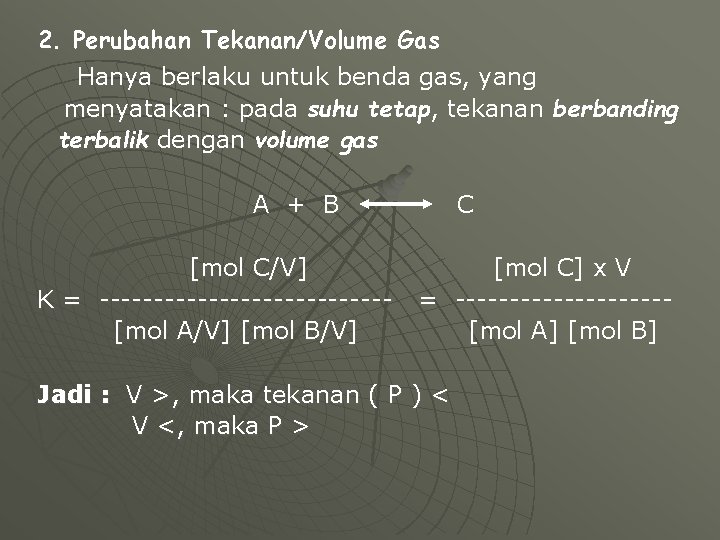
2. Perubahan Tekanan/Volume Gas Hanya berlaku untuk benda gas, yang menyatakan : pada suhu tetap, tekanan berbanding terbalik dengan volume gas A + B [mol C/V] K = -------------[mol A/V] [mol B/V] C [mol C] x V = ----------[mol A] [mol B] Jadi : V >, maka tekanan ( P ) < V <, maka P >

V = m. RT / PM x l Dimana : R = 0, 082 l K-1 mol-1 M= ( g/mol ) m= (g) T = ( o. K ) P = ( atm )

Contoh : dalam analisis kualitatif Reaksi : As. O 4 -3 + 2 I- + 2 H+ As. O 3 -3 + I 2 + H 2 O [ As. O 3 -3 ] x [ I 2 ] x [ H 2 O ] K = ------------------[ As. O 4 -3 ] x [ I- ]2 x [ H+ ]2 Jika ingin produksi As. O-3 , berlebihan maka : a. [ H+ ] dinaikkan b. [ I- ] dinaikkan c. [ I 2 ] dikurangi

Jika reaksi ingin bergeser ke kiri, maka : a. Menambah I 2 b. Memisakan H+ dg buffer c. I- diendapkan dg Pb / timbal Kesimpulan : u Menambah pereaksi berlebihan § Pengendapan, ekstrasi atau penguapan Menjaga harga K tetap

KECEPATAN REAKSI u u u Reaksi kimia berlangsung dengan kecepatan yang berbeda : 1. Reaksi cepat yaitu melibatkan reaksi netralisasi, ( reaksi ion – ion ) 2. Reaksi lambat : melibatkan reaksi molekuler. Jadi kec. reaksi perubahan konsentrasi pereaksi atau hasil reaksi per satuan waktu.
![CARA MENGUKUR KECEPATAN REAKSI C B A t u Diukur dengan Pertambahan CARA MENGUKUR KECEPATAN REAKSI C [B] [A] t u Diukur dengan : Pertambahan [](https://slidetodoc.com/presentation_image_h2/5d651f710137db84101292c5e05357f9/image-27.jpg)
CARA MENGUKUR KECEPATAN REAKSI C [B] [A] t u Diukur dengan : Pertambahan [ B ] per satuan waktu Pengurangan [ A ] per satuan waktu + [B] V = -------- t , Θ [A] V = ---------- t

TAHAP-TAHAP KECEPATAN REAKSI u u u u 1. 2. 3. Ada tumbukan antar atom Dapat cepat atau lambat Satu atau lebih tahapan reaksinya 1. 2. 3. 4. FAKTOR YG MEMPENGARUHI KEC. REAKSI Luas permukaan zat Konsentrasi reaksi Suhu reaksi katalisator mempercepat reaksi tapi tidak ikut dlm reaksi tersebut.

Hub. Konsentrasi dng kec. reaksi Jika ( pereaksi ) dinaikkan 2 kali dari konsentrasi semula, reaksi 2 kali lebih cepat [ zat ]2 , [ zat ]3 Bilangan pangkat menyatakan hubungan konsentrasi zat dengan kecepatan reaksi dinamakan orde reaksi Mis. : A + B hasil reaksi u maka V ditentukan oleh [ A ] , [ B ] V = k [ A ] m [ B ]n m + n = orde reaksi total

Katalisator u AC ( lambat ) Misal : A + C ditambah katalisator : B A + B AB ( cepat ) AB + C AC + B ( cepat ) ---------------------------A + B + C AC + B ( cepat ) B A +C AC Katalisator B tetap ada Σ tetap

Hal yang perlu diperhatikan : u u Hanya mempercepat reaksi tidak membuat reaksi Zat yg kerjanya >< katalisator inhibitor / anti katalisator Katalis yg terlibat dalam reaksi sifatnya tetap ( stoikiometri ) Hasil suatu reaksi dimana memiliki sifat sebagai katalis auto katalis ( Hg , Zn )

 Analisis kualitatif senyawa obat
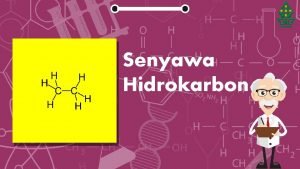
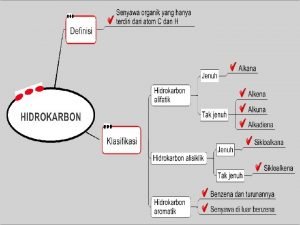
Analisis kualitatif senyawa obat Perbedaan senyawa hidrokarbon dan senyawa karbon
Perbedaan senyawa hidrokarbon dan senyawa karbon Turunan alkana kelas 12
Turunan alkana kelas 12 Tata nama senyawa kimia
Tata nama senyawa kimia Pengertian senyawa karbon
Pengertian senyawa karbon Apa yang dimaksud dengan senyawa hidrokarbon
Apa yang dimaksud dengan senyawa hidrokarbon Apa perbedaan unsur dan senyawa
Apa perbedaan unsur dan senyawa Apa yang dimaksud dengan senyawa hidrokarbon? *
Apa yang dimaksud dengan senyawa hidrokarbon? * Contoh ion kompleks
Contoh ion kompleks Penggunaan fenol
Penggunaan fenol Perhatikan gambar pemisahan campuran berikut
Perhatikan gambar pemisahan campuran berikut Kesalahan analitik
Kesalahan analitik Pemeriaan
Pemeriaan Bahan kimia dalam dadah
Bahan kimia dalam dadah Apa itu bahaya kimia
Apa itu bahaya kimia Contoh analisis kualitatif
Contoh analisis kualitatif Contoh analisis topik
Contoh analisis topik Risk grading matrix keselamatan pasien
Risk grading matrix keselamatan pasien 1/2-3/10
1/2-3/10 Contoh analisis risiko kualitatif dan kuantitatif
Contoh analisis risiko kualitatif dan kuantitatif Contoh analisis isi kualitatif
Contoh analisis isi kualitatif Contoh analisis domain dan taksonomi
Contoh analisis domain dan taksonomi Pengolahan dan analisis data kualitatif
Pengolahan dan analisis data kualitatif Pengolahan dan analisis data kualitatif
Pengolahan dan analisis data kualitatif Teknik analisis data kualitatif dan kuantitatif
Teknik analisis data kualitatif dan kuantitatif Bedanya sampel dan populasi
Bedanya sampel dan populasi Pendekatan kuantitatif dan kualitatif
Pendekatan kuantitatif dan kualitatif Ruang lingkup penelitian kuantitatif
Ruang lingkup penelitian kuantitatif Apa itu metode penelitian kualitatif
Apa itu metode penelitian kualitatif Sifat sifat unsur dan senyawa periode 3
Sifat sifat unsur dan senyawa periode 3 Optis aktif adalah
Optis aktif adalah Atom senyawa
Atom senyawa Senyawa amfibolik adalah
Senyawa amfibolik adalah