Idea 10 elettrochimica Pile a concentrazione Per laltra




























































- Slides: 62

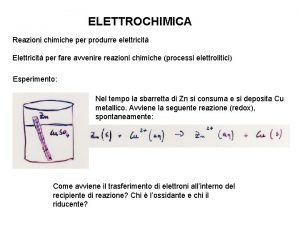
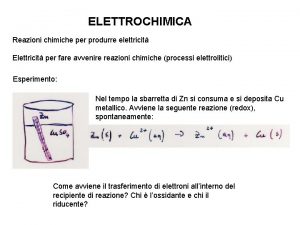
Idea 10 elettrochimica












Pile a concentrazione






Per l’altra semireazione


elettrolisi

Forza controelettromotrice

Forza controelettromotrice

sovratensione

• Gli ioni H+, sotto forma di idrossonio (H 3 O+), sia provenienti dalla dissociazione dell'acqua che da quella di un acido, si riducono più facilmente degli ioni dei metalli che precedono l'idrogeno nella scala dei potenziali di riduzione; raggiungendo il catodo captano elettroni (riduzione), passano allo stato atomico e quindi a idrogeno molecolare. • Gli ioni dei metalli che seguono l'idrogeno nella scala dei potenziali di riduzione si riducono più facilmente di esso, raggiungendo il catodo captano elettroni (riduzione), diventano atomi neutri e si depositano sul catodo in forma di metallo. • Gli ioni cloruro, Cl-, se la soluzione è concentrata, si ossidano più facilmente degli ioni ossidrilici, raggiungono l'anodo, cedono elettroni (ossidazione) e si ha quindi sviluppo di cloro gassoso. • Gli anioni degli ossiacidi e gli ioni fluoruro si ossidano meno facilmente degli ioni ossidrilici che, reagendo a due, danno acqua e sviluppano ossigeno gassoso.

Elettrolisi del Na. Cl fuso

Elettrolisi del Na. Cl fuso




M è la massa totale depositata sul catodo; m è la massa molare della sostanza depositata; q è la carica elettrica totale associata ai portatori di carica che attraversano la soluzione; Z è la valenza degli ioni della sostanza (cariche trasferite per ione); F è la costante di Faraday (pari a 96, 485 k. C/mol).














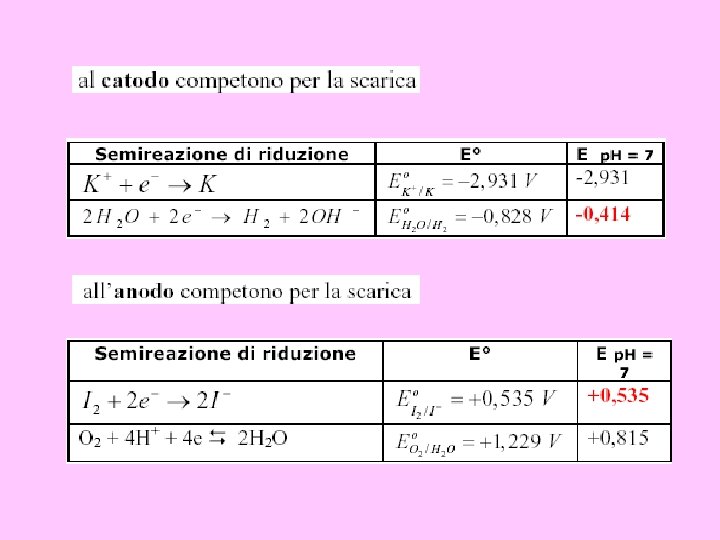
Competizione tra ioni










Elettrolisi in sol acquosa di Ag. Cl • Al catodo • 2 H+ + 2 e- →H 2 • 2 H 2 O + 2 e- → H 2 +2 OH • Ag++e- →Ag E° = 0 E° = - 0, 8277 E° = +0, 80 • Risultato: formazione di argento solido al catodo

Elettrolisi in sol acquosa di Ag. Cl • 2 Cl- → Cl 2 + 2 e- E° = 1, 36 V • 2 Ag++2 e- → 2 Ag E° = +0, 80 V catodo anodo • ---------------------------- • 2 Ag+ + 2 e-+ 2 Cl- → 2 Ag + Cl 2 + 2 e-

Elettrolisi del K 2 SO 4 Ho una soluzione di 100 g con 10% in peso di K 2 SO 4, faccio passare 107. 200 coulomb, come varia la percentuale in peso alla fine?

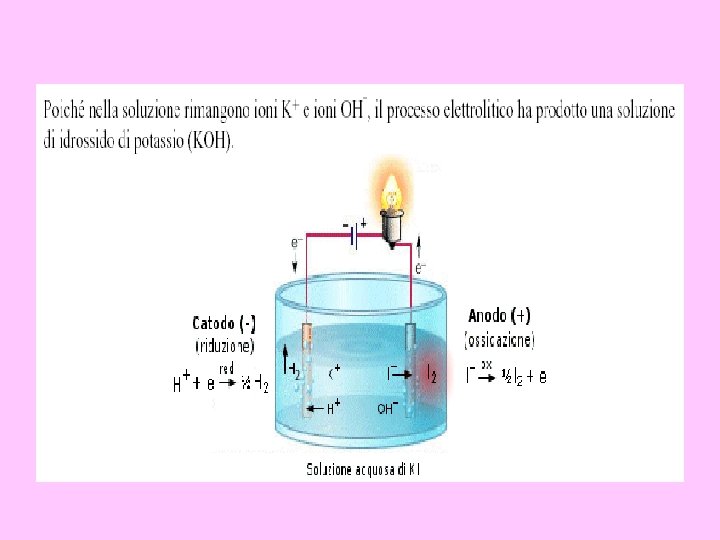
• Al catodo (polo negativo, polo a cui avviene la riduzione) possono avvenire le seguenti reazioni. . . 2 H 2 O + 2 e- → H 2 + 2 OHK+ + e - → K E° = -0, 83 V E° = -2, 93 V • Al catodo avviene la riduzione della specie con potenziale di riduzione più elevato, rappresentato in questo caso dalla riduzione dell'idrogeno dell'acqua ad idrogeno molecolare.

• All'anodo (polo positivo, polo a cui avvengono le ossidazioni) possono avvenire le seguenti reazioni. . . 2 H 2 O → O 2 + 4 H+ + 4 e. SO 4 -² → S 2 O 8 -² + 2 e- E° = +1. 23 V E° = +2. 01 V All'anodo avviene l'ossidazione della specie con potenziale di riduzione più piccolo, rappresentato dall'ossidazione dell'ossigeno dell'acqua a ossigeno molecolare.

• In pratica, l'esperimento in questione è semplicemente l'elettrolisi dell'acqua. • Il ricorso a solfato di potassio serve solo per aumentare la conducibilità della soluzione: siccome l'acqua pura è molto poco dissociata, è necessario ricorrere ad un elettrolita per aumentare la conducibilità della soluzione. La reazione che si realizza sarà quindi data dalla due semireazioni. . . • 2 H 2 O → O 2 + 4 H+ + 4 e • 4 H 2 O + 4 e- → 2 H 2 + 4 OH- • ----------------------------- • 4 H 2 O + 4 e- +2 H 2 O → O 2 + 4 H+ + 4 e-+2 H 2 + 4 OH-

M è la massa totale depositata sul catodo; m è la massa molare della sostanza depositata; q è la carica elettrica totale associata ai portatori di carica che attraversano la soluzione; Z è la valenza degli ioni della sostanza (cariche trasferite per ione); F è la costante di Faraday (pari a 96, 485 k. C/mol). • Dopo il passaggio di 107. 200 C, vi sarà stata l'elettrolisi di una massa di acqua pari a. . . m = A·t · PM / (n ·F) m = 107200 C · 18 g/mol / (4 mol · 96500 C) = 5 g Pertanto, se la composizione della soluzione di partenza era. . . 10 g K 2 SO 4 90 g H 2 O • dopo elettrolisi, in soluzione saranno presenti. . . 10 g K 2 SO 4 85 g H 2 O • La composizione della soluzione finale sarà. . . (10 / 95) · 100 = 10. 5 % in peso di K 2 SO 4

 Esercizi pile a concentrazione
Esercizi pile a concentrazione Molarità
Molarità Concentrazione percentuale massa su massa
Concentrazione percentuale massa su massa M in chimica
M in chimica Difficoltà di concentrazione adulti
Difficoltà di concentrazione adulti Formule inverse abbassamento crioscopico
Formule inverse abbassamento crioscopico Preparazione di soluzioni a concentrazione nota
Preparazione di soluzioni a concentrazione nota Legge di teorell
Legge di teorell Gradiente di concentrazione
Gradiente di concentrazione Formule inverse concentrazione delle soluzioni
Formule inverse concentrazione delle soluzioni Capitolo 16 le reazioni chimiche soluzioni
Capitolo 16 le reazioni chimiche soluzioni Dalle soluzioni all'elettrochimica soluzioni capitolo 19
Dalle soluzioni all'elettrochimica soluzioni capitolo 19 Valitutti soluzioni capitolo 18
Valitutti soluzioni capitolo 18 Cv voltammetry
Cv voltammetry Topic sentence and supporting sentence examples
Topic sentence and supporting sentence examples Exegetical idea vs homiletical idea
Exegetical idea vs homiletical idea It reveals the main or central idea of the paragraph
It reveals the main or central idea of the paragraph Main idea examples
Main idea examples Supporting ideas
Supporting ideas Tetapi penanda wacana
Tetapi penanda wacana What's the big idea
What's the big idea Pile
Pile What is negative skin friction
What is negative skin friction Luke drops a pile of roof shingles
Luke drops a pile of roof shingles Tension d'une pile plate
Tension d'une pile plate Long pile and alternate shovel method
Long pile and alternate shovel method Triangular spoil bank
Triangular spoil bank Pile worms teeth
Pile worms teeth Fabric testing standards
Fabric testing standards Pile loading test
Pile loading test Surge pile
Surge pile Carla bruni je suis ton pile
Carla bruni je suis ton pile Pile n
Pile n Which russian leader does snowball most resemble?
Which russian leader does snowball most resemble? Langage scheme
Langage scheme Pile tcp ip
Pile tcp ip Atlas pile driving
Atlas pile driving Nadia fomin
Nadia fomin Pythagoras pile up
Pythagoras pile up Pile sorts
Pile sorts Kinematic equations examples
Kinematic equations examples After hemorrhoid surgery pictures
After hemorrhoid surgery pictures Lisce zbirna imenica
Lisce zbirna imenica Koden test bored pile
Koden test bored pile Irc 2911
Irc 2911 Friction cum bearing pile
Friction cum bearing pile Two squirrels race up a tree to reach a hidden pile of nuts
Two squirrels race up a tree to reach a hidden pile of nuts Pile simple
Pile simple American piledriving
American piledriving Pile saline schéma
Pile saline schéma Pile osi
Pile osi Raft foundation vs pad foundation
Raft foundation vs pad foundation Pile foundation in black cotton soil
Pile foundation in black cotton soil How to play steal the pile card game
How to play steal the pile card game Cumulus mean
Cumulus mean Pile electrice utilizate in practica
Pile electrice utilizate in practica Achan pile of rocks
Achan pile of rocks Well foundation
Well foundation Luke autbeloe drops a pile of roof shingles
Luke autbeloe drops a pile of roof shingles A pile of rusty iron filings homogeneous or heterogeneous
A pile of rusty iron filings homogeneous or heterogeneous Soldier pile adalah
Soldier pile adalah 1 hour 1 minute 1 second
1 hour 1 minute 1 second Longum iter est per praecepta breve per exempla
Longum iter est per praecepta breve per exempla