Elettrochimica Elettrochimica Lelettrochimica studia limpiego di energia elettrica












- Slides: 27

Elettrochimica

Elettrochimica L’elettrochimica studia l’impiego di energia elettrica per promuovere reazioni non spontanee e l’impiego di reazioni spontanee per produrre energia elettrica, entrambi i processi coinvolgono reazioni redox. ENERGIA CHIMICA ENERGIA ELETTRICA I sistemi in cui tale conversione si realizza sono indicati come CELLE ELETTROCHIMICHE 1. Celle elettrolitiche Processi ossidoriduttivi NON SPONTANEI - trasformazione di energia elettrica in energia Chimica 2. Celle galvaniche/voltaiche o pile Processi ossidoriduttivi SPONTANEI - trasformazione di energia chimica in energia elettrica

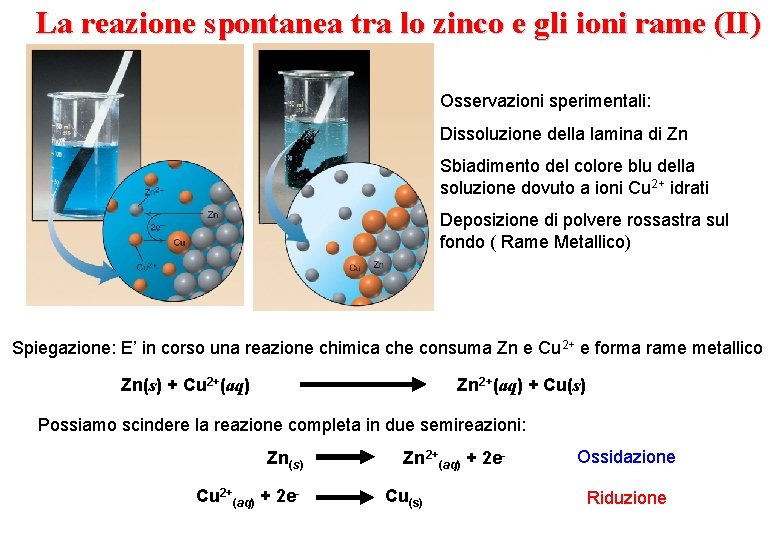
La reazione spontanea tra lo zinco e gli ioni rame (II) Osservazioni sperimentali: Dissoluzione della lamina di Zn Sbiadimento del colore blu della soluzione dovuto a ioni Cu 2+ idrati Deposizione di polvere rossastra sul fondo ( Rame Metallico) Spiegazione: E’ in corso una reazione chimica che consuma Zn e Cu 2+ e forma rame metallico Zn(s) + Cu 2+(aq) Zn 2+(aq) + Cu(s) Possiamo scindere la reazione completa in due semireazioni: Zn(s) Cu 2+(aq) + 2 e- Zn 2+(aq) + 2 e. Cu(s) Ossidazione Riduzione

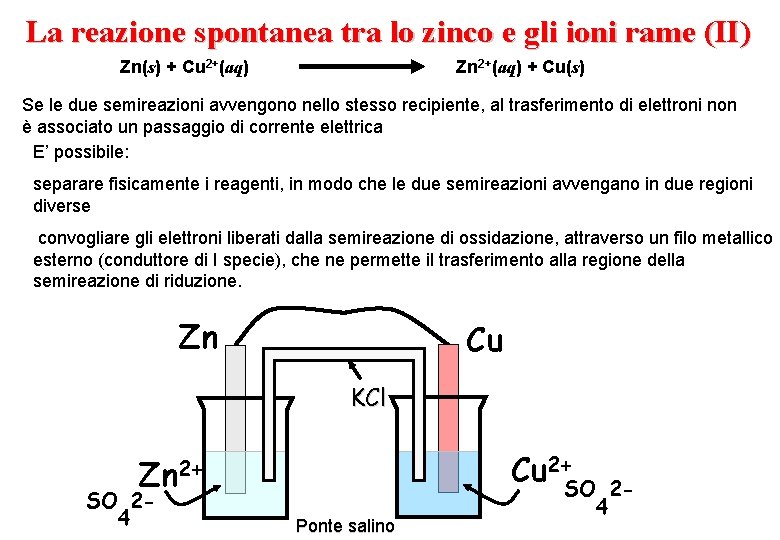
La reazione spontanea tra lo zinco e gli ioni rame (II) Zn(s) + Cu 2+(aq) Zn 2+(aq) + Cu(s) Se le due semireazioni avvengono nello stesso recipiente, al trasferimento di elettroni non è associato un passaggio di corrente elettrica E’ possibile: separare fisicamente i reagenti, in modo che le due semireazioni avvengano in due regioni diverse convogliare gli elettroni liberati dalla semireazione di ossidazione, attraverso un filo metallico esterno (conduttore di I specie), che ne permette il trasferimento alla regione della semireazione di riduzione. Zn Cu KCl Zn 2+ SO 24 Cu 2+SO Ponte salino 4 2 -

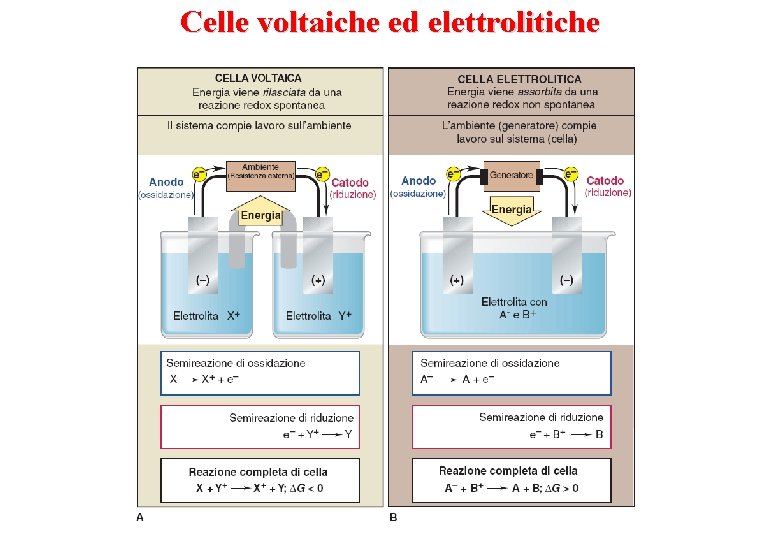
Celle voltaiche ed elettrolitiche

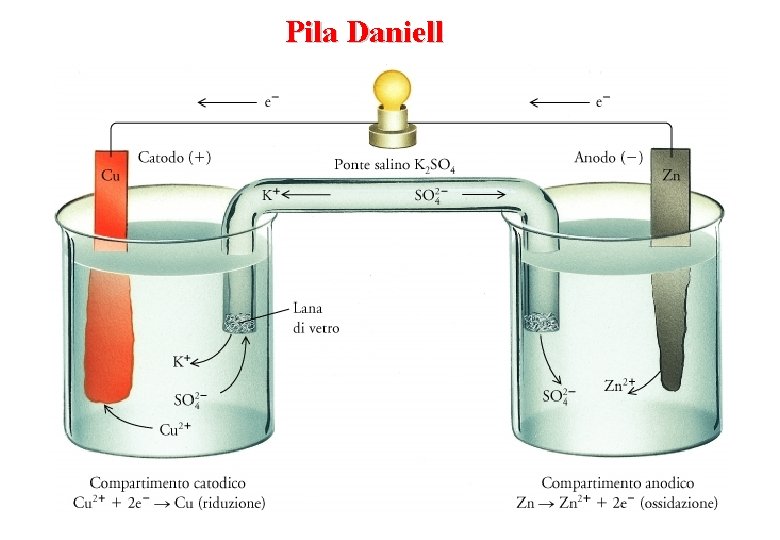
Pila Daniell

Semicelle I due recipienti in cui avvengono le reazioni di ossidazione e di riduzione sono detti semicelle. Una semicella o semielemento è composta da una soluzione (generalmente acquosa) e da un elettrodo di materiale conduttore. A volte, come nella pila Daniell, l'elettrodo partecipa alla reazione, altre volte la specie ossidata e ridotta sono entrambe in soluzione, e l'elettrodo è di materiale inerte, spesso platino (Pt) o grafite. Rappresentazione schematica di un semielemento Un semielemento può essere rappresentato con i simboli chimici dell'elettrodo e delle specie in soluzione, separate da una linea verticale. I semielementi della Pila Daniell: Zn | Zn 2+ e Cu 2+ | Cu Rappresentazione schematica di una pila Una pila viene schematizzata indicando prima il semielemento anodico e poi quello catodico, separati dal simbolo || che rappresenta il ponte salino Pila Daniell Zn(s) | Zn 2+(aq) || Cu 2+(aq) | Cu(s)

Anodo e Catodo Anodo l’elettrodo al quale si ha l’ossidazione Catodo l’elettrodo al quale si ha la riduzione In una cella gli elettroni fluiscono dall’anodo al catodo per cui l’anodo ha segno negativo e il catodo ha segno positivo Zn(s) Zn 2+(aq) + 2 e- ossidazione anodo negativo Cu 2+(aq) + 2 e- Cu(s) riduzione catodo positivo Zn(s) + Cu 2+(aq) Zn 2+(aq) + Cu(s) reazione della cella

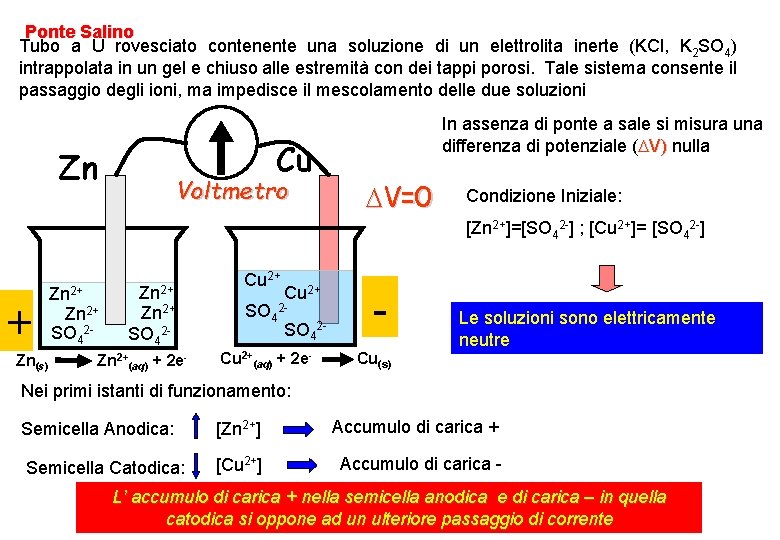
Ponte Salino Tubo a U rovesciato contenente una soluzione di un elettrolita inerte (KCl, K 2 SO 4) intrappolata in un gel e chiuso alle estremità con dei tappi porosi. Tale sistema consente il passaggio degli ioni, ma impedisce il mescolamento delle due soluzioni Cu Zn Voltmetro In assenza di ponte a sale si misura una differenza di potenziale ( V) nulla V=0 Condizione Iniziale: [Zn 2+]=[SO 42 -] ; [Cu 2+]= [SO 42 -] + Zn(s) Zn 2+ SO 42 - Zn 2+(aq) + 2 e- Cu 2+ SO 42 Cu 2+(aq) + 2 e- - Le soluzioni sono elettricamente neutre Cu(s) Nei primi istanti di funzionamento: Semicella Anodica: [Zn 2+] Accumulo di carica + Semicella Catodica: [Cu 2+] Accumulo di carica - L’ accumulo di carica + nella semicella anodica e di carica – in quella catodica si oppone ad un ulteriore passaggio di corrente

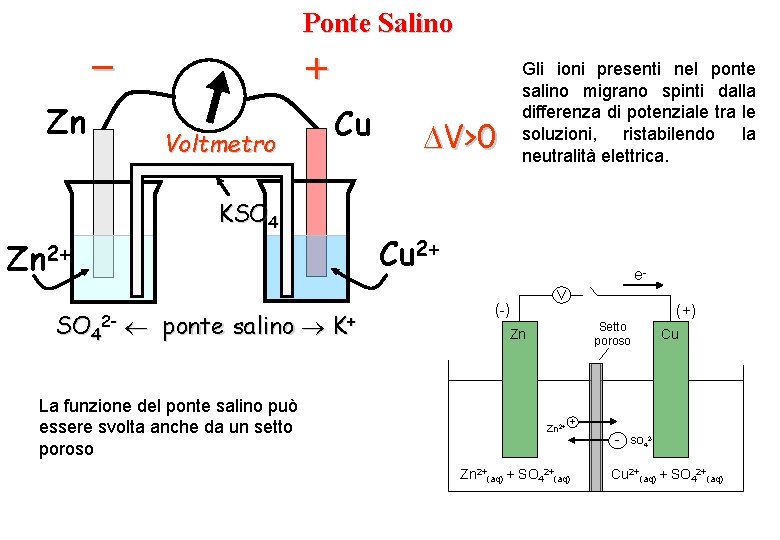
Ponte Salino – Zn + Voltmetro Cu KSO 4 ponte salino La funzione del ponte salino può essere svolta anche da un setto poroso V>0 Cu 2+ Zn 2+ SO 42 - Gli ioni presenti nel ponte salino migrano spinti dalla differenza di potenziale tra le soluzioni, ristabilendo la neutralità elettrica. K+ e(-) V (+) Setto poroso Zn Zn 2+ Cu + Zn 2+(aq) + SO 42+(aq) - SO 42 - Cu 2+(aq) + SO 42+(aq)

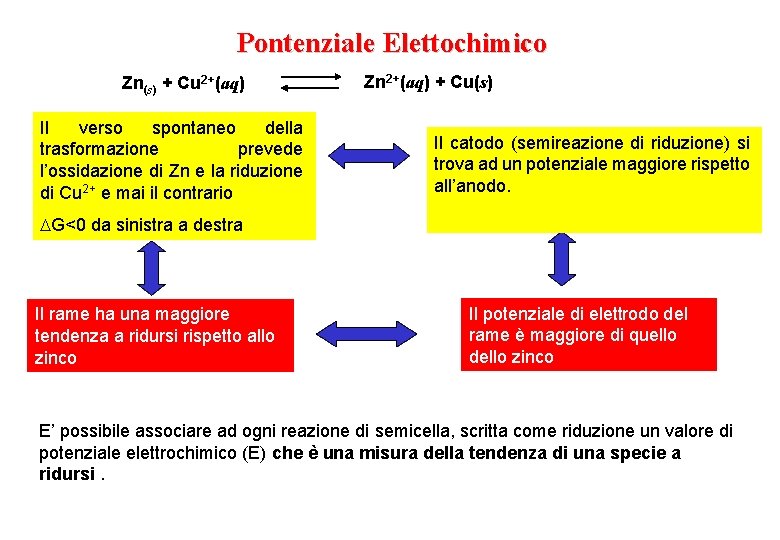
Pontenziale Elettochimico Zn(s) + Cu 2+(aq) Il verso spontaneo della trasformazione prevede l’ossidazione di Zn e la riduzione di Cu 2+ e mai il contrario Zn 2+(aq) + Cu(s) Il catodo (semireazione di riduzione) si trova ad un potenziale maggiore rispetto all’anodo. G<0 da sinistra a destra Il rame ha una maggiore tendenza a ridursi rispetto allo zinco Il potenziale di elettrodo del rame è maggiore di quello dello zinco E’ possibile associare ad ogni reazione di semicella, scritta come riduzione un valore di potenziale elettrochimico (E) che è una misura della tendenza di una specie a ridursi.

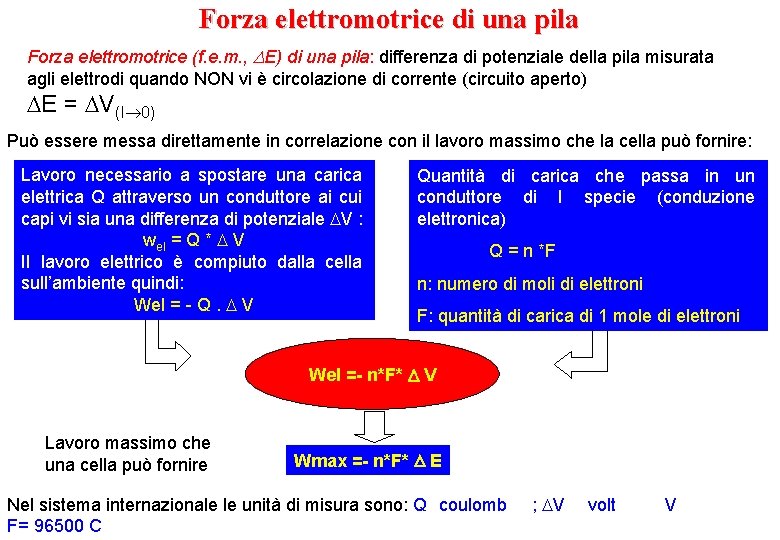
Forza elettromotrice di una pila Forza elettromotrice (f. e. m. , E) di una pila: differenza di potenziale della pila misurata agli elettrodi quando NON vi è circolazione di corrente (circuito aperto) E = V(I 0) Può essere messa direttamente in correlazione con il lavoro massimo che la cella può fornire: Lavoro necessario a spostare una carica elettrica Q attraverso un conduttore ai cui capi vi sia una differenza di potenziale V : wel = Q * V Il lavoro elettrico è compiuto dalla cella sull’ambiente quindi: Wel = - Q. V Quantità di carica che passa in un conduttore di I specie (conduzione elettronica) Q = n *F n: numero di moli di elettroni F: quantità di carica di 1 mole di elettroni Wel =- n*F* V Lavoro massimo che una cella può fornire Wmax =- n*F* E Nel sistema internazionale le unità di misura sono: Q coulomb F= 96500 C ; V volt V

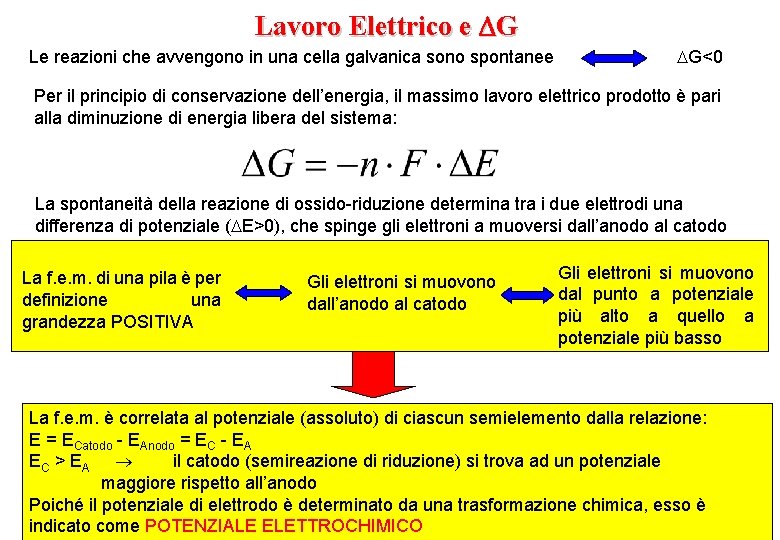
Lavoro Elettrico e G Le reazioni che avvengono in una cella galvanica sono spontanee G<0 Per il principio di conservazione dell’energia, il massimo lavoro elettrico prodotto è pari alla diminuzione di energia libera del sistema: La spontaneità della reazione di ossido-riduzione determina tra i due elettrodi una differenza di potenziale ( E>0), che spinge gli elettroni a muoversi dall’anodo al catodo La f. e. m. di una pila è per definizione una grandezza POSITIVA Gli elettroni si muovono dall’anodo al catodo Gli elettroni si muovono dal punto a potenziale più alto a quello a potenziale più basso La f. e. m. è correlata al potenziale (assoluto) di ciascun semielemento dalla relazione: E = ECatodo - EAnodo = EC - EA EC > EA il catodo (semireazione di riduzione) si trova ad un potenziale maggiore rispetto all’anodo Poiché il potenziale di elettrodo è determinato da una trasformazione chimica, esso è indicato come POTENZIALE ELETTROCHIMICO

f. e. m. standard di cella La f. e. m. di una cella voltaica è caratteristica per ogni data cella cioè per ogni data reazione di ossidoriduzione. Per ogni data cella voltaica la f. e. m. dipende da: -concentrazioni delle specie coinvolte nella reazione - temperatura. Per poter confrontare le fem di diverse celle in maniera univoca è necessario riferirsi a delle condizioni standard. CONDIZIONI STANDARD Concentrazione dei soluti pari a 1 M; Pressione parziale dei gas pari a 1 atm Temperatura di 25°C. f. e. m standard, E 0, di una cella voltaica: la fem della che opera in condizioni standard Esempio: Per la pila Daniell E 0 = 1, 10 V cioè se fatta operare con [Zn 2+]=[Cu 2+]=1 M genera una differenza di potenziale massimo di 1. 10 V.

Potenziali standard di elettrodo Il potenziale standard di un elettrodo E 0 è il potenziale di quell’elettrodo nelle condizioni standard (1 M per i soluti 1 atm per i gas e 25°C). Non è possibile misurare il potenziale di un singolo elettrodo ma solo la differenza di potenziale fra due elettrodi E’ possibile attribuire dei valori assoluti ai potenziali di elettrodo solo assegnando il valore zero ad un elettrodo di riferimento e misurando la differenza di potenziale che si crea fra questo elettrodo e tutti gli altri elettrodi che si vogliono caratterizzare. Per convenzione l’elettrodo di riferimento è l’elettrodo standard di idrogeno in cui la concentrazione degli ioni H+ è 1 M, la pressione parziale di H 2 è di 1 atm e la temperatura è 25°C

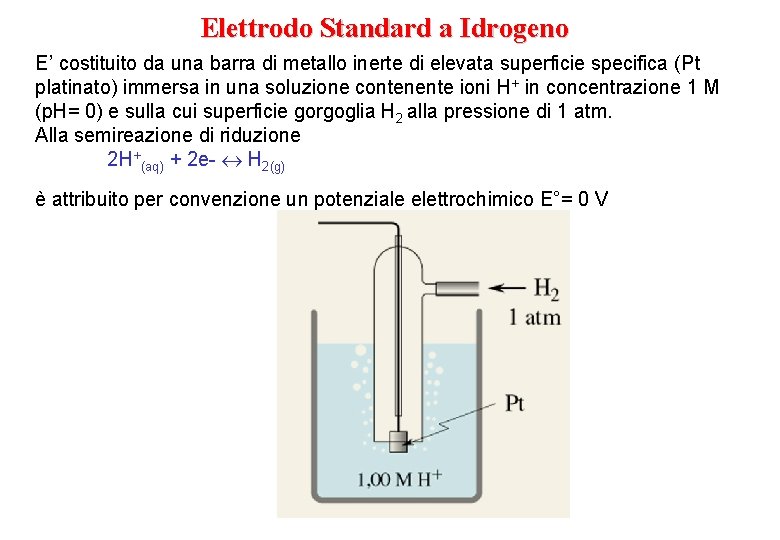
Elettrodo Standard a Idrogeno E’ costituito da una barra di metallo inerte di elevata superficie specifica (Pt platinato) immersa in una soluzione contenente ioni H+ in concentrazione 1 M (p. H= 0) e sulla cui superficie gorgoglia H 2 alla pressione di 1 atm. Alla semireazione di riduzione 2 H+(aq) + 2 e- H 2(g) è attribuito per convenzione un potenziale elettrochimico E°= 0 V

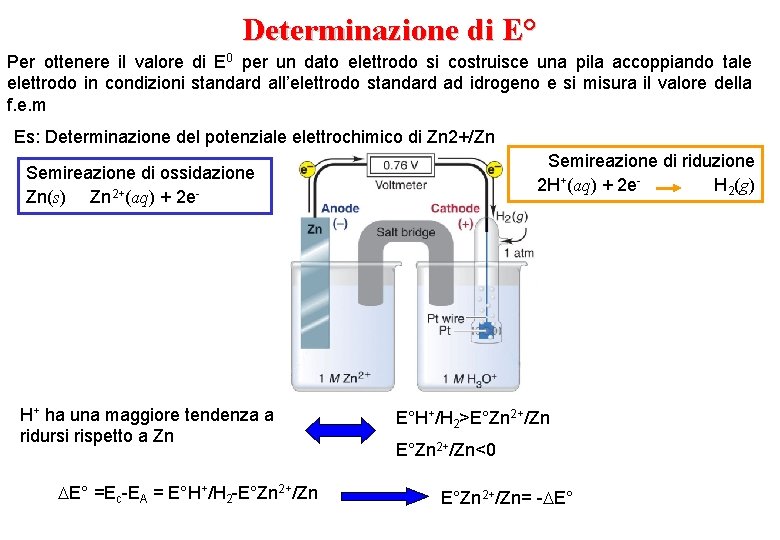
Determinazione di E° Per ottenere il valore di E 0 per un dato elettrodo si costruisce una pila accoppiando tale elettrodo in condizioni standard all’elettrodo standard ad idrogeno e si misura il valore della f. e. m Es: Determinazione del potenziale elettrochimico di Zn 2+/Zn Semireazione di riduzione 2 H+(aq) + 2 e. H 2(g) Semireazione di ossidazione Zn(s) Zn 2+(aq) + 2 e- H+ ha una maggiore tendenza a ridursi rispetto a Zn E° =Ec-EA = E°H+/H 2 -E°Zn 2+/Zn E°H+/H 2>E°Zn 2+/Zn<0 E°Zn 2+/Zn= - E°

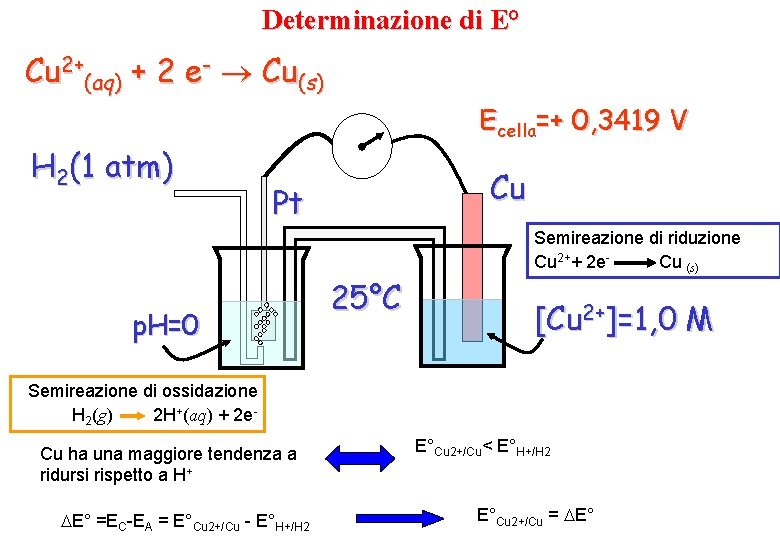
Determinazione di E° Cu 2+(aq) + 2 e- Cu(s) H 2(1 atm) Ecella=+ 0, 3419 V Cu Pt p. H=0 25°C Semireazione di riduzione Cu 2++ 2 e. Cu (s) [Cu 2+]=1, 0 M Semireazione di ossidazione H 2(g) 2 H+(aq) + 2 e. Cu ha una maggiore tendenza a ridursi rispetto a H+ E° =EC-EA = E°Cu 2+/Cu - E°H+/H 2 E°Cu 2+/Cu< E°H+/H 2 E°Cu 2+/Cu = E°

La serie elettrochimica dei potenziali standard Semireazione E° (V) F 2(g) + 2 e- 2 F- +2. 87 2 H+(aq) + 2 e- H 2(g) 0. 00 Sn 2+(aq) + 2 e- Ni(s) -0. 14 Ni 2+(aq) + 2 e- Ni(s) -0. 25 Co 2+(aq) + 2 e- Co(s) -0. 28 Pb. O 2(s) + SO 42 -(aq) + 4 H+ + 2 e- Pb. SO 4(s) + H 2 O +1. 69 2 HOCl(aq) + 2 H+(aq) + 2 e- Cl 2(g) + 2 H 20 Mn. O 4 -(aq) 8 H+(aq) + Pb. O 2(s) + 4 H+(aq) + + 5 e- 2 e- Mn 2+(aq) Pb 2+(aq) + 4 H 20 + 2 H 2 O Br. O 3 -(aq) + 6 H+(aq) + 6 e- Br-(aq) + 3 H 2 O Au 3+(aq) + Cl 2 (g) + 2 e- O 2(g) + 3 e- Au(s) 4 H+(aq) Cl+ (aq) 4 e- 2 H 2 O +1. 63 +1. 51 +1. 46 +1. 44 +1. 42 +1. 36 +1. 23 Pb. SO 4(s) + 2 e- Pb(s) + SO 42 -(aq) -0. 36 Cd 2+(aq) + 2 e- Cd(s) -0. 40 Fe 2+(aq) + 2 e- Fe(s) -0. 44 Cr 3+(aq) + 3 e- Cr(s) -0. 74 Br 2 (aq) + 2 e- 2 Br-(aq) +1. 07 Zn 2+(aq) + 2 e- Zn(s) -0. 83 NO 3 -(aq) + 4 H+(aq) + 3 e- NO(g) + 2 H 2 O +0. 96 2 H 2 O(aq) + 2 e- H 2(g) + 2 OH-(aq) -1. 66 Ag+(aq) + e- Ag(s) +0. 80 Mg 2+(aq) + 2 e- Mg(s) -2. 37 Fe 3+(aq) + e- Fe 2+(aq) +0. 77 Na+(aq) + e- Na(s) -2. 71 I 2(s) + 2 e- 2 I-(aq) +0. 54 Ca 2+(aq) + 2 e- Ca(s) -2. 76 Ni. O 2(aq) + 4 H+(aq) + 3 e- Ni(OH)2(s) + 2 OH-(aq) +0. 49 K+(aq) + e- K(s) -2. 92 Cu 2+(aq) + 2 e- Cu(s) +0. 34 Li+(aq) + e- Li(s) -3. 05 SO 42 -(aq) + 4 H+(aq) + 2 e- H 2 SO 3(aq) + H 2 O +0. 17

Equazione di Nernst b OSS 2 +n e- d RID 2 Faraday (F): quantità di carica corrispondente ad una mole di elettroni n: numero di moli di elettroni E° potenziale elettrochimico standard E: potenziale elettrochimico Convertendo i logaritimi naturali in decimali, sostituendo i valori di F e R e considerando T= 298 K: Esempio Cu 2+(aq) + 2 e- Cu N. B. Ponendo il segno positivo tra E° e il termine logaritmico, si inverte l’argomento del logaritmo

Equazione di Nernst Zn(s) + Cu 2+(aq) Zn 2+(aq) + Cu(s) Zn(s) Zn 2+(aq) + 2 e. Cu 2+(aq) + 2 e- Cu(s) Anodo (ossidazione) Catodo (riduzione) (T=25°C) f. e. m. della pila f. e. m. standard della pila

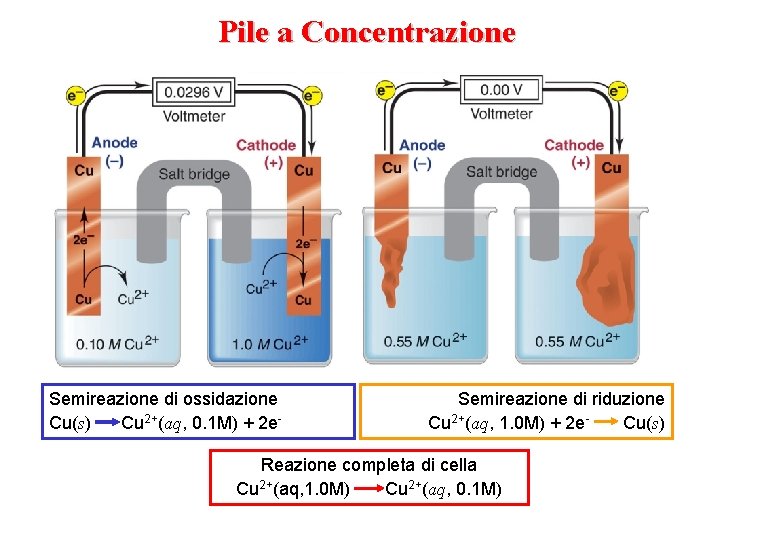
Pile a Concentrazione Semireazione di ossidazione Cu(s) Cu 2+(aq, 0. 1 M) + 2 e- Semireazione di riduzione Cu 2+(aq, 1. 0 M) + 2 e. Cu(s) Reazione completa di cella Cu 2+(aq, 1. 0 M) Cu 2+(aq, 0. 1 M)

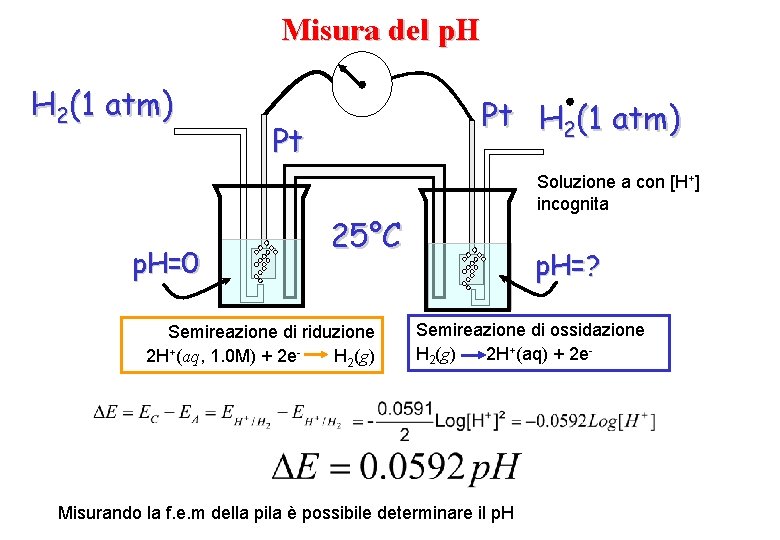
Misura del p. H H 2(1 atm) p. H=0 Pt H 2(1 atm) Pt Soluzione a con [H+] incognita 25°C Semireazione di riduzione 2 H+(aq, 1. 0 M) + 2 e. H 2(g) p. H=? Semireazione di ossidazione H 2(g) 2 H+(aq) + 2 e- Misurando la f. e. m della pila è possibile determinare il p. H

ELETTROLISI Una cella elettrolitica è una cella nella quale somministrando energia elettrica (compiendo lavoro elettrico) si fa avvenire una reazione chimica che altrimenti non avverrebbe in quanto non spontanea. Il processo che avviene in una cella elettrolitica è detto elettrolisi. L’elettrolisi è un processo molto utile per la preparazione di alcuni elementi fortemente riducenti difficilmente ottenibili per via chimica. Na+ + e- Na(s) E 0 Na+/Na=-2, 71 V Mg 2+ + 2 e- Mg(s) E 0 Mg 2+/Mg=-2, 36 V Al 3+ + 3 e- Al(s) E 0 Al 3+/Al=-1, 68 V

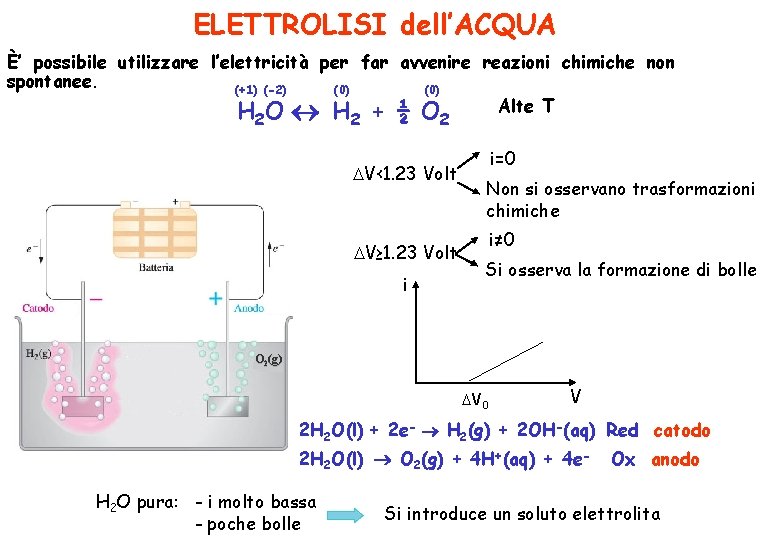
ELETTROLISI dell’ACQUA È’ possibile utilizzare l’elettricità per far avvenire reazioni chimiche non spontanee. (0) (+1) (-2) (0) Alte T H O H + ½ O 2 2 2 V‹ 1. 23 Volt V≥ 1. 23 Volt i i=0 Non si osservano trasformazioni chimiche i≠ 0 Si osserva la formazione di bolle O 2(g) V 0 V 2 H 2 O(l) + 2 e- H 2(g) + 2 OH-(aq) Red catodo 2 H 2 O(l) O 2(g) + 4 H+(aq) + 4 e. H 2 O pura: - i molto bassa - poche bolle Ox anodo Si introduce un soluto elettrolita

ELETTROLISI in soluzione acquosa Per valutare cosa succede agli elettrodi dobbiamo considerare tutte le possibili semireazioni di riduzione al catodo e tutte le possibili semireazioni di ossidazione all’anodo. Elettrolita: Cu. SO 4 Cu 2+ + SO 42 CATODO: si deposita Cu metallico avviene la riduzione di Cu 2+ a Cu Al catodo si riduce per prima la specie chimica che ha maggiore tendenza a farlo All’anodo si ossida per prima la specie che ha una minore tendenza a ridursi ossia con potenziale elettrochimico minore Le semireazioni catodiche avvengono secondo l’ordine di potenziale elettrochimico decrescente Le semireazioni anodiche avvengono secondo l’ordine di potenziale elettrochimico crescente Per avere al catodo la riduzione di H 2 O è necessario un catione con E‹ di quello della semireazione di riduzione dell’acqua; 2 H 2 O(l) + 2 e- H 2(g) + 2 OH-(aq) Red catodo Per avere all’anodo l’ossidazione di H 2 O è necessario un anione con E> di quello della semireazione: O 2(g) + 4 H+(aq) + 4 e- 2 H 2 O(l) Ox anodo

-CATODO: si osserva solo la riduzione delle specie col potenziale di riduzione maggiore -ANODO: si osserva solo l’ossidazione della specie col potenziale di ossidazione maggiore e equivalentemente col potenziale di riduzione minore
 Via castelgomberto 73 torino
Via castelgomberto 73 torino Potenziale elettrostatico
Potenziale elettrostatico Potenziale elettrico
Potenziale elettrico I combustibili mappa concettuale
I combustibili mappa concettuale Sos energia elettrica
Sos energia elettrica Il potenziale elettrico zanichelli
Il potenziale elettrico zanichelli Il potenziale elettrico
Il potenziale elettrico La deduzione del campo elettrico dal potenziale
La deduzione del campo elettrico dal potenziale Energia campo elettrico
Energia campo elettrico Teorema variatiei energiei mecanice
Teorema variatiei energiei mecanice Como transformar energia potencial em energia cinética
Como transformar energia potencial em energia cinética Energia cinetica primaria
Energia cinetica primaria Isotta fraschini elettrica
Isotta fraschini elettrica Analogia elettrica idraulica
Analogia elettrica idraulica Elettroforo di volta zanichelli
Elettroforo di volta zanichelli Resistenza elettrica corpo umano
Resistenza elettrica corpo umano Superconduttori zanichelli
Superconduttori zanichelli Tartaruga elettrica legnano
Tartaruga elettrica legnano Il team erfahrungen
Il team erfahrungen Elementi di elettrotecnica
Elementi di elettrotecnica Effetto joule zanichelli
Effetto joule zanichelli Ingegneria energetica bari
Ingegneria energetica bari Una particella carica negativamente di massa
Una particella carica negativamente di massa Turbinenhalle behrens
Turbinenhalle behrens Energia definizione
Energia definizione Noi siamo corrente elettrica
Noi siamo corrente elettrica Chimica più soluzioni capitolo 18
Chimica più soluzioni capitolo 18 Elettrochimica
Elettrochimica