G Valitutti A Tifi A Gentile Le idee












![2. La ionizzazione dell’acqua • Se [H 3 O+] > 10– 7 M l’ambiente 2. La ionizzazione dell’acqua • Se [H 3 O+] > 10– 7 M l’ambiente](https://slidetodoc.com/presentation_image_h/e7040007e5576ca974f28cef4d9608df/image-15.jpg)












![infatti In cui [H 3 O+] = [A-] per cui posso scrivere [H 3 infatti In cui [H 3 O+] = [A-] per cui posso scrivere [H 3](https://slidetodoc.com/presentation_image_h/e7040007e5576ca974f28cef4d9608df/image-29.jpg)



























- Slides: 58

G. Valitutti A. Tifi A. Gentile Le idee della chimica Seconda edizione Copyright © 2009 Zanichelli editore

Capitolo 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell’acqua 3. Il p. H 4. La forza degli acidi e delle basi 5. Come calcolare il p. H di soluzioni acide e basiche 6. Come misurare il p. H 7. La neutralizzazione: una reazione tra acidi e basi 8. La titolazione acido-base 9. L’idrolisi: anche i sali cambiano il p. H dell’acqua 10. Le soluzioni tampone Copyright © 2009 Zanichelli editore Le idee della chimica

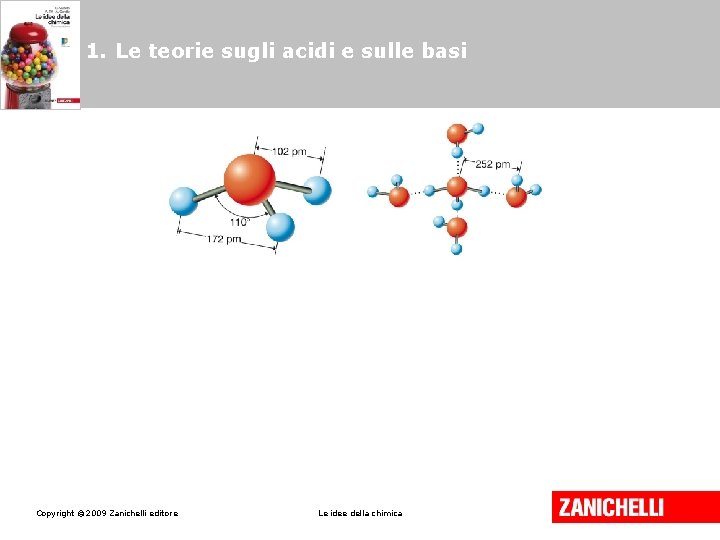
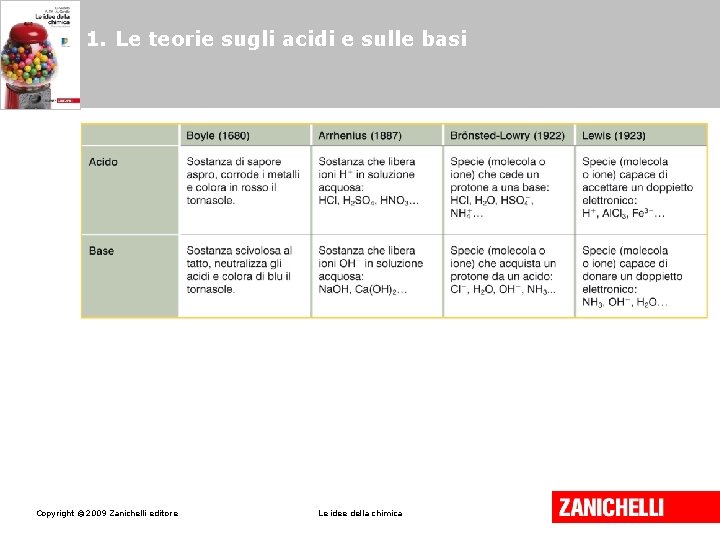
1. Le teorie sugli acidi e sulle basi Acidi e basi secondo Arrhenius Gli acidi sono sostanze che, sciolte in acqua, liberano ioni H+ (H 3 O+) Le basi sono sostanze che, sciolte in acqua liberano ioni OH-. HCl(g) H+(aq) + Cl-(aq) Na. OH Copyright © 2009 Zanichelli editore (s) Na+ (aq) + Cl-(aq) Le idee della chimica

1. Le teorie sugli acidi e sulle basi Copyright © 2009 Zanichelli editore Le idee della chimica

1. Le teorie sugli acidi e sulle basi Gli acidi si distinguono in: • acidi monoprotici se sono in grado di liberare un solo H+; • acidi poliprotici se liberano più ioni H+. Copyright © 2009 Zanichelli editore Le idee della chimica

1. Le teorie sugli acidi e sulle basi Il limite della teoria di Arrhenius risiede nel fatto che è applicabile solo alle soluzioni acquose. Copyright © 2009 Zanichelli editore Le idee della chimica

1. Le teorie sugli acidi e sulle basi Acidi e basi secondo Brönsted e Lowry Un acido è una qualsiasi molecola o ione in grado di donare protoni. Una base è una qualsiasi molecola o ione che può di accettare un protone. Copyright © 2009 Zanichelli editore Le idee della chimica

1. Le teorie sugli acidi e sulle basi La teoria di Brönsted e Lowry amplia la classificazione degli acidi e delle basi, poiché non è indispensabile la presenza di acqua. Copyright © 2009 Zanichelli editore Le idee della chimica

1. Le teorie sugli acidi e sulle basi Sono anfiprotiche le sostanze che, come l’acqua, possono sia accettare che donare protoni. Copyright © 2009 Zanichelli editore Le idee della chimica

1. Le teorie sugli acidi e sulle basi Acidi e basi secondo Lewis Un acido è una specie (molecola o ione) che può accettare una coppia di elettroni. Una base è una specie (molecola o ione) capace di donare una coppia di elettroni liberi da legami. Copyright © 2009 Zanichelli editore Le idee della chimica

1. Le teorie sugli acidi e sulle basi Copyright © 2009 Zanichelli editore Le idee della chimica

2. La ionizzazione dell’acqua La reazione di ionizzazione dell’acqua o autoprotolisi, è una reazione acido-base in cui la formazione degli ioni avviene per scambio di un protone fra due molecole d’acqua. Copyright © 2009 Zanichelli editore Le idee della chimica

2. La ionizzazione dell’acqua Poiché H 2 O(l) si può considerare un liquido puro, la costante di equilibrio (Kw) alla temperatura di 25 °C è Kw = [H 3 O+] [OH–] = 1, 00 10– 14 mol/L poiché [H 3 O+] = [OH–] = 1, 00 10– 7 mol/L Copyright © 2009 Zanichelli editore Le idee della chimica

2. La ionizzazione dell’acqua La Kw, come tutte le costanti di equilibrio, varia con la temperatura e si chiama prodotto ionico dell’acqua. Copyright © 2009 Zanichelli editore Le idee della chimica
![2 La ionizzazione dellacqua Se H 3 O 10 7 M lambiente 2. La ionizzazione dell’acqua • Se [H 3 O+] > 10– 7 M l’ambiente](https://slidetodoc.com/presentation_image_h/e7040007e5576ca974f28cef4d9608df/image-15.jpg)
2. La ionizzazione dell’acqua • Se [H 3 O+] > 10– 7 M l’ambiente è acido; • Se [H 3 O+] = 10– 7 M l’ambiente è neutro; • Se [H 3 O+] < 10– 7 M l’ambiente è basico. Copyright © 2009 Zanichelli editore Le idee della chimica

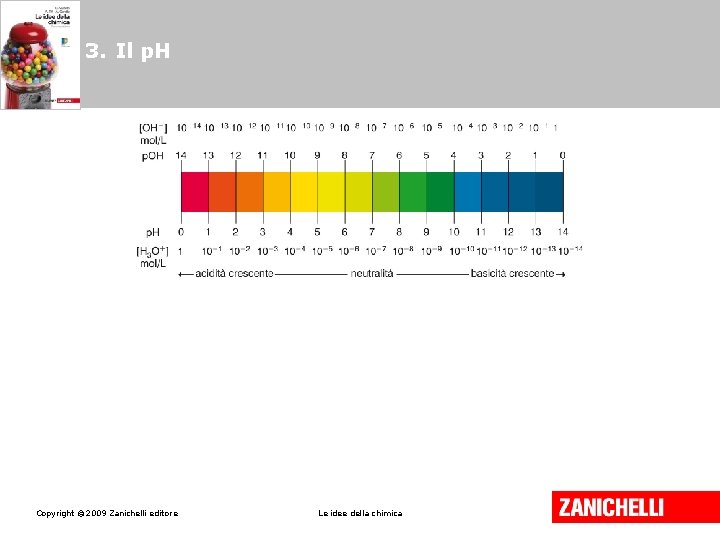
3. Il p. H misura il grado di acidità di una sostanza e si definisce come il logaritmo negativo in base 10 della concentrazione molare degli ioni H+. [H+] = 10–p. H ovvero p. H = –log[H+] Copyright © 2009 Zanichelli editore Le idee della chimica

3. Il p. H Analogamente il p. OH misura il grado di basicità di una sostanza e si definisce come il logaritmo negativo in base 10 della concentrazione molare degli ioni OH–. [OH–] = 10–p. OH ovvero p. OH = –log[OH–] Copyright © 2009 Zanichelli editore Le idee della chimica

3. Il p. H Mettendo insieme le due annotazioni si ottiene la relazione fondamentale: p. Kw = p. H + p. OH ovvero 14 = p. H + p. OH Copyright © 2009 Zanichelli editore Le idee della chimica

3. Il p. H Copyright © 2009 Zanichelli editore Le idee della chimica

4. La forza degli acidi e delle basi Secondo la teoria di Brönsted e Lowry, una specie è acida se può protonare l’acqua secondo la reazione: HA + H 2 O ⇄ H 3 O+ (aq) + A-(aq) Copyright © 2009 Zanichelli editore Le idee della chimica

4. La forza degli acidi e delle basi La costante di equilibrio di questo tipo di reazioni è detta costante di ionizzazione acida (Ka): L’acqua non è riportata in quanto viene considerata liquido puro. Copyright © 2009 Zanichelli editore Le idee della chimica

4. La forza degli acidi e delle basi Gli acidi si dicono: • forti se hanno la Ka molto grande e si ionizzano completamente; • deboli se hanno Ka piccola e non si ionizzano completamente. Copyright © 2009 Zanichelli editore Le idee della chimica

4. La forza degli acidi e delle basi Secondo la teoria di Brönsted e Lowry, una specie è basica se può acquistare un protone dall’acqua secondo la reazione: B + H 2 O ⇄ BH+(aq) + OH–(aq) Copyright © 2009 Zanichelli editore Le idee della chimica

4. La forza degli acidi e delle basi La costante di equilibrio di questo tipo di reazioni è detta costante di ionizzazione basica (Kb) ed è L’acqua non è riportata in quanto viene considerata liquido puro. Copyright © 2009 Zanichelli editore Le idee della chimica

4. La forza degli acidi e delle basi Le basi si dicono • forti se hanno la Kb molto grande e si ionizzano completamente; • deboli se hanno Kb piccola e non si ionizzano completamente. Copyright © 2009 Zanichelli editore Le idee della chimica

4. La forza degli acidi e delle basi Poiché a ciascuna specie acida corrisponde una base coniugata, e viceversa, si può dire che Kb Ka = Kw E anche p. Ka + p. Kb = p. Kw = 14 Da cui si deduce che, all’aumentare della forza di una specie, diminuisce la forza della specie coniugata. Copyright © 2009 Zanichelli editore Le idee della chimica

5. Come calcolare il p. H di soluzioni acide e basiche Gli acidi forti in soluzione acquosa sono completamente ionizzati: per calcolare il p. H di tali soluzioni basta conoscere la concentrazione dell’acido: HA + H 2 O ⇄ H 3 O+ (aq) + A-(aq) p. H = -log. MHA Dove MHA = molarità dell’acido Copyright © 2009 Zanichelli editore Le idee della chimica

5. Come calcolare il p. H di soluzioni acide e basiche Il p. H di una soluzione di acido debole è: p. H = –log √Ka. [acido] Quando desideriamo calcolare i valori di [H+] e p. H per una soluzione diluita di un acido debole HA, con Ka noto, possiamo generalmente considerare che: la concentrazione all’equilibrio dell’acido indissociato sia uguale alla concentrazione iniziale: [HA]eq = [HA]iniziale - [HA]ionizzato ≈ [HA]iniziale [H+] = [A-] Copyright © 2009 Zanichelli editore Le idee della chimica
![infatti In cui H 3 O A per cui posso scrivere H 3 infatti In cui [H 3 O+] = [A-] per cui posso scrivere [H 3](https://slidetodoc.com/presentation_image_h/e7040007e5576ca974f28cef4d9608df/image-29.jpg)
infatti In cui [H 3 O+] = [A-] per cui posso scrivere [H 3 O+]2

5. Come calcolare il p. H di soluzioni acide e basiche Il p. H di una soluzione di base debole è p. OH = –log √Kb. [base] In cui [OH-] = [BH+] per cui posso scrivere [OH-] 2 ricordando poi che Copyright © 2009 Zanichelli editore 14 = p. H + p. OH e quindi p. H = 14 - p. OH Le idee della chimica

• Esempio: Determinare il p. H di una soluzione 0, 100 M di una base con Kb=9, 6 × 10 -6 • Analisi: Il valore della Kb indica che la sostanza è una base debole e Kb <0, 0010 M. Dobbiamo scrivere l’equazione per la ionizzazione di una base debole e l’espressione della sua Kb • Soluzione: • B + H 2 O ⇌ BH+ + OH- • • CI (M) • VC (M) • CE (M) H 2 O + B⇌ BH+ + OH 0, 100 0 -x +x 0, 100 - x + x 0 +x +x

• Sostituiamo le concentrazioni all’equilibrio nell’espressione dell’azione di massa: • Risolvendo per x otteniamo x = 9, 80 × 10 -4. Da questo valore che rappresenta la [OH-] è possibile ricavare il p. OH • p. OH = - log (9, 80 × 10 -4)= 3, 01 • E il p. H dalla relazione p. H + p. OH = 14 • p. H = 14, 00 -3, 01 = 10, 99

• Che è lo stesso che usare la

7. La neutralizzazione: una reazione tra acidi e basi La neutralizzazione è una reazione fra un acido e una base in quantità stechiometricamente equivalenti che porta alla formazione di sale e di acqua, con liberazione di calore. Copyright © 2009 Zanichelli editore Le idee della chimica

7. La neutralizzazione: una reazione tra acidi e basi Nelle reazioni acido-base di neutralizzazione in cui gli ioni H+ devono uguagliare gli ioni OH–, è più corretto esprimere la concentrazione in normalità e non in molarità. Copyright © 2009 Zanichelli editore Le idee della chimica

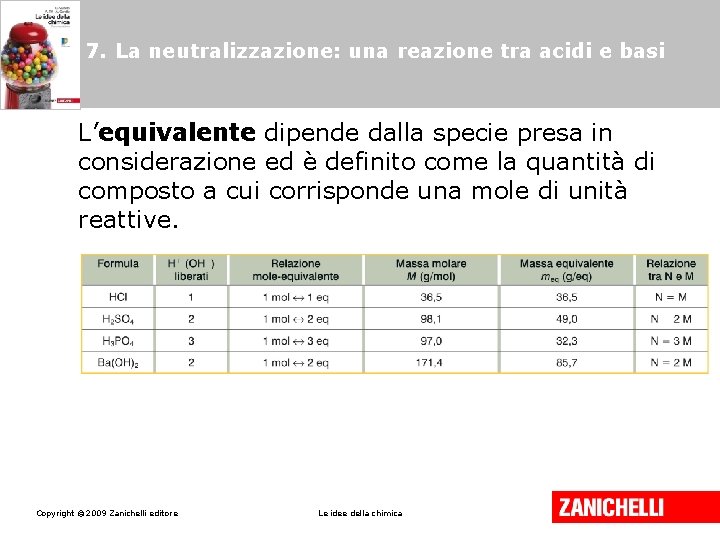
7. La neutralizzazione: una reazione tra acidi e basi La normalità (N) di una soluzione è il rapporto fra il numero di equivalenti e il volume, espresso in litri, di soluzione Copyright © 2009 Zanichelli editore Le idee della chimica

7. La neutralizzazione: una reazione tra acidi e basi L’equivalente dipende dalla specie presa in considerazione ed è definito come la quantità di composto a cui corrisponde una mole di unità reattive. Copyright © 2009 Zanichelli editore Le idee della chimica

8. La titolazione acido-base La neutralizzazione è alla base della titolazione, cioè la tecnica che permette di determinare la concentrazione incognita di una soluzione acida (o basica), aggiungendo una soluzione basica (o acida) a concentrazione nota misurandone il volume. La relazione per risalire al titolo di soluzione incognita in una titolazione acido-base è: Nacido · Vacido = Nbase · Vbase Copyright © 2009 Zanichelli editore Le idee della chimica

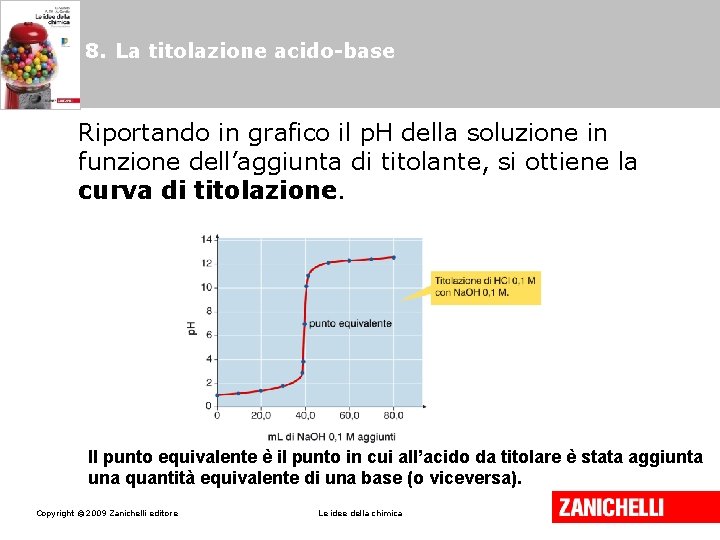
8. La titolazione acido-base Copyright © 2009 Zanichelli editore Le idee della chimica

8. La titolazione acido-base Riportando in grafico il p. H della soluzione in funzione dell’aggiunta di titolante, si ottiene la curva di titolazione. Il punto equivalente è il punto in cui all’acido da titolare è stata aggiunta una quantità equivalente di una base (o viceversa). Copyright © 2009 Zanichelli editore Le idee della chimica

9. L’idrolisi: anche i sali cambiano il p. H dell’acqua L’idrolisi è la reazione fra gli ioni del sale disciolto e le molecole d’acqua. Esistono quattro possibilità: 1. Se né il catione né l’anione possono influenzare il p. H, la soluzione risulta neutra. Per esempio Na. Cl 2. Se il solo catione del sale è acido, la soluzione risulta acida. Per esempio NH 4 Cl 3. Se il solo anione del sale è basico, la soluzione risulta basica. Per esempio Na. NO 2 4. Se il sale è formato da un catione acido e da un anione basico, il p. H della soluzione dipende dalla forza relativa dell’acido e della base. Per esempio NH 4 NO 2 rende la soluzione acida mentre NH 4 OCl rende la soluzione basica. Copyright © 2009 Zanichelli editore Le idee della chimica

9. L’idrolisi: anche i sali cambiano il p. H dell’acqua Tutti gli anioni e i cationi provenienti da acidi o da basi forti, quando vengono disciolti in acqua, non fanno variare il p. H. Copyright © 2009 Zanichelli editore Le idee della chimica

9. L’idrolisi: anche i sali cambiano il p. H dell’acqua Se il sale contiene un anione che è la base coniugata di un acido debole, forma soluzioni basiche. Copyright © 2009 Zanichelli editore Le idee della chimica

9. L’idrolisi: anche i sali cambiano il p. H dell’acqua Se il sale contiene un catione che è l’acido coniugato di una base debole, forma soluzioni acide. Copyright © 2009 Zanichelli editore Le idee della chimica

6. Come misurare il p. H Il p. H di una soluzione si misura tramite gli indicatori. Gli indicatori sono sostanze che assumono colorazioni diverse a seconda del p. H della soluzione in cui si trovano. Il punto di passaggio da un colore a un altro è detto punto di viraggio. Copyright © 2009 Zanichelli editore Le idee della chimica

La maggior parte degli indicatori acido-base sono acidi organici deboli e possiamo rappresentarli con il simbolo generale HIn (In sta per indicatore). La forma acida (HIn) ha un colore, mentre la sua base coniugata (In -) ha un colore diverso: HIn ⇌ H+ + Informa acida forma basica (un colore) (un altro colore)

Al punto di viraggio in una titolazione acido-base sono presenti quantità uguali di entrambe le forme dell'indicatore, cioè [HIn] = [In-] e quindi: p. H (al punto di equivalenza) = infatti se [HIn] = [In-] Una volta raggiunto il punto di equivalenza si ha una brusca e ampia variazione di p. H che viene visivamente evidenziata dal cambiamento di colorazione dell'indicatore. In una titolazione la scelta deve cadere su un indicatore che abbia p. KHIn uguale o più vicino possibile al p. H del punto di equivalenza.

10. Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello stesso ordine di grandezza. Molto spesso sono formati dall’associazione di un acido debole con il suo sale di una base forte Copyright © 2009 Zanichelli editore Le idee della chimica

10. Le soluzioni tampone sono soluzioni che resistono al cambiamento del p. H per moderate aggiunte di acido o di base. Copyright © 2009 Zanichelli editore Le idee della chimica

• Una sostanza del tampone neutralizza gli H+ eventualmente aggiunti alla soluzione mentre l’altra sostanza neutralizza gli OH-. • Consideriamo un sistema tampone del tipo HA/A-: – Quando aggiungiamo H+ (da un acido forte) al tampone, la base debole coniugata reagisce nel seguente modo: • H+(aq) + A-(aq) → HA(aq) – Quando aggiungiamo OH- (da una base forte) al tampone l’acido debole HA del tampone reagisce nel seguente modo: • HA(aq) + OH-(aq) → A-(aq) + H 2 O

18 • I TAMPONI CONSENTONO DI CONTROLLARE IL p. H Come calcolare il p. H di una soluzione tampone: si può assumere che le concentrazioni iniziali dell’acido debole e della sua base coniugata corrispondano ai valori all’equilibrio. Per risolvere i problemi sulle soluzioni tampone, possiamo usare indifferentemente i valori di Ka o Kb e il risultato finale è lo stesso. Nel caso si decida di usare Ka, deve essere scritta l’equazione chimica relativa alla ionizzazione dell’acido; al contrario, l’uso della Kb implica l’impiego dell’equazione per la ionizzazione della base.

18 • I TAMPONI CONSENTONO DI CONTROLLARE IL p. H Esempio: Qual è il p. H di un tampone che contiene NH 3 0, 050 M e NH 4 Cl 0, 055 M? La Kb per l’ammoniaca è 1, 8 × 10 -5 Analisi: Possiamo adoperare per i valori di concentrazione all’equilibrio i valori iniziali lavorando sull’equazione di ionizzazione della base visto che conosciamo la Kb di NH 3. Soluzione: NH 4+(aq) + OH-(aq) → NH 3(aq) + H 2 O

18 • I TAMPONI CONSENTONO DI CONTROLLARE IL p. H Possiamo mettere in evidenza i fattori che determinano il p. H di una soluzione: Per un acido debole HA: H+(aq) + A-(aq) → HA(aq) e Risolvendo: • il primo fattore è la Ka dell'acido debole • il secondo fattore è il rapporto fra le concentrazioni molari dei due membri della coppia acido-base coniugata

18 • I TAMPONI CONSENTONO DI CONTROLLARE IL p. H Adoperando la forma logaritmica otteniamo un espressione conosciuta come l'equazione di Henderson-Hasselbalch che permette di ottenere direttamente il p. H di soluzioni costituite da un acido debole con la sua base coniugata: Quando prepariamo un tampone in modo che le concentrazioni dei due componenti siano uguali, il rapporto [HA]iniziale/[A]iniziale risulta uguale a 1, quindi il fattore principale è il p. Ka dell’acido debole. Per una soluzione ottenuta da una base debole e da un suo sale:

10. Le soluzioni tampone Cioè Il p. H di una soluzione tampone si calcola con la relazione dove Ca = concentrazione iniziale di acido Cs = concentrazione del sale disciolto Copyright © 2009 Zanichelli editore Le idee della chimica

18 • I TAMPONI CONSENTONO DI CONTROLLARE IL p. H La capacità di un tampone è determinata dalle concentrazioni molari dei suoi componenti. La diluizione determina una variazione della capacità di un tampone, cioè della quantità di acido o base forte che questo è in grado di assorbire prima che il suo effetto sia esaurito. La diluizione determina una variazione di volume della soluzione ma non altera il numero di moli dei soluti: il rapporto in moli rimane pertanto costante. Solo per le soluzioni tampone, nell’espressione di Ka (o Kb) possiamo usare indifferentemente le concentrazioni molari o le moli per rappresentare le quantità delle due sostanze che costituiscono la coppia acido-base coniugata.

18 • I TAMPONI CONSENTONO DI CONTROLLARE IL p. H Esempio: Qual è la variazione di p. H causata dall’aggiunta di 0, 002 mol di HCl a 2, 0 l di soluzione tampone contenenti 0, 10 mol HA (p. Ka=7. 20) e 0, 15 mol Na. A? Analisi: Possiamo risolvere il problema adoperando le moli nell’equazione di Henderson-Hasselbalch. L’aggiunta di H+ aumenta la concentrazione di HA presente a spese di. A-. Soluzione: il p. H prima dell’aggiunta di HCl era

18 • I TAMPONI CONSENTONO DI CONTROLLARE IL p. H Dopo l’aggiunta di HCl: [Afinale] = (0, 15 – 0, 02) mol = 0, 13 mol [HAfinale] = (0, 10 + 0, 02) mol = 0, 12 mol Il p. H della nuova soluzione è: La variazione di p. H è: ∆ p. H = p. Hfinale - p. Hiniziale = 7, 23 – 7, 38 = - 0, 15 Se HCl puro fosse stato aggiunto a 2, 0 l di acqua pura il ∆ p. H sarebbe stato: