G Valitutti A Tifi A Gentile Le idee











































- Slides: 54

G. Valitutti A. Tifi A. Gentile Le idee della chimica Seconda edizione Copyright © 2009 Zanichelli editore

Capitolo 25 Le basi della biochimica 1. I carboidrati 2. I lipidi 3. Gli amminoacidi, i peptidi e le proteine 4. La struttura delle proteine e la loro attività biologica 5. Gli enzimi: i catalizzatori biologici 6. La chimica degli acidi nucleici Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati o glucidi sono la sorgente primaria di energia per gli organismi viventi. Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati possono essere: • semplici (monosaccaridi); • complessi (polisaccaridi). Copyright © 2009 Zanichelli editore Le idee della chimica

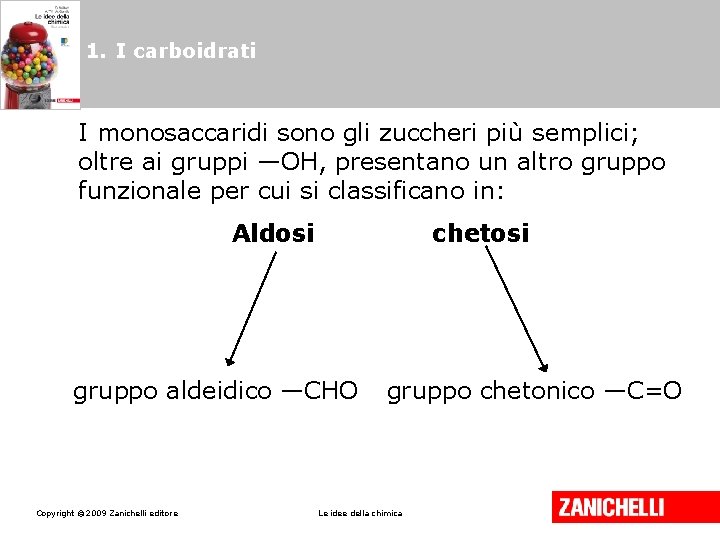
1. I carboidrati I monosaccaridi sono gli zuccheri più semplici; oltre ai gruppi —OH, presentano un altro gruppo funzionale per cui si classificano in: Aldosi chetosi gruppo aldeidico —CHO Copyright © 2009 Zanichelli editore gruppo chetonico —C=O Le idee della chimica

1. I carboidrati A seconda del numero di atomi di carbonio da cui sono composti, i monosaccaridi si classificano in triosi, tetrosi, pentosi, esosi. Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati Le molecole dei monosaccaridi presentano stereocentri e quindi sono otticamente attive: per esempio la gliceraldeide prende il nome di L- o D- gliceraldeide a seconda il gruppo —OH si trovi a sinistra oppure a destra del carbonio. Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati L’assegnazione della lettera si effettua a partire dalle formule di Fisher. La configurazione degli zuccheri si ricava per confronto con la gliceraldeide. Copyright © 2009 Zanichelli editore Le idee della chimica

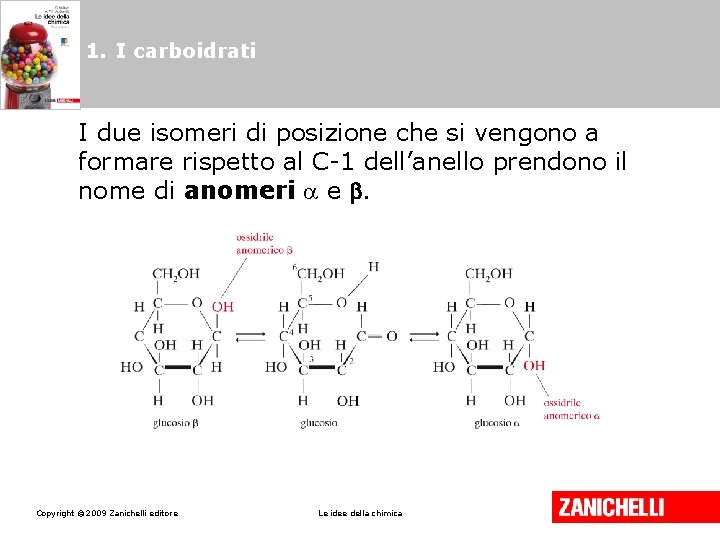
1. I carboidrati Nei monosaccaridi tendono ad avere luogo reazioni di addizione nucleofila tra il gruppo —OH di uno dei carboni terminali e il gruppo aldeidico o chetonico. Per questo motivo si trovano più che altro in forma ciclica (formule di Haworth). Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati I due isomeri di posizione che si vengono a formare rispetto al C-1 dell’anello prendono il nome di anomeri e . Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati I monosaccaridi presentano anelli a cinque (furanosi) oppure a sei (piranosi) atomi di carbonio. Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati Il glucosio è un piranoso: Il fruttosio è un furanoso: Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati Quando due monosaccaridi si uniscono per reazione dell’—OH anomerico di un monosaccaride con l’ —OH alcolico dell’altro monosaccaride si ha la formazione di un disaccaride con liberazione di una molecola d’acqua. Il legame che si forma prende il nome di legame O-glicosidico. Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati I principali disaccaridi sono: • saccarosio (glucosio + fruttosio) • maltosio (glucosio + glucosio) • lattosio (galattosio + glucosio). Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati I polisaccaridi sono polimeri dei monosaccaridi; presentano alta massa molecolare e sono formati, in media, da 100 unità monomeriche. Copyright © 2009 Zanichelli editore Le idee della chimica

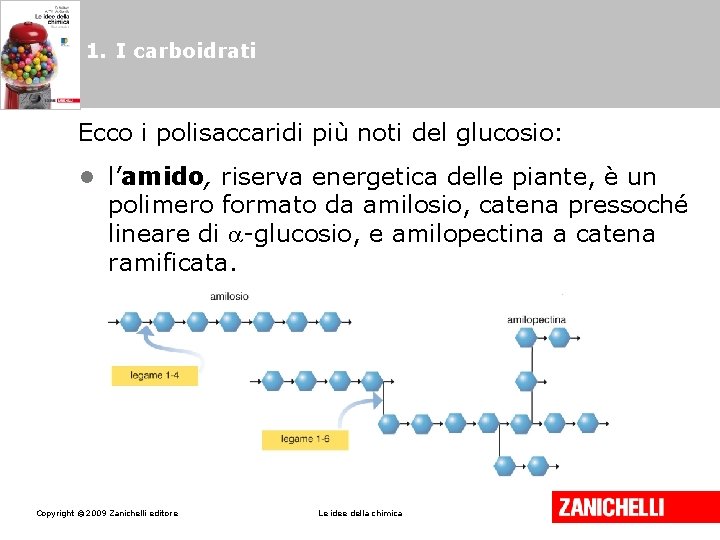
1. I carboidrati Ecco i polisaccaridi più noti del glucosio: • l’amido, riserva energetica delle piante, è un polimero formato da amilosio, catena pressoché lineare di -glucosio, e amilopectina a catena ramificata. Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati • il glicogeno, riserva energetica degli organismi animali, ha una struttura molto ramificata ed è costituito da più di 100 000 unità di glucosio. • la cellulosa, costituente principale del mondo vegetale, è formata da lunghissime catene lineari di -D-glucosio, con massa molecolare media di 500 000 u. Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati L’amido e la cellulosa differiscono per il tipo di legame glicosidico che formano fra le molecole di glucosio; è per questo che l’organismo umano riesce a digerire l’amido, ma non la cellulosa. Copyright © 2009 Zanichelli editore Le idee della chimica

1. I carboidrati I polisaccaridi: • hanno funzione di sostegno; • hanno funzione di riserva energetica; • si aggregano alle proteine della superficie cellulare formando le glicoproteine. Copyright © 2009 Zanichelli editore Le idee della chimica

2. I lipidi rappresentano, insieme ai carboidrati, una sorgente di energia per gli organismi animali. I lipidi sono i costituenti di tutti i tipi di membrane e, come ormoni, vitamine e sali biliari, risultano indispensabili alla vita. Copyright © 2009 Zanichelli editore Le idee della chimica

2. I lipidi A seconda del loro stato di aggregazione a temperatura ambiente, i lipidi vengono classificati in: • grassi (solidi a temperatura ambiente); • oli (liquidi a temperatura ambiente). Copyright © 2009 Zanichelli editore Le idee della chimica

2. I lipidi sono esteri della glicerina e prendono il nome di trigliceridi. I trigliceridi si formano per reazione fra la glicerina e tre molecole di acidi grassi a catena satura e insatura. Copyright © 2009 Zanichelli editore Le idee della chimica

2. I lipidi I fosfolipidi (o fosfogliceridi) sono esteri dell’acido fosforico, H 3 PO 4. Copyright © 2009 Zanichelli editore Le idee della chimica

2. I lipidi I fosfogliceridi hanno struttura simile a quella di un grasso, tuttavia la terza catena idrocarburica èsostituita da un gruppo fosfato a sua volta legato da un gruppo polare. Copyright © 2009 Zanichelli editore Le idee della chimica

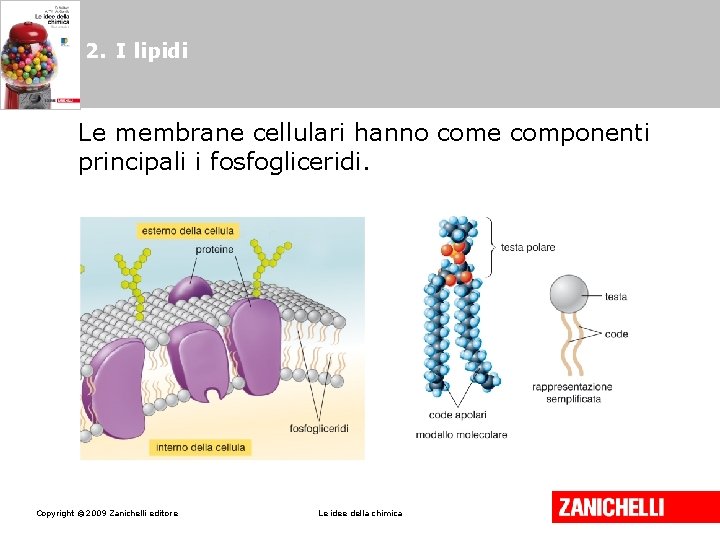
2. I lipidi Le membrane cellulari hanno come componenti principali i fosfogliceridi. Copyright © 2009 Zanichelli editore Le idee della chimica

3. Gli amminoacidi, i peptidi e le proteine Le proteine sono catene formate dalle numerose combinazioni degli amminoacidi. Si distinguono in: • peptidi formati da pochi amminoacidi; • polipeptidi che contengono fino a 50 000 amminoacidi; • proteine che contengono fino a 80 000 amminoacidi. Copyright © 2009 Zanichelli editore Le idee della chimica

3. Gli amminoacidi, i peptidi e le proteine Gli amminoacidi presentano nella stessa molecola i gruppi funzionali —COOH e —NH 2 a cui è legata una catena di atomi di carbonio caratteristica. Copyright © 2009 Zanichelli editore Le idee della chimica

3. Gli amminoacidi, i peptidi e le proteine Gli amminoacidi possono comportarsi come basi, poiché il gruppo —NH 2 è in grado di accettare un protone, ma anche come acidi, in quanto il gruppo —COOH può cedere un protone. Copyright © 2009 Zanichelli editore Le idee della chimica

3. Gli amminoacidi, i peptidi e le proteine Le proteine o polipeptidi sono formate da catene di amminoacidi legati fra loro da un legame peptidico —CONH— che si forma quando il gruppo amminico di una amminoacido lega il gruppo carbossilico di un altro amminoacido. Copyright © 2009 Zanichelli editore Le idee della chimica

4. La struttura delle proteine e la loro attività biologica La struttura di una proteina dipende dal numero, dal tipo e dalla disposizione degli amminoacidi che la formano. Copyright © 2009 Zanichelli editore Le idee della chimica

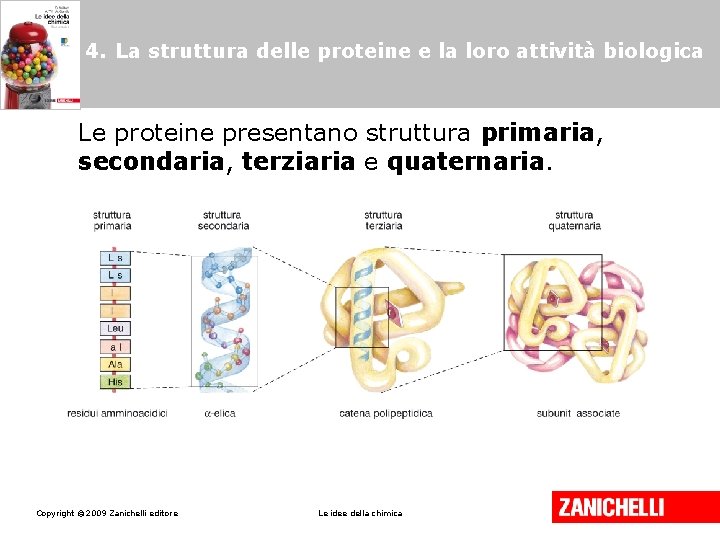
4. La struttura delle proteine e la loro attività biologica Le proteine presentano struttura primaria, secondaria, terziaria e quaternaria. Copyright © 2009 Zanichelli editore Le idee della chimica

4. La struttura delle proteine e la loro attività biologica La struttura primaria delle proteine definisce la sequenza degli aminoacidi e determina la forma e la funzionalità della proteina. Copyright © 2009 Zanichelli editore Le idee della chimica

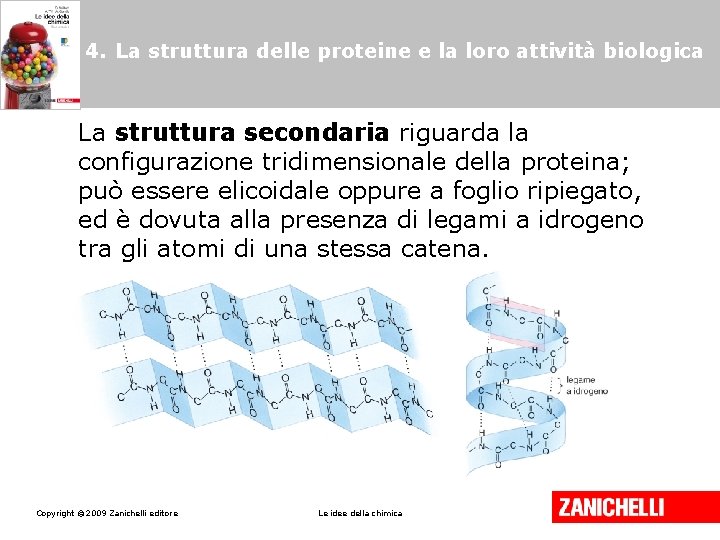
4. La struttura delle proteine e la loro attività biologica La struttura secondaria riguarda la configurazione tridimensionale della proteina; può essere elicoidale oppure a foglio ripiegato, ed è dovuta alla presenza di legami a idrogeno tra gli atomi di una stessa catena. Copyright © 2009 Zanichelli editore Le idee della chimica

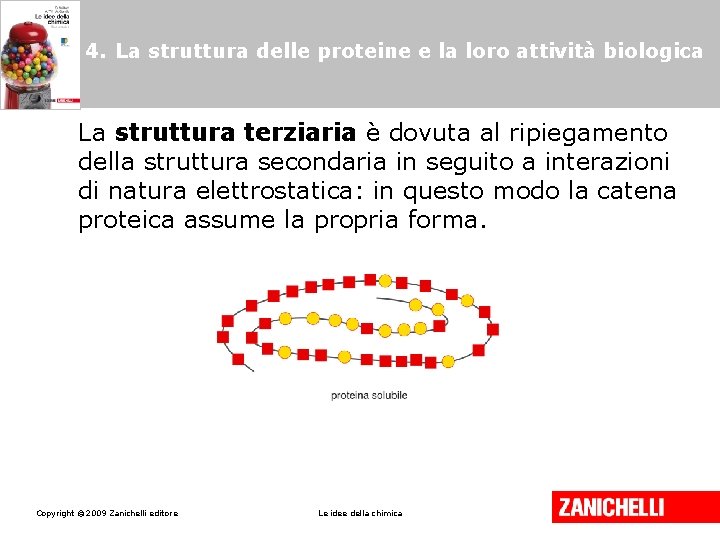
4. La struttura delle proteine e la loro attività biologica La struttura terziaria è dovuta al ripiegamento della struttura secondaria in seguito a interazioni di natura elettrostatica: in questo modo la catena proteica assume la propria forma. Copyright © 2009 Zanichelli editore Le idee della chimica

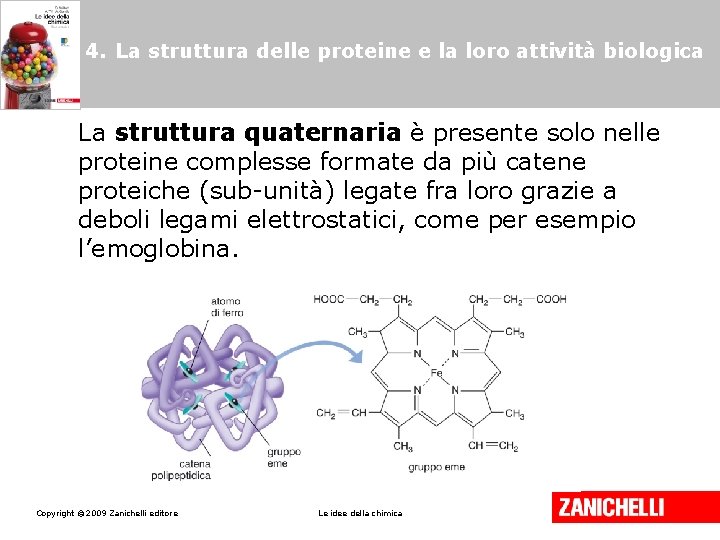
4. La struttura delle proteine e la loro attività biologica La struttura quaternaria è presente solo nelle proteine complesse formate da più catene proteiche (sub-unità) legate fra loro grazie a deboli legami elettrostatici, come per esempio l’emoglobina. Copyright © 2009 Zanichelli editore Le idee della chimica

4. La struttura delle proteine e la loro attività biologica La forma delle proteine è strettamente correlata alla funzione biologica che deve svolgere. Copyright © 2009 Zanichelli editore Le idee della chimica

4. La struttura delle proteine e la loro attività biologica • Le proteine fibrose sono insolubili in acqua e sono caratterizzate dalla presenza di ponti disolfuro che uniscono le catene attribuendo loro una struttura molto robusta. • Le proteine globulari sono solubili in acqua e hanno forma quasi sferica. Copyright © 2009 Zanichelli editore Le idee della chimica

4. La struttura delle proteine e la loro attività biologica Se una proteina passa da una conformazione ordinata a una disordinata, con perdita o diminuzione dell’attività biologica, si dice che ha subito denaturazione. Copyright © 2009 Zanichelli editore Le idee della chimica

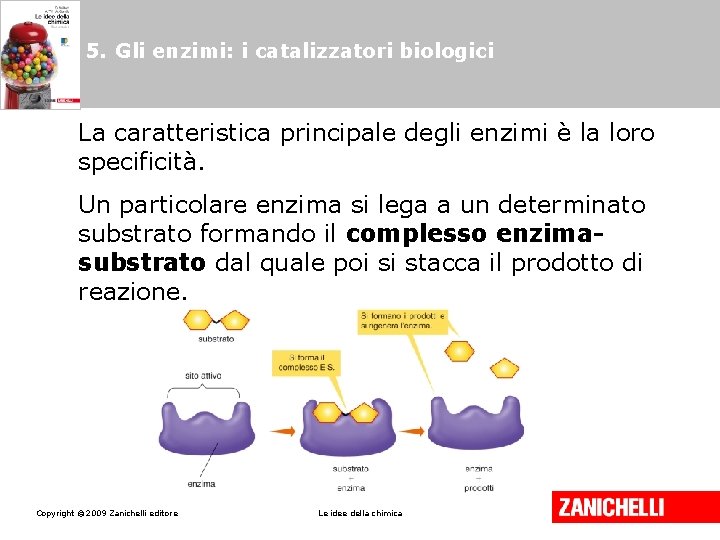
5. Gli enzimi: i catalizzatori biologici Gli enzimi sono particolari proteine che svolgono il ruolo di catalizzatori nelle reazioni metaboliche. Copyright © 2009 Zanichelli editore Le idee della chimica

5. Gli enzimi: i catalizzatori biologici La caratteristica principale degli enzimi è la loro specificità. Un particolare enzima si lega a un determinato substrato formando il complesso enzimasubstrato dal quale poi si stacca il prodotto di reazione. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici Gli acidi nucleici sono: • il DNA o acido desossiribonucleico; • l’RNA o acido ribonucleico. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici Gli acidi nucleici sono formati da sub-unità dette nucleotidi. I nucleotidi sono costituiti da: • una base azotata; • uno zucchero pentoso; • un gruppo fosfato. Copyright © 2009 Zanichelli editore Le idee della chimica

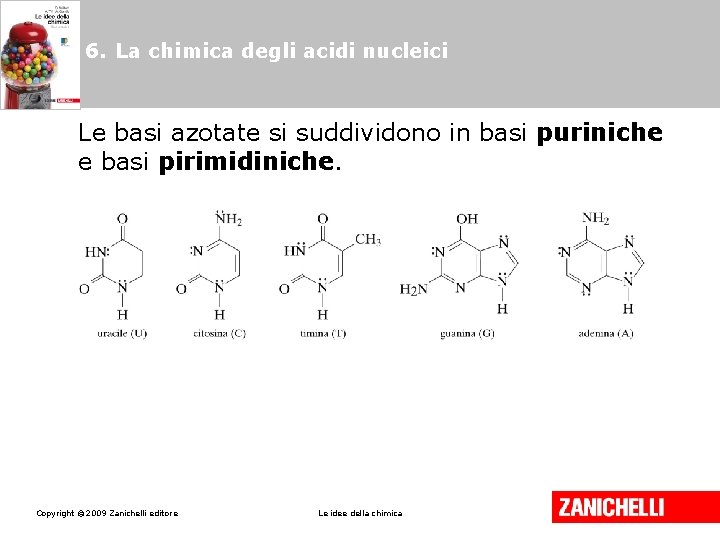
6. La chimica degli acidi nucleici Le basi azotate si suddividono in basi puriniche e basi pirimidiniche. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici Adenina, guanina, citosina e timina sono le basi azotate del DNA. Adenina, guanina, citosina e uracile sono le basi azotate dell’RNA. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici L’RNA si presenta come un filamento singolo. Il DNA ha struttura a doppio filamento in cui le due catene sono legate fra loro da legami a idrogeno fra l’adenina e la timina, e tra la citosina e la guanina. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici La doppia elica del DNA contiene le informazioni ereditarie, che vengono trasmesse da una generazione all’altra. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici Fasi della duplicazione del DNA 1. Enzimi specifici rompono in vari punti del DNA i legami a idrogeno. 2. La doppia elica si svolge e i filamenti si separano. 3. Su ogni filamento, per azione di altri enzimi specifici, viene ricostruita la sequenza nucleotidica complementare. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici Al termine del processo, da una doppia elica se ne ottengono due identiche le quali si distribuiscono tra le due cellule figlie (duplicazione semiconservativa). Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici Il DNA contiene le informazioni in codice per la sintesi delle proteine: a ogni tripletta di basi corrisponde un particolare amminoacido. Un gene è il tratto di DNA che codifica per una proteina. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici Le proteine vengono costruite attraverso i processi di: • trascrizione del DNA (nel nucleo); • traduzione dell’RNA (nel citoplasma tramite i ribosomi). In questi processi entrano in gioco tre tipi di RNA: m. RNA, r. RNA, t. RNA. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici I tre tipi di RNA: 1. RNA messaggero (m. RNA) trascrive il codice genetico e trasporta l’informazione fino ai ribosomi. 2. RNA ribosiomiale (r. RNA) è il principale costituente dei ribosomi. 3. RNA transfer (t. RNA) è il più piccolo e trasporta gli amminoacidi durante la sintesi proteica. Copyright © 2009 Zanichelli editore Le idee della chimica

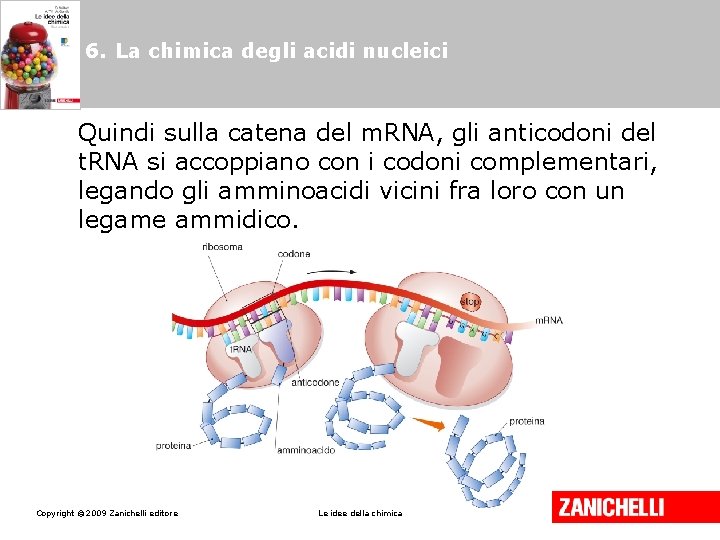
6. La chimica degli acidi nucleici Nella traduzione del messaggio genetico il m. RNA determina, attraverso la sequenza di triplette dette codoni, l’ordine con cui gli amminoacidi formano la proteina. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici Il t. RNA traduce il messaggio contenuto nel m. RNA perché possiede un anticodone (tripletta complementare a quella del codone) e trasporta uno specifico amminoacido. Copyright © 2009 Zanichelli editore Le idee della chimica

6. La chimica degli acidi nucleici Quindi sulla catena del m. RNA, gli anticodoni del t. RNA si accoppiano con i codoni complementari, legando gli amminoacidi vicini fra loro con un legame ammidico. Copyright © 2009 Zanichelli editore Le idee della chimica