Fyzika kondenzovanho stavu 2 pednka Konstrukce reciprok me











- Slides: 27

Fyzika kondenzovaného stavu 2. přednáška

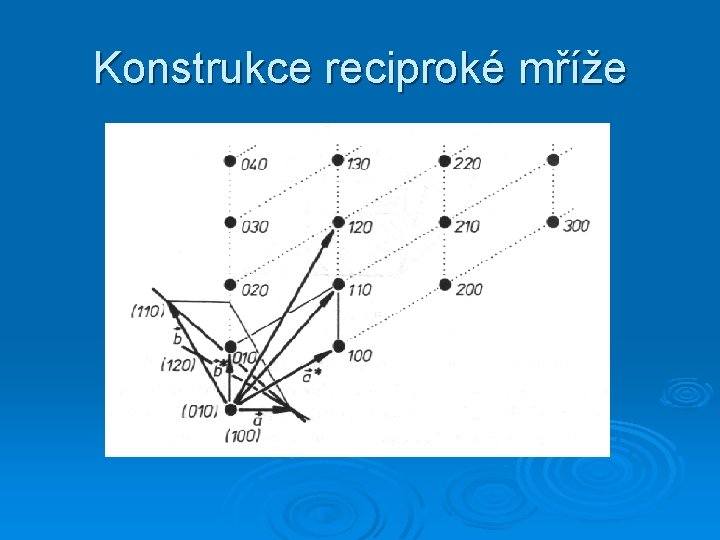
Konstrukce reciproké mříže

Objem primitivní buňky

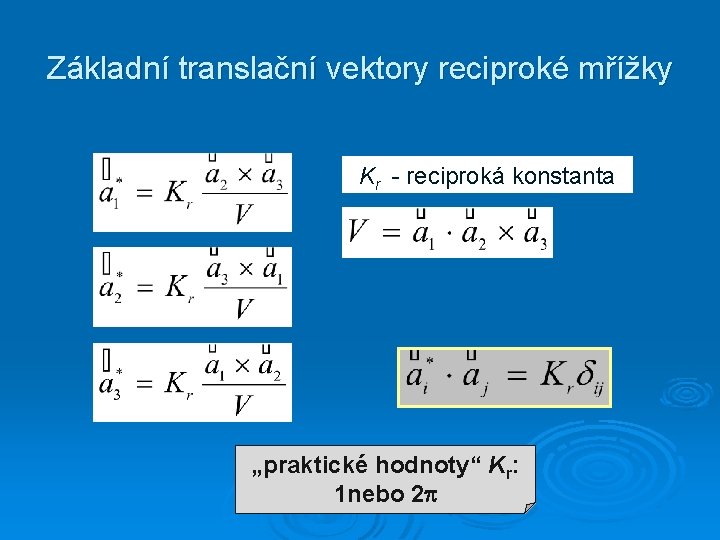
Základní translační vektory reciproké mřížky Kr - reciproká konstanta „praktické hodnoty“ Kr: 1 nebo 2

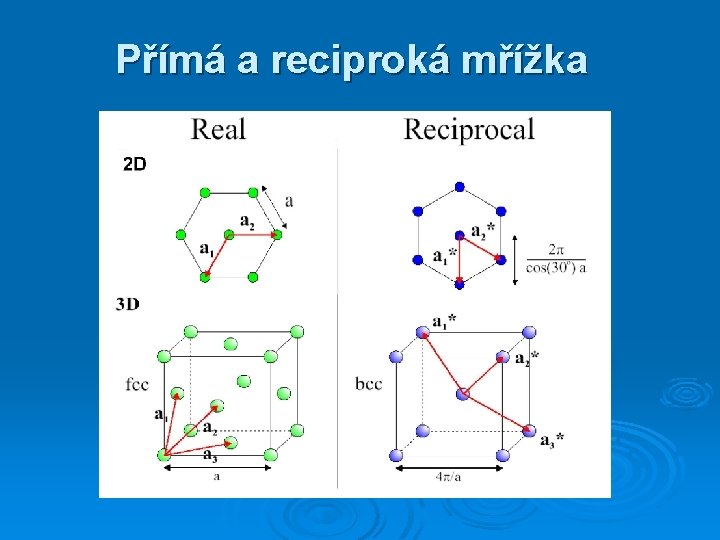
Přímá a reciproká mřížka

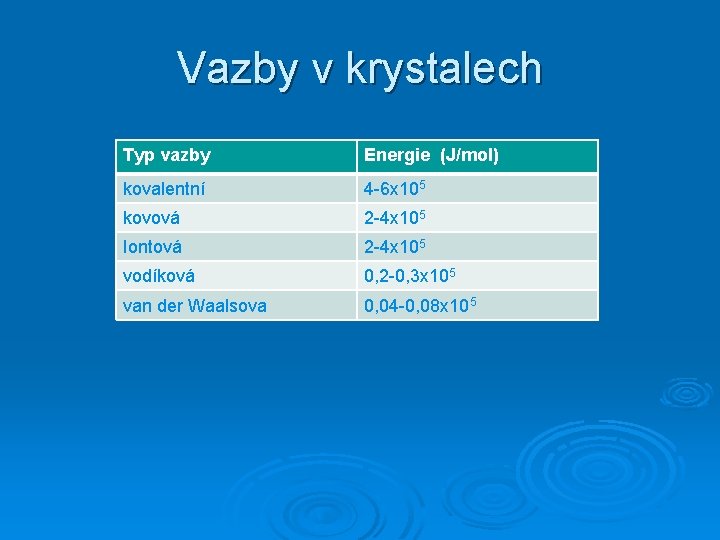
Vazby v krystalech Typ vazby Energie (J/mol) kovalentní 4 -6 x 105 kovová 2 -4 x 105 Iontová 2 -4 x 105 vodíková 0, 2 -0, 3 x 105 van der Waalsova 0, 04 -0, 08 x 105

Periodická soustava prvků

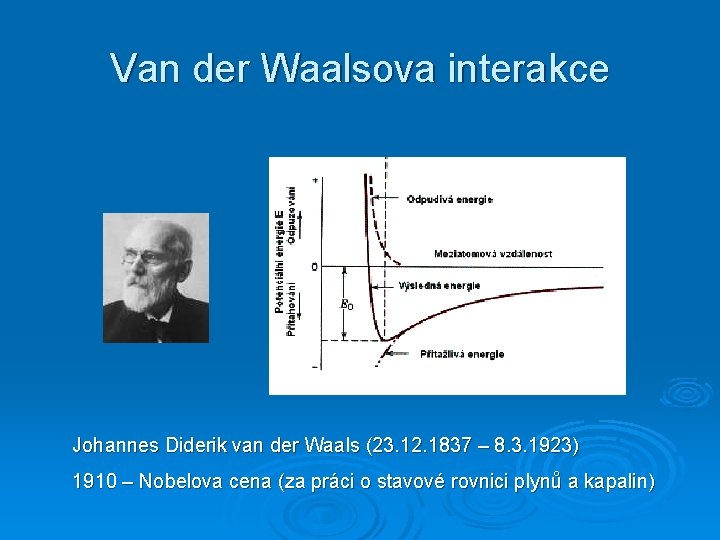
Van der Waalsova interakce Johannes Diderik van der Waals (23. 12. 1837 – 8. 3. 1923) 1910 – Nobelova cena (za práci o stavové rovnici plynů a kapalin)

Molekuly s nulovým celkovým elektrickým nábojem 1. interakce mezi permanentními dipólovými momenty molekul 2. interakce mezi permanentním dipólovým momentem jedné molekuly a mezi indukovaným dipólovým momentem druhé molekuly 3. interakce mezi molekulami (atomy) bez dipólového momentu 4. překryvová interakce

Permanentní dipólové momenty těžiště kladných a záporných nábojů molekuly nejsou totožná (ať je molekula ve vnějším elektrickém poli, nebo ne) Ø tzv. polární molekuly Ø el. pole molekuly je podobné poli elementárního dipólu (E r -3) Ø – dipólový moment r – vzdálenost molekul 0 – permitivita vakua energie příslušná interakci silového působení dvou molekul (párová interakce)

Interakce polární a nepolární molekuly - Petrus Josephus Wilhelmus Debye (1920) - polarizovatelnost molekuly (jak snadno se deformuje elektronový obal v el. poli)

Interakce mezi nepolárními molekulami (disperzní interakce) Fritz Wolfgang London (1930) h – Planckova konstanta – polarizovatelnost molekuly 0 – frekvence „zástupných“ oscilátorů Interakce je založena na mžikových dipólových momentech

Překryvová interakce - párový mezimolekulární potenciál

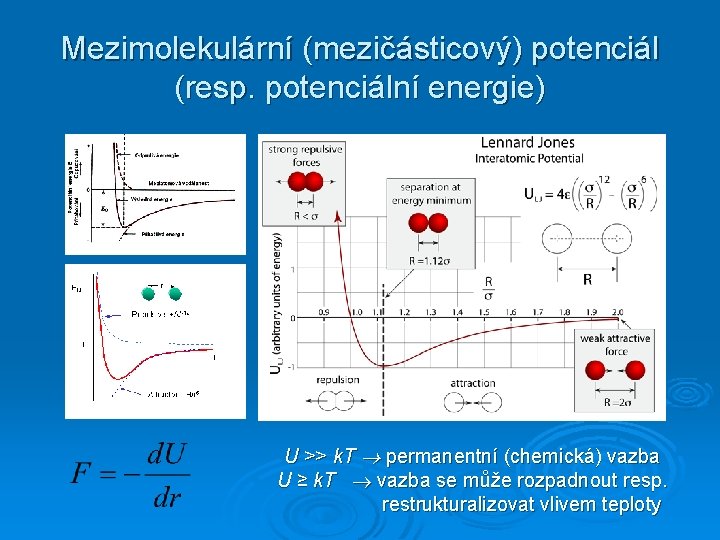
Lenard – Jonesův potenciál

Mezimolekulární (mezičásticový) potenciál (resp. potenciální energie) U >> k. T permanentní (chemická) vazba U ≥ k. T vazba se může rozpadnout resp. restrukturalizovat vlivem teploty

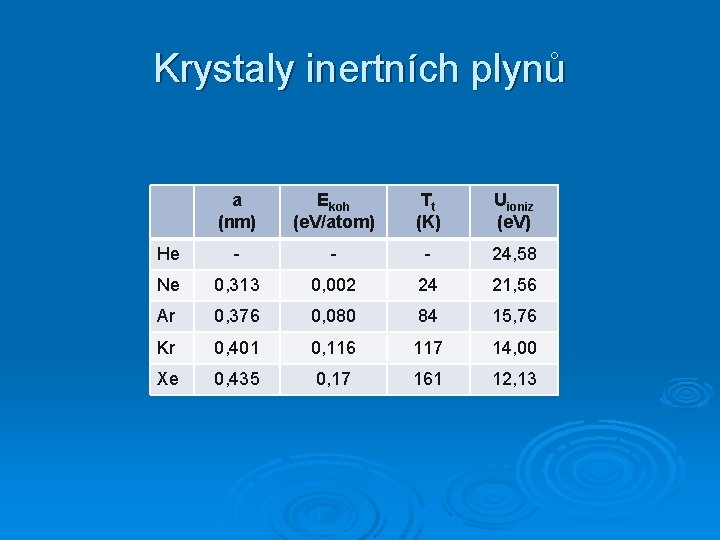
Krystaly inertních plynů a (nm) Ekoh (e. V/atom) Tt (K) Uioniz (e. V) He - - - 24, 58 Ne 0, 313 0, 002 24 21, 56 Ar 0, 376 0, 080 84 15, 76 Kr 0, 401 0, 116 117 14, 00 Xe 0, 435 0, 17 161 12, 13

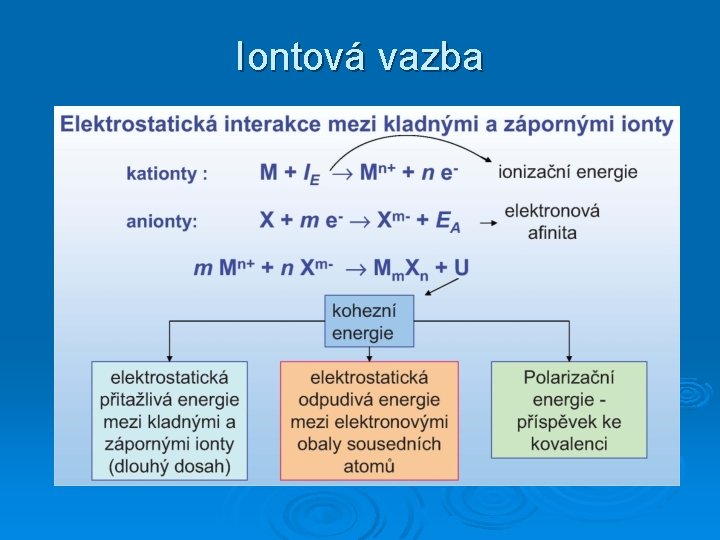
Iontová vazba

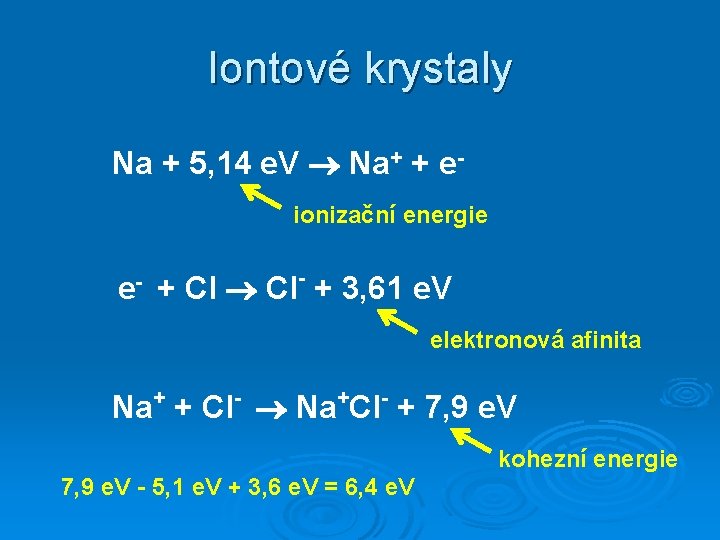
Iontové krystaly Na + 5, 14 e. V Na+ + eionizační energie e- + Cl Cl- + 3, 61 e. V elektronová afinita Na+ + Cl- Na+Cl- + 7, 9 e. V kohezní energie 7, 9 e. V - 5, 1 e. V + 3, 6 e. V = 6, 4 e. V

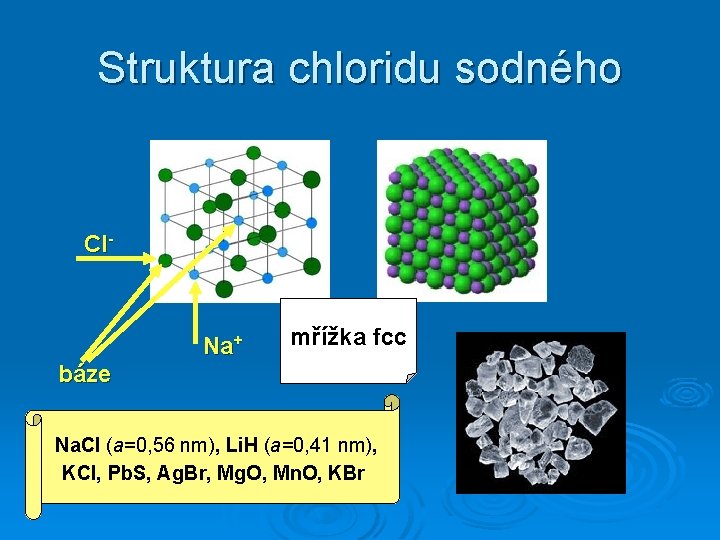
Struktura chloridu sodného Cl- Na+ mřížka fcc báze Na. Cl (a=0, 56 nm), Li. H (a=0, 41 nm), KCl, Pb. S, Ag. Br, Mg. O, Mn. O, KBr

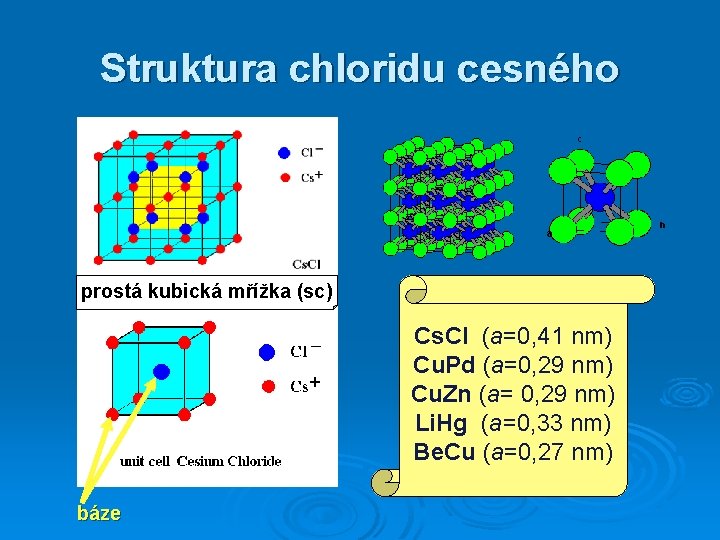
Struktura chloridu cesného prostá kubická mřížka (sc) Cs. Cl (a=0, 41 nm) Cu. Pd (a=0, 29 nm) Cu. Zn (a= 0, 29 nm) Li. Hg (a=0, 33 nm) Be. Cu (a=0, 27 nm) báze

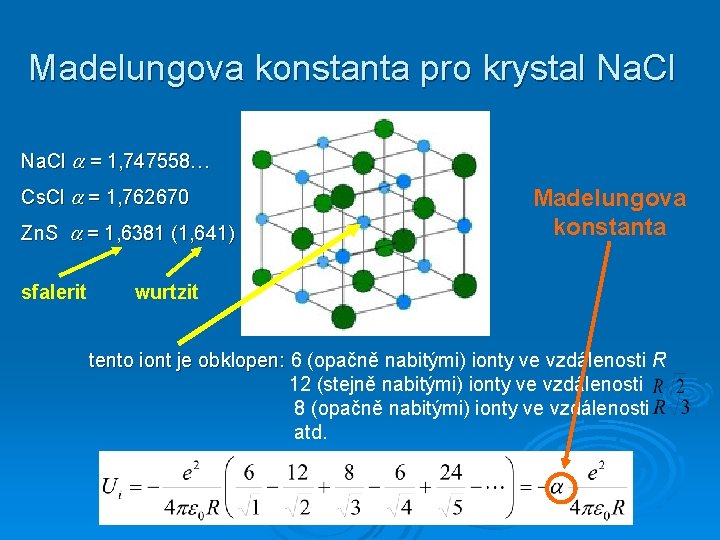
Madelungova konstanta pro krystal Na. Cl = 1, 747558… Cs. Cl = 1, 762670 Zn. S = 1, 6381 (1, 641) sfalerit Madelungova konstanta wurtzit tento iont je obklopen: 6 (opačně nabitými) ionty ve vzdálenosti R 12 (stejně nabitými) ionty ve vzdálenosti 8 (opačně nabitými) ionty ve vzdálenosti atd.

Kovalentní vazba Bornova-Oppenheimerova aproximace: Jádra jsou mnohem těžší než elektrony a pohybují se mnohem pomaleji → jádra považujeme za nehybná. Hellmannův-Feynmanův přístup: Elektrostatické působení elektronů lze vyjádřit jako působení prostorového rozložení záporného náboje s hustotou = e 2 Princip rezonance: 1, 2 – vlnové funkce, které popisují stavy systému 1, 2: → = a 1 + b 2 je rovněž vlastní funkcí systému → lze nalézt takové b/a pro které energie nabývá minima (základní stav)

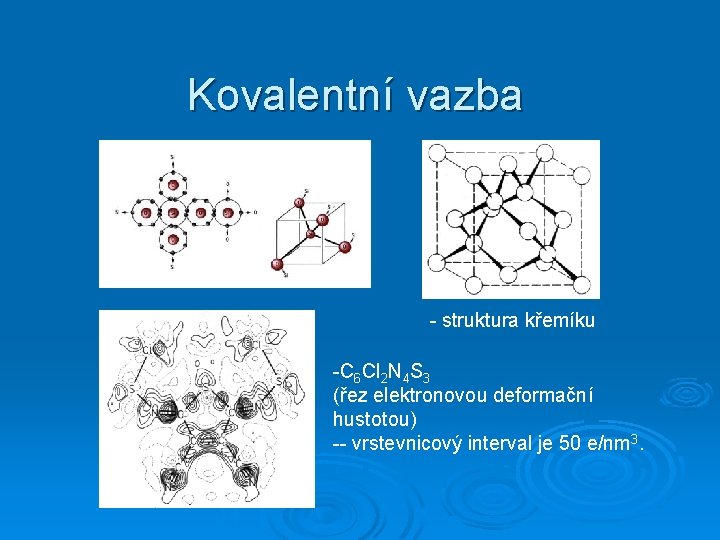
Kovalentní vazba - struktura křemíku -C 6 Cl 2 N 4 S 3 (řez elektronovou deformační hustotou) -- vrstevnicový interval je 50 e/nm 3.

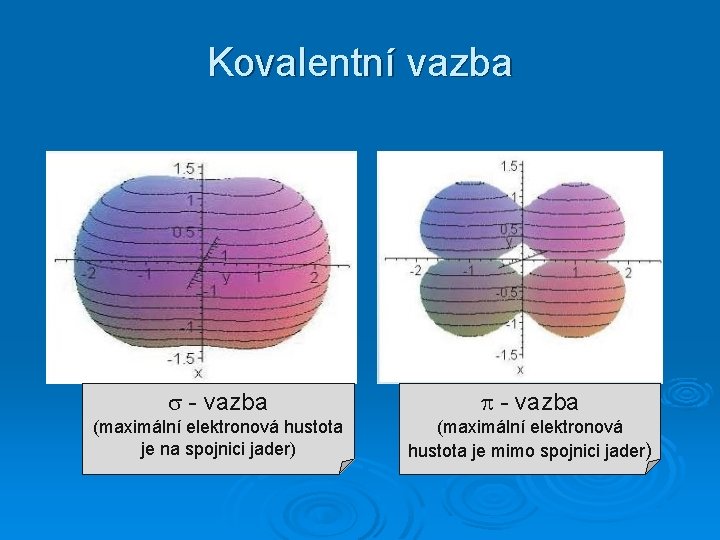
Kovalentní vazba - vazba (maximální elektronová hustota je na spojnici jader) (maximální elektronová hustota je mimo spojnici jader)

Vazby v kovech Ø alkalické kovy – téměř čistě kovová vazba (kladné ionty v téměř homogenním „moři“ záporného náboje) Ø přechodové kovy (a v periodické tabulce bezprostředně navazující) kovová vazba elektronů z vnitřní slupky (velké slupky d) kovalentní a van der Waalsova interakce iontových zbytků (např. Fe, W – d-elektrony podstatně přispívají k vazebné energii)

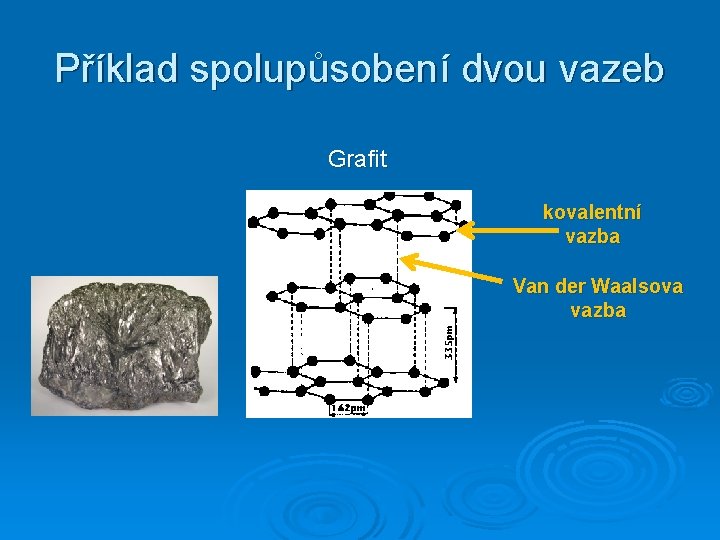
Příklad spolupůsobení dvou vazeb Grafit kovalentní vazba Van der Waalsova vazba

Pro zajímavost: halogenová vazba Ø Ø Ø zvláštní druh nekovalentní interakce objevena relativně nedávno při studiu struktury krystalů halogenidových sloučenin s uvážením elektronegativit (např. halogen – uhlík, kyslík) a Coulonbova zákona by neměla vazba existovat důvodem je tzv. -díra (budoucí) aplikace v medicíně (? ) Vlastnosti: velmi směrová vazba, její síla roste s atomovým číslem příslušného halogenu (v řadě Cl Br I), fluor na organických sloučeninách nevykazuje -díru, vazbu lze „ladit“ chemickým okolím halogenu
 Kontrola stavu pokladnice
Kontrola stavu pokladnice Kontrola stavu trénovanosti
Kontrola stavu trénovanosti Bunkovu stavu obsahuje
Bunkovu stavu obsahuje Reciprok fogalma
Reciprok fogalma Miotatikus reflex
Miotatikus reflex Kristály fogalma
Kristály fogalma Dóziskompenzáció
Dóziskompenzáció Reciprok determinizmus
Reciprok determinizmus Excitáció
Excitáció Pravoúhlý trojúhelník
Pravoúhlý trojúhelník Konstrukce kosodélníku
Konstrukce kosodélníku Konstruovaný grotesk
Konstruovaný grotesk Konstrukce vozovky
Konstrukce vozovky Rovnoběžník
Rovnoběžník Konstrukce osy úsečky
Konstrukce osy úsečky Osmiúhelník konstrukce
Osmiúhelník konstrukce Konstrukce trojúhelníku 2 výšky a strana
Konstrukce trojúhelníku 2 výšky a strana Konstrukce osmiúhelníku
Konstrukce osmiúhelníku Rovnoramenný lichoběžník konstrukce
Rovnoramenný lichoběžník konstrukce Konstrukce trojúhelníku
Konstrukce trojúhelníku Jak narýsovat šestiúhelník
Jak narýsovat šestiúhelník Konstrukce úhlů bez úhloměru
Konstrukce úhlů bez úhloměru Konstrukce rovnoběžníku s výškou
Konstrukce rovnoběžníku s výškou Postup konstrukce kosočtverce
Postup konstrukce kosočtverce Konstrukce trojúhelníku sss, sus, usu příklady
Konstrukce trojúhelníku sss, sus, usu příklady Konstrukce rovnoběžníku s výškou
Konstrukce rovnoběžníku s výškou Konstrukční vrstvy komunikace
Konstrukční vrstvy komunikace Pravidelný šestiboký hranol konstrukce
Pravidelný šestiboký hranol konstrukce