Fyzika kondenzovanho stavu 1 prezentace 2016 17 Sloupy

























- Slides: 58

Fyzika kondenzovaného stavu 1. prezentace (2016 -17)

Sloupy podpírající lidskou civilizaci - materiály - komunikace - informace

Co jsou a jak vznikají kondenzované látky ?

Kondenzace a tuhnutí Ø vysoká teplota - zanedbatelný vliv přitažlivých sil - Ek (energie tepelného pohybu částic) převažuje Ø snižování teploty - přitažlivé síly začínají nabývat na důležitosti - molekulární páry (dvojice) zůstávají déle pohromadě - korelace v pohybu molekul - krátkodobě existující klastry molekul

Kondenzace a tuhnutí Ø kondenzační teplota - významná korelace pohybu molekul (vznik kapaliny) - energie přitažlivé interakce Ek - vliv energie odpudivých sil - krátkodosahové uspořádávání molekul (přeuspořádání po uplynutí relaxační doby) - přitažlivé interakce co nejvíce „stěsnávají“ molekuly - odpudivé interakce zajišťují minimální separaci Ø další snižování teploty - uspořádávání molekul (resp. atomů, iontů) - tuhnutí vznik pevné látky (PL)

Dva typy tuhnutí kapalin Ø krystalizace (Tt) Ø tuhnutí v důsledku rychlého zvýšení viskozity při jejím ochlazení - amorfní látky (vosk, asfalt, . . . ) - sklo (má schopnost krystalizace, ale viskozita roste s poklesem teploty tak rychle, že látka ztuhne dříve, než stačí zkrystalizovat)

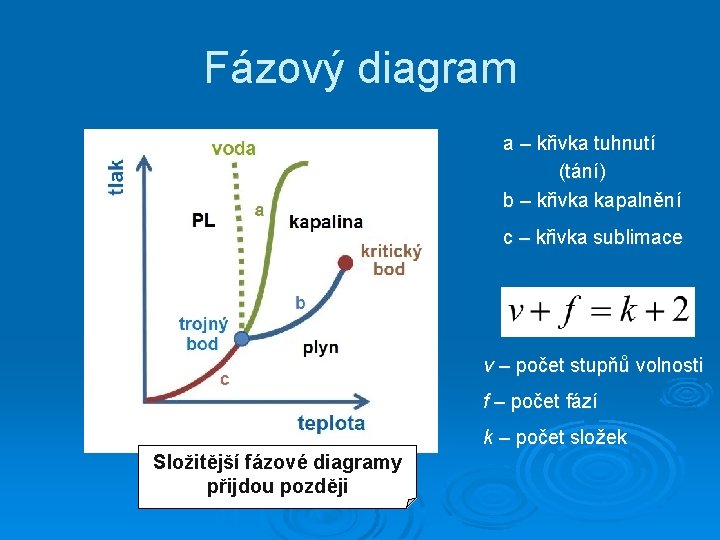
Fázový diagram a – křivka tuhnutí (tání) b – křivka kapalnění c – křivka sublimace v – počet stupňů volnosti f – počet fází k – počet složek Složitější fázové diagramy přijdou později

Kondenzované látky dělení na kapalné a pevné látky Ø kapalné - newtonovské kapaliny - nenewtonowské kapaliny Ø pevné (hookovské, nehookovské) - krystalické - amorfní - polymery Ø skla

Kondenzované látky dělení na pevné a měkké látky Ø pevné látky (hookovské, nehookovské) - krystalické - amorfní Ø měkké látky (MKL) - mýdlo, kečup, tvaroh, barvy. . . ) - polymery - kapalné krystaly - kapaliny (newtonovské, nenewtonovské)

Společné vlastnosti MKL Ø rozměrová škála - koloidní částice < 1 m - polymerní řetězce ~ desítky nm Ø strukturní prvky mají podobné rozměry Ø strukturní modely neberou většinou v úvahu vlastnosti jednotlivých atomů, ale jejich shluků, řetězců, . . . Ø vliv Brownova pohybu na strukturní prvky

Společné vlastnosti MKL Ø srovnatelné velikosti vazebních energií mezi strukturními prvky Ø nelze jednoduše použít „pravidlo minima volné energie“ Ø molekuly se samouspořádávají do „supermolekul“

Síly, energie a časové škály v KL Ø KL drží pohromadě mezimolekulární (mezičásticové) síly Ø PL - každá částice má definované místo ve struktuře - souvislost mezi energií vazby a tuhostí látky Ø kapaliny - mezimolekulární síly - relaxační doba (souvislost s tím „jak tečou“ při aplikaci napětí)

Síly, energie a časové škály v KL Ø MKL, amorfní PL - viskoelasticita - v mnoha systémech roste relaxační doba r s klesající teplotou, až při jisté teplotě r → nerovnovážný stav - vznik skla - uspořádání částic podobné kapalinám - mechanické vlastnosti podobné PL

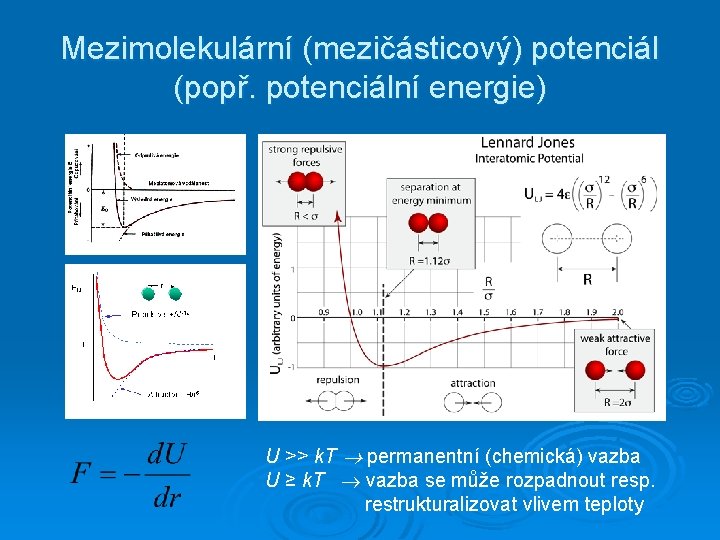
Mezimolekulární (mezičásticový) potenciál (popř. potenciální energie) U >> k. T permanentní (chemická) vazba U ≥ k. T vazba se může rozpadnout resp. restrukturalizovat vlivem teploty

Vazby v kondenzovaných látkách Ø Van der Waalsova vazba Ø iontová vazba Ø kovalentní vazba Ø kovová vazba Ø vodíková vazba Ø hydrofobní interakce Ø halogenová vazba podrobněji později

Krystalické látky

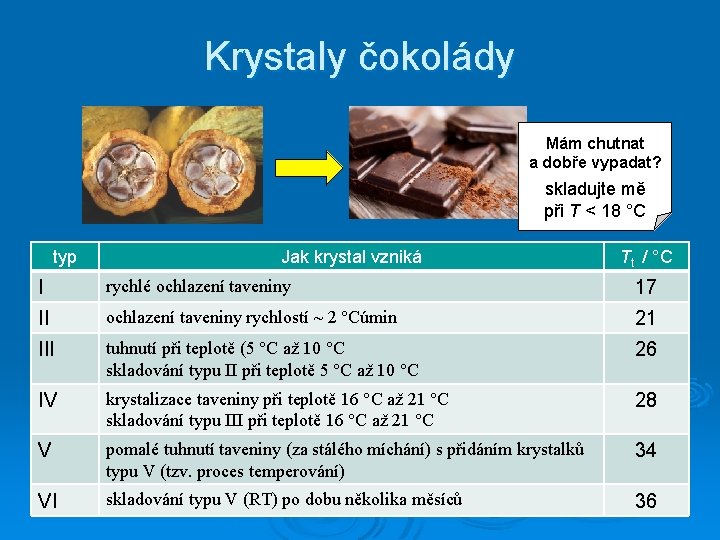
Čokoláda a její krystaly

Krystaly čokolády Mám chutnat a dobře vypadat? skladujte mě při T < 18 °C typ Jak krystal vzniká Tt / °C I rychlé ochlazení taveniny 17 II ochlazení taveniny rychlostí ~ 2 °Cúmin 21 III tuhnutí při teplotě (5 °C až 10 °C skladování typu II při teplotě 5 °C až 10 °C 26 IV krystalizace taveniny při teplotě 16 °C až 21 °C skladování typu III při teplotě 16 °C až 21 °C 28 V pomalé tuhnutí taveniny (za stálého míchání) s přidáním krystalků typu V (tzv. proces temperování) 34 VI skladování typu V (RT) po dobu několika měsíců 36

Struktura krystalických látek

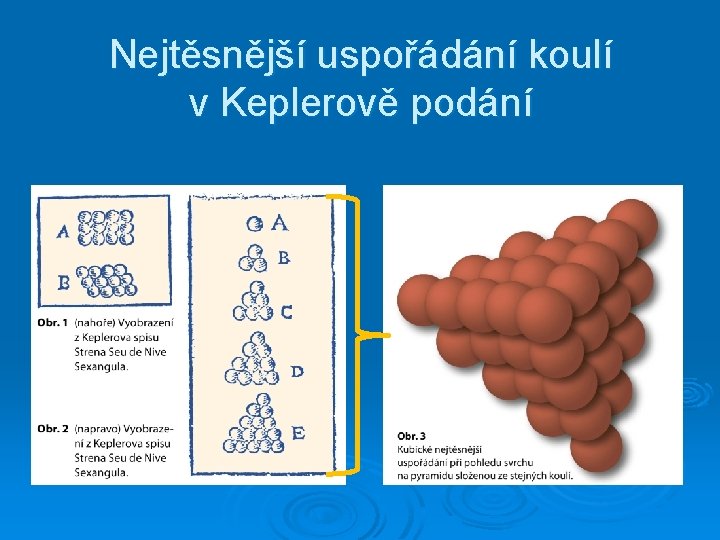
Johannes Kepler (1611) O šestiúhelné sněhové vločce poutavé čtení o „ničem“ -v jistém smyslu první krystalografická práce - napsáno roku 1610 v Praze - vyšlo 1611 ve Frankfurtu nad Mohanem

Nejtěsnější uspořádání koulí v Keplerově podání

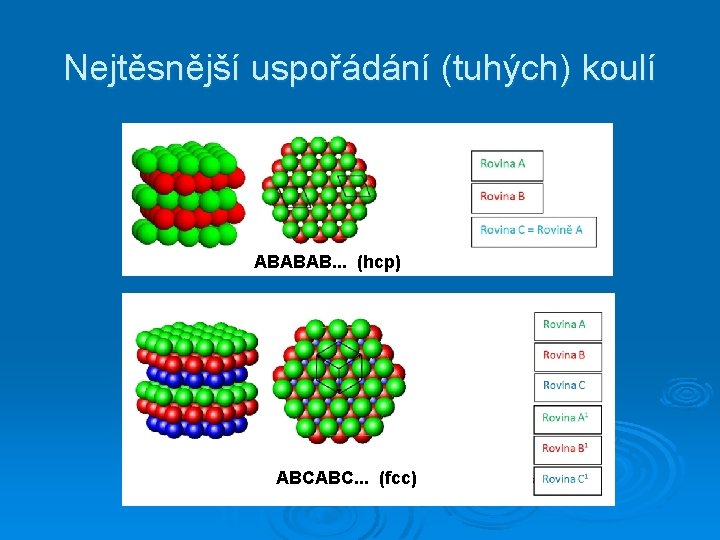
Nejtěsnější uspořádání koulí (hexagonální a kubické)

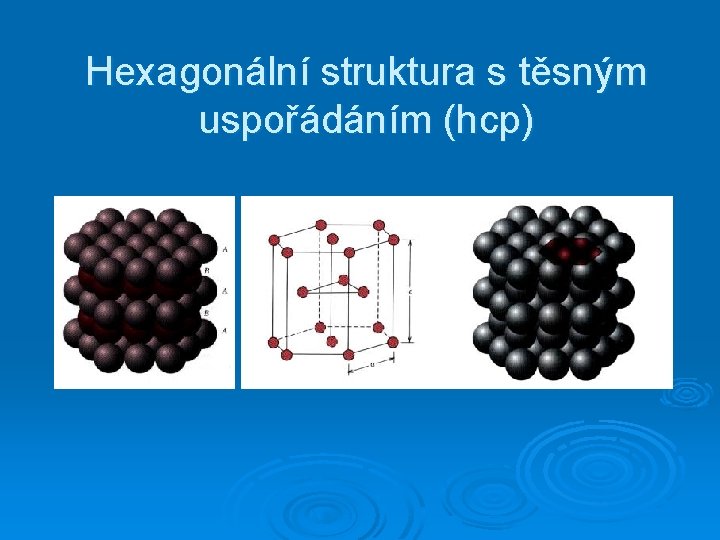
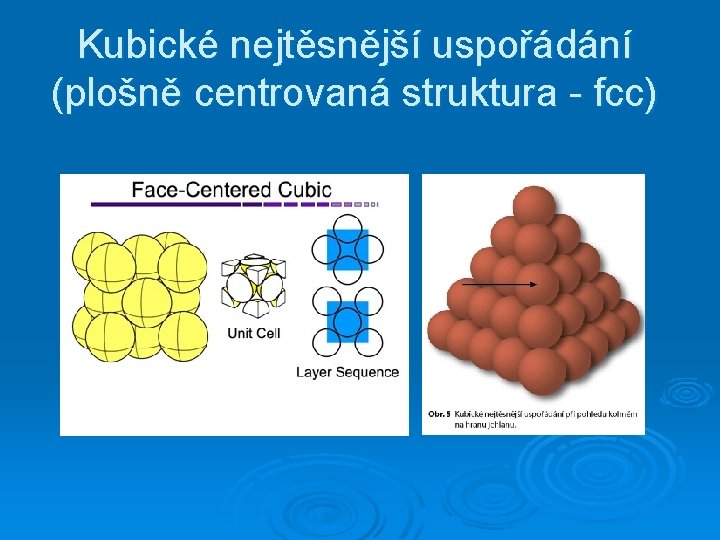
Nejtěsnější uspořádání (tuhých) koulí ABABAB. . . (hcp) ABCABC. . . (fcc)

Hexagonální struktura s těsným uspořádáním (hcp)

Kubické nejtěsnější uspořádání (plošně centrovaná struktura - fcc)

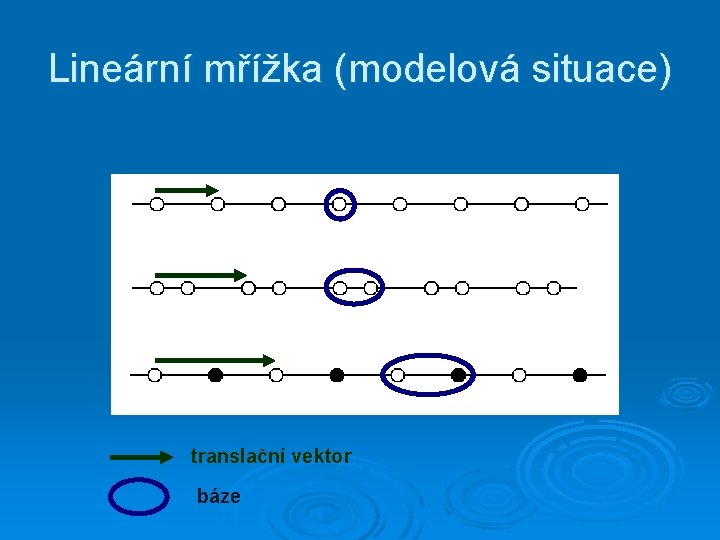
Lineární mřížka (modelová situace) translační vektor báze

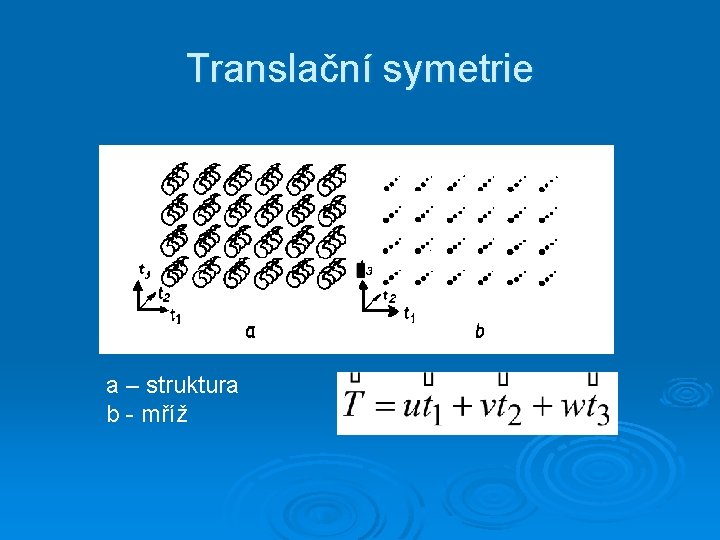
Translační symetrie a – struktura b - mříž

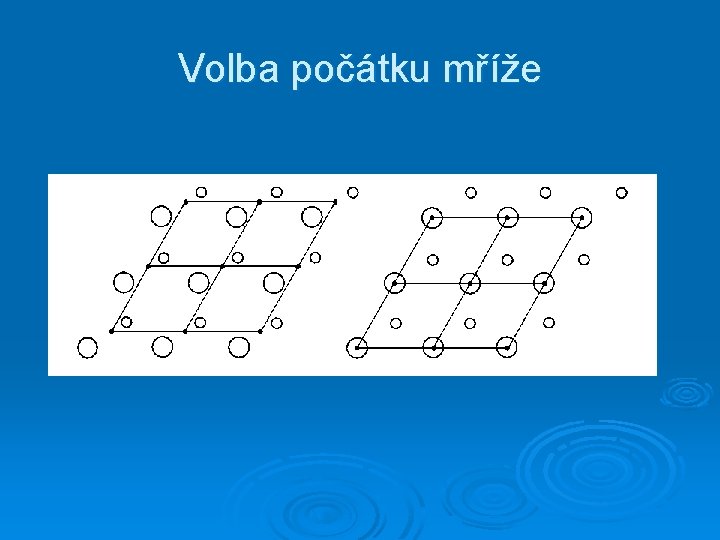
Volba počátku mříže

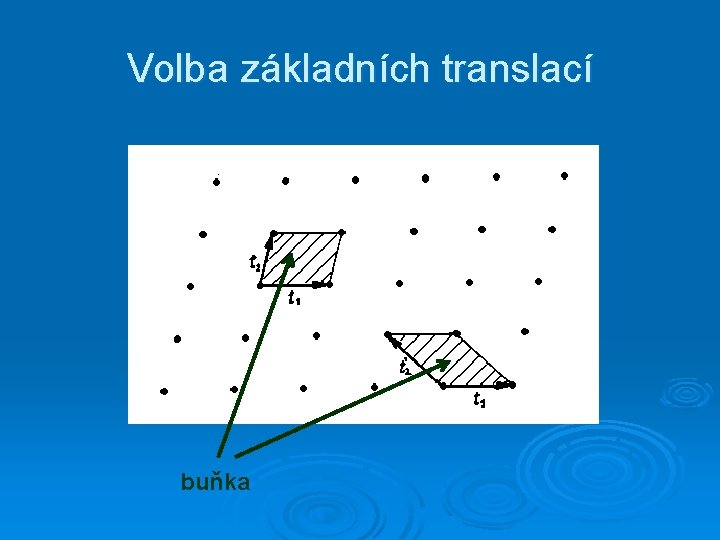
Volba základních translací buňka

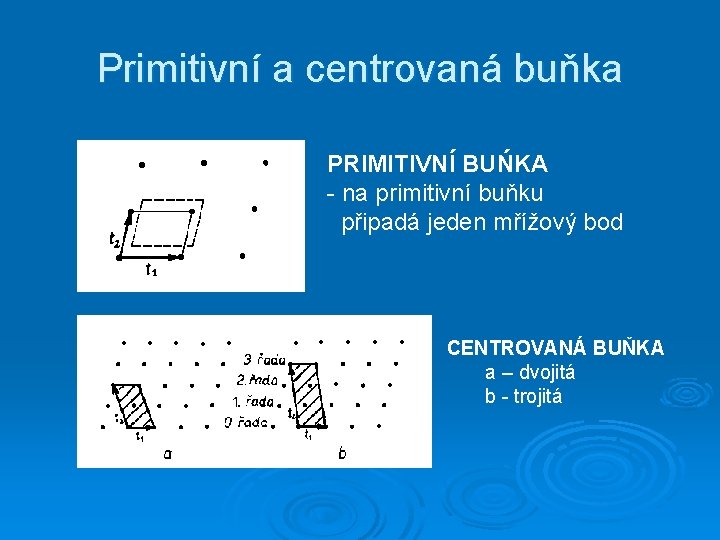
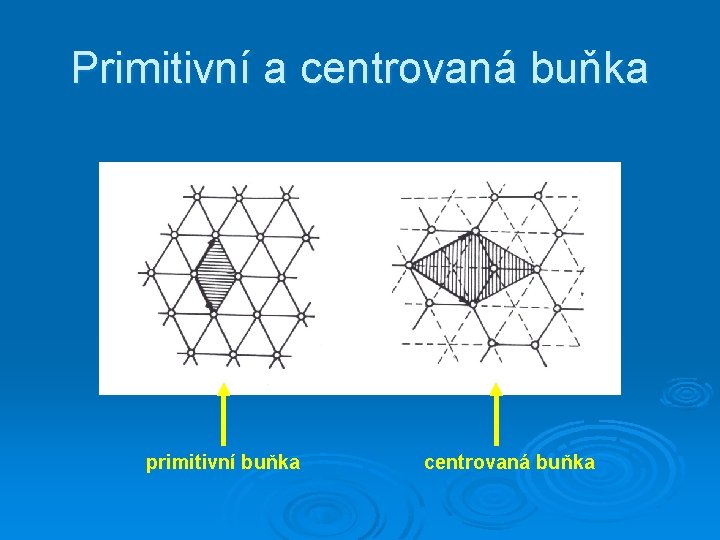
Primitivní a centrovaná buňka PRIMITIVNÍ BUŃKA - na primitivní buňku připadá jeden mřížový bod CENTROVANÁ BUŇKA a – dvojitá b - trojitá

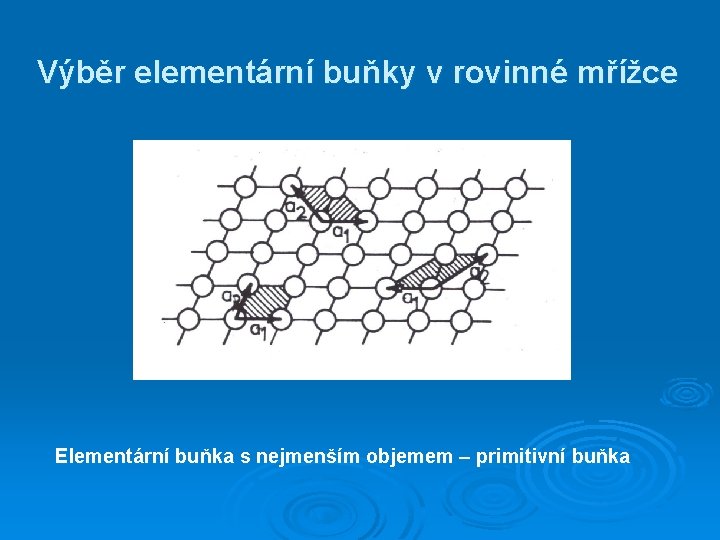
Výběr elementární buňky v rovinné mřížce Elementární buňka s nejmenším objemem – primitivní buňka

Primitivní a centrovaná buňka primitivní buňka centrovaná buňka

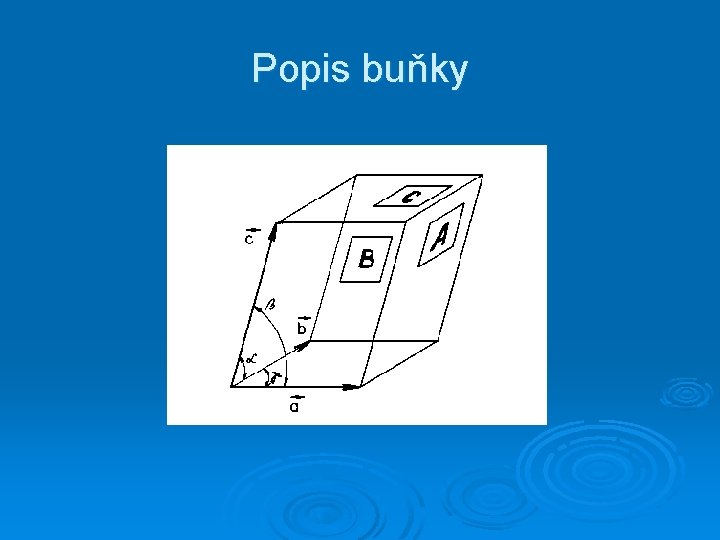
Popis buňky

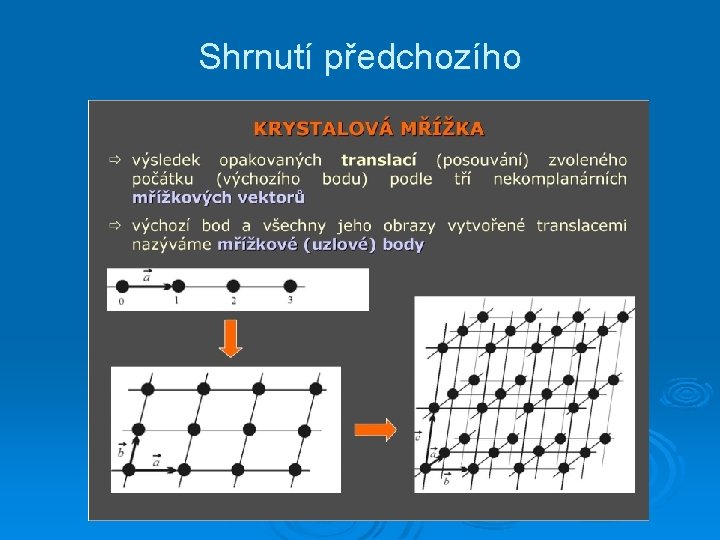
Shrnutí předchozího

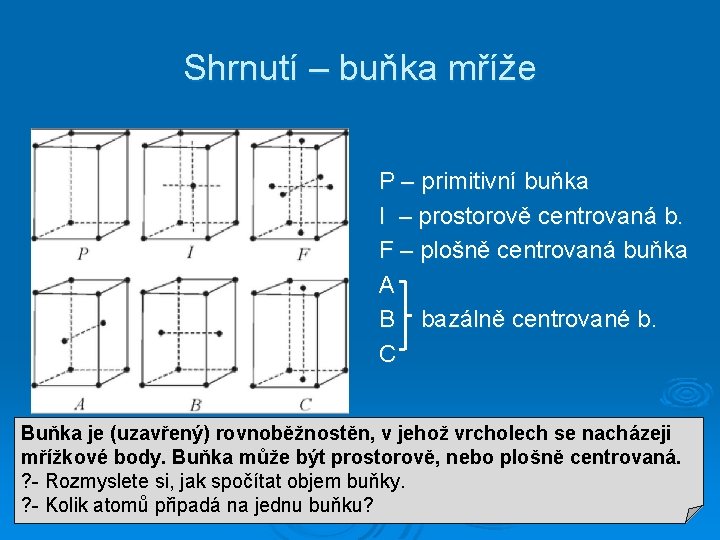
Shrnutí – buňka mříže P – primitivní buňka I – prostorově centrovaná b. F – plošně centrovaná buňka A B bazálně centrované b. C Buňka je (uzavřený) rovnoběžnostěn, v jehož vrcholech se nacházeji mřížkové body. Buňka může být prostorově, nebo plošně centrovaná. ? - Rozmyslete si, jak spočítat objem buňky. ? - Kolik atomů připadá na jednu buňku?

Základní prvky symetrie krystalů Ø střed inverze Ø rovina souměrnosti (zrcadlení) Ø n-četná rotační osa symetrie Ø n-četná inverzní osa rotace Ø n-četná šroubová rotační osa symetrie Ø translační rovina souměrnosti (skluzová rovina)

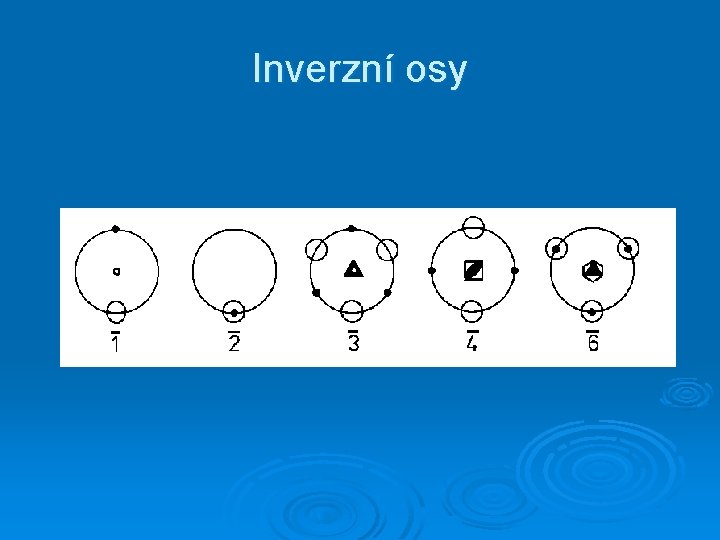
Inverzní osy

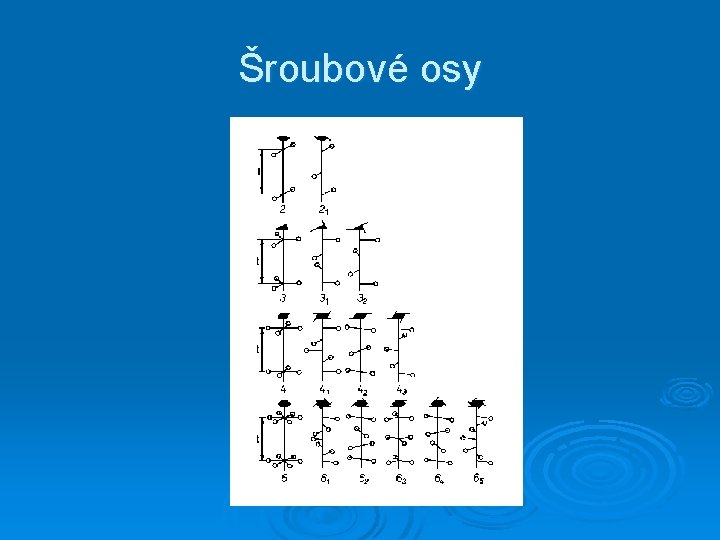
Šroubové osy

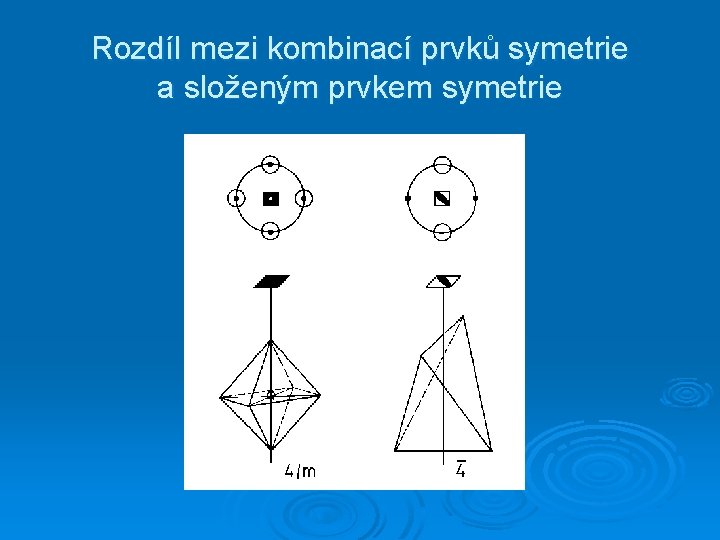
Rozdíl mezi kombinací prvků symetrie a složeným prvkem symetrie

Prvky symetrie neobsahující translaci střed inverze - ke každému atomu s průvodičem R existuje identický atom s průvodičem –R rovina souměrnosti (m) - rovina vůči níž jsou obě části krystalové struktury vzájemným zrcadlovým obrazem n-četná rotační osa - otočením o úhel 2 /n se krystal ztotožní sám se sebou n-četná inverzní osa rotace - po rotaci o úhel 2 /n kolem této osy a po následující inverzi splyne krystal sám se sebou

Prvky symetrie obsahující translaci n-četná šroubová osa - otočení o 2 /n a následující translace o c/n (kde c je nejmenší vzdálenost mezi uzlovými body ve směru osy) translační rovina souměrnosti (skluzová rovina) - krystalová struktura přechází sama v sebe operací zrcadlení a s ní spojenou translací ve směru rovnoběžném s touto rovinou zrcadlení

Bravaisovy buňky Bravaisova pravidla pro výběr základní buňky 1. Počet pravých úhlů v základní buňce musí být maximální. 2. Symetrie základní buňky musí být shodná se symetrií celé mřížky. 3. Při dodržení předchozích podmínek musí být objem základní buňky minimální. 4. V případě, kdy symetrie nemůže rozhodnout, vybírá se základní buňka, tak aby její hrany byly co nejkratší.

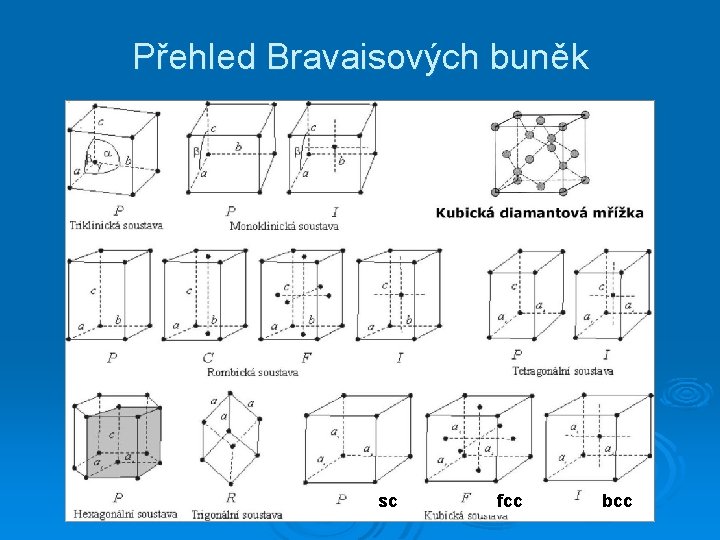
Bravaisovy buňky

Symetrie Bravaisových buněk krystalová soustava minimální symetrie triklinická (trojklonná) žádná monoklinická (jednoklonná) jedna 2četná osa podél c ortorombická (rombická, kosočtverečná) tři 2četné osy podél a, b , c tetragonální (čtverečná) jedna 4četná osa podél c kubická (izometrická) čtyři 3četné osy podél tělesových úhlopříček krychle hexagonální (šesterečná) jedna 6četná osa podél c trigonální (romboedrická, klencová) jedna 3četná osa podél hexagon. buňky

Přehled Bravaisových buněk sc fcc bcc

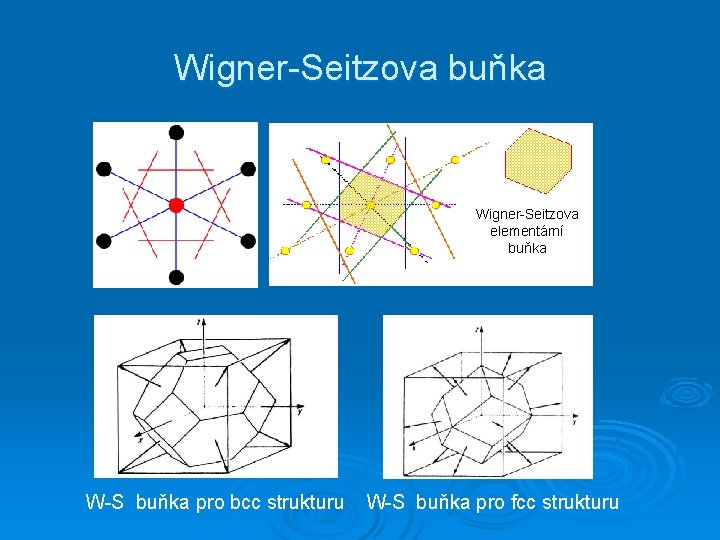
Wigner-Seitzova buňka Wigner-Seitzova elementární buňka W-S buňka pro bcc strukturu W-S buňka pro fcc strukturu

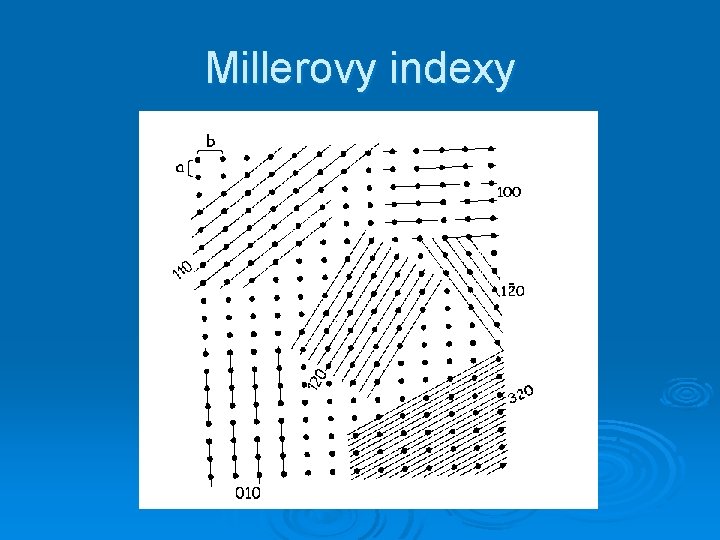
Millerovy indexy mřížových rovin

Millerovy indexy

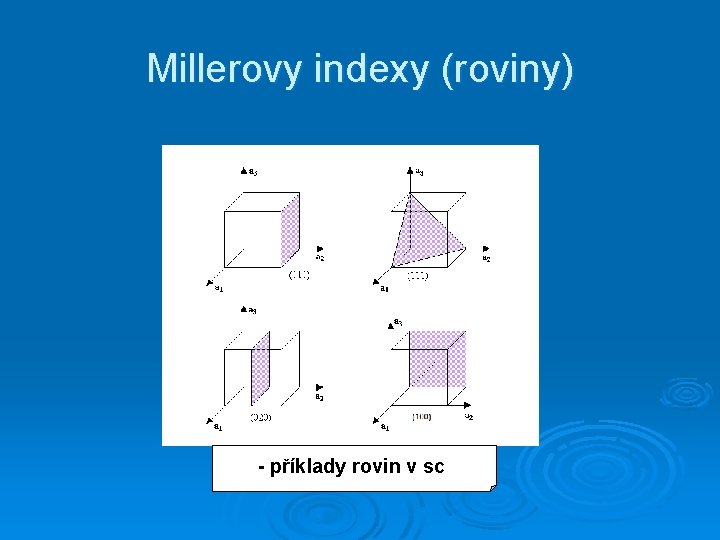
Millerovy indexy (roviny) - příklady rovin v sc

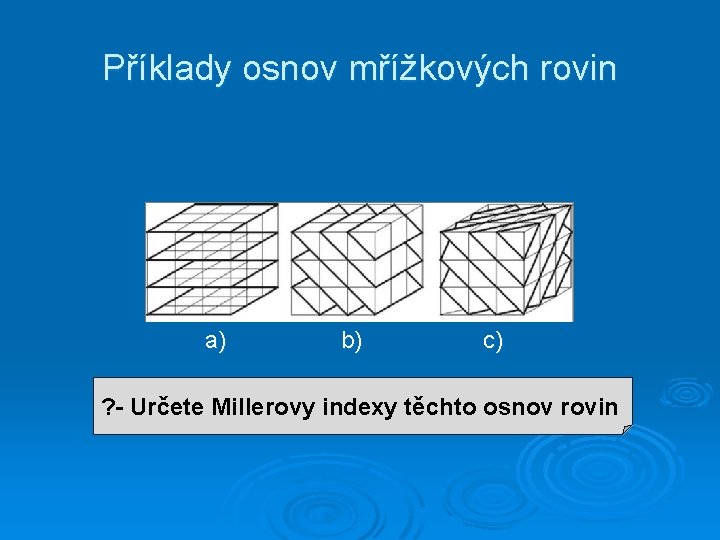
Příklady osnov mřížkových rovin a) b) c) ? - Určete Millerovy indexy těchto osnov rovin

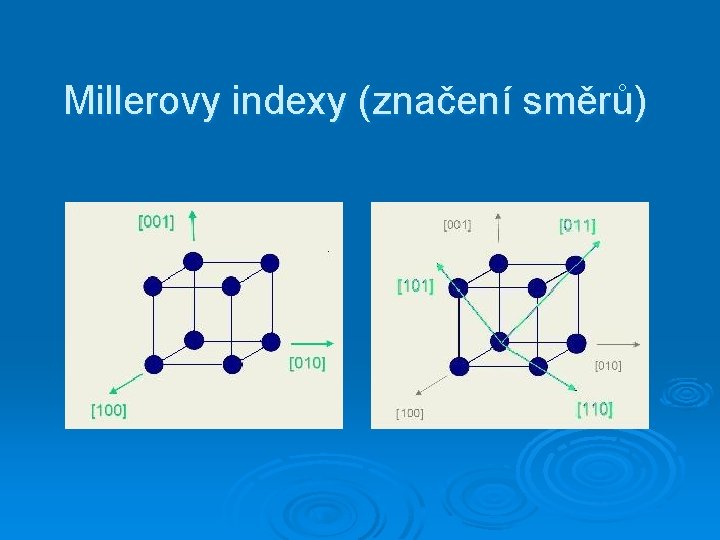
Millerovy indexy směrů

Millerovy indexy (značení směrů)

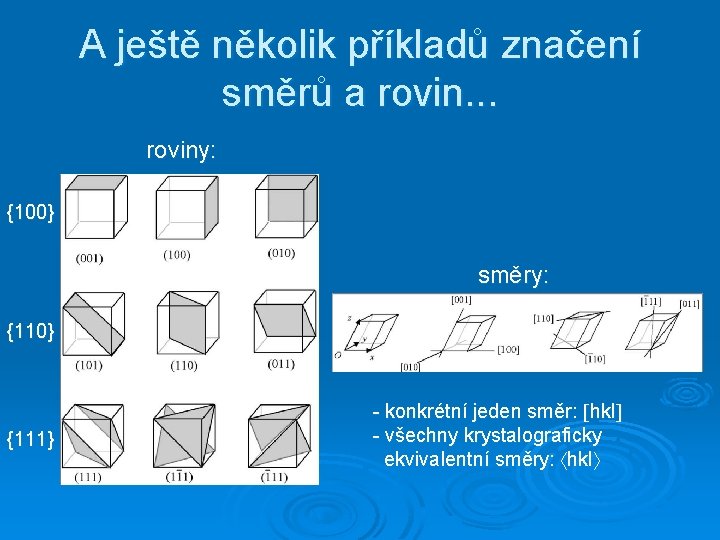
A ještě několik příkladů značení směrů a rovin. . . roviny: {100} směry: {110} {111} - konkrétní jeden směr: hkl - všechny krystalograficky ekvivalentní směry: hkl

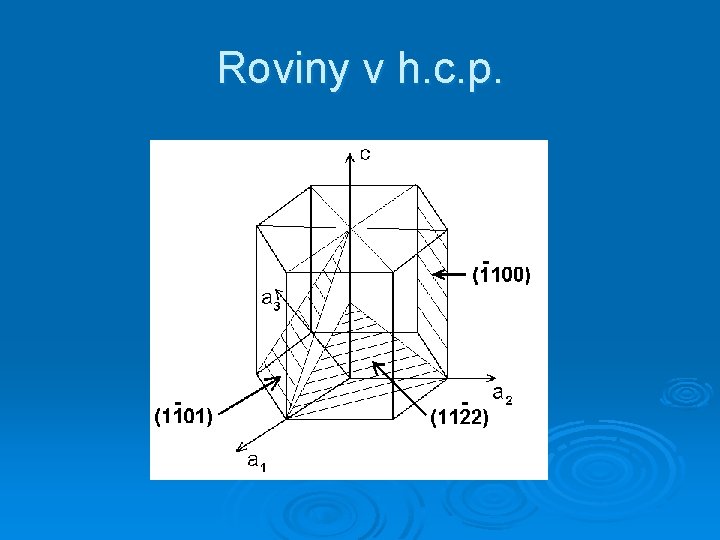
Roviny v h. c. p.

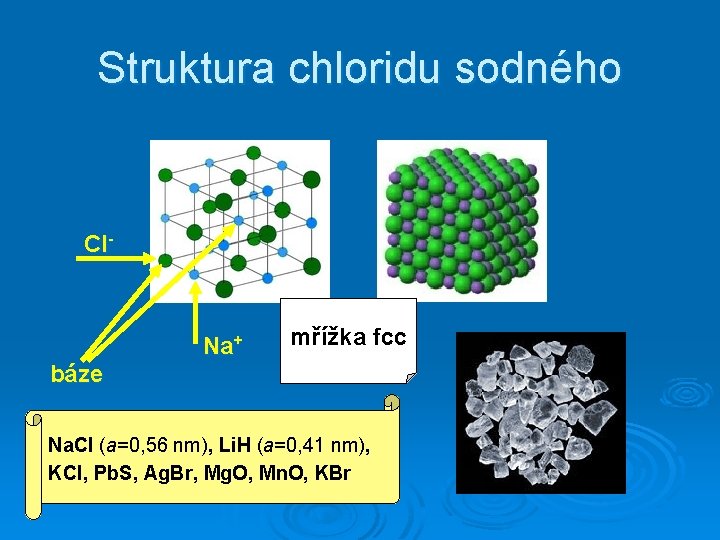
Struktura chloridu sodného Cl- Na+ mřížka fcc báze Na. Cl (a=0, 56 nm), Li. H (a=0, 41 nm), KCl, Pb. S, Ag. Br, Mg. O, Mn. O, KBr

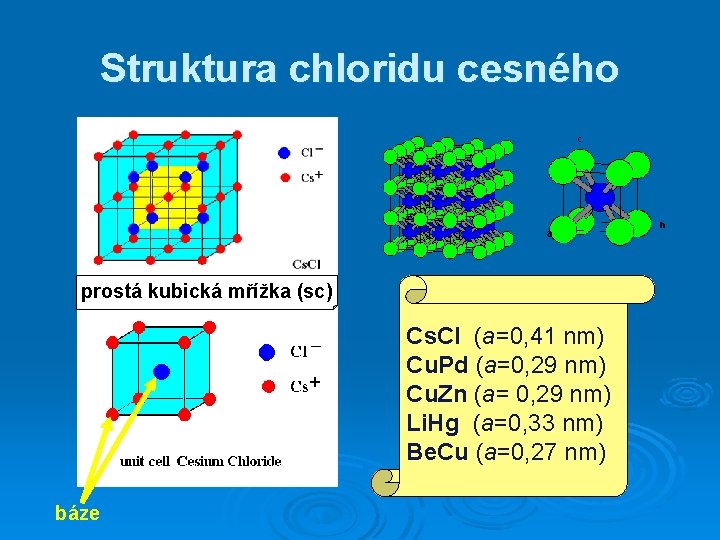
Struktura chloridu cesného prostá kubická mřížka (sc) Cs. Cl (a=0, 41 nm) Cu. Pd (a=0, 29 nm) Cu. Zn (a= 0, 29 nm) Li. Hg (a=0, 33 nm) Be. Cu (a=0, 27 nm) báze

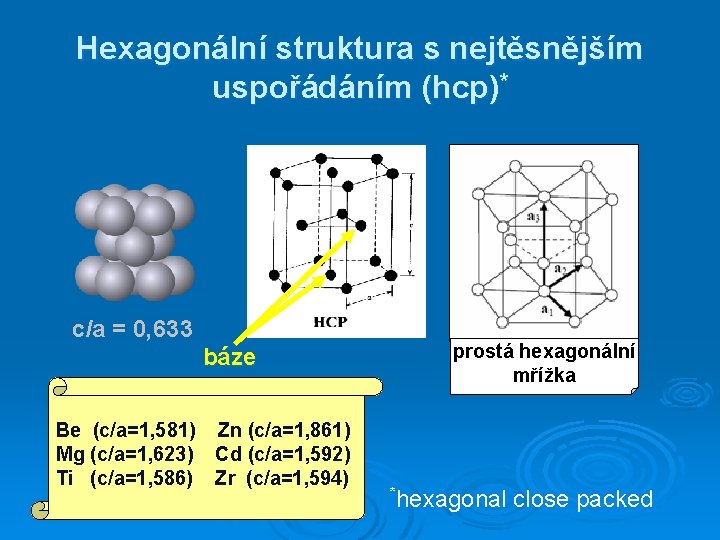
Hexagonální struktura s nejtěsnějším uspořádáním (hcp)* c/a = 0, 633 báze Be (c/a=1, 581) Zn (c/a=1, 861) Mg (c/a=1, 623) Cd (c/a=1, 592) Ti (c/a=1, 586) Zr (c/a=1, 594) prostá hexagonální mřížka *hexagonal close packed

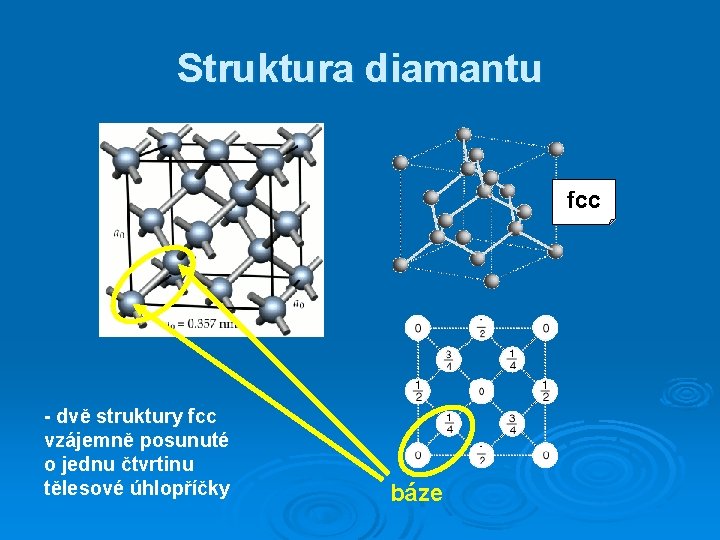
Struktura diamantu fcc - dvě struktury fcc vzájemně posunuté o jednu čtvrtinu tělesové úhlopříčky báze
 Centrom bunkového dýchania sú:
Centrom bunkového dýchania sú: Kontrola stavu pokladnice
Kontrola stavu pokladnice Kontrola stavu trénovanosti
Kontrola stavu trénovanosti Afrodita knidská
Afrodita knidská Půlkruhový oblouk románský sloh
Půlkruhový oblouk románský sloh Dorsky ionsky korintsky
Dorsky ionsky korintsky Benjamin franklin bleskozvod
Benjamin franklin bleskozvod Deformacne ucinky sily
Deformacne ucinky sily Fyzika v praxi
Fyzika v praxi Rezonancia oscilatora
Rezonancia oscilatora Kvantová fyzika test
Kvantová fyzika test Fyzika
Fyzika Klin fyzika
Klin fyzika Stavba oka fyzika
Stavba oka fyzika S v t fyzika
S v t fyzika Oko
Oko Jákobův žebřík fyzika
Jákobův žebřík fyzika Ivana gibová
Ivana gibová Fyzika
Fyzika Odchylka merania objemu
Odchylka merania objemu Popis rovnoramenné váhy
Popis rovnoramenné váhy Trecia sila
Trecia sila Schémy elektrických obvodov
Schémy elektrických obvodov Stavba oka fyzika
Stavba oka fyzika Zrážkomer fyzika
Zrážkomer fyzika Energia v prirode fyzika
Energia v prirode fyzika Man lat
Man lat Spojka fyzika
Spojka fyzika Polohová a pohybová energia
Polohová a pohybová energia Pohyb telesa fyzika
Pohyb telesa fyzika Vlhkomer projekt fyzika
Vlhkomer projekt fyzika Protdy
Protdy Zdroje zvuku fyzika
Zdroje zvuku fyzika Druhy teploměrů fyzika
Druhy teploměrů fyzika Ako meriame teplo
Ako meriame teplo Archimedova skrutka
Archimedova skrutka Slnečná energia fyzika
Slnečná energia fyzika Kvantová fyzika
Kvantová fyzika Fyzika
Fyzika Rovnoramenné váhy popis
Rovnoramenné váhy popis Fyzika veličiny
Fyzika veličiny Jednoduché stroje ozubené koleso
Jednoduché stroje ozubené koleso Oko stavba
Oko stavba Elektromagnetická indukce fyzika 9.ročník
Elektromagnetická indukce fyzika 9.ročník Druhy zrcadel fyzika
Druhy zrcadel fyzika Premeny skupenstva
Premeny skupenstva Polovodiče test fyzika
Polovodiče test fyzika Fyzika
Fyzika Fyzika 8 rocnik pohyb telesa
Fyzika 8 rocnik pohyb telesa Heinrich rudolf hertz
Heinrich rudolf hertz Dakujem za pozornost fyzika
Dakujem za pozornost fyzika Pascal fyzika
Pascal fyzika Zrážkomer fyzika
Zrážkomer fyzika Ohnisko fyzika
Ohnisko fyzika Odchýlka merania fyzika 6 rocnik
Odchýlka merania fyzika 6 rocnik Kvantová fyzika
Kvantová fyzika Kvantová fyzika
Kvantová fyzika Priklady hustota 6 rocnik
Priklady hustota 6 rocnik Teplo je druh
Teplo je druh