Europische Patientenakademie zu Therapeutischen Innovationen Prinzipien von neuen














- Slides: 24

Europäische Patientenakademie zu Therapeutischen Innovationen Prinzipien von neuen Studiendesigns

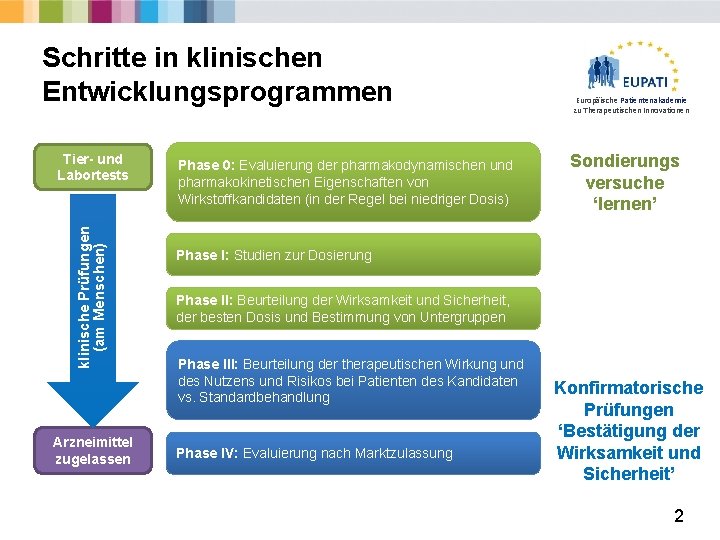
Schritte in klinischen Entwicklungsprogrammen klinische Prüfungen (am Menschen) Tier- und Labortests Arzneimittel zugelassen Phase 0: Evaluierung der pharmakodynamischen und pharmakokinetischen Eigenschaften von Wirkstoffkandidaten (in der Regel bei niedriger Dosis) Europäische Patientenakademie zu Therapeutischen Innovationen Sondierungs versuche ‘lernen’ Phase I: Studien zur Dosierung Phase II: Beurteilung der Wirksamkeit und Sicherheit, der besten Dosis und Bestimmung von Untergruppen Phase III: Beurteilung der therapeutischen Wirkung und des Nutzens und Risikos bei Patienten des Kandidaten vs. Standardbehandlung Phase IV: Evaluierung nach Marktzulassung Konfirmatorische Prüfungen ‘Bestätigung der Wirksamkeit und Sicherheit’ 2

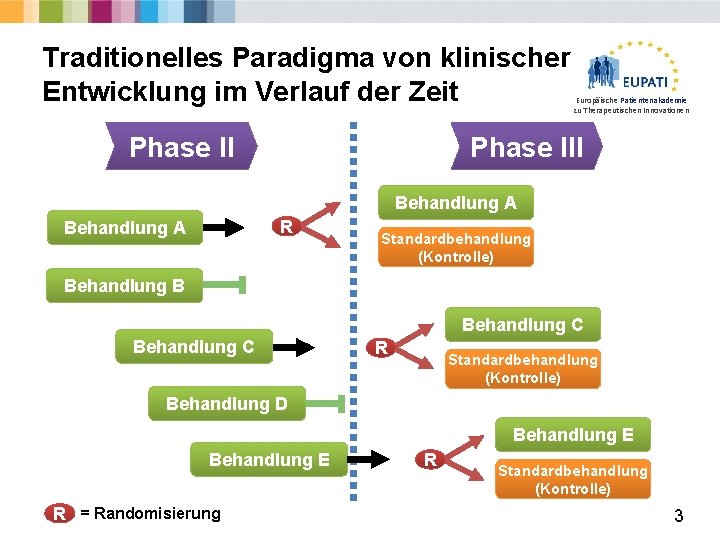
Traditionelles Paradigma von klinischer Entwicklung im Verlauf der Zeit Phase II Europäische Patientenakademie zu Therapeutischen Innovationen Phase III Behandlung A R Behandlung A Standardbehandlung (Kontrolle) Behandlung B Behandlung C R Standardbehandlung (Kontrolle) Behandlung D Behandlung E R = Randomisierung R Standardbehandlung (Kontrolle) 3

Herausforderungen des traditionellen Ansatzes Europäische Patientenakademie zu Therapeutischen Innovationen § Unwirksame Verwendung von finanziellen Ressourcen § Viele Patienten müssen in jede Prüfung involviert werden § Langsam und inflexibel: Ø Ermöglicht kein Lernen in Echtzeit im Verlauf der Prüfung § Modifikationen während des Studienverlaufs, um den Ansatz realitätsnäher zu gestalten, sind nicht erlaubt. Adaptives Design rationalisiert und optimiert den traditionellen Arzneimittelentwicklungsprozess. 4

Was ist ein adaptives Design? Europäische Patientenakademie zu Therapeutischen Innovationen ‚… Ein Studiendesign wird als ‘adaptiv’ bezeichnet, wenn die statistische Vorgehensweise die Modifikation eines Designelements (z. B. Stichprobengröße, Randomisierungsverhältnis, Anzahl der Behandlungsarme) bei einer Zwischenanalyse zulässt. . . ‘ Europäische Arzneimittel-Agentur (2007). CHMP/EWP/2459/02 Reflection paper on methodological issues in confirmatory clinical trials planned with an adaptive design. Abgerufen am 4. September 2015 von http: //www. ema. europa. eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC 500003616. pdf 5

Herausforderungen des adaptiven Designs Europäische Patientenakademie zu Therapeutischen Innovationen § Um die operativen Merkmale zu kontrollieren § Um die Verzerrung aufgrund der Anpassung zu kontrollieren Ø Statistisch Ø Operativ § Um zu gewährleisten, dass die Ergebnisse erklärt und interpretiert werden können 6

Einige mögliche Ansätze § Modifikationen der/des Ø Eignungskriterien für die Studie Europäische Patientenakademie zu Therapeutischen Innovationen Gut verstanden Ø Studienstichprobengröße oder des Studienziels, um die Gesamtstärke zu erhalten Ø Behandlungsarms Ø Analyseplans § frühen Abbruchregeln aus Gründen der Nutzlosigkeit oder Wirksamkeit (gruppensequenzielle Designs) § Weglassens von Behandlungsarmen / ‘Pick-the. Winner’-Designs § Bereicherungs-Designs § Adaptive Randomisierung Weniger gut verstanden 7

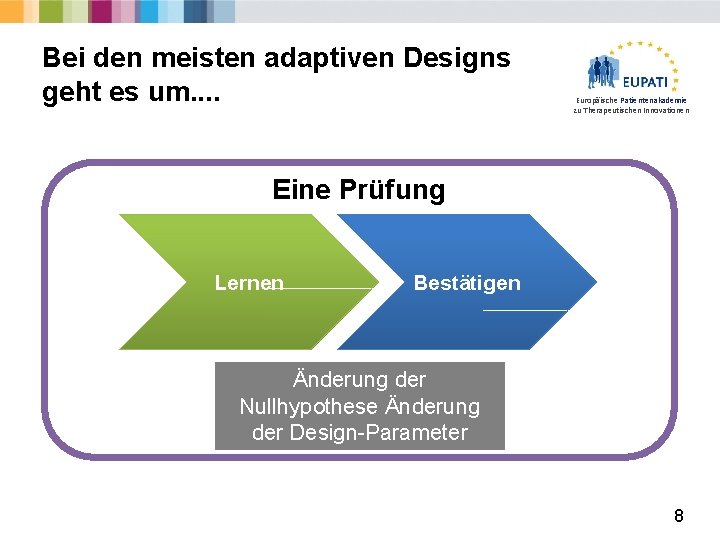
Bei den meisten adaptiven Designs geht es um. . Europäische Patientenakademie zu Therapeutischen Innovationen Eine Prüfung Lernen Bestätigen Änderung der Nullhypothese Änderung der Design-Parameter 8

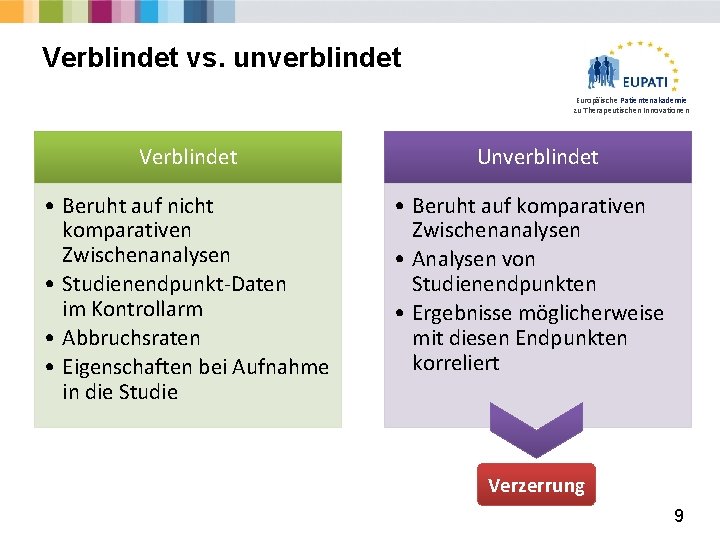
Verblindet vs. unverblindet Europäische Patientenakademie zu Therapeutischen Innovationen Verblindet • Beruht auf nicht komparativen Zwischenanalysen • Studienendpunkt-Daten im Kontrollarm • Abbruchsraten • Eigenschaften bei Aufnahme in die Studie Unverblindet • Beruht auf komparativen Zwischenanalysen • Analysen von Studienendpunkten • Ergebnisse möglicherweise mit diesen Endpunkten korreliert Verzerrung 9

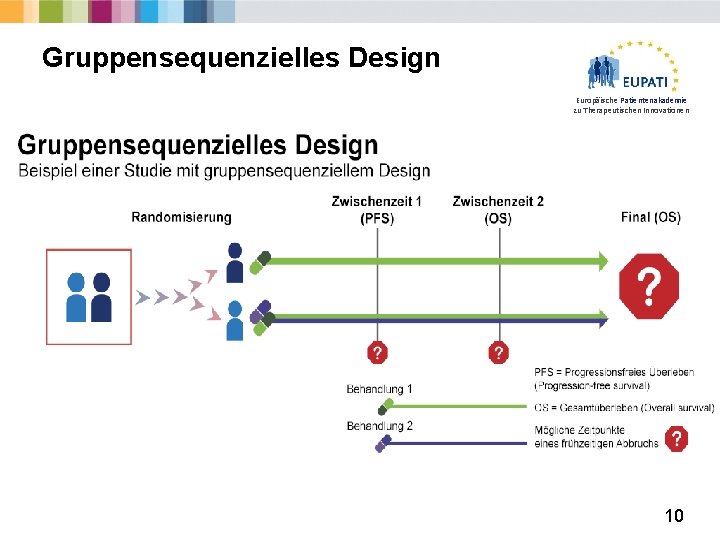
Gruppensequenzielles Design Europäische Patientenakademie zu Therapeutischen Innovationen 10

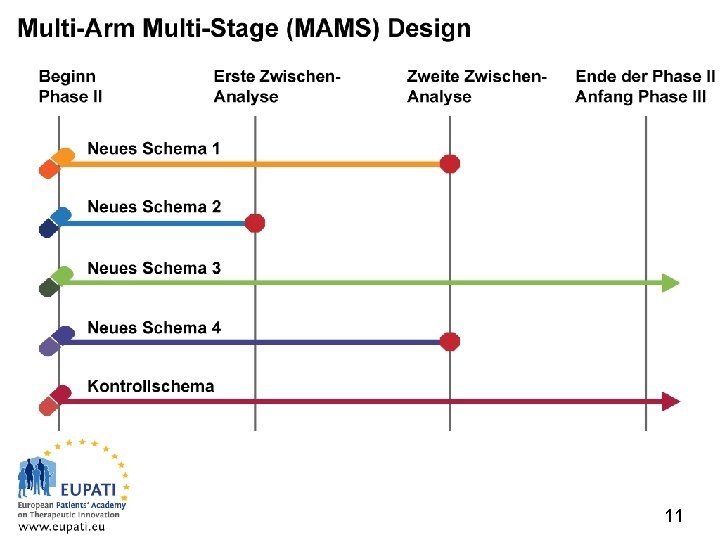
Multi-Arm Multi-Stage (MAMS) Design Europäische Patientenakademie zu Therapeutischen Innovationen 11

Beispiel 2 – Vor- und Nachteile des Multi-Arm Multi-Stage Designs Europäische Patientenakademie zu Therapeutischen Innovationen Vorteile Nachteile • Weniger Patienten • Insgesamt weniger Zeit erforderlich für die Arzneimittelentdeckung • Weniger Anträge und Genehmigungen erforderlich • Flexibel: Arme können hinzugefügt oder weggelassen werden • Reduzierte Kosten • Komplexe operative Merkmale • Erforderliche Anzahl an Patienten • Studiendauer • Weitere Rekrutierung im Kontrollarm • Kein Vergleich zwischen den Studienarmen 12

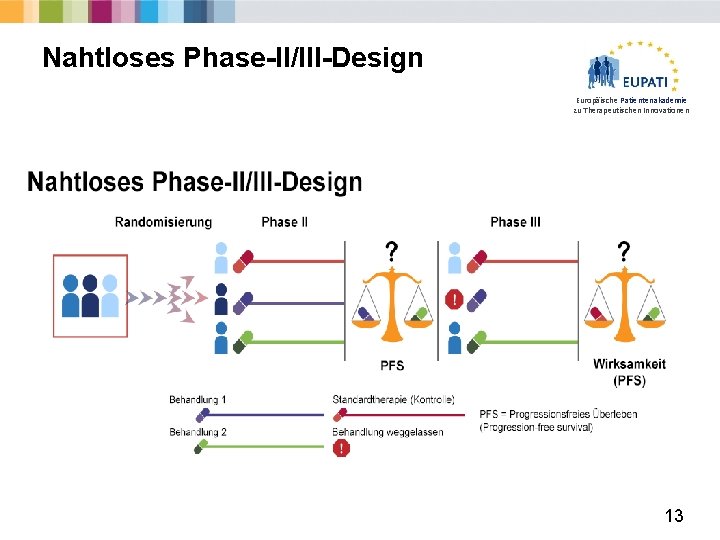
Nahtloses Phase-II/III-Design Europäische Patientenakademie zu Therapeutischen Innovationen 13

Vor- und Nachteile des nahtlosen Phase-II/III-Designs Europäische Patientenakademie zu Therapeutischen Innovationen Vorteile Nachteile • Beide Schritte werden unabhängig durchgeführt und in einem Testergebnis miteinander kombiniert • Verkürzt die Zeit und die Exposition der Patienten • Relativ flexibel • Effiziente Verwendung von Patientenressourcen • Komplexes Statistik-Design • Lücke in der Rekrutierung zwischen Phase II und Phase III • Logistisch herausfordernd • Schwierig bei Studien mit langfristigen Endpunkten • Verkürzt die Exposition der Patienten (nicht immer gut) • Können „Signale” (gut oder schlecht) in der Kombination verloren gehen? 14

Adaptive Designs in seltenen Krankheiten Europäische Patientenakademie zu Therapeutischen Innovationen § Klassische Studien für seltene Krankheiten werden in der Regel für große Wirkungen durchgeführt. § Adaptive Designs bieten eine ansprechende Alternative, zumal: Ø sie den Entwicklungsprozess verkürzen, ohne dabei die Gültigkeit oder Wirksamkeit zu beeinträchtigen Ø unwirksame Behandlungen früher identifiziert werden können Ø sie eine effizientere Verwendung von Ressourcen ermöglichen 15

Schlussfolgerungen (1) Europäische Patientenakademie zu Therapeutischen Innovationen § Neue Studiendesigns können Folgendes ermöglichen: Ø Flexible Designstrategien Ø Effizientere Verwendung von Ressourcen Ø Kürzerer Entwicklungsprozess § Aus regulatorischer Sicht ist es wichtig, die Gültigkeit und Integrität in adaptiven Designs zu erhalten: Ø Sie müssen die gleiche Frage behandeln, wie traditionelle klassische klinische Prüfungen Ø Die operative Verzerrung muss kontrolliert werden Ø Mögliche statistisch signifikante Fehler müssen kontrolliert werden Ø Ergebnisse müssen zuverlässig interpretiert werden 16

Schlussfolgerungen (2) Europäische Patientenakademie zu Therapeutischen Innovationen „Obwohl adaptive Designs die Antwort in Bezug auf die Wirksamkeit einer bestimmten Behandlung 'nicht verändern können', können sie die Effizienz bei der Suche nach einer Antwort erhöhen. “ Kairalla, J. A. , Coffey, C. S. , Thomann, M. A. , & Muller, K. E. (2012) ‘Adaptive trial designs: A review of barriers and open opportunities. ’ Trials, 13(145), abgerufen am 4. September 2015 von http: //www. trialsjournal. com/content/pdf/1745 -6215 -13 -145. pdf 17

Literatur (1): Europäische Patientenakademie zu Therapeutischen Innovationen § Europäische Arzneimittel-Agentur (2007). CHMP/EWP/2459/02 Reflection paper on methodological issues in confirmatory clinical trials planned with an adaptive design. Abgerufen am 4. September 2015 von http: //www. ema. europa. eu/docs/en_GB/document_library/Scientific_guideline/ 2009/09/WC 500003616. pdf § Chow, SC, Chang M (2008). ‘Adaptive design methods in clinical trials – a review. ’ Orphanet Journal of Rare Diseases, 3(11), abgerufen am 4. September 2015 von http: //www. ojrd. com/content/pdf/1750 -1172 -3 -11. pdf § Judson, I. , Verweij, J. , Gelderblom, H. , et al. (2012). Results of a randomised phase III trial (EORTC 62012) of single agent doxorubicin versus doxorubicin plus ifosfamide as first line chemotherapy for patients with advanced or metastatic soft tissue sarcoma: a survival study by the EORTC Soft Tissue and Bone Sarcoma Group. Abgerufen am 4. September 2015 von https: //www. webges. com/cslide/esmo 2012/public/download_uploaded_media/ pdf/1082 18

Literatur (2): Europäische Patientenakademie zu Therapeutischen Innovationen § Sydes, M. R. , Parmar, M. K. , James, N. D. , et al. (2009). ‘Issues in applying multi -arm multi-stage methodology to a clinical trial in prostate cancer: the MRC STAMPEDE trial. ’ Trials, 10(39), abgerufen am 4. September 2015 von http: //www. trialsjournal. com/content/10/1/39 § Kairalla, J. A. , Coffey, C. S. , Thomann, M. A. , & Muller, K. E. (2012) ‘Adaptive trial designs: A review of barriers and open opportunities. ’ Trials, 13(145), abgerufen am 4. September 2015 von http: //www. trialsjournal. com/content/pdf/1745 -6215 -13 -145. pdf § Mehta, C. R. (2010). Software for adaptive sample size re-estimation of confirmatory time to event trials. Cytel Webinar. Cambridge, M. A. : Cytel. Abgerufen am 4. September 2015 von http: //www. cytel. com/pdfs/East. Surv. Adapt-Webinar_10. pdf 19

BACKUPS 20

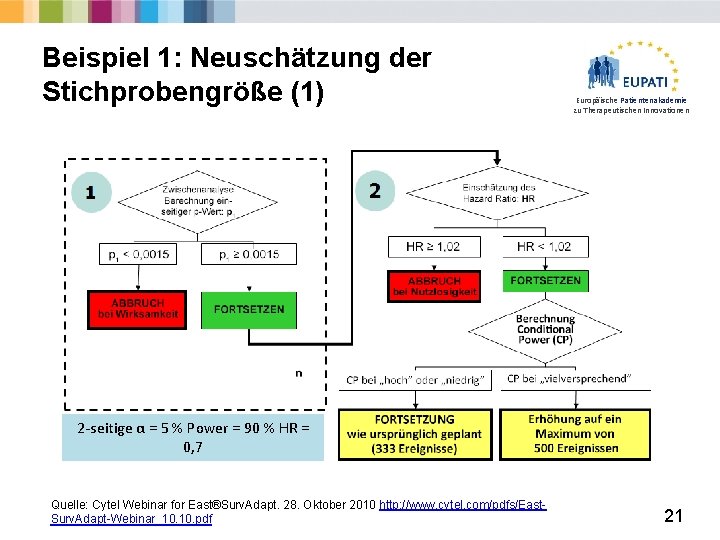
Beispiel 1: Neuschätzung der Stichprobengröße (1) Europäische Patientenakademie zu Therapeutischen Innovationen 2 -seitige α = 5 % Power = 90 % HR = 0, 7 Quelle: Cytel Webinar for East®Surv. Adapt. 28. Oktober 2010 http: //www. cytel. com/pdfs/East. Surv. Adapt-Webinar_10. pdf 21

Beispiel 1: Neuschätzung der Stichprobengröße (2) Europäische Patientenakademie zu Therapeutischen Innovationen Nachteile: § Kann das Risiko einer vergrößerten, negativen Studie erhöhen. § Beruht auf unverblindeten Zwischenergebnissen – Verzerrung. § Möglichkeit von ‘Mutmaßungen’ Ø Eine Entscheidung für eine Neuschätzung kann leicht so ausgelegt werden, dass ‚die Behandlung nicht so wirksam ist, wie erwartet‘. Ø Operative Verzerrung? Rekrutierung? Ø Erfordert möglicherweise umfangreiche (teure) Logistik. Der Schutz der Studienintegrität ist unerlässlich! 22

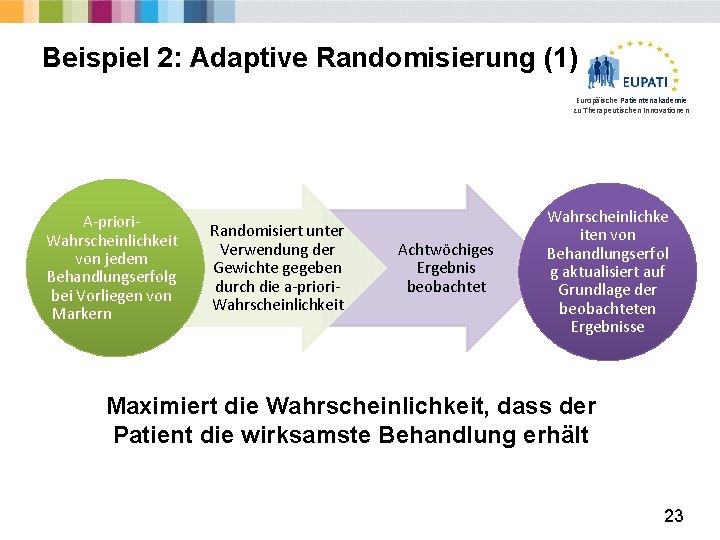
Beispiel 2: Adaptive Randomisierung (1) Europäische Patientenakademie zu Therapeutischen Innovationen A-priori. Wahrscheinlichkeit von jedem Behandlungserfolg bei Vorliegen von Markern Randomisiert unter Verwendung der Gewichte gegeben durch die a-priori. Wahrscheinlichkeit Achtwöchiges Ergebnis beobachtet Wahrscheinlichke iten von Behandlungserfol g aktualisiert auf Grundlage der beobachteten Ergebnisse Maximiert die Wahrscheinlichkeit, dass der Patient die wirksamste Behandlung erhält 23

Beispiel 2: Adaptive Randomisierung (2) Europäische Patientenakademie zu Therapeutischen Innovationen Herausforderungen: § Erfordert schnellen Datenfluss - logistisch anspruchsvoll, vor allem in großen multizentrischen Studien. § Funktioniert nicht bei langfristigen Endpunkten. § Es ist schwierig, Ergebnisse jenseits der Einschätzung zu interpretieren: Ø Vergleiche sind schwierig Ø Präzision § Rekrutierungsmuster können während des Studienverlaufs geändert werden (operative Verzerrung). Verblindung ist unerlässlich, ist jedoch möglicherweise nicht immer machbar. 24
 Patientenakademie
Patientenakademie Konfrontationsmethode sport
Konfrontationsmethode sport Universalgriff badminton
Universalgriff badminton Prinzipien guten unterrichts
Prinzipien guten unterrichts Aufgabenanalyse projektmanagement
Aufgabenanalyse projektmanagement Induktiv deduktiv beispiel unterricht
Induktiv deduktiv beispiel unterricht Vorderarmfraktur
Vorderarmfraktur Prinzipien des geschichtsunterrichts
Prinzipien des geschichtsunterrichts Bewegungsbeschreibung hochsprung
Bewegungsbeschreibung hochsprung Azyklische bewegung beispiele
Azyklische bewegung beispiele Fallstrukturhypothese
Fallstrukturhypothese Etymologisches prinzip
Etymologisches prinzip Bernd knittel
Bernd knittel Grapheminventar
Grapheminventar Erasmus von rotterdam beeinflusst von
Erasmus von rotterdam beeinflusst von Kurshalter
Kurshalter Complejo von meyenburg
Complejo von meyenburg Plexus de rashkow
Plexus de rashkow Pulsmessung werte
Pulsmessung werte Conjunktivit
Conjunktivit Schemat systemu komputerowego
Schemat systemu komputerowego Copyright
Copyright Tổng kết vốn từ 151
Tổng kết vốn từ 151 Martin luther lebenslauf unterrichtsmaterial
Martin luther lebenslauf unterrichtsmaterial Manipulation von schutzeinrichtungen rechtliche folgen
Manipulation von schutzeinrichtungen rechtliche folgen