Elektron Transport Zincir Solunum Zinciri Elektronlar NADHtan 02ye
























- Slides: 35

Elektron Transport Zincirî (Solunum Zinciri)

Elektronlar ; NADH'tan 02'ye, ØFlavinlerden, ØHem gruplarından, ØFe-S protein komplekslerinden, ØKinonlardan ibaret elektron taşıyıcıları tarafından aktarılır Kinonların dışında bu elektron taşıyıcılarının tamamı proteinlerin prostetik gruplarıdır.

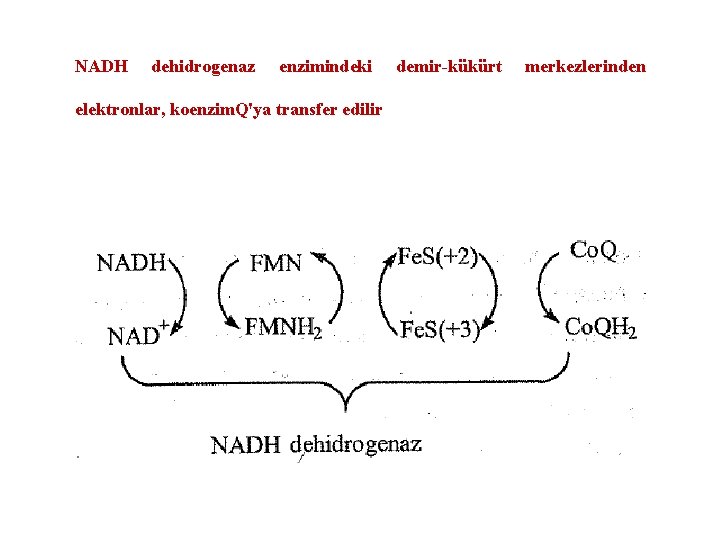
İlk reaksiyon NADH'ın NADH dehidrögenaz (veya NADH-Q redüktaz) multienzim kompleksi tarafından yükseltgenmesidir. NADH'dan iki elektron enzimin prostetik grubu olan flavin mononükleotid (FMN)'e aktarılarak FMNH 2'ye indirgenir. NADH + H+ FMNH 2 + NAD+

Daha sonra elektronlar FMNH 2'den NADH dehidrogenaz kompleksinin bir başka prostetik grubunu teşkil eden bir seri demir-kükürt (Fe. S olarak gösterilir) komplekslerine aktarılır. Burada demir atomları "hem" grubuna ait değildir.

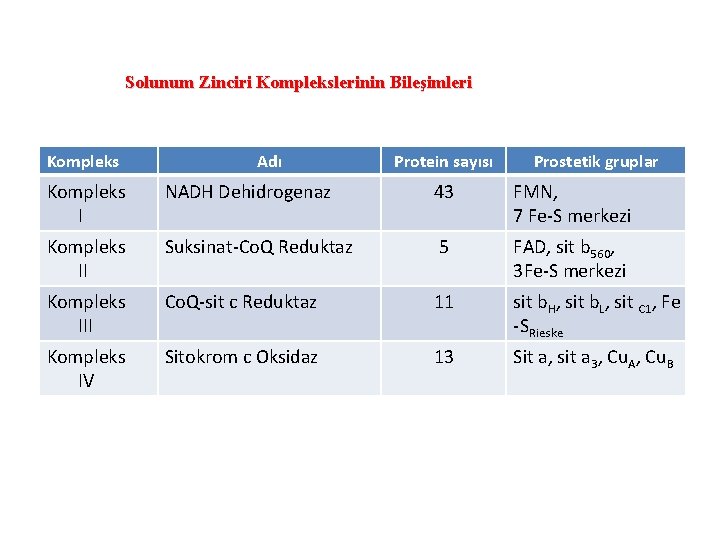
Solunum Zinciri Komplekslerinin Bileşimleri Kompleks Adı Protein sayısı Prostetik gruplar Kompleks I NADH Dehidrogenaz 43 FMN, 7 Fe-S merkezi Kompleks II Suksinat-Co. Q Reduktaz 5 FAD, sit b 560, 3 Fe-S merkezi Kompleks III Co. Q-sit c Reduktaz 11 sit b. H, sit b. L, sit C 1, Fe -SRieske Kompleks IV Sitokrom c Oksidaz 13 Sit a, sit a 3, Cu. A, Cu. B

Son yıllarda yapılan araştırmalar demir-kükürt proteinlerinin biyolojik sistemlerdeki bir çok redoks reaksiyonlarında çok önemli roller oynadığını ortaya koymuştur

Üç tip Fe. S merkezi, bilinmektedir Bunların en basitinde, tek bir Fe atomu, protein yapısındaki sisteinlerin -SH gruplarına tetrahedral koordinasyon bağları ile bağlanmış haldedir.

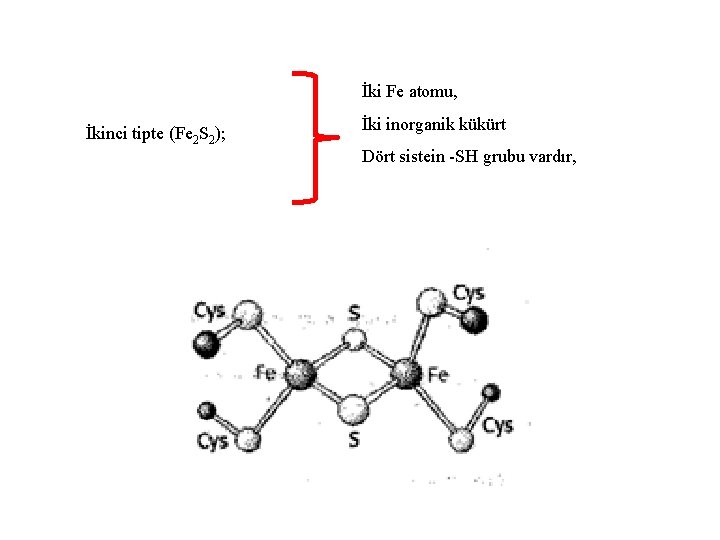
İki Fe atomu, İkinci tipte (Fe 2 S 2); İki inorganik kükürt Dört sistein -SH grubu vardır,

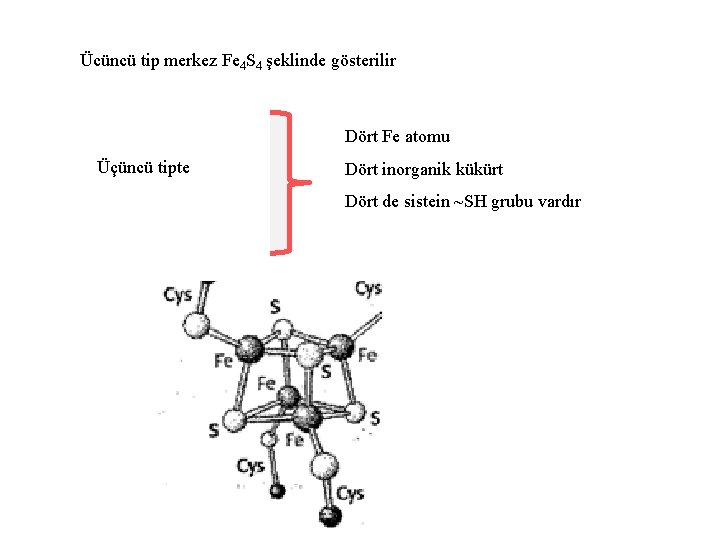
Ücüncü tip merkez Fe 4 S 4 şeklinde gösterilir Dört Fe atomu Üçüncü tipte Dört inorganik kükürt Dört de sistein ~SH grubu vardır

Bu komplekslerde demir atomu, Fe+2 ve Fe+3 yükseltgenme basamaklarındadır. NADH dehidrogenaz sisteminde Fe 4 S 4 tipindeki merkezler vardır. hem Fe 2 S 2 hem de

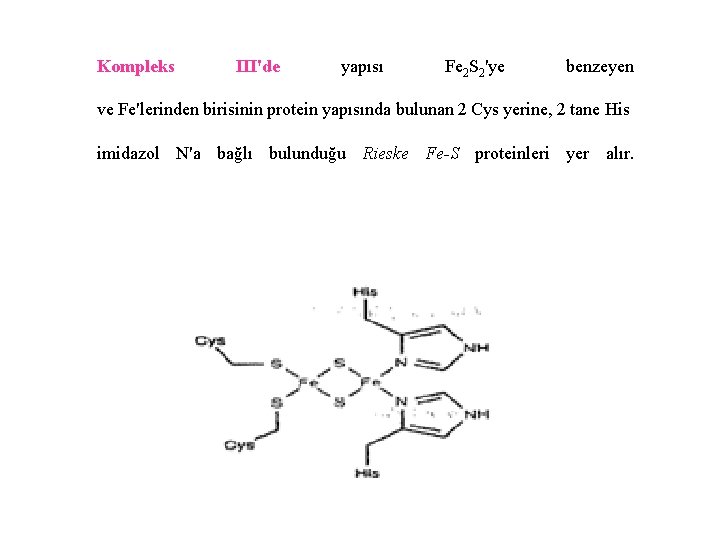
Kompleks III'de yapısı Fe 2 S 2'ye benzeyen ve Fe'lerinden birisinin protein yapısında bulunan 2 Cys yerine, 2 tane His imidazol N'a bağlı bulunduğu Rieske Fe-S proteinleri yer alır.

NADH dehidrogenaz enzimindeki elektronlar, koenzim. Q'ya transfer edilir demir-kükürt merkezlerinden

Koenzim Q (Co. Q), uzun bir izopren zinciri takılı bir kinon türevidir UBİKİNON adı da verilir İzopren birimlerinin sayısı türden türe değişir Memelilerde en bol bulunanı n=10 Co. Qıo olarak gösterilir

Koenzim Q (Co. Q)’nun okside ve redükte yapıları

İzopren zinciri Co. Q'yu oldukça apolar yapar ve iç mitokondri membranında hidrokarbon fazına kolayca difüze olmasını sağlar. Co. Q solunum zincirinde bir proteinin prostetik grubu olmayan tek elektron taşıyıcısıdır ve zincirin flavoproteinleri ile sitokromları arasında oldukça hareketli bir taşıyıcılık görevi yapabilmesine yol açar.

Süksinat dehidfogenaz enzimi tarafından sitrik asit devrinde, süksinatın fumarata yükseltgenniesiyle FADH 2 oluşur. Bu enzim süksinat-Co. Q redüktâz enzim kompleksinin bir bileşeni olup, diğer bileşeni de 3 adet Fe-S merkezine şahip olan bir proteindir

Bu kompleks de NADH dehidrogenaz gibi iç mitokondri membranının integral proteinidir. FADH 2' deki yüksek potansiyele sahip elektronlar kompleksteki Fe. S merkezlerine ve oradan da solunum zincirindeki Co. Q'ya aktarılır.

Bu kompleksin yapısında membrana gömülü altbirimlerine bağlı olarak bir Hem b prostetik ğrubu bulunmaktadır. Ancak, bu grup e transferinde görev almaz, süperoksit oluşumunun engellenmesinde bulunur.

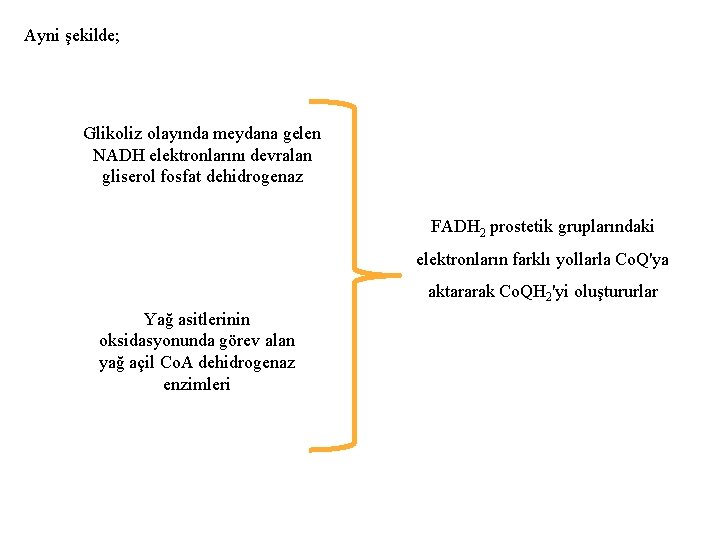
Ayni şekilde; Glikoliz olayında meydana gelen NADH elektronlarını devralan gliserol fosfat dehidrogenaz FADH 2 prostetik gruplarındaki elektronların farklı yollarla Co. Q'ya aktararak Co. QH 2'yi oluştururlar Yağ asitlerinin oksidasyonunda görev alan yağ açil Co. A dehidrogenaz enzimleri

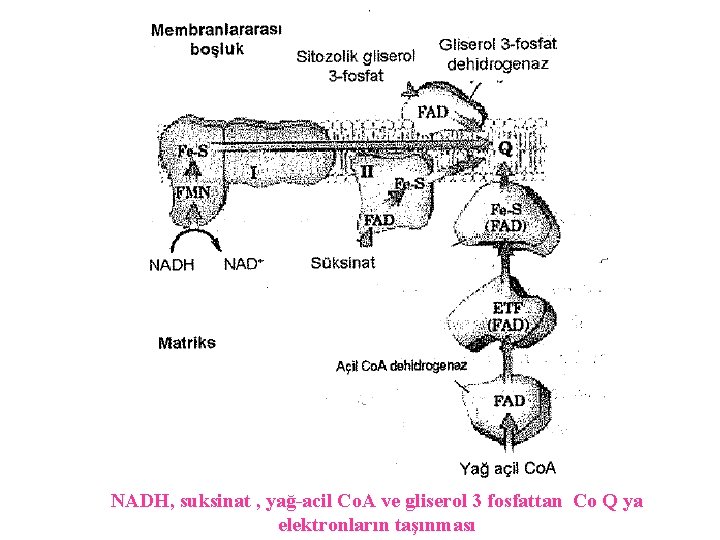
NADH, suksinat , yağ-acil Co. A ve gliserol 3 fosfattan Co Q ya elektronların taşınması

Co. QH 2 ile O 2 arasındaki elektron taşıyıcıların bir tane Fe. S proteinin dışında, hepsi SİTOKROMLARDIR. Sitokromlar prostetik grup olarak "hem" grubu ihtiva eden elektron taşıyıcı proteinlerdir

ü Sitokromlardaki Fe atomları indirgenmiş Fe+2 hali ile, yükseltgenmiş Fe+3 hali arasında mekik dokur. ü Hem grubu bir Fe. S merkezi gibi tek elektron taşıyabilir. ü NAOH, flavinler ve Co. Q iki elektron transfer edebilir. üBir Co. QH 2 molekülü yüksek potansiyelli iki elektronunu solunum zincirinin daha sonraki üyesi olan iki adet sitokrom b'ye aktarır

Co. QH 2 ve 02 arasında beş çeşit sitokrom vardır Sitokrom b ve cı, bir tane Fe. S Tprot. Qİm(Rieske Fe-S ) ile beraber Co. QSit c redüktaz (veya ubikinon-sitokrom multienzim kompleksinin bileşenleridir. c oksidoredüktaz)

Sitokrom c, elektronları bu kompleksten, bileşen olarak sitokrom a ve a 3 ihtiva eden, Sit c, oksidaz (yeya sitokrom oksidaz) kompleksiııe transfer ederler. Bu sitokromlar artan indirgenme potansiyellerine göre sıralanmıştır. OH 2 Sit b Fe. S Sit c 1 Sit c Sit a 3 O 2

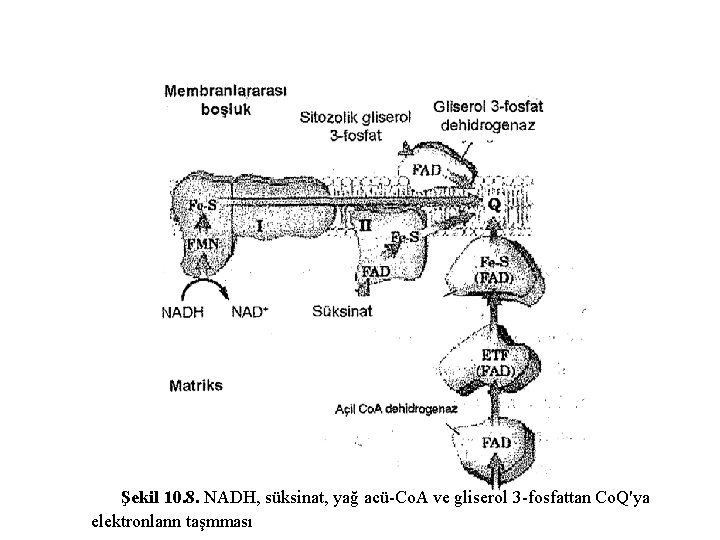
Şekil 10. 8. NADH, süksinat, yağ acü-Co. A ve gliserol 3 -fosfattan Co. Q'ya elektronlann taşmması

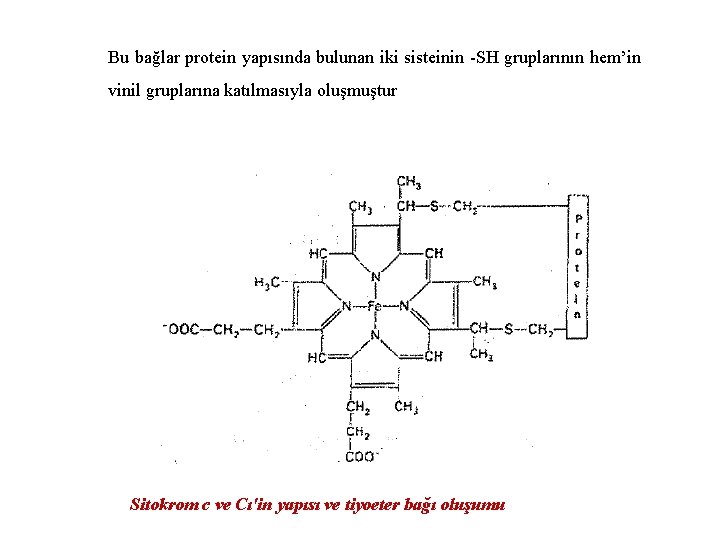
ØBu sitokromların yapıları birbirinden farklı özelliklere sahiptir. ØSitokrom b c 1 ve c de prostetik grup “hem” adı verilen bir demir protoporfirin IX’dur. ØSitokrom b de “hem” proteine kovalent bağanmamıstır. ØSitokrom c ve c 1 de “hem” proteine tiyoeter bağlarıyla bağlanmıştır.

Bu bağlar protein yapısında bulunan iki sisteinin -SH gruplarının hem’in vinil gruplarına katılmasıyla oluşmuştur Sitokrom c ve Cı'in yapısı ve tiyoeter bağı oluşumu

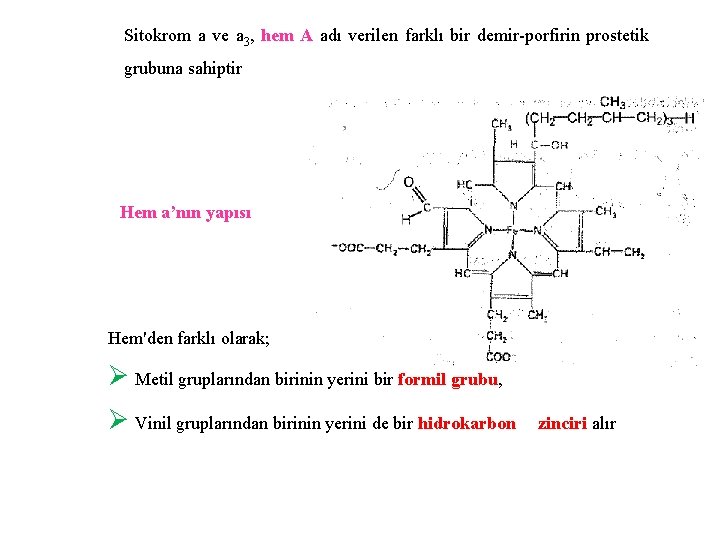
Sitokrom a ve a 3, hem A adı verilen farklı bir demir-porfirin prostetik grubuna sahiptir Hem a’nın yapısı Hem'den farklı olarak; Ø Metil gruplarından birinin yerini bir formil grubu, Ø Vinil gruplarından birinin yerini de bir hidrokarbon zinciri alır

Sitokrom a ve a 3, solunum zincirinin son üyeleridir ve bazen sitokrom oksidaz adı da verilen bir kompleks halinde bulunur.

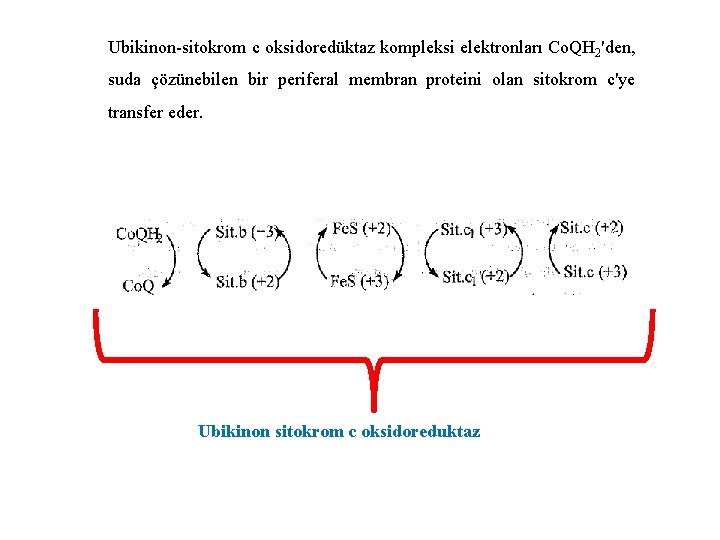
Ubikinon-sitokrom c oksidoredüktaz kompleksi elektronları Co. QH 2'den, suda çözünebilen bir periferal membran proteini olan sitokrom c'ye transfer eder. Ubikinon sitokrom c oksidoreduktaz

Daha sonra indirgenmiş sitokrom c, elektronunu sitokrom oksidaz kompleksine aktarır. Sitokrom c'nin rolü Co. Q'ya benzemektedir ve solunum zincirindeki kompleksler arasında hareketli bir elektron taşıyıcısı görevini görür.

Elektronlar önce kompleksin sitokrom a bileşenine, oradan da bakır ihtiva eden sitokrom a 3'e aktarılır. Bu bakır atomu sit a 3'den 02'ye elektronu transfer ederken +2 ve +1 yükseltgenme basamakları arasında mekik dokur.

Bir 02 molekülünden iki H 20 molekülünün oluşumu dört elektron gerektiren bir aktarabilmektedir. olaydır, fakat hem grupları birer elektron

Dört, elektronun bir 02 molekülünü indirgemek üzere aynı anda nasıl bir araya geldiği henüz tam aydınlanmamış olmamakla birlikte, açıklayıcı bilgilere son yıllarda ulaşılmış ve bazı hipotezler ileri sürülmüştür Bir örneği de aşağıdadır

 Elektron tijorat tizimlari va ularning ahamiyati
Elektron tijorat tizimlari va ularning ahamiyati Proses fosforilasi oksidatif
Proses fosforilasi oksidatif Elektron transport zinciri nedir
Elektron transport zinciri nedir Anlamlı zincir kalıp zincir
Anlamlı zincir kalıp zincir Solunum zinciri
Solunum zinciri Oksijenli solunumda kaç atp üretilir
Oksijenli solunumda kaç atp üretilir Enfeksiyon zinciri elemanları
Enfeksiyon zinciri elemanları Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Sublingual lenf nodu
Sublingual lenf nodu Progresif rezistif egzersiz
Progresif rezistif egzersiz Hikaye tarzında analoji örnekleri
Hikaye tarzında analoji örnekleri Dinamik
Dinamik Hafize uzun
Hafize uzun Kinematik diyagram nasıl çizilir
Kinematik diyagram nasıl çizilir Kavram haritaları
Kavram haritaları Zincir polimerizasyonu
Zincir polimerizasyonu Hiyerarşik olmayan kavram haritası
Hiyerarşik olmayan kavram haritası Sürtünmeli çark mekanizmaları
Sürtünmeli çark mekanizmaları Mekanizmayı oluşturan temel elemanlar
Mekanizmayı oluşturan temel elemanlar Mekanizma serbestlik derecesi
Mekanizma serbestlik derecesi Primary active transport vs secondary active transport
Primary active transport vs secondary active transport Passive transport vs active transport venn diagram
Passive transport vs active transport venn diagram Bioflix activity membrane transport active transport
Bioflix activity membrane transport active transport Active transport vs passive transport venn diagram
Active transport vs passive transport venn diagram Active transport and passive transport
Active transport and passive transport Primary transport and secondary transport
Primary transport and secondary transport Pinocytosis vs phagocytosis
Pinocytosis vs phagocytosis Selectively permeable definition biology
Selectively permeable definition biology Membrane structures that function in active transport
Membrane structures that function in active transport Tedarik zinciri aşamaları
Tedarik zinciri aşamaları Kavram kargaşası yaratma tekniği
Kavram kargaşası yaratma tekniği Tedarik zincirinde lojistik ağ tasarımı
Tedarik zincirinde lojistik ağ tasarımı Hayat kurtarma zinciri nedir
Hayat kurtarma zinciri nedir 1-29-300 oranı nedir
1-29-300 oranı nedir Dedikodu zinciri nedir
Dedikodu zinciri nedir Sevk zinciri basamakları
Sevk zinciri basamakları