Die neue Verordnung zu klinischen Prfungen Herausforderungen und
































- Slides: 34

Die neue Verordnung zu klinischen Prüfungen Herausforderungen und Chancen PD Dr. med. Thomas Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 1

Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 2

Zweck der Verordnung (EU) 536/2014 • Ablösung der Richtlinie 2001/20/EG • Richtlinie 2001/20/EG erlaubte nationale Besonderheiten • Verfahren bei Ethik-Kommissionen derzeit unzureichend harmonisiert • Ziel: Europaweit harmonisiertes Verfahren, u. a. durch • Einführung eines gemeinsamen, koordinierten Assessments bei multinationalen klinischen Prüfungen in der EU • Aber kein zentrales Genehmigungsverfahren • Mitgliedstaaten erteilen weiterhin nationale Genehmigung • Vollständig papierlose Antragstellung und Kommunikation über ein gemeinsames EU-Portal • Prinzip des „tacit approvals“ und „tacit withdrawals“ bei Fristüberschreitung Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 3

Europäische Harmonisierung • Die geplante Vollharmonisierung wurde nur teilweise erreicht • Nationale Besonderheiten/Erlaubnisse sind teilweise möglich, bei • Ethik-Kommissionen • Sponsorvertretung für Nicht-EU/EWR-Sponsoren • Cluster-Studien • Nicht-einwilligungsfähige Erwachsene und andere vulnerable Populationen • Entschädigung bei minimalinterventionellen klinischen Prüfungen • u. a. • Aufgrund der nationalen Besonderheiten ist eine nationale Durchführungsgesetzgebung in den Mitgliedstaaten erforderlich • Referentenentwurf zum „Vierten Gesetzes zur Änderung arzneimittelrechtlicher und anderer Vorschriften“ am 27. November veröffentlicht Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 4

Geänderte Definition einer Klinischen Prüfung Klinische Prüfung eine klinische Studie, die mindestens eine der folgenden Bedingungen erfüllt: • Der Prüfungsteilnehmer wird vorab einer bestimmten Behandlungsstrategie zugewiesen, die nicht der normalen klinischen Praxis des betroffenen Mitgliedstaats entspricht, • die Entscheidung, die Prüfpräparate zu verschreiben, wird zusammen mit der Entscheidung getroffen, den Prüfungsteilnehmer in die klinische Studie aufzunehmen, oder • an den Prüfungsteilnehmern werden diagnostische oder Überwachungsverfahren angewendet, die über die normale klinische Praxis hinausgehen Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 5

Definition einer klinischen Studie Jede am Menschen durchgeführte Untersuchung, die dazu bestimmt ist, • die klinischen, pharmakologischen oder sonstigen pharmakodynamischen Wirkungen eines oder mehrerer Arzneimittel zu erforschen oder zu bestätigen [Wirksamkeit], • jegliche Nebenwirkungen eines oder mehrerer Arzneimittel festzustellen [Sicherheit], oder • die Absorption, die Verteilung, den Stoffwechsel oder die Ausscheidung eines oder mehrerer Arzneimittel zu untersuchen [Pharmakokinetik], mit dem Ziel, die Sicherheit und/oder Wirksamkeit dieser Arzneimittel festzustellen Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 6

Nichtinterventionelle Studien (NIS) • Klinische Studien, die nicht die Kriterien einer klinischen Prüfung erfüllen, werden zukünftig als nichtinterventionelle Studien (NIS) eingestuft • Für eine NIS besteht damit zukünftig kein Bezug zum Zulassungsstatus und auch nicht zum Risiko einer Untersuchung • Unter bestimmten Umständen können auch bestimmte Studien im Off. Label Use als NIS durchgeführt werden • Fallen aber ggf. weiter unter Regelung für PASS und AWBs gem. § 67 Abs. 6 AMG Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 7

Minimalinterventionelle klinische Prüfung Low-intervention Clinical Trial Minimalinterventionelle klinische Prüfung ist eine klinische Prüfung, die alle folgende Bedingungen erfüllt: a) Die Prüfpräparate - außer Placebos - sind zugelassen b) dem Prüfplan der klinischen Prüfung zufolge - werden die Prüfpräparate gemäß den Bedingungen der Zulassung verwendet oder - stellt die Verwendung der Prüfpräparate in einem der betroffenen Mitgliedstaaten eine evidenzbasierte Verwendung dar, die durch veröffentlichte wissenschaftliche Erkenntnisse über Sicherheit und Wirksamkeit dieser Prüfpräparate untermauert ist und [wiss. gesicherter Off. Label Use] c) die zusätzlichen diagnostischen oder Überwachungsverfahren stellen im Vergleich zur normalen klinischen Praxis in dem betroffenen Mitgliedstaat nur ein minimales zusätzliches Risiko bzw. eine minimale zusätzliche Belastung für die Sicherheit der Prüfungsteilnehmer dar Vorteile einer minimalinterventionellen Prüfung: Keine Versicherung erforderlich! Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 8

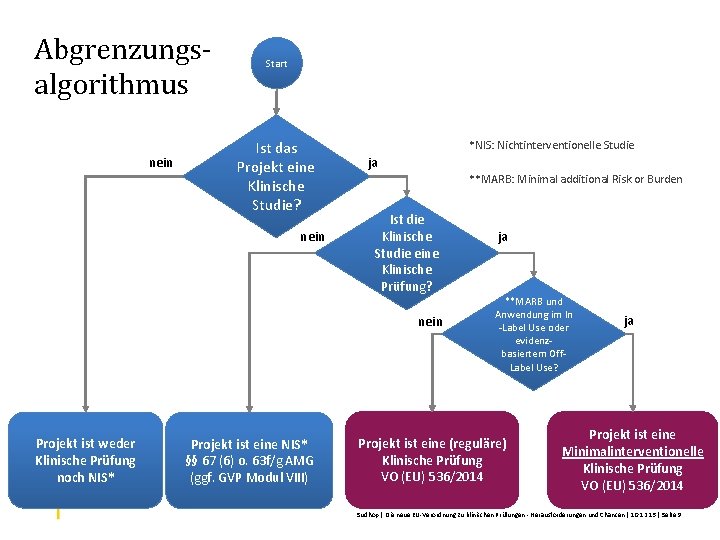
Abgrenzungsalgorithmus nein Start Ist das Projekt eine Klinische Studie? nein *NIS: Nichtinterventionelle Studie ja **MARB: Minimal additional Risk or Burden Ist die Klinische Studie eine Klinische Prüfung? nein Projekt ist weder Klinische Prüfung noch NIS* Projekt ist eine NIS* §§ 67 (6) o. 63 f/g AMG (ggf. GVP Modul VIII) ja **MARB und Anwendung im In -Label Use oder evidenzbasiertem Off. Label Use? Projekt ist eine (reguläre) Klinische Prüfung VO (EU) 536/2014 ja Projekt ist eine Minimalinterventionelle Klinische Prüfung VO (EU) 536/2014 Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 9

Sponsor- und Prüferdefinition Sponsor • Eine Person, ein Unternehmen, eine Einrichtung oder eine Organisation, die bzw. das die Verantwortung für die Einleitung, das Management und die Aufstellung der Finanzierung einer klinischen Prüfung übernimmt • Verordnung erlaubt das Co-Sponsor-Konzept Prüfer • Eine für die Durchführung einer klinischen Prüfung an einer Prüfstelle verantwortliche Person • kein Arztvorbehalt für Prüfer, aber med. Behandlung nur durch Ärzte Hauptprüfer • Ein Prüfer, bei dem es sich um den verantwortlichen Leiter eines Prüferteams handelt, das die klinische Prüfung an einer Prüfstelle durchführt Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 10

Bewertung eines Genehmigungsantrags • Im Antrag wird ein Teil I und ein Teil II unterschieden Teil I (Artikel 6): BOB Teil II (Artikel 7): Ethik-Kommission Minimalinterventionelle Prüfung* Rekrutierung von Prüfungsteilnehmern Nutzen-Risiko-Bewertung* Einwilligung nach Aufklärung (IC) Herstellung und Import Eignung der beteiligten Personen und Zentren Labelling Datenschutzaspekte Investigator‘s Brochure (IB) Entschädigung und Schadensersatz / Versicherung Therapeutischer Nutzen und Nutzen f. öffentliche Gesundheit vs. Risiken für die Prüfungsteilnehmer Biologische Proben • Teil I des Antrages kann als „stand alone“ Antrag zur Genehmigung vorab eingereicht werden • Teil II wird ausschließlich national bewertet, Teil I bei multinationalen Studien federführend durch einen „Reporting member state“ (RMS) *EK nimmt Stellung Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 11

Antragstellung • Sponsor reicht Antrag über das EU-Portal bei den Mitgliedstaaten seiner Wahl ein • Bei Einreichung schlägt Sponsor aus den beteiligten MS den Reporting Member State (RMS) vor • Falls vorgeschlagener RMS ablehnt oder andere MS selbst RMS sein möchten, wird dies den anderen beteiligten MS innerhalb von 3 Tagen mitgeteilt • Mitteilung des RMS an den Sponsor spätestes 6 Tage nach Antragstellung • Im Falle minimalinterventioneller klinischer Prüfungen mit evidenzbasiertem Off-Label Use schlägt der Sponsor den MS als RMS vor, in dessen Hoheitsgebiet die Anwendung evidenzbasiert ist [nationale Evidenz? ] Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 12

Validierung • RMS validiert innerhalb von 10 Tagen nach Eingang den Antrag (Validierungsphase) • Falls RMS Frist nicht einhält, gilt Antrag als gültig validiert (tacit approval) • Bei Mängeln in der Validierung • RMS setzt dem Sponsor eine Frist von höchstens 10 Tagen zur Mängelbeseitigung / Nachlieferung • Falls der Sponsor nicht innerhalb der gesetzten Frist liefert, gilt der Antrag als „hinfällig“ („CTA has lapsed“) • RMS überprüft Nachlieferung innerhalb von höchstens 5 Tagen nach Eingang und teilt Sponsor Entscheidung mit • Sonst auch hier „tacit approval“ Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 13

Bewertung Teil I • RMS übermittelt Sponsor und beteiligten MS einen „Assessment Report“ innerhalb von 45 Tagen nach Validierung • Aufteilung der 45 -tägigen Assessment-Phase in drei Einzelphasen • Phase der Erstbewertung durch RMS (< 26 d) • Phase der koordinierten Überprüfung durch alle beteiligten MS (< 12 d) • Phase der Konsolidierung, in der RMS die Kommentare der anderen MS im Assessment Report konsolidiert (< 7 d) • Ausschließlich RMS kann zusätzliche Informationen vom Sponsor verlangen • RMS setzt Sponsor dann eine max. 12 -tägige Antwortfrist (Tacit withdrawal) • Zur Bewertung der Rückantwort zusätzliche 19 Tage • Dauer: 45 -76 Tage Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 14

Bewertung Teil II • 45 -Tage-Frist nach Validierung für Teil II • Validierung für isolierte Teil II-Bewertung nicht geregelt • Verlangt MS zusätzliche Informationen vom Sponsor, kann der MS die 45 Tage-Frist um maximal 31 Tage verlängern • Die 31 Tage teilen sich folgendermaßen auf: • MS setzt Sponsor eine Antwortfrist von höchstens 12 Tagen • Dem MS verbleiben maximal 19 Tage für die Schlussbewertung nach Eingang der Antwort des Sponsors • Für die Inhalte der Bewertung zu Teil II wird ebenfalls ein Assessment Report erstellt • In DE durch die zuständige Ethik-Kommission Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 15

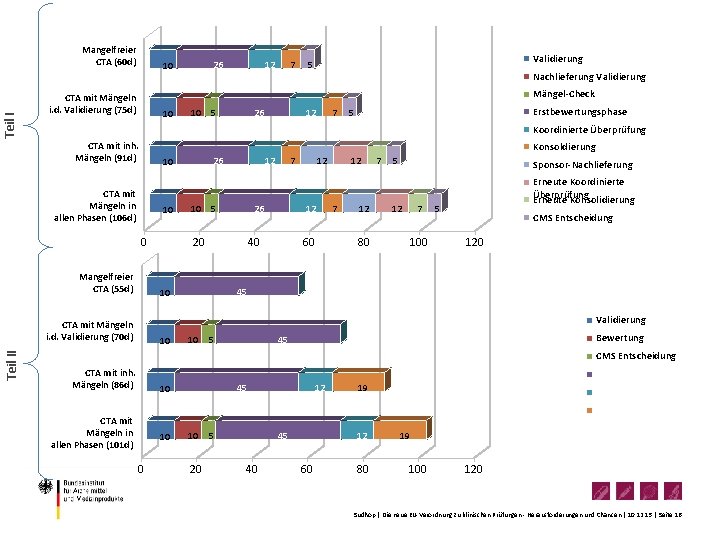
Teil I Mangelfreier CTA (60 d) 10 12 7 Validierung 5 Nachlieferung Validierung Mängel-Check CTA mit Mängeln i. d. Validierung (75 d) 10 10 5 26 12 7 Erstbewertungsphase 5 Koordinierte Überprüfung CTA mit inh. Mängeln (91 d) Konsoldierung 10 CTA mit Mängeln in allen Phasen (106 d) 10 0 Mangelfreier CTA (55 d) 26 12 10 5 7 26 20 12 12 40 10 60 12 7 12 80 7 5 Sponsor-Nachlieferung 12 7 100 Erneute Koordinierte Überprüfung Erneute Konsolidierung 5 CMS Entscheidung 120 45 Validierung CTA mit Mängeln i. d. Validierung (70 d) Teil II 26 10 10 5 Bewertung 45 CMS Entscheidung CTA mit inh. Mängeln (86 d) 10 CTA mit Mängeln in allen Phasen (101 d) 10 0 45 10 20 5 12 45 40 19 12 60 80 19 100 120 Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 16

Entscheidung über die Genehmigung Teil I - Rolle der RMS • RMS legt für Teil I im Assessment Report dar, ob die Durchführung der klinischen Prüfung • vertretbar ist • unter Auflagen vertretbar ist • nicht vertretbar ist • Hält der RMS die Durchführung für nicht vertretbar, ist die klinische Prüfung damit in allen beteiligten MS abgelehnt • Grundsätzlich verbleibt die Genehmigung eine nationale Entscheidung, die spätestens 5 Tage nach Veröffentlichung des Assessment Report im Portal von den beteiligten MS dem Sponsor durch das Portal mitgeteilt wird • Aber: Beteiligte MS sollen dem RMS folgen und dürfen nur aus 3 Gründen ablehnen Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 17

Wann darf ein beteiligter MS die Übernahme einer positiver RMS-Entscheidung zu Teil I ablehnen? • Wenn ein CMS der Auffassung ist, dass die Teilnahme an der klinischen Prüfung dazu führen würde, dass ein Prüfungsteilnehmer eine schlechtere Behandlung erhalten würde als dies gemäß normaler klinischer Praxis im betroffenen Mitgliedstaat der Fall wäre • Bei einem Verstoß gegen bestimmte in Artikel 90 genannten nationalen Rechtsvorschriften • xenogene AM, AM für Schwangerschaftsabbruch, Suchtstoffe • Bei Bedenken hinsichtlich der Sicherheit der Prüfungsteilnehmer sowie der Zuverlässigkeit und Belastbarkeit der gemäß Artikel 6 Absatz 5 [Assessment Report] oder Absatz 8 [Nachlieferung des Sponsors] übermittelten Daten Im Falle der Ablehnung einer positiven RMS-Entscheidung, muss dies der ablehnende CMS gegenüber der Kommission, allen MS und dem Sponsor über das Portal detailliert begründe Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 18

Hinzufügen weiterer Mitgliedstaaten nach Erstgenehmigung • RMS bleibt verantwortlich für die Verfahrensführung • Neue MS dürfen Informationen zu Teil I (über RMS) oder Teil II (direkt) anfordern • Verfahren ist bewusst länger gestaltet als bei der Erstgenehmigung Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 19

Substantial Modifications Wesentliche Änderungen • einschließlich der Hinzufügung einer Prüfstelle oder • der Änderung eines Hauptprüfers an einer Prüfstelle, dürfen nur vorgenommen werden, wenn sie zuvor gemäß der Verfahren in Kapitel III der Verordnung genehmigt wurden Verfahrensprinzipien • Für Teil I betreffende Inhalte bleibt RMS federführend und erstellt Assessment Report • Verfahren ähnlich der Erstgenehmigung mit Validierung, Assessment-Phase und 5 -Tagesfrist ab dem Berichtstag • Fristen: Validierung: 6 d, Assessment-Phase: 38 d • Bei Nachfragen Verlängerung um maximal 31 Tage • Beteiligte MS folgen i. d. R. der RMS Entscheidungen bzgl. Teil I • Opt-Out-Gründe und Verfahren wie bei der Erstgenehmigung Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 20

Administrative Meldeverpflichtungen • Sponsor unterrichtet jeden betroffenen MS innerhalb von 15 Tagen über das EU Portal über folgende Ereignisse im betroffenen Mitgliedstaat: • Beginn der Klinischen Prüfung (Beginn der Rekrutierung) • Die erste Visite des ersten Patienten • Das Ende der Rekrutierung • Ev. Beginn einer erneuten Rekrutierung • Die Beendigung der klinischen Prüfung (im betroffenen MS) • Über das Ende der klinischen Prüfung in allen betroffenen Mitgliedstaaten und in allen Drittstaaten • Innerhalb eines Jahres nach Ende der Prüfung Zusammenfassung der Ergebnisse • Zusätzlich laien-verständliche Zusammenfassung • Falls die klinische Prüfung für Zulassungszwecke verwendet wurde, muss der vollständige ICSR in die EUDatenbank eingestellt werden, spätestens 30 Tage nach • Ende des Zulassungsverfahrens (+ wie -) oder Rücknahme des Zulassungsantrags Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 21

EU-Datenbank Transparenzvorschriften • Alle Inhalte der EU-Datenbank sind nach Erteilung einer Genehmigung einer klinischen Studie öffentlich abrufbar mit Ausnahme folgender Informationen oder zum Schutz von • Personenbezogenen Daten • Betriebs- und Geschäftsgeheimnissen (unter Berücksichtigung des Zulassungsstatus, ggf. übergeordnetes öffentliches Interesse) • Mitteilungen der MS untereinander zur Erstellung der Assessment Reports • Überwachungsmaßnahmen der MS • Bei übergeordnetem öffentlichen Interesse (overriding public interest) an einer Veröffentlichung können diese Informationen auch bereits vor Genehmigung der klinischen Prüfung öffentlich und auch die zuvor genannten - eigentlich geschützten - Informationen öffentlich verfügbar gemacht werden Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 22

Nationale Durchführungsgesetzgebung Referentenentwurf am 27. 11. 2015 veröffentlicht Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 23

Geplante Änderungen • Aufhebung der GCP-Verordnung • Änderung des sechsten Abschnitts des AMG • §§ 40 -42 b • Übergangsregelung mit paralleler Anwendung von alter und neuer Fassung • GCP-V für Altverfahren noch gültig • Neue Rechtsverordnung zu den Verfahren bei den Ethikkommissionen • Neue Gebührenordnungen Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 24

Bundesoberbehörde und Ethik. Kommissionen • CTAs werden von der zuständigen Bundesoberbehörde und einer zuständigen Ethik-Kommission bewertet • Pro Antrag nur eine Ethik-Kommission • Ethik-Kommission kann ggf. im Rahmen der Amtshilfe andere Ethik. Kommission(en) um Unterstützung bei der Zentrumsbewertung bitten • Bewertung teilweise jeweils exklusiv nur von einer Einrichtung • Zuständige Bundesoberbehörde erlässt Gesamtbescheid Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 25

Zuständigkeit für Teil I • Bundesoberbehörde ist für Teil I (gem. Artikel 6) zuständig • Nutzen/Risiko-Bewertung • Therapeut. Nutzen u. Nutzen für die öffentliche Gesundheit • Risiken/Nachteile für Teilnehmer • Investigators‘ Brochure • Herstellung/Einfuhr/ Kennzeichnung für Prüfpräparate (IMPs) und Hilfspräparate (AMPs) • Ethik-Kommission nimmt eingeschränkt Stellung zu Teil I: • Minimalinterventionelle klinische Prüfung • Nutzen-Risiko-Bewertung • EK muss Votum samt Begründung abgeben • Bundesoberbehörde hat Stellungnahme der Ethik-Kommission maßgeblich zu berücksichtigen Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 26

Verfahren für die Ethik. Kommissionen • Ethik-Kommissionen müssen sich beim Bf. Ar. M registrieren lassen • Pflicht (vgl. MPG) • Nur nach Landesrecht gebildete Ethik-Kommissionen können sich registrieren lassen • Registrierung ist zeitlich begrenzt und muss verlängert/neu beantragt werden • Änderungen, die Voraussetzungen der Registrierung betreffen, müssen von der Ethik-Kommissionen unverzüglich an das Bf. Ar. M mitgeteilt werden • Wenn nachträglich Voraussetzungen für die Registrierung wegfallen, kann (muss? ) Registrierung entzogen werden Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 27

Verfahrensordnung • Bundesregierung erlässt mit Zustimmung des Bundesrats eine Verfahrensordnung über die Zusammenarbeit der Bf. Ar. M/PEI und Ethik. Kommission • Inhalte • Registrierungsverfahren • Geschäftsverteilungsplan • Fristen für Ethik-Kommission • Verfahren für Ersuchen zusätzlicher Informationen • Gebührenanteile für Ethik-Kommission Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 28

Gebühren • Nur ein Gebührenbescheid • Wird durch die zuständige Bundesoberbehörde erhoben • Bundesoberbehörde beteiligt Ethik-Kommission anteilmäßig • Gesamtgebühr für Bundesoberbehörde und Ethik-Kommission gemäß Gebührenverordnung des BMG • Neue Gebührentatbestände • Assessment Report • Funktion des RMS • Hinzufügen weiterer Mitgliedstaaten • . . . Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 29

Versicherung • Kein allgemeiner Haftungsfond • Aber Erleichterungen für minimalinterventionelle Prüfungen in Anlehnung an § 40 Abs. 1 b AMG (a. F. ) • Keine Versicherung erforderlich, wenn anderweitige Versicherung für Sponsor und Prüfer bestehen Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 30

Nichteinwilligungsfähige Erwachsene • Artikel 31 der Verordnung erlaubt gruppennützige Forschung an nicht einwilligungsfähigen Erwachsenen unter strengen Auflagen • „Minimal Risk & Minimal Burden“ • Jetziger Referentenentwurf sieht Beibehaltung derzeitigen (strengeren) Regelungen vor • In Konsequenz aus dem Bundestagsbeschluss aus der letzten Legislaturperiode zu den Verhandlungen zur EU-Verordnungen Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 31

Weitere Nationale Besonderheiten • Keine Teilnahme von Personen, die auf gerichtliche/behördliche Anordnung in einer Anstalt untergebracht sind • Haftanstalten • Forensische Psychiatrie • Aber: Pflegeheiminsassen • Keine Cluster-Prüfungen • Minimal interventionelle In-Label-Studien mit reduzierter Aufklärung/Einwilligung, aber jederzeitigem Rücktrittsrecht Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 32

Start der neuen Verfahren • Die Verfahren der Verordnung werden erstmalig sechs Monate nach Veröffentlichung der Funktionsfähigkeit des EU Portals im Eur. Amtsblatt anwendbar • Für bis dahin laufende klinische Prüfungen gelten die alten Verfahren für maximal 3 Jahre • Nach erstmaliger Anwendbarkeit besteht Wahlrecht zwischen den Verfahren für maximal 12 Monate • Für klinische Prüfungen mit Blut und Gewebe (in DE Arzneimittel) • Weitergeltung der alten Rechtslage für 8 Jahre Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 33

Vielen Dank für Ihre Aufmerksamkeit! Kontakt Bundesinstitut für Arzneimittel und Medizinprodukte Abteilung Wissenschaftlicher Service Kurt-Georg-Kiesinger-Allee 3 53175 Bonn Ansprechpartner PD Dr. Thomas Sudhop thomas. sudhop@bfarm. de www. bfarm. de Tel. +49 (0)228 99 307 -xxxx Fax +49 (0)228 99 307 -xxxx Sudhop | Die neue EU-Verordnung zu klinischen Prüfungen - Herausforderungen und Chancen | 10. 12. 15 | Seite 34
 Gymnasiale oberstufe niedersachsen
Gymnasiale oberstufe niedersachsen Die mier en die springkaan
Die mier en die springkaan Neue deklination
Neue deklination Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen Neue sachlichkeit historischer hintergrund
Neue sachlichkeit historischer hintergrund Neues denken für neue lösungen
Neues denken für neue lösungen St galler management modell definition
St galler management modell definition Neue wege heppenheim
Neue wege heppenheim Neue sachlichkeit themen
Neue sachlichkeit themen Helvetica neue ltstd-cn
Helvetica neue ltstd-cn Daten sind das neue gold
Daten sind das neue gold Neue gymnasiale oberstufe
Neue gymnasiale oberstufe Neue oberstufe
Neue oberstufe Braille neue
Braille neue Schmuckums
Schmuckums Die pad van waarheid tot die lewe
Die pad van waarheid tot die lewe Bedrywende en lydende vorm
Bedrywende en lydende vorm Die kinder verbringen die ferien
Die kinder verbringen die ferien Laatste druppel die de emmer doet overlopen
Laatste druppel die de emmer doet overlopen Die einde van die koue oorlog 1989
Die einde van die koue oorlog 1989 Die europäer verteilen die welt
Die europäer verteilen die welt Je höher die berge desto schöner die gams
Je höher die berge desto schöner die gams Die vorhaut ist die haut spruch
Die vorhaut ist die haut spruch Voegwoorde sinne
Voegwoorde sinne Ek glo in god die vader
Ek glo in god die vader Jys die stem in die stilte wat agterbly
Jys die stem in die stilte wat agterbly Voorbeelde van medium termyn doelwitte
Voorbeelde van medium termyn doelwitte Pad van waarheid en lewe
Pad van waarheid en lewe Pad van waarheid tot die lewe
Pad van waarheid tot die lewe Du machst mich immer noch verrückt nach all jahren
Du machst mich immer noch verrückt nach all jahren Die hippie die
Die hippie die How did judas die?
How did judas die? Ergänze die sätze am montag und am mittwoch
Ergänze die sätze am montag und am mittwoch Wohin stellen wir die kommode
Wohin stellen wir die kommode Ballabgabe an den vorherigen spieler
Ballabgabe an den vorherigen spieler


























































