DERAJAT KEASAMAN p H p H Derajat Keasaman
























- Slides: 27

DERAJAT KEASAMAN (p. H)

p. H ( Derajat Keasaman) 1. 2. 3. Asam Basa Campuran A. Buffer / Penyangga B. Hidrolisis

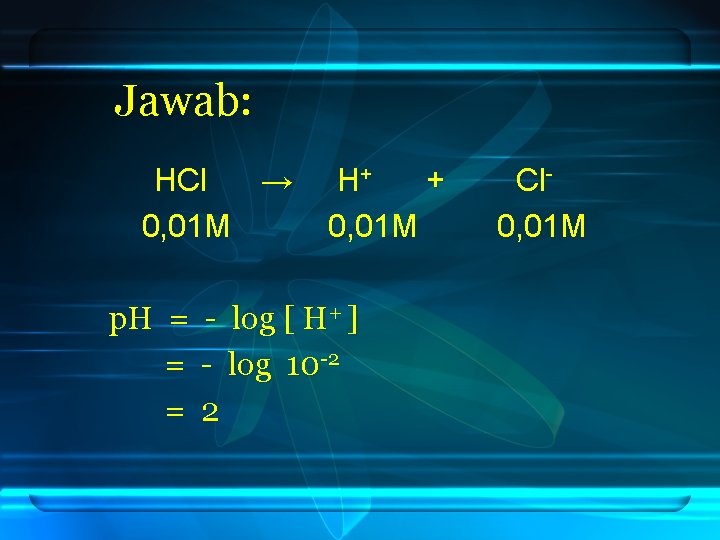
1. p. H Asam a. Asam Kuat Contoh: Tentukan derajat keasaman (p. H) HCl 0, 01 M

Jawab: HCl → 0, 01 M H+ + 0, 01 M p. H = - log [ H+ ] = - log 10 -2 = 2 Cl 0, 01 M

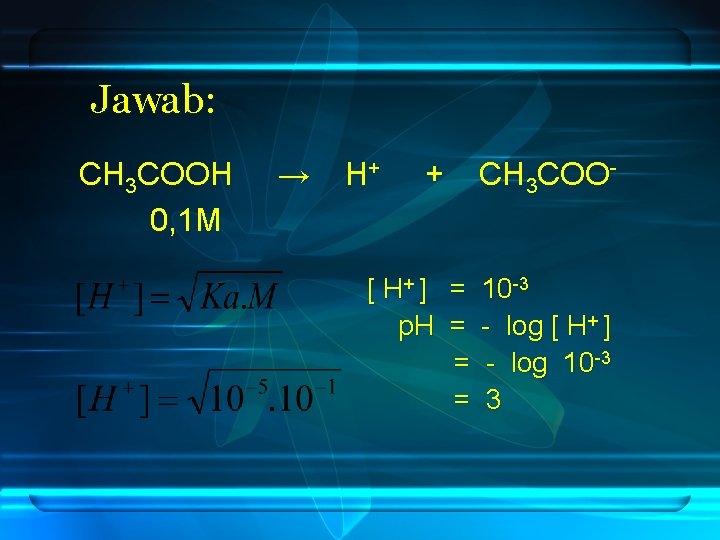
b. Asam Lemah Contoh: Tentukan derajat keasaman(p. H) CH 3 COOH 0, 1 M dengan Ka CH 3 COOH = 10 -5

Jawab: CH 3 COOH 0, 1 M → H+ + CH 3 COO- [ H+ ] = 10 -3 p. H = - log [ H+ ] = - log 10 -3 = 3

2. p. H Basa a. Basa Kuat Contoh: Tentukan derajat keasama(p. H) Ca(OH)2 0, 01 M

Jawab: Ca(OH)2 → Ca 2+ + 2 OH 0, 01 M 0, 02 M p. OH = - log [ OH- ] = - log 2 x 10 -2 = 2 – log 2 p. H = 14 – (2 – log 2 ) = 12 + log 2

b. Basa Lemah Contoh: Tentukan derajat keasaman (p. H) NH 4 OH 0, 1 M dengan Kb NH 4 OH = 10 -5

Jawab: NH 4 OH → 0, 1 M Kb = 10 -5 NH 4+ p. OH = - log [ OH- ] = - log 10 -3 = 3 p. H = ( 14 – 3 ) = 11 + OH-

3. p. H Campuran A. Buffer / Penyangga 1. Asam 2. Basa

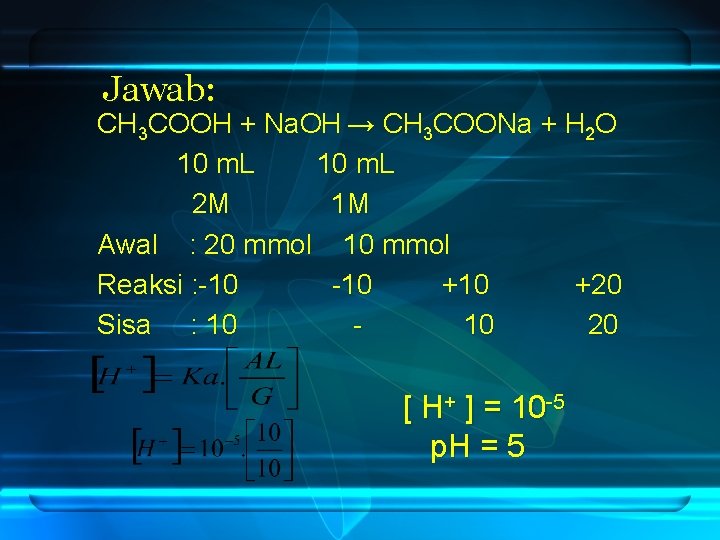
Contoh: 1. Sebanyak 10 m. L CH 3 COOH 2 M direaksikan dengan 10 m. L Na. OH 1 M, Ka = 10 -5 , tentukan p. H campuran!

Jawab: CH 3 COOH + Na. OH → CH 3 COONa + H 2 O 10 m. L 2 M 1 M Awal : 20 mmol 10 mmol Reaksi : -10 +10 +20 Sisa : 10 10 20 [ H+ ] = 10 -5 p. H = 5

Contoh: 2. Sebanyak 10 m. L HCl 1 M direaksikan dengan 10 m. L NH 4 OH 2 M, Kb = 10 -5 , tentukan p. H campuran!

Jawab: HCl + 10 m. L 1 M Awal : 10 mmol Reaksi : -10 Sisa : - NH 4 OH → NH 4 Cl + H 2 O 10 m. L 2 M 20 mmol -10 +10 10 [ OH- ] = 10 -5 p. OH = 5 p. H = 9

Kegunaan larutan buffer dalam makhluk hidup diantaranya: 1. Mempertahankan p. H darah, untuk menjaga agar p. H darah tidak berubah. Maka dalam darah terdapat sistem penyangga antara H 2 CO 3 dan HCO 3–. 2. Dalam cairan sel tubuh terdapat sistem penyangga H 2 PO 4– dan HPO 42– yang juga berperan dalam ekskresi ion H+ di ginjal.

B. Hidrolisis 1. Asam Kuat dengan Basa Lemah 2. Asam Lemah dengan Basa Kuat 3. Asam Lemah dengan Basa Lemah

1. Hidrolisis Asam Kuat Dengan Basa Lemah Contoh: 1. Sebanyak 10 m. L HCl 1 M direaksikan dengan 10 m. L NH 4 OH 1 M, Kb = 10 -5 , tentukan p. H campuran!

Jawab: HCl + NH 4 OH → NH 4 Cl + H 2 O 10 m. L 1 M 1 M Awal : 10 mmol Reaksi : -10 +10 Sisa : 10 10 [ H+ ] = 2, 24 x 10 -5 p. H = 5 – log 2, 24

2. Hidrolisis Asam Lemah Dengan Basa Kuat Contoh: 1. Sebanyak 10 m. L CH 3 COOH 1 M direaksikan dengan 10 m. L KOH 1 M, Ka = 10 -5 , tentukan p. H campuran!

CH 3 COOH + 10 m. L 1 M Awal : 10 mmol Reaksi : -10 Sisa : - KOH → CH 3 COOK + H 2 O 10 m. L 1 M 10 mol -10 +10 10 10 [OH- ] = 2, 24 x 10 -5 p. OH = 5 – log 2, 24 p. H = 9 + log 2, 24

Contoh: 2. Sebanyak 20 m. L HCl 1 M direaksikan dengan 10 m. L NH 4 OH 1 M, Kb = 10 -5 , tentukan p. H campuran!

Jawab: HCl + NH 4 OH → CH 3 COOK + H 2 O 20 m. L 1 M 1 M Awal : 20 mmol 10 mmol Reaksi : -10 +10 Sisa : 10 10 10 [H+ ] = 0, 33 [H+] = 3, 3 x 10 -1 p. H = 1 – log 3, 3

Pertanyaan: 1. Suatu larutan yang mempunyai p. H di bawah 7 akan bersifat … Asam

2. Larutan garam CH 3 COONa merupakan garam terhidrolisis yang bersifat … Basa


 Kalkulator
Kalkulator Nilai dari sin 160° + sin 40° adalah
Nilai dari sin 160° + sin 40° adalah Azimuth parabola
Azimuth parabola Isa erd
Isa erd Interpolate vs extrapolate
Interpolate vs extrapolate Suhu suatu benda 1000 celcius sama dengan
Suhu suatu benda 1000 celcius sama dengan Pemanasan senyawa xy3 pada suhu 600 menyebabkan
Pemanasan senyawa xy3 pada suhu 600 menyebabkan Materi pengukuran sudut
Materi pengukuran sudut Ukuran keruncingan
Ukuran keruncingan Disosiasi adalah
Disosiasi adalah Diagnosis banding pneumonia
Diagnosis banding pneumonia Metode krioskopik adalah
Metode krioskopik adalah Pasangan sudut
Pasangan sudut Imparsial kbbi
Imparsial kbbi Seratus gram air dengan suhu 30 derajat celcius
Seratus gram air dengan suhu 30 derajat celcius Grade prolaps uteri
Grade prolaps uteri Proporsi penelitian
Proporsi penelitian Ionisasi elektrolit poliprotik
Ionisasi elektrolit poliprotik Hitunglah besar sudut sudut berikut a. poq b. prq
Hitunglah besar sudut sudut berikut a. poq b. prq Derajat tuli
Derajat tuli Sudut luar sepihak adalah
Sudut luar sepihak adalah Tatalaksana syok kardiogenik
Tatalaksana syok kardiogenik Dari gambar ini notasi infix yang dihasilkan adalah :
Dari gambar ini notasi infix yang dihasilkan adalah : Pengertian karya non ilmiah
Pengertian karya non ilmiah Besar sudut yang bertolak belakang dengan 1350 adalah….
Besar sudut yang bertolak belakang dengan 1350 adalah…. Derajat ketelitian
Derajat ketelitian Contoh soal work sampling
Contoh soal work sampling Rumus sasaran balik
Rumus sasaran balik