DECRETO 4725 DE 2005 Por el cual se






















- Slides: 39

DECRETO 4725 DE 2005 Por el cual se reglamenta el régimen de registros sanitarios, permiso de comercialización y vigilancia sanitaria de los dispositivos médicos para uso humano.

DECRETO 4957 DE 2007 Art. 1 Los dispositivos médicos y equipos biomédicos de tecnología controlada que se fabriquen en el territorio nacional o que se importen, deberán contar con sus correspondientes registros sanitarios o permisos de comercialización de acuerdo con lo establecido en el decreto 4725 de 2005, para lo cual tendrán plazo hasta el 31 de diciembre de 2008.

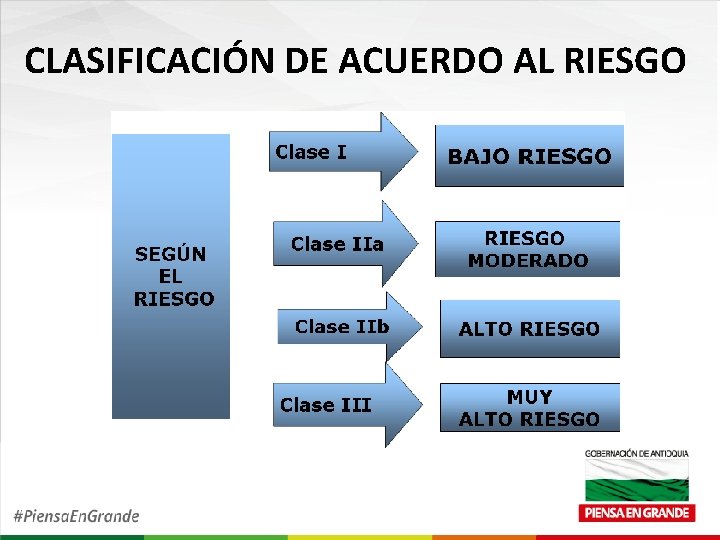
CLASIFICACIÓN DE ACUERDO AL RIESGO

CIRCULAR EXTERNA No 500 -8060 -13 5 de Diciembre de 2013 DEL INVIMA Asunto: Adecuación de establecimientos importadores y fabricantes nacionales, obtención del registro sanitario , etc. Establece como plazo hasta el 11 de agosto de 2014 para que cuenten con el registro sanitario pertinente para los siguientes dispositivos médicos.



DECRETO 4725 DE 2005 Artículo 2: Definiciones • Servicio de Soporte Técnico: Son todas las actividades realizadas para asegurar el buen funcionamiento del equipo biomédico, involucrando aquellas consideradas como de mantenimiento preventivo, correctivo y verificación de la calibración, entre otras.

DOTACIÓN

DOTACIÓN Definición: Son las condiciones, suficiencia y mantenimiento de los equipos médicos que determinen procesos críticos institucionales

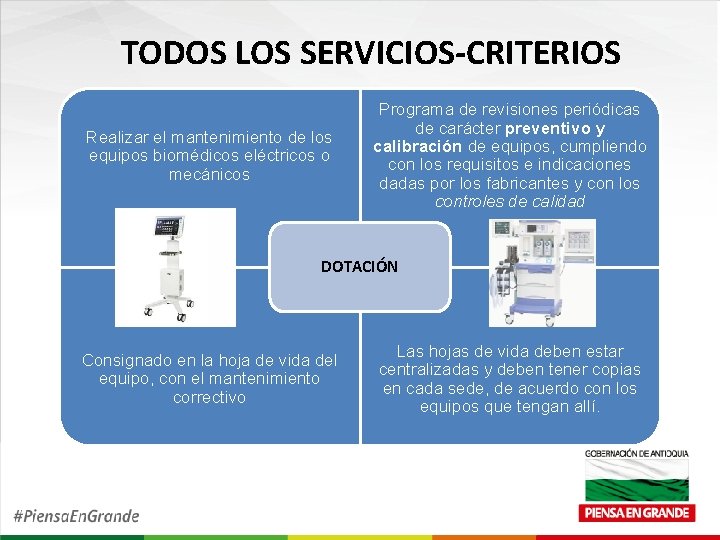
TODOS LOS SERVICIOS-CRITERIOS Utilizar los equipos que cuenten con las condiciones técnicas de calidad y soporte técnico - científico. REGISTRO SANITARIO INVIMA MANUALES CERTIFICADOS DE CALIBRACION SOPORTES DE MANTENIMIENTO Y APROVISIONAMIENT O DE REPUESTOS

TODOS LOS SERVICIOS-CRITERIOS Realizar el mantenimiento de los equipos biomédicos eléctricos o mecánicos Programa de revisiones periódicas de carácter preventivo y calibración de equipos, cumpliendo con los requisitos e indicaciones dadas por los fabricantes y con los controles de calidad DOTACIÓN Consignado en la hoja de vida del equipo, con el mantenimiento correctivo Las hojas de vida deben estar centralizadas y deben tener copias en cada sede, de acuerdo con los equipos que tengan allí.

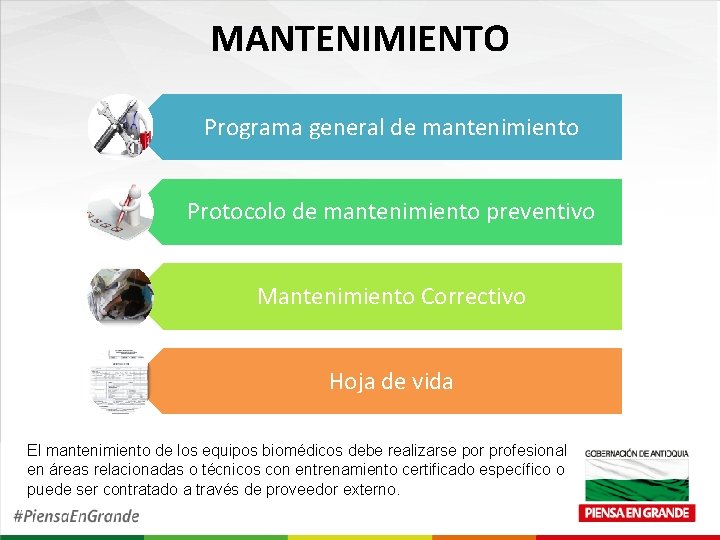
MANTENIMIENTO Programa general de mantenimiento Protocolo de mantenimiento preventivo Mantenimiento Correctivo Hoja de vida El mantenimiento de los equipos biomédicos debe realizarse por profesional en áreas relacionadas o técnicos con entrenamiento certificado específico o puede ser contratado a través de proveedor externo.

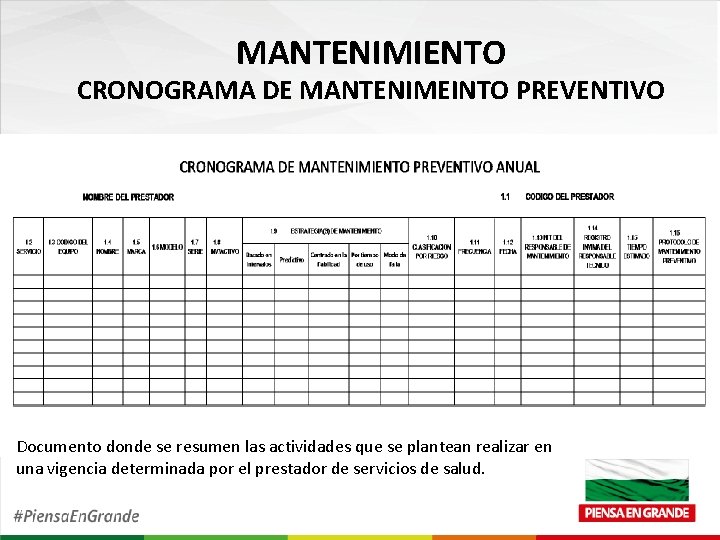
MANTENIMIENTO CRONOGRAMA DE MANTENIMEINTO PREVENTIVO Documento donde se resumen las actividades que se plantean realizar en una vigencia determinada por el prestador de servicios de salud.

PROTOCOLO DE MANTENIMEINTO PREVENTIVO Definición: Lista de chequeo donde se enlista las actividades de mantenimiento realizadas al equipo. Decreto 4725 de 2005, Art. 39 Recurso humano para el mantenimiento de los dispositivos médicos considerados equipos biomédicos. Toda persona jurídica o natural que preste servicios de mantenimiento y verificación de la calibración para equipos biomédicos de Clases IIb y III, deberá contar con un responsable técnico, deberá registrarse ante INVIMA, o la entidad sanitaria competente.

HOJAS DE VIDA DE LOS EQUIPOS Hoja de vida institucional: • Nombre del equipo, marca, modelo, serie, clasificación de acuerdo al riesgo, registro sanitario permiso de comercialización. • Reportes de los mantenimientos correctivos/preventivos y las calibraciones/metrologías (cuando aplique). • Licencia de mantenimiento funcionamiento y control de calidad Equipos de Rayos X (cuando aplique).

EQUIPOS DE RAYOS X Todo equipo emisor de radiación ionizante debe tener licencia de funcionamiento expedida por el Servicio Seccional de Salud correspondiente. Resolución 9031 de 1990. Art. 19. Control de calidad para equipos de diagnósticos serán por lo menos una (1) vez cada dos (2) años… Art. 20. Para renovación de la licencia se exigirán los certificados de control de calidad… Art. 27. Licencia de funcionamiento tendrá vigencia de 4 años…

ESTERILIZACIÓN Resolución 2003 de 2014. Todos los servicio. Dotación. Los esterilizadores cuentan con programa de mantenimiento preventivo, validación a la instalación y recalificación anual. Resolución 2183 de 2004. Por la cual se adopta el Manual de Buenas Prácticas de Esterilización para Prestadores de Servicios de Salud.

ESTERILIZACIÓN Manual de Buenas Prácticas de Esterilización para Prestadores de Servicios de Salud. Validación: El propósito de la validación es demostrar que el proceso de esterilización establecido en la definición del proceso arrojará sistemáticamente un producto estéril La validación consta de varias etapas identificadas: calificación de la instalación, calificación operacional y calificación del desempeño Al finalizar la validación una persona calificada debe revisar, aprobar y certificar todos los datos obtenidos. La revalidación se debe realizar como mínimo cada 12 meses.

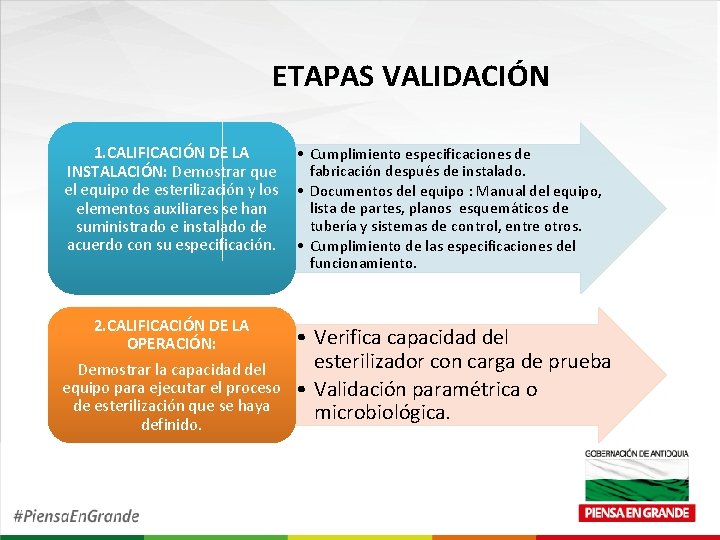
ETAPAS VALIDACIÓN 1. CALIFICACIÓN DE LA INSTALACIÓN: Demostrar que el equipo de esterilización y los elementos auxiliares se han suministrado e instalado de acuerdo con su especificación. • Cumplimiento especificaciones de fabricación después de instalado. • Documentos del equipo : Manual del equipo, lista de partes, planos esquemáticos de tubería y sistemas de control, entre otros. • Cumplimiento de las especificaciones del funcionamiento. 2. CALIFICACIÓN DE LA OPERACIÓN: Demostrar la capacidad del equipo para ejecutar el proceso de esterilización que se haya definido. • Verifica capacidad del esterilizador con carga de prueba • Validación paramétrica o microbiológica.

ETAPAS VALIDACIÓN 3. CALIFICACIÓN DEL DESEMPEÑO: Demostrar que el equipo opera consistentemente de acuerdo con criterios determinados y que el proceso genera productos estériles y cumple con los requisitos especificados. • Demuestra uniformidad de los parámetros físicos dentro de los limites específicos a través de toda la cámara y carga. • Demostración de la correlación de los parámetros físicos y los efectos letales microbiológicos, utilizando información tomada de literatura establecida o de investigación original. • Especificar el número de sensores de temperatura y otros ciclos a utilizarse para la calificación y recalificación del funcionamiento. Se debe simular evidencia documentada para demostrar que este número es suficiente para establecer que el proceso cumple con las especificaciones generales durante el desarrollo del mismo. Ejemplo: Distribución de sensores de temperatura en la cámara.

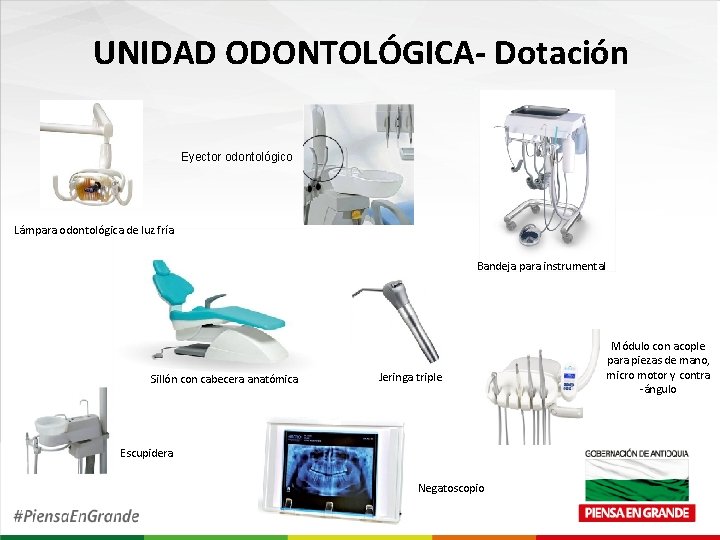
UNIDAD ODONTOLÓGICA- Dotación Eyector odontológico Lámpara odontológica de luz fría Bandeja para instrumental Sillón con cabecera anatómica Jeringa triple Escupidera Negatoscopio Módulo con acople para piezas de mano, micro motor y contra -ángulo

TODOS LOS SERVICIOS-CRITERIOS En las áreas donde se requiera el cumplimiento del protocolo de lavado de manos, manos se cuenta con jabón liquido y sistema de secado.

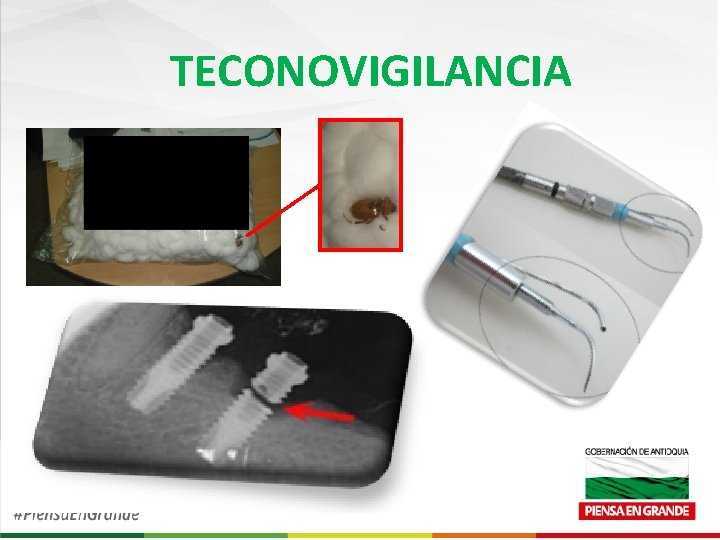
TECONOVIGILANCIA POS - MERCADO DE LOS DISPOSITIVOS MÉDICOS • Identificación de los factores de riesgos asociados a los Dispositivos Médicos. • Con base en la NOTIFICACIÓN, REGISTRO Y EVALUACIÓN SISTEMÁTICA de los Eventos/Incidentes adversos de los dispositivos médicos, con el fin de determinar la FRECUENCIA, GRAVEDAD e INCIDENCIA de los mismos para prevenir su aparición.

TECONOVIGILANCIA

DISPOSITIVO MÉDICO Propuesta por el fabricante para su uso en: Decreto 4725 de 2005, At. 2. Dispositivo Médico para uso humano. Cualquier instrumento, aparato, máquina, software, equipo biomédico u otro artículo similar o relacionado, utilizado sólo o en combinación, incluyendo sus componentes, partes, accesorios y programas informáticos que intervengan en su correcta aplicación, Los dispositivos médicos para uso humano, no deberán ejercer la acción principal que se desea por medios farmacológicos, inmunológicos o metabólicos. Diagnóstico, prevención, supervisión, tratamiento o alivio de una enfermedad Diagnóstico del embarazo y control de la concepción Investigación, sustitución, modificación o soporte de la estructura anatómica o de un proceso fisiológico Diagnóstico, prevención, supervisión, tratamiento, alivio o compensación de una lesión o de una deficiencia; Cuidado durante el embarazo, el nacimiento o después del mismo, incluyendo el cuidado del recién nacido; Productos para desinfección y/o esterilización de dispositivos médicos

TECNOVIGILANCIA -MARCO LEGAL DECRETO 4725 de 2005 RESOLUCIÓN 04816 de 2008 RESOLUCIÓN 2003 DE 2014 • Por el cual se reglamenta el régimen de registros sanitarios, permiso de comercialización vigilancia sanitaria de los dispositivos médicos para uso humano. • Reglamentar el Programa Nacional de Tecnovigilancia a fi n de fortalecer la protección de la salud y la seguridad de los pacientes, operadores y todas aquellas personas que se vean implicadas directa o indirectamente en la utilización de dispositivos médicos • Por la cual se definen los procedimientos y condiciones de inscripción de los Prestadores de Servicios de Salud y de habilitación de servicios de salud

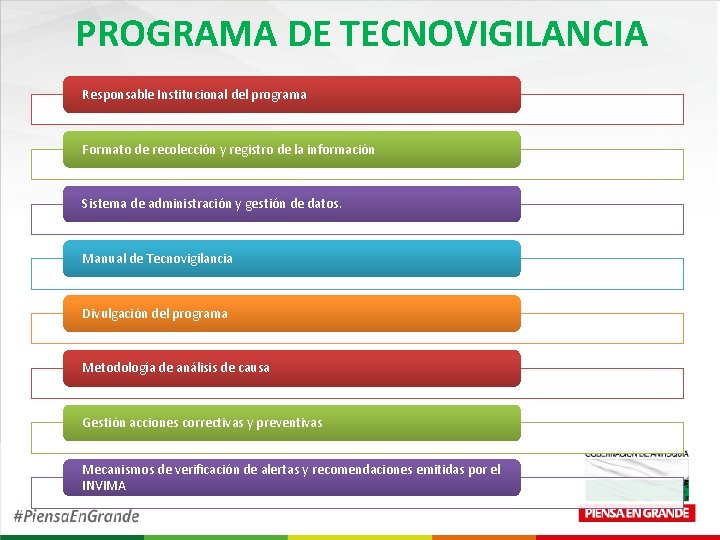
PROGRAMA DE TECNOVIGILANCIA Responsable Institucional del programa Formato de recolección y registro de la información Sistema de administración y gestión de datos. Manual de Tecnovigilancia Divulgación del programa Metodología de análisis de causa Gestión acciones correctivas y preventivas Mecanismos de verificación de alertas y recomendaciones emitidas por el INVIMA

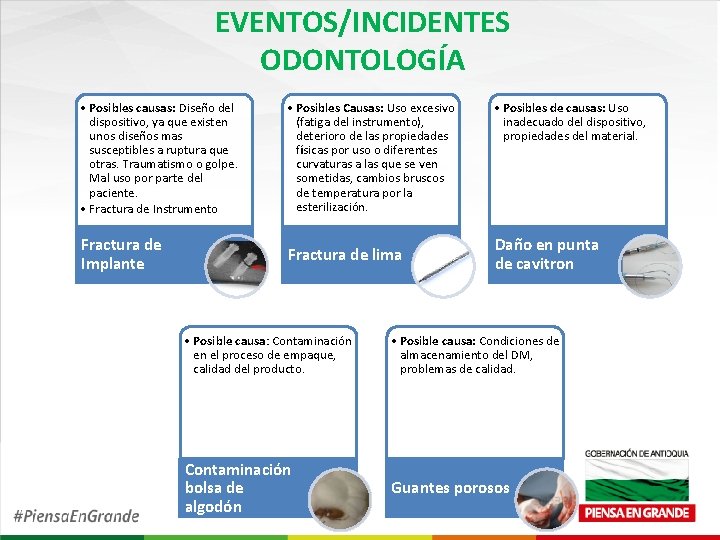
EVENTOS/INCIDENTES ODONTOLOGÍA • Posibles causas: Diseño del dispositivo, ya que existen unos diseños mas susceptibles a ruptura que otras. Traumatismo o golpe. Mal uso por parte del paciente. • Fractura de Instrumento • Posibles Causas: Uso excesivo (fatiga del instrumento), deterioro de las propiedades físicas por uso o diferentes curvaturas a las que se ven sometidas, cambios bruscos de temperatura por la esterilización. Fractura de Implante Fractura de lima • Posibles de causas: Uso inadecuado del dispositivo, propiedades del material. Daño en punta de cavitron • Posible causa: Contaminación en el proceso de empaque, calidad del producto. • Posible causa: Condiciones de almacenamiento del DM, problemas de calidad. Contaminación bolsa de algodón Guantes porosos

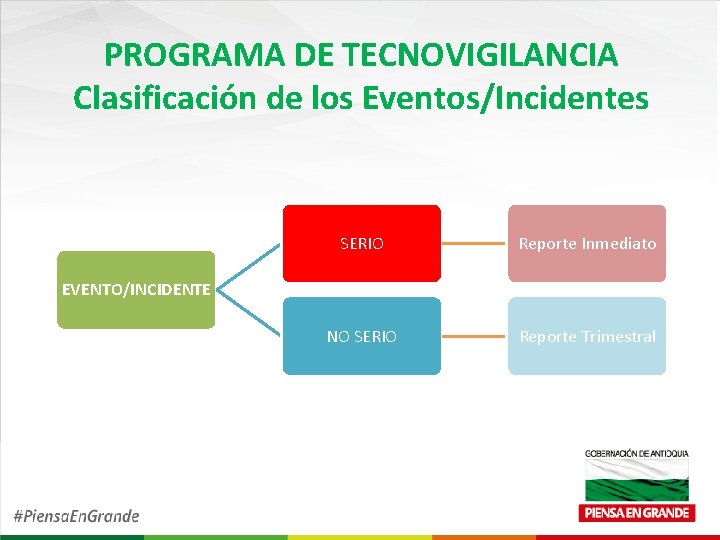
PROGRAMA DE TECNOVIGILANCIA Clasificación de los Eventos/Incidentes SERIO Reporte Inmediato NO SERIO Reporte Trimestral EVENTO/INCIDENTE

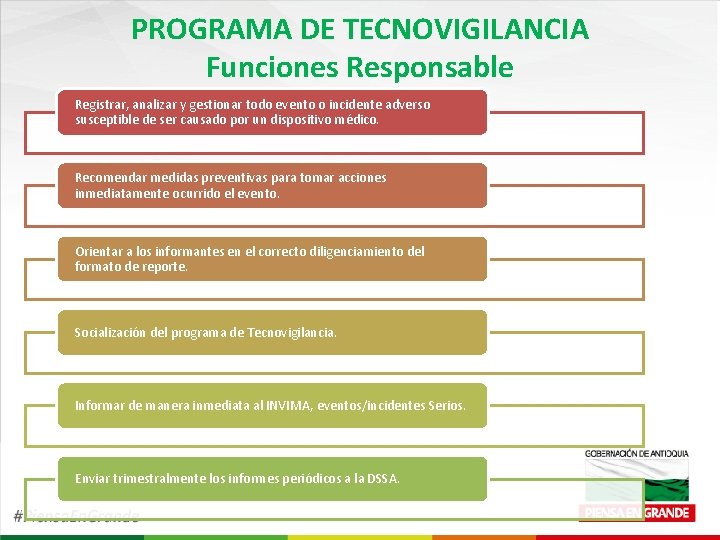
PROGRAMA DE TECNOVIGILANCIA Funciones Responsable Registrar, analizar y gestionar todo evento o incidente adverso susceptible de ser causado por un dispositivo médico. Recomendar medidas preventivas para tomar acciones inmediatamente ocurrido el evento. Orientar a los informantes en el correcto diligenciamiento del formato de reporte. Socialización del programa de Tecnovigilancia. Informar de manera inmediata al INVIMA, eventos/incidentes Serios. Enviar trimestralmente los informes periódicos a la DSSA.

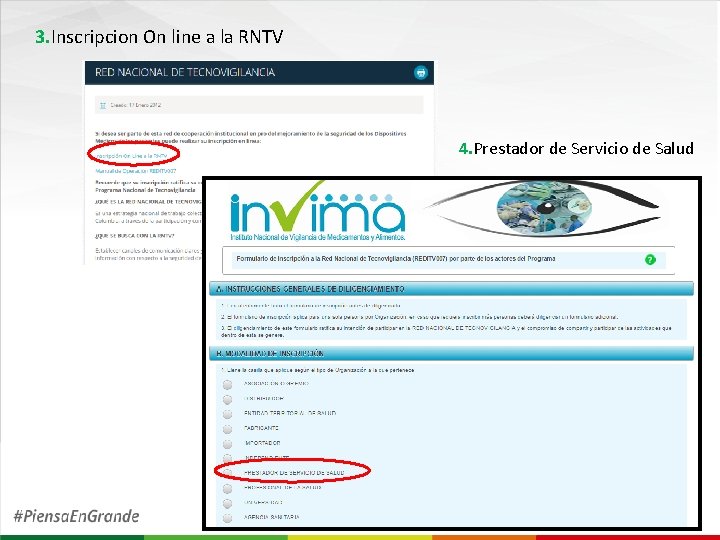
PROGRAMA DE TECNOVIGILANCIA Inscripción al la RED NACIONAL DE TECNOVIGILANCIA 1. Ingresar a la pagina del INVIMA – Seleccionar Tecnovigilancia 2. Red Nacional de Tecnovigilancia

3. Inscripcion On line a la RNTV 4. Prestador de Servicio de Salud

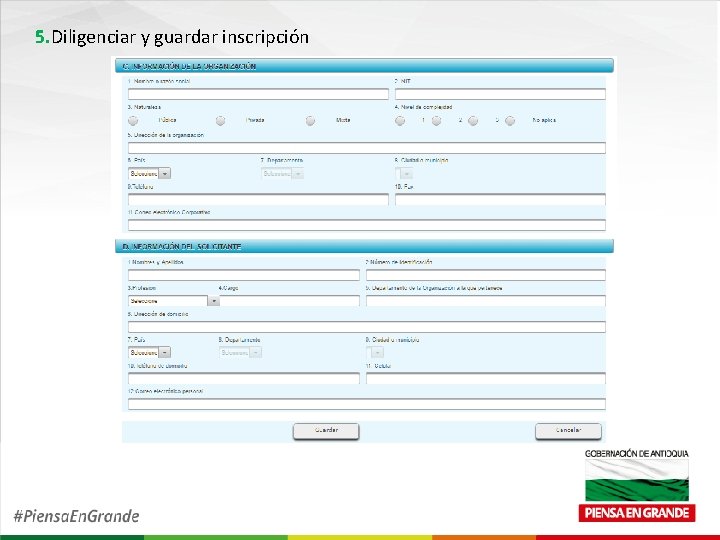
5. Diligenciar y guardar inscripción


FORMATOS DE REPORTE FOREIA 001. Reporte Inmediato. EVENTOS/INCIDENTES SERIOS

FORMATOS DE REPORTE RETIPS 003. Formato para reporte trimestral. EVENTOS/INCIDENTES NO SERIOS

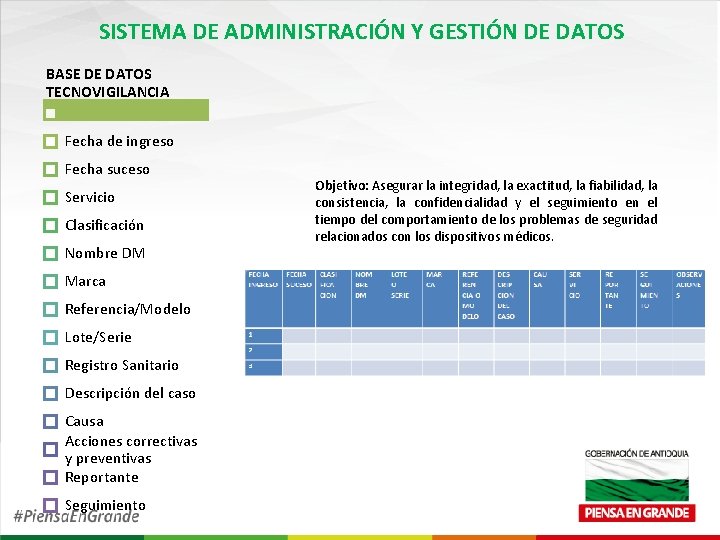
SISTEMA DE ADMINISTRACIÓN Y GESTIÓN DE DATOS BASE DE DATOS TECNOVIGILANCIA Fecha de ingreso Fecha suceso Servicio Clasificación Nombre DM Marca Referencia/Modelo Lote/Serie Registro Sanitario Descripción del caso Causa Acciones correctivas y preventivas Reportante Seguimiento Objetivo: Asegurar la integridad, la exactitud, la fiabilidad, la consistencia, la confidencialidad y el seguimiento en el tiempo del comportamiento de los problemas de seguridad relacionados con los dispositivos médicos.

SEGUIMIENTO DE ALERTAS INTERNACIONALES

Grupo Departamental de Tecnovigilancia Dirección de Calidad y Red de Servicios Secretaría Seccional de Salud y Protección Social de Antioquia Calle 42 B 52 -186 Piso 8, oficina 807 teléfono 3839847 -3835052 tecnovigilancia@antioquia. gov. co luisfernando. taborda@antioquia. gov. co
 Decreto 4725 de 2005
Decreto 4725 de 2005 4725/350
4725/350 Redes de apoyo decreto
Redes de apoyo decreto Numerador y denominador
Numerador y denominador Categorías del patrimonio cultural
Categorías del patrimonio cultural Texto informativo
Texto informativo Pueblo elegido por dios
Pueblo elegido por dios Ejemplos de textos informativos
Ejemplos de textos informativos Cual es la notacion de lewis para el atomo representado por
Cual es la notacion de lewis para el atomo representado por Los dos caminos de la biblia
Los dos caminos de la biblia Decreto 1757
Decreto 1757 Decreto 1757
Decreto 1757 Decreto 2706 de 2012
Decreto 2706 de 2012 Decreto 2200/05
Decreto 2200/05 O que é
O que é Decreto 231/2007
Decreto 231/2007 Decreto 120/98
Decreto 120/98 Decreto legislativo 1150
Decreto legislativo 1150 Decreto de convivencia
Decreto de convivencia Decreto 677 de 1995
Decreto 677 de 1995 2784 de 2012
2784 de 2012 Decreto 1330 del 25 de julio de 2019
Decreto 1330 del 25 de julio de 2019 Decreto 1290 de 2009
Decreto 1290 de 2009 Decreto 2706 2012
Decreto 2706 2012 Decreto 8145/2013
Decreto 8145/2013 Decreto 1683 de 2013
Decreto 1683 de 2013 Decreto nº7.830/2012
Decreto nº7.830/2012 Decreto 1791 del 4 de octubre de 1996
Decreto 1791 del 4 de octubre de 1996 Decreto 1279 de 2002
Decreto 1279 de 2002 648 de 2017
648 de 2017 Decreto ley 192
Decreto ley 192 Decreto 2680 de 2009
Decreto 2680 de 2009 Decreto 3158/66
Decreto 3158/66 Decreto 295
Decreto 295 Decreto 298/2022
Decreto 298/2022 1477 de 2014
1477 de 2014 Decreto 2399 de 2019
Decreto 2399 de 2019 Decreto 96 2019 sintesi mappa
Decreto 96 2019 sintesi mappa Dm 739 del 94
Dm 739 del 94 Real decreto 3484 2000
Real decreto 3484 2000