Cursul 3 Fizica atomic 29 03 2011 Structura












- Slides: 23

Cursul 3 Fizica atomică (29. 03. 2011) • Structura atomului • Spectre atomice • Cuantificarea orbitelor staţionare Spectrul de absorbţie Spectrul de emisie 1

Structura atomului 1665 – Isaac Newton observă că, folosind o prismă, poate descompune lumina albă într-un amestec de fascicule având toate culorile curcubeului (ROGVAIV). Newton a denumit această “bandă de culori” spectru (de la cuvântul latin fantomă). Adept al atomismului, Newton afirmă că lumina este formată din particule minuscule lipsite de masă. c 1678 – Chrystiaan Huygens afirmă că lumina este formată din unde minuscule, care se deplasează în linie dreaptă; două raze alcătuite din unde se pot intersecta fără nicio perturbare ulterioară. Huygens este considerat (din aceste motive şi din multe altele, legate de experimentele de referinţă pe care le-a efectuat) iniţiatorul teoriei ondulatorii a luminii, teorie care la momentul respectiv – nu s-a bucurat de prea mult succes; 2

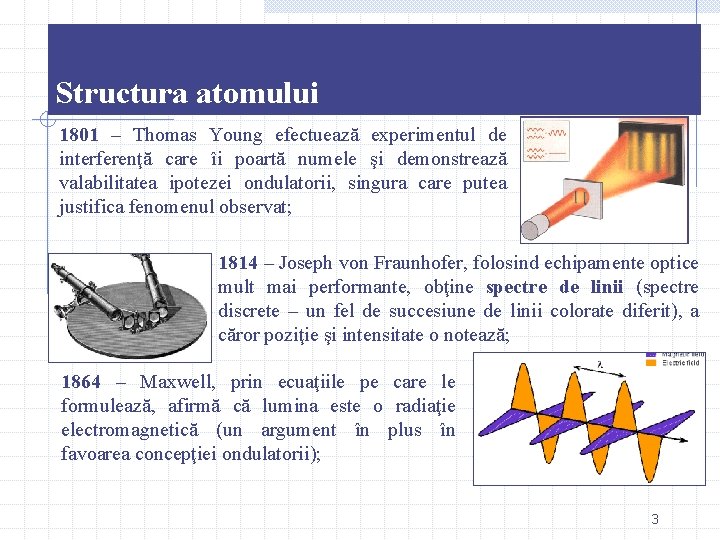
Structura atomului 1801 – Thomas Young efectuează experimentul de interferenţă care îi poartă numele şi demonstrează valabilitatea ipotezei ondulatorii, singura care putea justifica fenomenul observat; 1814 – Joseph von Fraunhofer, folosind echipamente optice mult mai performante, obţine spectre de linii (spectre discrete – un fel de succesiune de linii colorate diferit), a căror poziţie şi intensitate o notează; 1864 – Maxwell, prin ecuaţiile pe care le formulează, afirmă că lumina este o radiaţie electromagnetică (un argument în plus în favoarea concepţiei ondulatorii); 3

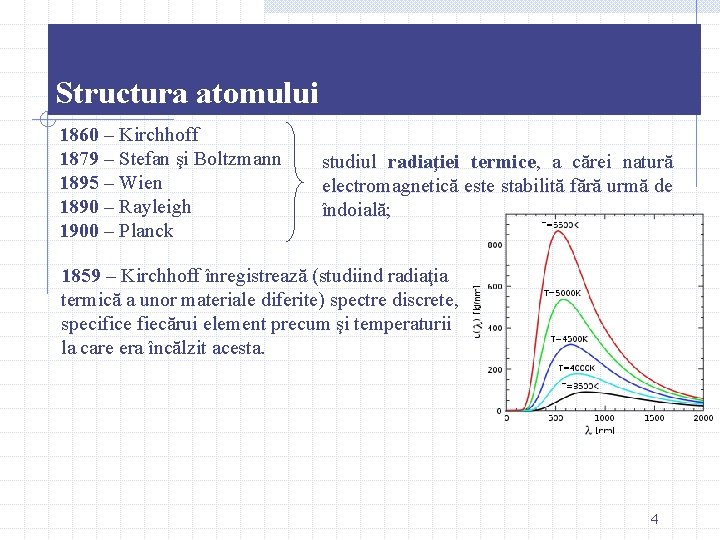
Structura atomului 1860 – Kirchhoff 1879 – Stefan şi Boltzmann 1895 – Wien 1890 – Rayleigh 1900 – Planck studiul radiaţiei termice, a cărei natură electromagnetică este stabilită fără urmă de îndoială; 1859 – Kirchhoff înregistrează (studiind radiaţia termică a unor materiale diferite) spectre discrete, specifice fiecărui element precum şi temperaturii la care era încălzit acesta. 4

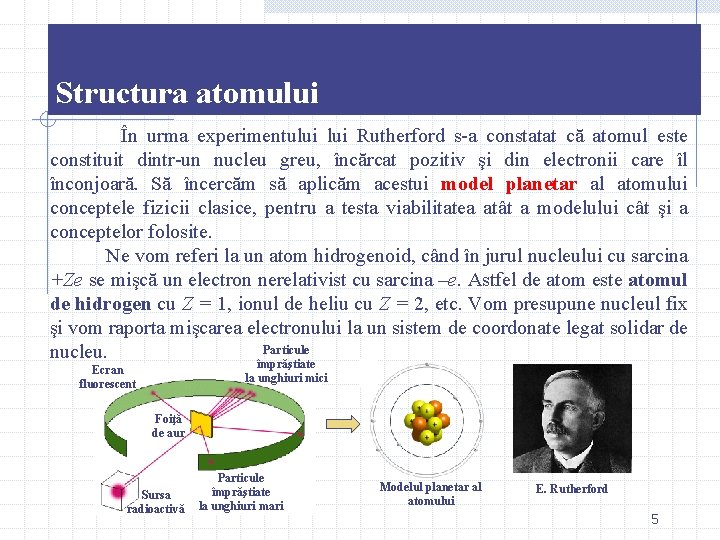
Structura atomului În urma experimentului Rutherford s-a constatat că atomul este constituit dintr-un nucleu greu, încărcat pozitiv şi din electronii care îl înconjoară. Să încercăm să aplicăm acestui model planetar al atomului conceptele fizicii clasice, pentru a testa viabilitatea atât a modelului cât şi a conceptelor folosite. Ne vom referi la un atom hidrogenoid, când în jurul nucleului cu sarcina +Ze se mişcă un electron nerelativist cu sarcina –e. Astfel de atom este atomul de hidrogen cu Z = 1, ionul de heliu cu Z = 2, etc. Vom presupune nucleul fix şi vom raporta mişcarea electronului la un sistem de coordonate legat solidar de Particule nucleu. împrăştiate Ecran fluorescent la unghiuri mici Foiţă de aur Sursa radioactivă Particule împrăştiate la unghiuri mari Modelul planetar al atomului E. Rutherford 5

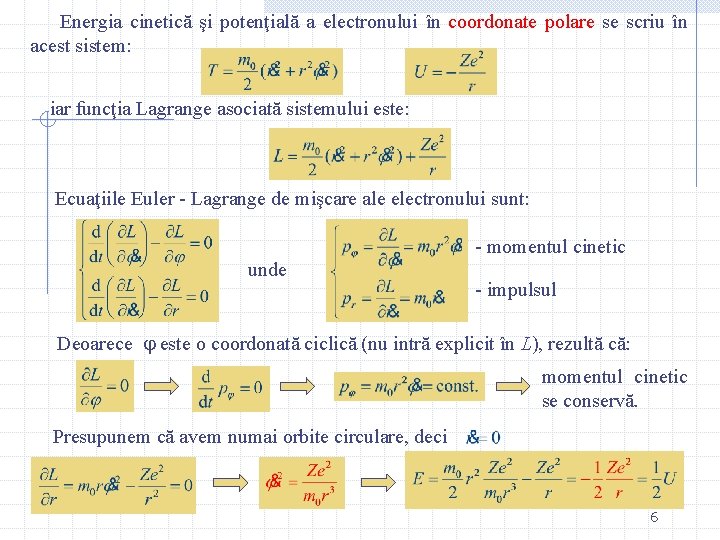
Energia cinetică şi potenţială a electronului în coordonate polare se scriu în acest sistem: iar funcţia Lagrange asociată sistemului este: Ecuaţiile Euler - Lagrange de mişcare ale electronului sunt: - momentul cinetic unde - impulsul Deoarece este o coordonată ciclică (nu intră explicit în L), rezultă că: momentul cinetic se conservă. Presupunem că avem numai orbite circulare, deci 6

Vom exprima parametrii de bază ce caracterizează atomul prin aşa numiţii invarianţi adiabatici ai sistemului, introduşi de Ehrenfest. După Ehrenfest, în cazul unei mişcări periodice (mişcarea în care punctul material revine în poziţia iniţială după acelaşi interval de timp, exemplu de astfel de mişcare fiind: mişcarea pe elipsă, cerc, etc. ) mărimile: numite invarianţi adiabatici (pi sunt impulsurile generalizate, iar qi - coordonatele generalizate) trebuie să rămână constante la o variaţie lentă (adiabatică) a parametrilor sistemului. P. Ehrenfest În cazul considerat aici avem un singur grad de libertate qi = şi astfel rezultă: 7

Conform fizicii clasice, frecvenţa 0 a oscilaţiilor mecanice ale electronului cu energia E, este: Deoarece sistemul execută o mişcare periodică, el poate emite alături de frecvenţa fundamentală şi armonici ale acesteia: Teoria clasică a modelului planetar s-a lovit de o serie de dificultăţi în încercările de a explica emisia atomilor. Într-adevăr, modelul fiind dinamic, electronul rotindu-se în jurul nucleului, accelerat, cu acceleraţia centrifugă r fiind raza orbitei, conform electrodinamicii clasice, el pierde energia: şi la un moment dat (după un timp de ~10 – 9 s) ar trebui să cadă pe nucleu. În realitate însă, acest lucru nu se întâmplă, atomii în stare liberă găsindu-se vreme îndelungată. 8

Spectre atomice În spectroscopie este cunoscut faptul că atomii excitaţi emit radiaţii electromagnetice. Analizându-se radiaţia emisă, care formează spectrele de emisie ale atomilor respectivi, s-a constatat că liniile spectrale sunt grupate în serii spectrale. Aceste serii spectrale au constituit obiectul studiului experimental, la început, în cazul hidrogenului. Experimental, au fost descoperite diferite serii, adică grupuri de linii spectrale, în care liniile spectrale erau aşezate după o anumită lege. S-au observat anumite regularităţi în spectre, care au fost încadrate în formule empirice, separat pentru fiecare serie stabilindu-se câte o astfel de formulă. 9

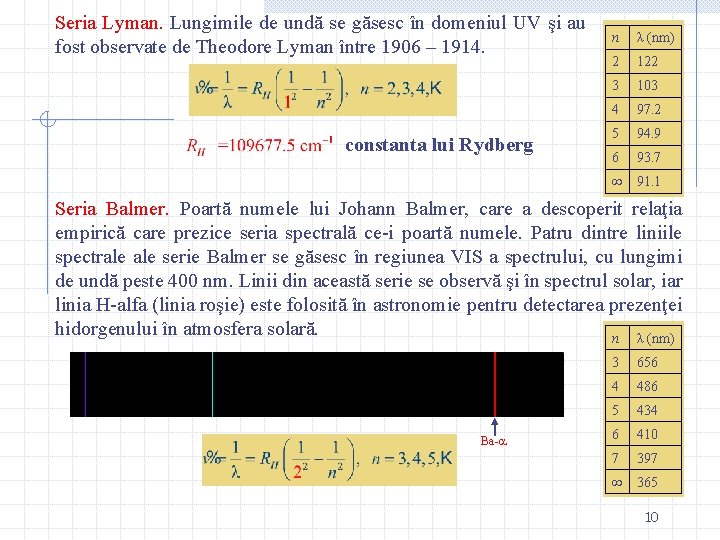
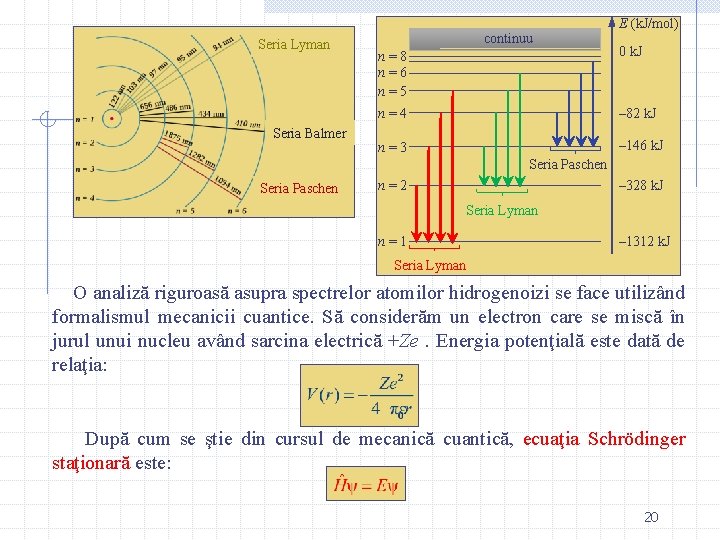
Seria Lyman. Lungimile de undă se găsesc în domeniul UV şi au fost observate de Theodore Lyman între 1906 – 1914. constanta lui Rydberg n λ (nm) 2 122 3 103 4 97. 2 5 94. 9 6 93. 7 91. 1 Seria Balmer. Poartă numele lui Johann Balmer, care a descoperit relaţia empirică care prezice seria spectrală ce-i poartă numele. Patru dintre liniile spectrale serie Balmer se găsesc în regiunea VIS a spectrului, cu lungimi de undă peste 400 nm. Linii din această serie se observă şi în spectrul solar, iar linia H-alfa (linia roşie) este folosită în astronomie pentru detectarea prezenţei hidorgenului în atmosfera solară. n λ (nm) Ba- 3 656 4 486 5 434 6 410 7 397 365 10

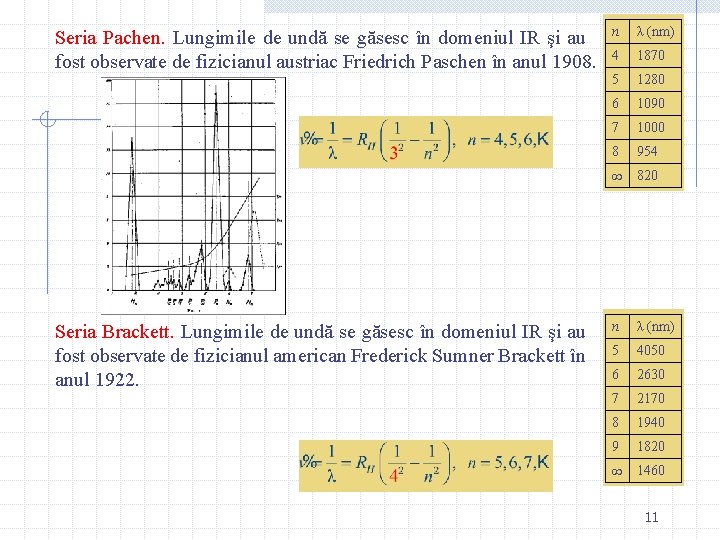
Seria Pachen. Lungimile de undă se găsesc în domeniul IR şi au fost observate de fizicianul austriac Friedrich Paschen în anul 1908. Seria Brackett. Lungimile de undă se găsesc în domeniul IR şi au fost observate de fizicianul american Frederick Sumner Brackett în anul 1922. n λ (nm) 4 1870 5 1280 6 1090 7 1000 8 954 820 n λ (nm) 5 4050 6 2630 7 2170 8 1940 9 1820 1460 11

Seria Pfund. Descoperită experimental de August Herman Pfund în anul 1924. Seria Humphreys. Descoperită experimental de fizicianul american Curtis J. Humphreys. Toate aceste formule empirice pot fi scrise într-o singură formulă, numită formula lui Balmer generalizată: n λ (nm) 6 7460 7 4650 8 3740 9 3300 10 3040 2280 n λ (nm) 7 12400 8 7500 9 5910 10 5130 11 4670 3280 12

În această formulă, m dă tipul seriei, iar n numărul liniei dintr-o serie dată. Se observă că pentru un m fixat şi n foarte mare (n ), vom avea: adică, dacă n creşte foarte mult, liniile spectrale se "înghesuie" spre limita seriei, căreia îi corespunde . Dacă se cunosc numerele de unde corespunzătoare la două linii dintr-o serie, atunci diferenţa lor dă numărul de unde al unei linii aparţinând unei alte serii, conform principiului de combinaţie al lui Ritz, stabilit din datele experimentale în mod empiric. Notând T(m) = RH /m 2, mărime pe care o vom numi termen spectral, rezultă: T(m) se numeşte termen fundamental şi caracterizează seria spectrală, iar T(n) este termenul curent şi determină linia din seria respectivă. Rezultate asemănătoare erau cunoscute şi pentru alte elemente. Aşa de exemplu, pentru heliu simplu ionizat era cunoscut faptul că seriile sale 13 spectrale erau asemănătoare cu cele ale hidrogenului.

Conform fizicii clasice, atomul poate să emită radiaţii cu frecvenţă dată de: sau eventual multiplii ale acestei frecvenţe: • Nu pot fi explicate în nici un fel regularităţile care apar în spectrul hidrogenului şi a altor elemente. • Conform fizicii clasice electronul care se mişcă accelerat trebuie să emită radiaţii în mod continuu şi deci, spectrul de frecvenţă al radiaţiei emise trebuie să fie continuu. • Experienţa arată că spectrele atomice sunt formate din linii distincte grupate în serii spectrale. Concluzie: Fizica clasică este inaplicabilă sistemelor atomice, adică ea nu poate explica legile specifice ale acestora. Ieşirea din acest impas a făcut-o N. Bohr care, în 1913, a completat legile clasice de mişcare a electronilor în atomi cu două postulate noi: • postulatul stărilor staţionare şi • postulatul frecvenţelor. 14

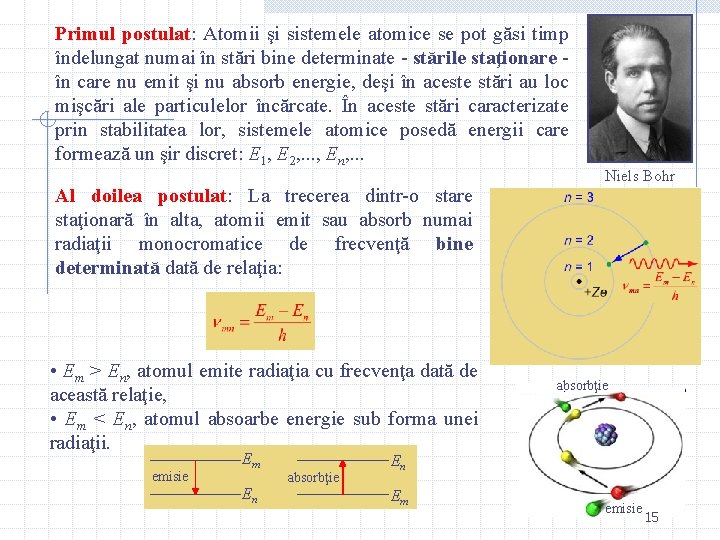
Primul postulat: Atomii şi sistemele atomice se pot găsi timp îndelungat numai în stări bine determinate - stările staţionare în care nu emit şi nu absorb energie, deşi în aceste stări au loc mişcări ale particulelor încărcate. În aceste stări caracterizate prin stabilitatea lor, sistemele atomice posedă energii care formează un şir discret: E 1, E 2, . . . , En, . . . Al doilea postulat: La trecerea dintr-o stare staţionară în alta, atomii emit sau absorb numai radiaţii monocromatice de frecvenţă bine determinată de relaţia: • Em > En, atomul emite radiaţia cu frecvenţa dată de această relaţie, • Em < En, atomul absoarbe energie sub forma unei radiaţii. emisie Em En absorbţie Niels Bohr absorbţie En Em emisie 15

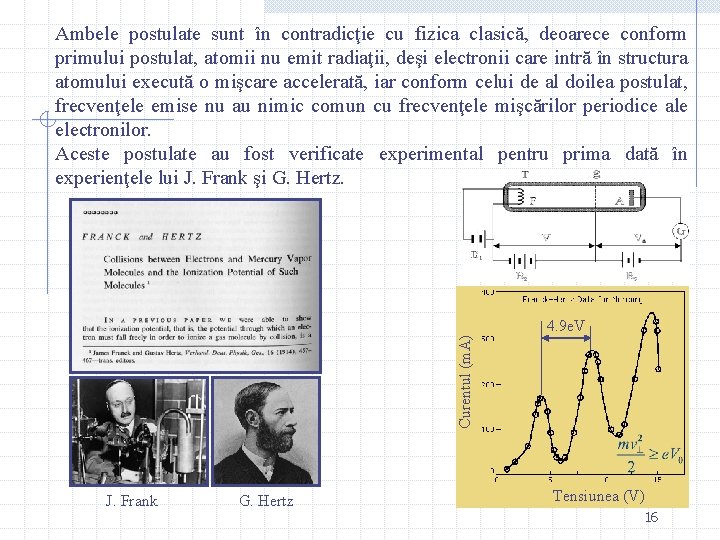
Curentul (m. A) Ambele postulate sunt în contradicţie cu fizica clasică, deoarece conform primului postulat, atomii nu emit radiaţii, deşi electronii care intră în structura atomului execută o mişcare accelerată, iar conform celui de al doilea postulat, frecvenţele emise nu au nimic comun cu frecvenţele mişcărilor periodice ale electronilor. Aceste postulate au fost verificate experimental pentru prima dată în experienţele lui J. Frank şi G. Hertz. J. Frank G. Hertz 4. 9 e. V Tensiunea (V) 16

Cuantificarea orbitelor staţionare Vom folosi acum postulatele lui Bohr pentru a da o teorie consistentă a atomilor hidrogenoizi. Alegem stările staţionare folosind condiţiile de cuantificare a invarianţilor adiabatici: Aşa cum este cunoscut, invarianţii adiabatici pot lua, în fizica clasică, numai valori constante la o variaţie lentă a parametrilor sistemului. Deoarece ei au dimensiunile unei acţiuni, pe baza ipotezei lui Planck, vom postula cuantificarea acestor invarianţi adiabatici: ni – numere cuantice În cazul atomului cu orbite circulare, cu un singur grad de libertate, avem un singur invariant adiabatic I = nh, rezultă: 17

Raza orbitei circulare pe care se mişcă electronul este direct proporţională cu pătratul numărului cuantic n. Se observă că nivelele de energie, începând cu cel mai de jos, formează un şir discret dat de numărul cuantic principal n. Aceste valori corespund stării legate ale electronului şi converg spre limita E = 0. Dincolo de această limită, spectrul este continuu, corespunzător mişcării libere a electronului. Scara de energii este astfel aleasă încât energia să fie zero când n . Valoarea En reprezintă lucrul mecanic necesar pentru a deplasa electronul din starea n în starea de repaus la infinit, şi se numeşte energie de ionizare pentru starea n. Pentru n = 1 obţinem nivelul fundamental, respectiv raza primei orbite Bohr a atomului hidrogenoid. unde a 0 – raza primei orbite Bohr a atomului de hidrogen. 18

Din al doilea postulat al lui Bohr, rezultă formula lui Balmer generalizată: unde RH este constanta lui Rydberg. ! Dacă ţinem cont şi de mişcarea nucleului atomului, atunci toate raţionamentele făcute până acum rămân valabile, dar trebuie să înlocuim masa electronului cu masa redusă a sistemului electron – nucleu, adică: pentru atomul de Hidrogen (Z = 1) Alături de aceste rezultate, excelent confirmate de experienţă, mai amintim: • explicarea seriei dată de Pickering pentru heliu ionizat; • găsirea principiului Ritz; • calculul constantei Rydberg care a coincis foarte bine cu valoarea dată de experienţă (până la a cincea zecimală). 19

Seria Lyman Seria Balmer continuu E (k. J/mol) n=8 n=6 n=5 0 k. J n=4 – 82 k. J n=3 – 146 k. J Seria Paschen n=2 – 328 k. J Seria Lyman n=1 – 1312 k. J Seria Lyman O analiză riguroasă asupra spectrelor atomilor hidrogenoizi se face utilizând formalismul mecanicii cuantice. Să considerăm un electron care se miscă în jurul unui nucleu având sarcina electrică +Ze. Energia potenţială este dată de relaţia: După cum se ştie din cursul de mecanică cuantică, ecuaţia Schrödinger staţionară este: 20

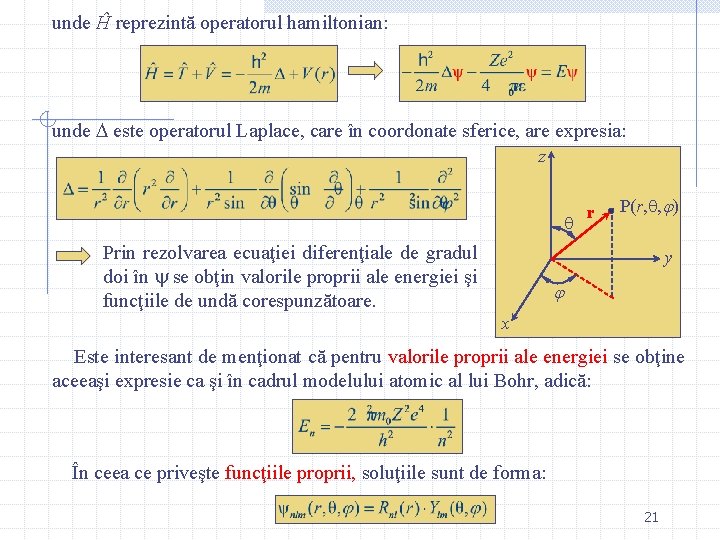
unde Ĥ reprezintă operatorul hamiltonian: unde este operatorul Laplace, care în coordonate sferice, are expresia: z Prin rezolvarea ecuaţiei diferenţiale de gradul doi în se obţin valorile proprii ale energiei şi funcţiile de undă corespunzătoare. r P(r, , ) y x Este interesant de menţionat că pentru valorile proprii ale energiei se obţine aceeaşi expresie ca şi în cadrul modelului atomic al lui Bohr, adică: În ceea ce priveşte funcţiile proprii, soluţiile sunt de forma: 21

Observăm că funcţia de undă conţine o parte radială şi una unghiulară. Partea unghiulară este dată de armonicele sferice Ylm( , ) şi depinde de numărul cuantic orbital l şi de numărul cuantic magnetic m. Partea radială poate fi exprimată în funcţie de aşa-numitele polinoame Laguerre şi depinde de numărul cuantic principal n şi de numărul cuantic orbital l. Numărul cuantic principal n poate lua valorile n = 1, 2, 3, … Valorile posibile ale numărului cuantic orbital sunt l = 0, 1, 2, …, n– 1 (orbitali de tip s, p, d, f, . . . ), iar pentru numărul cuantic magnetic, m = –l, –l+1, . . . , 0, . . . , l– 1, l. 22

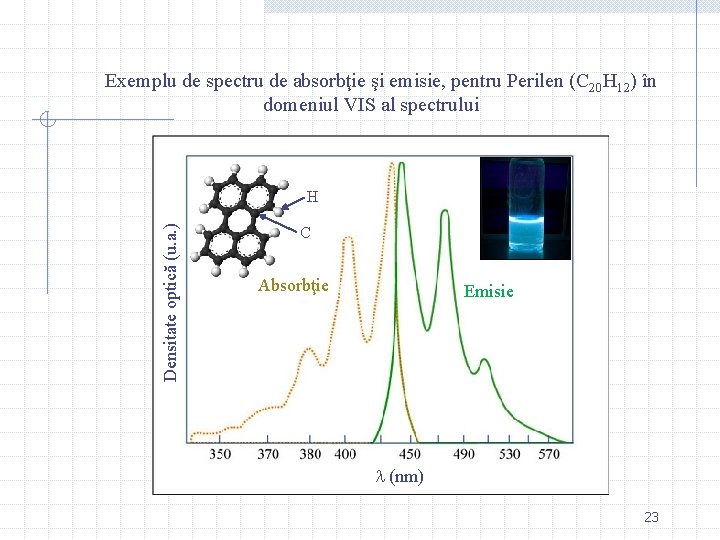
Exemplu de spectru de absorbţie şi emisie, pentru Perilen (C 20 H 12) în domeniul VIS al spectrului Densitate optică (u. a. ) H C Absorbţie Emisie (nm) 23
 Isotope abundance formula
Isotope abundance formula Is atomic mass and relative atomic mass the same
Is atomic mass and relative atomic mass the same Difference between atomic number and atomic mass
Difference between atomic number and atomic mass Patterns in the periodic table
Patterns in the periodic table Atomic number vs atomic radius
Atomic number vs atomic radius Atomic radius trend in periodic table
Atomic radius trend in periodic table Proiect la fizică
Proiect la fizică Echilibrul corpurilor
Echilibrul corpurilor Miscarea rectilinie uniforma variata clasa 9
Miscarea rectilinie uniforma variata clasa 9 Harta fizica a spaniei
Harta fizica a spaniei Formarea curcubeului
Formarea curcubeului Problema fizica
Problema fizica Aplicatii ale efectului fotoelectric extern
Aplicatii ale efectului fotoelectric extern Caietul profesorului de educatie fizica
Caietul profesorului de educatie fizica Reguli in cabinetul de informatica
Reguli in cabinetul de informatica Unitatea de masura a lucrului mecanic
Unitatea de masura a lucrului mecanic Institutul de chimie fizica
Institutul de chimie fizica Muntii marii britanii
Muntii marii britanii Italia harta
Italia harta Degradarea solului
Degradarea solului Fisa de optiuni curriculum la decizia scolii
Fisa de optiuni curriculum la decizia scolii Schema fizica a afacerii
Schema fizica a afacerii Menelaus unitbv
Menelaus unitbv Eroarea de masura datorata preciziei instrumentului
Eroarea de masura datorata preciziei instrumentului