Colegio Centroamrica Funciones Qumicas Inorgnicas Notacin y Nomenclatura












- Slides: 21

Colegio Centroamérica • Funciones Químicas Inorgánicas • Notación y Nomenclatura Martes 1° marzo 2016

Funciones Químicas Inorgánicas Es un conjunto de compuestos que se caracterizan por tener propiedades químicas muy semejantes, debido a que en sus moléculas existen uno o más átomos iguales que se denomina grupo funcional. Según el numero de elementos participantes pueden ser: Binarios, Terciarios o Cuaternarios

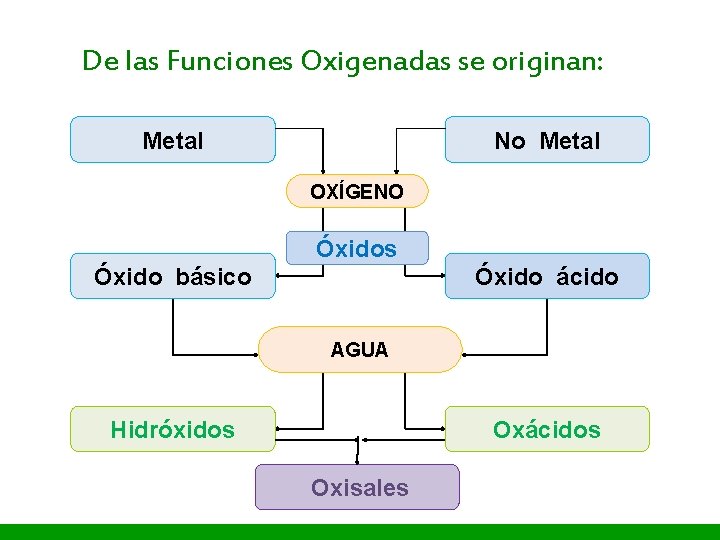
I. E. P «Nuestra Señora de Guadalupe» De las Funciones Oxigenadas se originan: Metal No Metal OXÍGENO Óxidos Óxido básico Óxido ácido AGUA Hidróxidos Oxácidos Oxisales

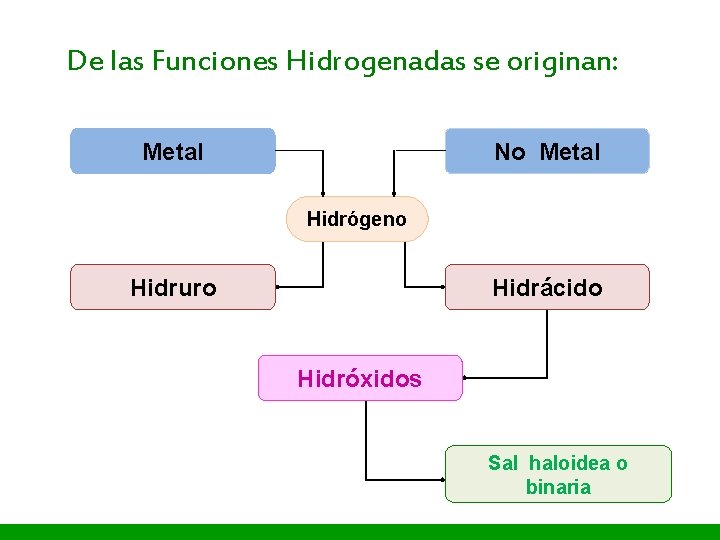
I. E. P «Nuestra Señora de Guadalupe» De las Funciones Hidrogenadas se originan: Metal No Metal Hidrógeno Hidruro Hidrácido Hidróxidos Sal haloidea o binaria


Notación y Nomenclatura Para nombrar compuestos inorgánicos se utiliza tres tipos de nomenclatura, de los cuáles los de mayor uso han sido aprobados por la IUPAC. • Nomenclatura sistemática • Nomenclatura stock • Nomenclatura tradicional

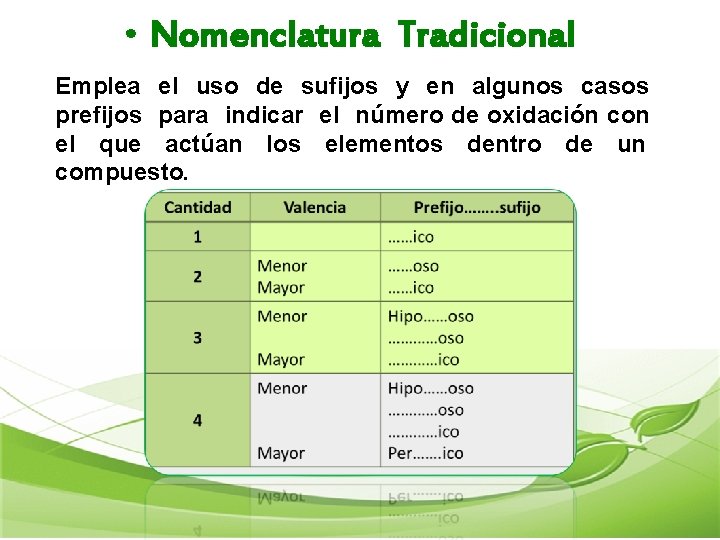
• Nomenclatura Tradicional Emplea el uso de sufijos y en algunos casos prefijos para indicar el número de oxidación con el que actúan los elementos dentro de un compuesto.

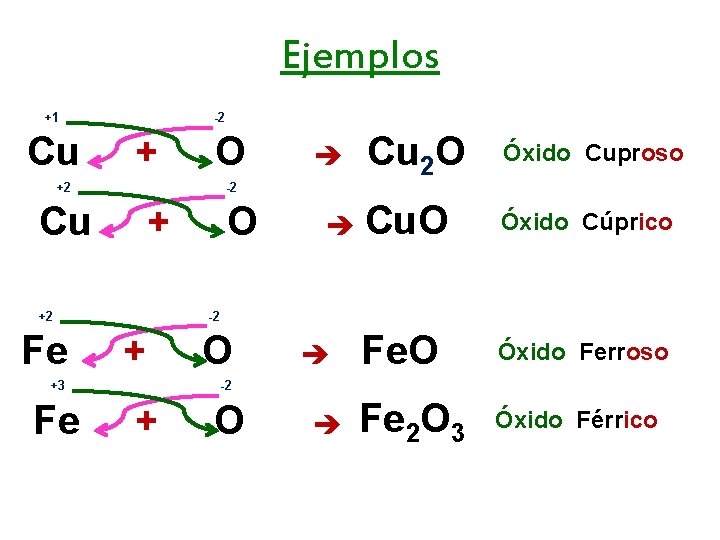
Ejemplos +1 Cu -2 + O +2 -2 Cu + +2 Fe O Cu 2 O Óxido Cuproso Cu. O Óxido Cúprico Fe. O Óxido Ferroso Fe 2 O 3 Óxido Férrico -2 + +3 Fe O -2 + O

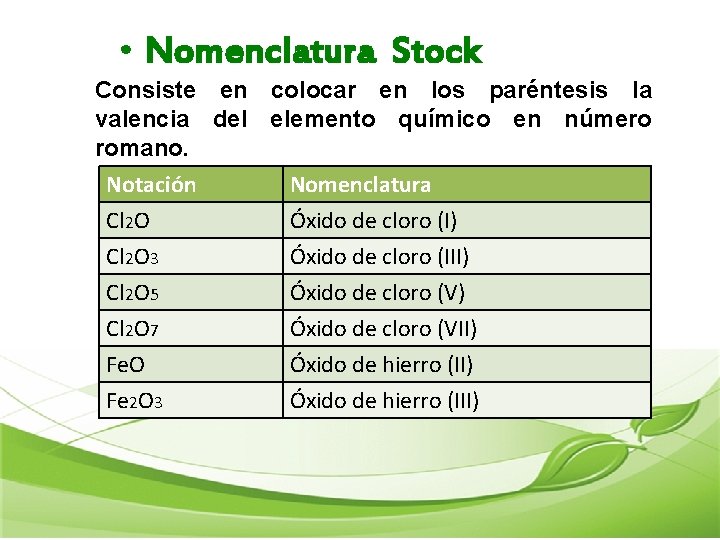
• Nomenclatura Stock Consiste en colocar en los paréntesis la valencia del elemento químico en número romano. Notación Cl 2 O 3 Cl 2 O 5 Nomenclatura Óxido de cloro (I) Óxido de cloro (III) Óxido de cloro (V) Cl 2 O 7 Fe. O Fe 2 O 3 Óxido de cloro (VII) Óxido de hierro (III)

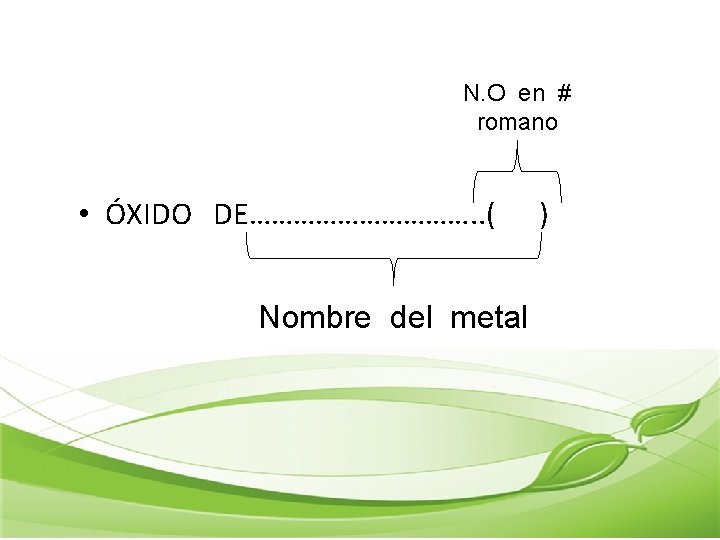
N. O en # romano • ÓXIDO DE……………. . ( Nombre del metal )

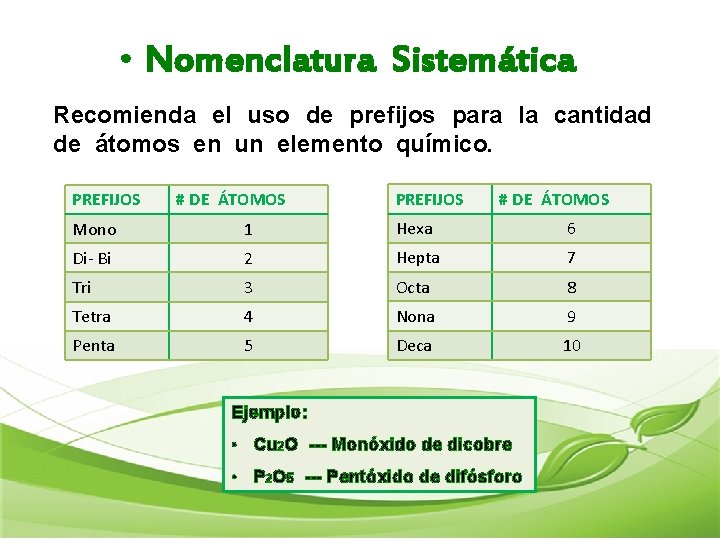
• Nomenclatura Sistemática Recomienda el uso de prefijos para la cantidad de átomos en un elemento químico. PREFIJOS # DE ÁTOMOS Mono 1 Hexa 6 Di- Bi 2 Hepta 7 Tri 3 Octa 8 Tetra 4 Nona 9 Penta 5 Deca 10 Ejemplo: • Cu 2 O --- Monóxido de dicobre • P 2 O 5 --- Pentóxido de difósforo

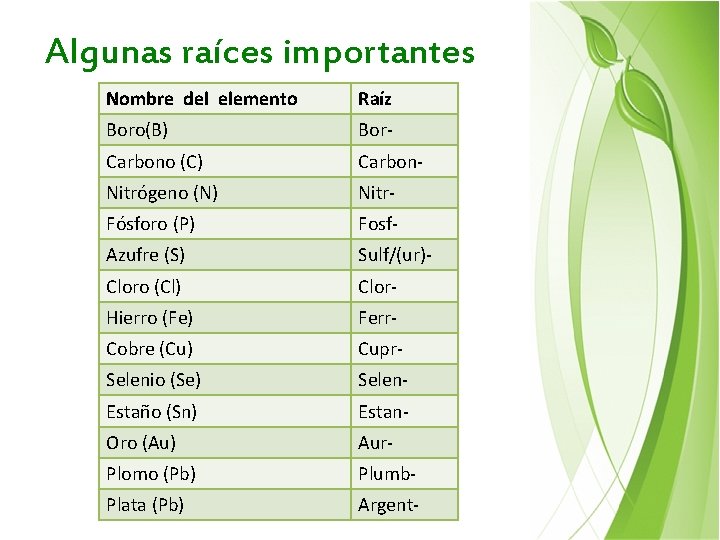
Algunas raíces importantes Nombre del elemento Raíz Boro(B) Bor- Carbono (C) Carbon- Nitrógeno (N) Nitr- Fósforo (P) Fosf- Azufre (S) Sulf/(ur)- Cloro (Cl) Clor- Hierro (Fe) Ferr- Cobre (Cu) Cupr- Selenio (Se) Selen- Estaño (Sn) Estan- Oro (Au) Aur- Plomo (Pb) Plumb- Plata (Pb) Argent-

I. E. P «Nuestra Señora de Guadalupe» Valencia: Es la capacidad de un átomo para enlazarse con otro. Ejemplos: 2, 2 s 2, 2 p 3 N 1 s 7 V=5 2, 2 s 2, 2 p 6 , 3 s 1 Na 1 s 11 V=1 2, 2 s 2, 2 p 6 , 3 s 2 Mg 1 s 12 V=2

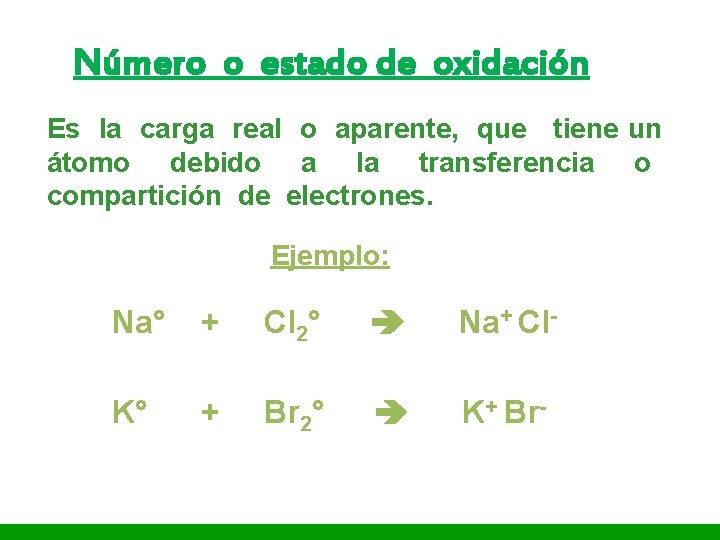
I. E. P «Nuestra Señora de Guadalupe» Número o estado de oxidación Es la carga real o aparente, que tiene un átomo debido a la transferencia o compartición de electrones. Ejemplo: Na° + Cl 2° Na+ Cl- K° + Br 2° K+ Br-

I. E. P «Nuestra Señora de Guadalupe» Reglas para determinar el número de oxidación 1. El estado de oxidación en un elemento libre = 0. Ejemplo: Na° ; Cu° ; O 2° ; P 4°

I. E. P «Nuestra Señora de Guadalupe» 2. En un compuesto químico el átomo de hidrógeno puede tener los siguientes E. O. a) E. O (H) = +1 compuestos. en la mayoría de sus Ejemplo: H+1 NO 3 ; H 2+1 SO 4 b) E. O (H) = -1 frente a metales, es decir cuando forman hidruros. Ejemplo: Ca. H 2 -1 ; Na. H 2 -1

I. E. P «Nuestra Señora de Guadalupe» 3. Generalmente el estado de oxidación (E. O) del oxígeno es igual a -2, por su alta electronegatividad. Ejemplo: Na 2 O-2 ; H 2 SO 4 -2 Excepción: En el F 2 O+2 En los peróxidos su E. O = -1 el E. O del oxígeno es +2, ya que el flúor es más electronegativo. (O+2 F-2)

I. E. P «Nuestra Señora de Guadalupe» 4. El estado de oxidación de los alcalinos (IA) como: Li, Na, K, Rb, ……etc. es igual a +1. Ejemplo: Li+1 ; K+1 5. El estado de oxidación (E. O) de los alcalinos térreos (IIA) como: Be, Mg, Ca, ……etc. es igual a +2. Ejemplo: Ca+2 ; Sr+2

I. E. P «Nuestra Señora de Guadalupe» 6. La suma total del estado de oxidación (E. O) en un compuesto es igual a cero. Ejemplo: Calcula el E. O. del carbono. +2 x -2 Ca C O 3 2 + x + 3 (-2) = 0 2 + x -6 = 0 X = +4

I. E. P «Nuestra Señora de Guadalupe» Ejercicios Ø Determina el número de oxidación de los siguientes compuestos. a) H 2 S e) HCl. O 3 i) Mg 3 N 2 b) HCl. O 4 f) H 3 PO 3 j) HNO 3 c) NO 2 - g) Fe(OH)3 k) H 2 CO 3 d) H 3 PO 4 h) H 2 SO 4 l) H 2 SO 3 .

I. E. P «Nuestra Señora de Guadalupe» Ejercicios Ø Formule correctamente compuestos. los siguientes 6. Óxido auroso 7. Monóxido de dicobre 8. Óxido de plata Óxido cuproso 1. Óxido ferroso 2. Óxido de aluminio 3. Monóxido de dipotasio 9. 4. Óxido plumboso 10. Óxido plúmbico 5. Óxido de calcio 11. Óxido niquélico . 12. Óxido de estaño (IV)
 Qumicas
Qumicas Notacin
Notacin Notacin
Notacin Que es la potencia de diez
Que es la potencia de diez Notación kendall
Notación kendall Trigliceridos mixtos ejemplos
Trigliceridos mixtos ejemplos Soluzioni chimica posca
Soluzioni chimica posca K202 nomenclatura
K202 nomenclatura Regras da nomenclatura dos seres vivos
Regras da nomenclatura dos seres vivos O-dibromobenceno
O-dibromobenceno árvore filogenética
árvore filogenética V=3i+4j
V=3i+4j Acido tetraosso manganico
Acido tetraosso manganico Nomenclatura iupac
Nomenclatura iupac Nacl nomenclatura
Nacl nomenclatura Nomenclatura micrometro
Nomenclatura micrometro Hidruro platinico
Hidruro platinico Nico3 nomenclatura
Nico3 nomenclatura Esteres mais simples aparecem no perfume das flores
Esteres mais simples aparecem no perfume das flores Structura kekule
Structura kekule Soluzione chimica più verde
Soluzione chimica più verde Nomenclatura aminas iupac
Nomenclatura aminas iupac